Физико-химическая модель поведения титана в профиле выветривания
Автор: Копейкин В.А.
Журнал: Вестник геонаук @vestnik-geo
Рубрика: Научные статьи
Статья в выпуске: 10 (286), 2018 года.
Бесплатный доступ
Представлены литературные и авторские данные по стандартной свободной энергии ионов и комплексов титана в водном растворе. Для анализа поведения титана в процессе выветривания использован метод физико-химического моделирования на ЭВМ по программе «Селектор». Установлено, что в профиле выветривания (при учете 41 комплекса и иона титана) титан в растворе представлен только одним гидроксокомплексом - Ti(OH)40. Его содержание контролируется растворимостью рутила и составляет 10-7 моль/л.
Титан, рутил, выветривание, стандартная свободная энергия, моделирование, программа "селектор"
Короткий адрес: https://sciup.org/149129279
IDR: 149129279 | УДК: 550.4:551.3:549.514.63 | DOI: 10.19110/2221-1381-2018-10-35-38
Текст научной статьи Физико-химическая модель поведения титана в профиле выветривания
-
А. П. Виноградов [1] считал титан «ключом» в оценке генезиса бокситов. Титан позволяет оценить химию латеритного процесса. Ранее [7] дана оценка стандартной свободной энергии Гиббса ( A G0 f ( 298 ) Дж/моль) ионов титана в водном растворе и выявлена несогласованность данных разных авторов.
Методы и подходы
Поскольку авторы [11] получили значение свободной энергии Гиббса для гидроксокомплекса титана Ti(OH) 4 0( p-p) ( A G0 f (29 8 ) Дж/моль) = —1323274 Дж/моль на основании экспериментальных данных, то мы принимаем их рекомендацию за основу. Из этой же работы взято значение A G0 f (29 8 ) для аниона Ti(OH) 5 -.
В публикации Е. В. Школьникова [14] на основе усреднённых данных ряда авторов вычислены логарифмы общих констант устойчивости гидроксокомплексов Ti(OH) 3 +, Ti(OH) 2 +2, Ti(OH) 3 +, Ti(OH) 4 0. Эти константы нами использованы для расчета стандартной свободной энергии Гиббса первых трёх гидроксокомплексов и катиона Ti+4.
Например, для реакции
Ti(OH) 3 + + ОН-= Ti(OH) 4 0 логарифм общей константы устойчивости (lg в ) будет равен 11.33 (lg в 4 = 58.65; lg в 3 = 47.32). Отсюда свободная энергия данной реакции составит 11.33 х 5708 = = 64672 Дж/моль и A G0 f(298) Ti(OH) 3 + = -1101340 ( A G0 f(298) OH- = -157262 Дж/моль).
Аналогично для реакций
Ti(OH)2+2 + ОН-= Ti(OH)3+ lg в2 = 47.32 - 35.42 = 11.9 и AG0f(298) Ti(OH)2+2 = = -876153 Дж/моль.
Ti(OH) +3 + ОН- = Ti(OH) 2 +2
lg в 1 = 35.42-17.98 = 17.44 и A G0 f(298) Ti(OH) 3 + = = -619343 Дж/моль.
Ti+4 + ОН- = Ti(OH) +3
lg в 0 = 17.98 и A G0 f ( 298 ) Ti+4 = -359451 Дж/моль. Отсюда для реакции Ti+4 + 4е = Ti стандартный окислительный потенциал E0 = 0.931 Вольт (Е0 = - A G0 R /nF [10]).
В работе [14] рекомендуется значение A G0 f ( 298 ) Ti+4 = = -349 ± 9 кДж/моль (E0 = 0.904 ± 0.023 Вольт).
В монографии [9] для титана имеются данные только по константам ступенчатой диссоциации сульфатов: рК10 = 6.33; рК 2 0 = 4.75; рК 3 0 = 2.43; рК10 = 0.17.
Для реакции
Ti(SO 4 )+2 = Ti+4 + SО 4 -2
свободная энергия реакции равна 36132 (6.33 х 5708) Дж/моль и A G0 f(298) Ti(SO 4 )+2 = -1140042 Дж/моль.
A G0 f ( 2 98> Дж/моль для других сульфатов титана равны: Ti(SO 4 ) 2 0= -1911614; Ti(SO 4 ) 3 -2 = -2669943 и Ti(SO 4 ) 4 - = = -3415372 Дж/моль.
В побочной подгруппе IV группы периодической системы Д. И. Менделеева вместе с титаном находятся также цирконий и гафний, для которых в монографии [9] приводятся данные по константам ступенчатой диссоциации (рК п 0) для карбонатов, гидрокарбонатов, хлоридов и фторидов. Для титана таких данных нет.
Анализируя химию подгруппы титана, авторы работы [3] указывают на близкое сходство химических свойств элементов этой подгруппы — титана, циркония и гафния.
Результаты
Исходя из предположения, что и у титана могут быть аналогичные комплексы с другими лигандами и константы ступенчатой диссоциации их изменяются аналогично сульфатным, методом аппроксимации (исходя из предположения, что рК для недостающих лигандов титана будет меняться с тем же шагом, что и для Zr и Hf) мы определили эти константы (табл. 1, жирный курсив). Например, разница в рК10 между карбонатными комплексами циркония и гафния составляет 0.03 (11.68—11.65). Такую же разницу мы допускаем и между карбонатными комплексами циркония и титана. Соответственно, рК 2 0 для титана будет равна 0.02 (9.82—9.80) и рК 3 0 равна 7.08 (7.10—7.09). Такое же допущение сделано и для гидрокарбонатных, хлоридных и фторидных комплексов титана.
Затем, исходя из констант ступенчатой диссоциации, была рассчитана их свободная энергия (табл. 2).
В таблице 1 приведены значения рК п 0 для Ti, Zr и Hf с другими лигандами (НСО 3 -, СО 3 -2, F-, Cl-), свободная энергия которых взята из [9]. Также использовались другие данные [15—17].
В таблице 2 приведены значения стандартной свободной энергии Гиббса A G° f ( 298 ) (Дж/моль) соединений титана, которые были использованы при моделировании.
В качестве породы для физико-химического моделирования процесса выветривания взят базальт [2] (%): SiO 2 — 49.06; Al 2 O 3 — 15.70; Fe 2 O 3 — 5.38; FeO — 6.37; MgO — 6.17; CaO — 8.95; Na 2 O — 3.11; K 2 O — 1.52; FeS 2 — 1.00; H 2 O — 0.50; FeTiO 3 — 1.36; CaF 2 — 0.30; NaCl — 0.28; CO 2 — 0.30. Z = 100.00 %.
Таблица 1. Значения pK n 0 диссоциации комплексов Ti, Zr и Hf при 25 °C и 0.1 МПа
Table 1. The pK n 0 values of the dissociation of Ti, Zr and Hf-complexes at 25 °C and 0.1 MPa
|
Катион Kation |
Анион Anion |
pKt° |
PK2° |
РК/ |
pKV |
pK5° |
|
Ti |
so4-2 |
6.33 |
4.75 |
2.43 |
0.17 |
.......... |
|
Zr |
6.06 |
4.53 |
2.29 |
0.12 |
_ |
|
|
Hf |
6.05 |
4.53 |
2.29 |
0.12 |
— |
|
|
Ti |
OH" |
17.98 |
17.44 |
11.9 |
11.33 |
|
|
Zr |
14.30 |
12.00 |
10.60 |
9.40 |
7.70 |
|
|
Hf |
13.75 |
11.85 |
10.40 |
9.30 |
7.50 |
|
|
Ti |
CO32 |
11.62 |
9.78 |
7.08 |
— |
_ |
|
Zr |
11.65 |
9.80 |
7.09 |
— |
— |
|
|
Hf |
11.68 |
9.82 |
7.10 |
— |
— |
|
|
Ti |
HCO3" |
3.30 |
2.81 |
2.06 |
1.36 |
— |
|
Zr |
3.32 |
2.82 |
2.08 |
1.37 |
— |
|
|
Hf |
3.34 |
2.83 |
2.10 |
1.38 |
™ |
|
|
Ti |
СГ |
1.49 |
-0.10 |
-0.67 |
-2.02 |
— |
|
Zr |
1.57 |
-0.10 |
-0.67 |
-2.02 |
— |
|
|
Hf |
1.65 |
-0.10 |
-0.67 |
-2.02 |
— |
|
|
Ti |
F~ |
9.31 |
7.29 |
5.00 |
4.00 |
2.80 |
|
Zr |
9.80 |
8.08 |
6.00 |
5.00 |
4.00 |
|
|
Hf |
10.29 |
8.87 |
7.00 |
6.00 |
5.20 |
Таблица 2. Значения стандартной свободной энергии Гиббса A G0 f(298) Дж/моль для соединений титана Table 2. The values of the standard free Gibbs energy A G0 f(298) J/mol for titanium compounds
|
Ион. минерал Ion. mineral |
f(298) Дж/моль |
Ион. минерал Ion. mineral |
AG°f(298) Дж/моль |
Ион. минерал Ion. mineral |
AG°f(298) Дж/моль |
|
J/mol |
J / mol |
J /mol |
|||
|
H,O |
-237141 |
TiF+3 |
-694343 |
TiCl/ |
-757431 |
|
Ti+ 4 |
-354451 |
TiF/2 |
-10117705 |
TiCl4° |
-877191 |
|
TiOH+3 |
-619343 |
TiF/ |
-1327996 |
Ti(OH)3Cl° |
-1237653 |
|
Ti(OH),+2 |
-876153 |
T1F4° |
-1632579 |
TiCO,+2 |
-953761 |
|
Ti(OH)3+ |
-1101340 |
TiF5- |
-1930312 |
Ti(CO3)7” |
-1537568 |
|
Ti(OH)4° |
-1323274 |
TiF6-2 |
-2276629 |
TitCO.);2 |
-2105964 |
|
Ti(OH)c |
-1457876 |
Ti(OH)3F° |
-1419222 |
TiHCO3+3 |
-965157 |
|
Ti(OH)c2 |
-1614100 |
TiOF+ |
-949768 |
Ti(HCO,)7+2 |
-1568066 |
|
TiSOZ2 |
-1140042 |
TiOF," |
-1253108 |
Ti(HCO3)3+ |
-2166694 |
|
Ti(SO4)7° |
-1911614 |
TiOF; |
-1561887 |
Ti(HCO3)4° |
-2761327 |
|
Ti(SO4)c2 |
-2669943 |
TiOF4-2 |
-1848909 |
T1OC7O4° |
-1343482 |
|
Ti(SO4)4^ |
-3410077 |
TiF„OH- |
-2187813 |
TiO(C7O4)7-2 |
-2042628 |
|
Ti0S04° |
-1392393 |
TiCF3 |
-499245 |
TiOCH,COO+ |
-1038887 |
|
Ti(OH)3SO4° |
-1623353 |
T1C17+2 |
—629963 |
TiO(CH,COO),° |
-1423815 |
|
TiO, |
TiO, |
FeTiO, |
|||
|
-883259 |
-888951 |
-1158173 |
|||
|
анатаз / anatase |
рутил / rutile |
ильменит / ilmenite |
Процесс физико-химического моделирования на ЭВМ детально разобран в работах [5, 12].
Профиль выветривания базальтов представлен на рисунке.
Начиная с самой верхней части профиля, от p[W/R], равного 6 (соотношение «вода — порода» = 1000000 : 1 [Wаter/Rock]), титан в растворе существует только в виде одного нейтрального гидроксокомплекса Ti(OH) 4 0. Других ионов титана практически нет. Растворимость рутила на всём интервале рН-профиля составляет 10-7 моль/л
(И. К. Карпов, автор метода физико- химического моделирования на ЭВМ и программы «Селектор» [5] для соотношения «вода — порода» использовал обозначение р и ) .
Верхняя часть профиля выветривания (на бокситовых месторождениях это зона кирасы) представлена парагенезисом «рутил + гётит + гиббсит», который наблюдается до уровня р[W/R] = 4.15. Зона «рутил + гётит + гиббсит + каолинит» начинается с р[W/R] = 4.55. Ниже отметки 4.15 гиббсит исчезает, здесь кончается боксит как руда.
В процессе моделирования можно менять соотношение «вода — порода». По мере увеличения количества растворённой породы в профиле исчезает гиббсит и появляется каолинит (зона p[W/R] 4.55 до 3). До границы смены окислительных условий на восстановительные наблюдается парагенез — рутил, гётит, каолинит.
Дождевая вода, просачиваясь по профилю выветривания, с верхними минеральными зонами профиля уже практически не реагирует, поскольку всё, что растворимо, вымыто из профиля раньше. К нижним участкам разреза поступает практически свежая дождевая вода. Здесь работает принцип частичного равновесия [8].
Восстановительные условия создавались титрованием атмосферы углеродом при соотношении «вода — порода» 1000 : 1 (p[W/R] = 3). Здесь проходит геохимический барьер смены окислительных условий на восстановительные, который четко фиксируется изменением минерального состава и параметров Eh и рН.
Смена окислительных условий на восстановительные отмечается скачком рН и особенно четко — резким изменением параметра Eh, который приобретает отрицательные значения (см. рисунок).
Минеральный парагенезис в восстановительных условиях профиля выветривания представлен рутилом, пиритом, кремнезёмом, каолинитом, сидеритом, кальцитом, иллитом и бейделлитом.
Зона «рутил + гётит + каолинит» окрашена гидро-окислами железа в красно-рыжий цвет и прослеживается до границы смены окислительных условий профиля выветривания на восстановительные. Эта граница четко вид на по сероватому цвету пород, поскольку железо в восстановительных условиях входит в состав пирита, сидерита и новообразованных смешанослойных алюмосиликатов, представленных иллитами и бейделлитами разного состава. Присутствует также кремнезём и карбонаты (кальцит и доломит). Красящей рыжей окраски оксидов железа здесь нет. Рутил, поскольку его растворимость 10-7 моль/л, присутствует в профиле выветривания по всему разрезу и сохраняется в дальнейшем при переносе в эрозионном процессе.
Аналогичная модель поведения олова в профиле выветривания приведена в работе [6].
Выводы
Таким образом, физико-химическое моделирование на ЭВМ поведения титана в профиле выветривания подтверждает постоянное наличие во всём разрезе профиля рутила, начиная с самой верхней его части — с зоны кирасы.
Образуется рутил при разрушении в окислительной обстановке ильменита, в котором железо двухвалентно. В коренных породах, подверженных выветриванию, возможен, конечно, и первичный рутил.
В итоге образуется лейкоксен, в состав которого рутил входит совместно с кремнезёмом и железом [4, 13]. Растворимость рутила на всём интервале рН-профиля составляет 10-7 моль/л. Из всех использованных нами при физико-химическом моделировании возможных ионов и комплексов титана последний в профиле выветривания существует только в виде одного нейтрального гидроксо-комплекса Ti(OH) 4 0.
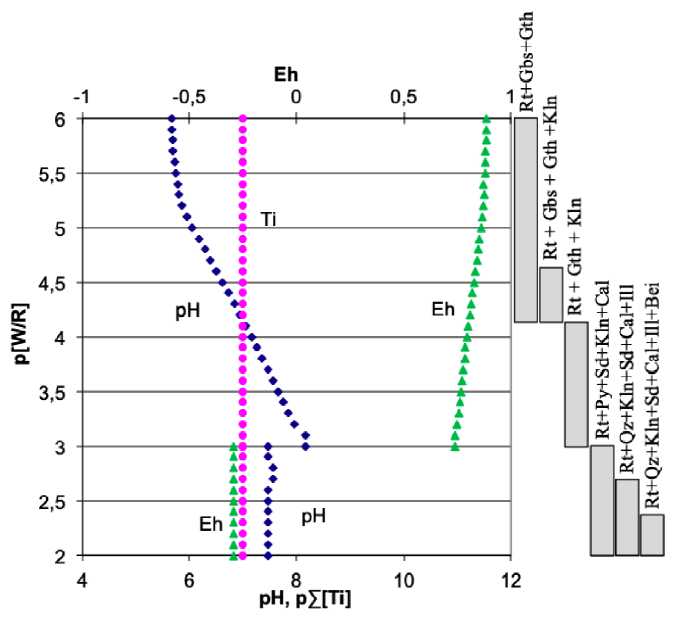
Профиль выветривания базальтов: Gbs — гиббсит, Gth — гётит, Rt — рутил, Kln — каолинит, Ill — иллит, Py — пирит, Sd — сидерит, Bei — бейделлит, Cal — кальцит, Qz — кварц (сокращённые названия минералов даны по рекомендации [18])
♦ рН, a Eh, • p Z [Ti]
Weathering profile of ilmenite basalts: Gbs — gibbsite, Gth — goethite, Rt — rutile, Kln — kaolinite, Ill — illite, Py — pyrite, Sd — siderite, Bei — beidellite, Cal — calcite, Qz — quartz (abbreviated names of minerals are given on the recommendation [18])
♦ рН, a Eh, • p £ [Ti]
Список литературы Физико-химическая модель поведения титана в профиле выветривания
- Виноградов А. П. О причинах высокого содержания титана в бокситах//Изв. АН СССР. 1957. Cерия геол. № 4. C. 98-103.
- Войткевич Г. В., Мирошников А. Е., Поваренных А. С., Прохоров В. Г. Краткий справочник по геохимии. М.: Недра, 1977. 184 с.
- Годнева М. М., Мотов Д. Л. Химия подгруппы титана: сульфаты, фториды, фторсульфаты из водных сред. М.: Наука, 2006. 302 с.
- Игнатьев В. Д., Бурцев И. Н. Лейкоксен Тимана: минералогия и проблемы технологии. СПб.: Наука, 1997. 215 с.
- Карпов И. К. Физико-химическое моделирование на ЭВМ в геохимии. Новосибирск: Наука, 1981. 248 с.


