Физико-химические характеристики, антиоксидантная активность и эффективность пептида, выделенного из молозива коров, на экспериментальной модели сахарного диабета 2-го типа
Автор: Тихонов С.Л., Мерзлякова Н.В., Тихонова Н.В., Ожгихина А.С.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 1 (88), 2023 года.
Бесплатный доступ
Целью исследований является и влияния пептида с аминокислотной последовательностью ILGKLLSTAAGLLSNL, выделенного из трипсинового гидролизата молозива коров, на показатели антиоксидантной защиты лабораторных животных на фоне модели сахарного диабета 2-го типа. Молекулярно-массовое распределение пептида оценивали масс-спектрометрическим методом и идентифицировали методом MALDI-TOF. Анализ масс-спектров осуществляли с помощью программы Mascot с использованием базы данных Protein NCBI. Микросеквенирование проводили с помощью секвенатора MiSeqи-системы для высокопроизводительного секвенирования PGM IonTorrent. Моделирование пространственной структуры выделенных пептидов осуществляли с помощью программы молекулярного моделирования Schrodinger Maestro. Антиоксидантную активность пептидов определяли методами DPPH, ABTS и FRAP. Из трипсинового гидролизата молозива коров выделен полипептид, состоящий из 16 аминокислот с последовательностью ILGKLLSTAAGLLSNL и молекулярной массой 1583,05 Да. Анализ смоделированных пространственных структур пептида позволил установить, что он образует только альфа-структуру и относится к амфифильным, суммарный заряд пептида составляет +1, изоэлектрическая точка - на уровне 10, 15. Полученные физико-химические характеристики пептида позволяют предположить, что выделенный пептид относится к антиоксидантным. Экспериментально установлено, что пептид обладает антиоксидантной активностью (3,21 ммоль экв. Тролокса/л). Доказано, что внутрижелудочное введение пептида ежедневно в течение 30 дней в дозе 0,9 мг/кг диабетическим крысам способствует снижению уровня гипергликемии и показателей оксидативного стресса.
Пептиды, молозиво коров, антиоксидантные свойства, сахарный диабет, молекулярная масса, аминокислотная последовательность
Короткий адрес: https://sciup.org/142237231
IDR: 142237231 | УДК: 543.645.6 | DOI: 10.53980/24131997_2023_1_36
Текст научной статьи Физико-химические характеристики, антиоксидантная активность и эффективность пептида, выделенного из молозива коров, на экспериментальной модели сахарного диабета 2-го типа
Во всем мире растет тенденция к использованию коровьего молозива и продуктов его переработки в составе функциональных продуктов питания и фармацевтических препаратов для профилактики желудочно-кишечных и респираторных заболеваний [1]. Естественное присутствие питательных и физиологически активных компонентов, таких как иммуноглобулины, факторы роста, гормоны и лактоферрины, пептиды, вызывает повышенный интерес к молозиву коров. Основные компоненты молозива могут быть разделены на: а) иммунные факторы, а именно иммуноглобины (IgG, IgA и IgM), лактоферрин (LF), лизоцим, лактопероксидазу, микроРНК, гликоконъюгаты, В- и Т-лимфоциты, лейкоциты, интерлейкины и другие полипептиды, богатые пролином; б) факторы роста, а именно факторы синтеза инсулина (IGF-I и -II), факторы роста эпителия, гормоны роста, факторы роста тромбоцитов, факторы роста фибробластов и эпидермального факторы роста; в) питательные компоненты, а именно жирные кислоты, олигосахариды, аминокислоты, витамины и минералы [2 - 4].
Важным биологическим активным компонентом молозива коров являются пептиды.
Белки и пептиды, выделяемые в молоко молочными железами, отвечают за биологическую активность молока. Опиоидные пептиды представляют собой пептиды с высоким сродством к опиоидным рецепторам и проявляют фармакологическую активность, сходную с морфином. Они ферментативно образуются ( in vitro ) из коровьего казеина и присутствуют в центральной нервной системе, желудочно-кишечном тракте и иммунной системе [5]. β-казомор-фины содержатся в человеческом и коровьем молозиве [6]. N-концевая последовательность всех обычных опиоидных пептидов одинакова (Try-Gly-Gly-Phe). Сывороточный протеин содержит идентичные опиоидам последовательности, в частности α-лактальбумин - как для человека, так и для крупного рогатого скота с фрагментом 50-53, и β-лактоглобулин для крупного рогатого скота с фрагментом 102-105 [7]. Эти пептиды называются α- и β-лакторфинами.
Биопептиды могут быть получены в результате ферментативного гидролиза белка [8], и такие пептиды по функциональным свойствам соответствуют исходному белку. Авторы получили ферментативный гидролизат из соевого белка со степенью гидролиза 82 - 83 % и выявили антиоксидантные свойства полученных пептидов [9]. Получен гидролизат яичного альбумина с высокой степенью гидролиза и определены оптимальные показатели [10].
Одним из наиболее изученных компонентов молозива является лактоферрин, многофункциональность которого заключается в регуляции железа в организме. Средняя концентрация лактоферрина в коровьем молозиве составляет 6 - 8 г/л [11].
Авторами [12] из лактоферина получены антиоксидантные пептиды с молекулярной массой от 913 до 2351 Да.
Одним из наиболее распространенных заболеваний является сахарный диабет 2-го типа (СД2). При развитии сахарного диабета усиливается свободнорадикальное окисление, снижается активность антиоксидантных ферментов и увеличивается количество перекиси водорода [13].
Актуальным является поиск новых биологически активных веществ, воздействующих на ключевые факторы патогенеза, определяющие формирование этого социально значимого заболевания и его хронических осложнений.
В исследованиях [14] установлено, что животные с диабетом, получавшие азотсодержащую карбоновую кислоту – креатин, имели увеличенную площадь клеток островков поджелудочной железы. Эти результаты также могут быть связаны с прямым антиоксидантным действием креатина, оказывающим защитный или регенеративный эффект на островки во время лечения СД [15]. Известно, что для синтеза креатина необходимы три аминокислоты, в частности глицин и аргинин, которые, согласно базе данных Protein NCBI, входят в состав многих антиоксидантных пептидов.
Целью исследований является характеристика и исследование влияния пептида с аминокислотной последовательностью ILGKLLSTAAGLLSNL, выделенного из трипсинового гидролизата молозива коров, на показатели антиоксидантной защиты лабораторных животных с индуцированным сахарным диабетом 2-го типа.
Материал и методы исследования
Молекулярно-массовое распределение пептида оценивали масс-спектрометрическим методом и идентифицировали методами MALDI-TOF и MS масс-спектрометрии на MALDI-времяпролетном масс-спектрометре Ultraflex (Bruker, Германия). Анализ масс-спектров проводили с помощью программы Mascot, опция Peptide Fingerprint (Matrix Science, США) с использованием базы данных Protein NCBI. Для микросеквенирования использовали секвенатор MiSeq (Illumina, США) и системы для высокопроизводительного секвенирования PGM IonTorrent (Life Technologies, США). Моделирование пространственной структуры выделен- ных пептидов осуществляли с помощью программы молекулярного моделирования
Schrodinger Maestro (США). Score пептида рассчитывали по формуле (1):
Mprot Х nnmi '
Score =
где Mprot — молекулярная масса для каждого совпавшего белка; n — произведение, которое рассчитывается из Mowse-матрицы весов M для каждого совпадения экспериментальных данных и масс пептидов, рассчитанных из записей в геномной базе данных Protein NCBI.
Антиоксидантную активность пептида определяли тремя методами: DPPH (2,2-diphenyl-1-picrylhydrazyl), ABTS (2.2-azino-bis(3-ethylbenzothiazoline-6-sulfonate)) и FRAP (ferric-reducing antioxidant power).
Исследования по экспериментальному обоснованию применения пептида при сахарном диабете 2-го типа проводили в Институте иммунологии и физиологии Уральского отделения Российской академии наук (ИИФ УрО РАН) (г. Екатеринбург). В эксперименте использованы крысы-самцы Wistar в возрасте 12 недель массой 354±7 г, которые содержались в клетках по 5 животных в каждой, в стандартных лабораторных условиях при температуре 20±2 °C, со сменой световой (12 ч) и темновой (12 ч) фаз, со свободным доступом к воде и корму. Все манипуляции с животными были осуществлены в соответствии с Директивой Совета ЕС 2010/63/EU и одобрены этическим комитетом ИИФ УрО РАН. Для эксперимента сформировали 3 группы крыс по 7 животных в каждой: 1-я группа - интактные, у крыс 2-й и 3-й групп моделировали СД2 после 16 ч голодания внутрибрюшинным введением раствора стрептозо-тоцина в цитратном буфере pH 4,5 дозой 65 мг/кг с предварительным введением раствора никотинамида в воде для инъекций дозой 110 мг/кг. Животные 3-й группы дополнительно к основному рациону получали пептид молозива коров ежедневно в течение 30 дней в дозе 0,9 мг/кг массы тела. Для внутрижелудочных введений пептида использовали зонд DE006A 18Gx50 mm (Великобритания).
Животные всех групп были выведены из эксперимента путем внутримышечного введения пентобарбитала натрия в дозе 40 мг/кг. Отделение плазмы крови от форменных элементов проводили центрифугированием при 1000 g в течение 10 мин. Содержание глюкозы в плазме крови определяли глюкозооксидазным методом с использованием набора реактивов Глюкоза-Ново («Вектор-Бест», Российская Федерация). В плазме крови определяли содержание продуктов свободнорадикального окисления, реагирующих с тиобарбитуровой кислотой, включающих малоновыйдиальдегид (МДА). Количество восстановленного глутатиона (GSH) и других тиолов определяли в плазме крови по реакции с реактивом Эллмана (5,5′-дитиобис(2-нитробензойная) кислота).
Статистический анализ проводился с использованием программного обеспечения OriginPro 9.0 (Originlab Corporation, США). Данные представлены в виде среднего значения ± стандартная ошибка среднего значения. Статистическая значимость различий в полученных данных оценивалась с использованием непараметрического критерия Манна – Уитни (U). Установлен 5%-ный уровень значимости различия средних значений в группе, P<0,05.
Результаты исследований и их обсуждение
Из трипсинового гидролизата молозива коров выделен полипептид, состоящий из 16 аминокислот в последовательности ILGKLLSTAAGLLSNL, которому дано условное название mpT2. При идентификации пептида по базе данных Protein NCBI установлено, что он близок к пептиду под названием «LL-16 Alytesobstetricans», обладающему противодиабетическим действием. Score выделенного пептида составляет 82 при оптимальном 80, что свидетельствует о высокой сходимости с пептидом «LL-16 Alytesobstetricans».
На рисунке 1 представлена хроматограмма пептида mpT2.
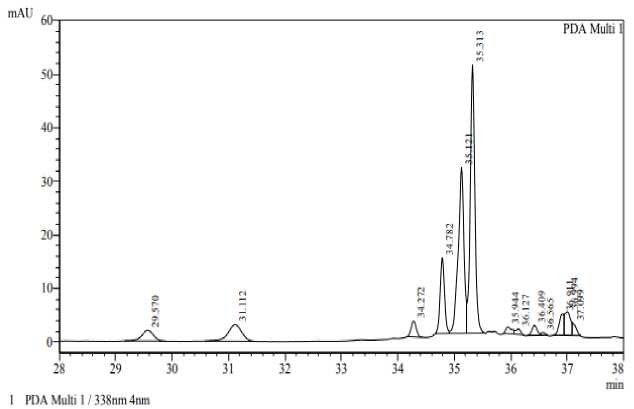
Рисунок 1 – Хроматограмма пептида mpT2
Авторами выдвинута гипотеза по использованию пептида mpT2 для коррекции оксида-тивного стресса при сахарном диабете 2-го типа (СД2), теоретическим обоснованием которой 39
являются количественный и качественный состав аминокислот, аминокислотная последовательность, молекулярная масса, заряд, гидрофильность и другие физико-химические характеристики пептида.
Аминокислотный состав пептида в значительной степени влияет на его свойства и биологическую активность [19]. Авторами [20] установлено, что присутствие лизина (K) способствует усилению антиоксидантных свойств активных пептидов. Лизин (K) действует как донор водорода и, следовательно, усиливает активность пептида по нейтрализации свободных радикалов. В исследуемом нами пептиде присутствует лизин.
По данным [21], антиоксидантная активность пептидов тесно связана с их относительной молекулярной массой, аминокислотной последовательностью и гидрофильностью. Молекулярная масса пептида mpT2 составляет 1583,05 Да. Авторами [22] установлено, что молекулярные массы антиоксидантных пептидов пищевого происхождения в основном ниже 2000 Да.
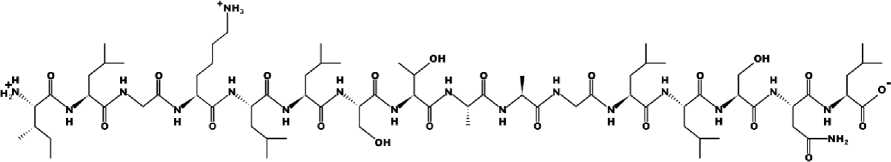
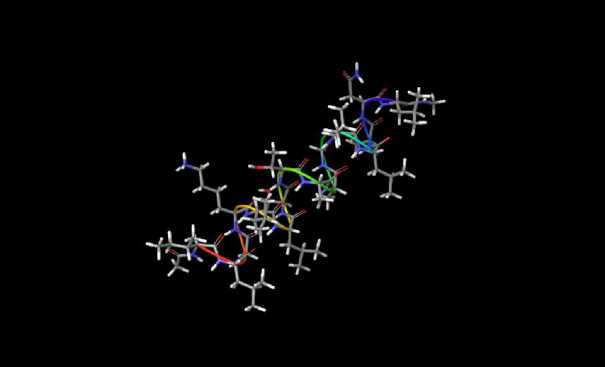
На рисунке 2 представлены двухмерная и трехмерная модели пептида.
а
б
Рисунок 2 – Модель пептида: а - двухмерная; б - трехмерная
Анализ смоделированных пространственных структур пептида позволил установить, что он образует только альфа-структуру, каждая спираль которой состоит из 4 аминокислотных остатков, при этом водородные связи образуются между первым и четвертым аминокислотными остатками.
Альфа-спиральная стержнеобразная структура образуется за счет плотного правостороннего скручивания аминокислотной цепи. Эта форма обусловлена водородной связью между водородом в аминогруппе и кислородом в карбоксильной группе. Большинство альфа-спиралей являются амфифильными, что означает, что они содержат как гидрофильные, так и гидрофобные области. Обычно гидрофильные остатки аминокислот расположены напротив гидрофобных остатков. Чем больше аминокислотная последовательность, тем меньше растворимость пептидов. Выделенный пептид относится к амфифильным (уровень гидрофильности равен +7,04 Ккал Х моль -1 ), что определяется наличием количеством гидрофильных и гидрофобных аминокислот. Суммарный заряд пептида равен +1, изоэлектрическая точка находится 40
в более щелочной среде и составляет 10,15. По данным [23], изоэлектрическая точка антиоксидантных пептидов находится в диапазоне от 9,58 до 12,48, а заряд - от +1 до +2. Полученные нами физико-химические характеристики пептида теоретически позволяют предположить, что он относится к антиоксидантным. На основании анализа аминокислотных последовательностей пептида можно прогнозировать, что механизм действия его нацелен на поверхностные антигены, на рецепторы нейрогипокретина и оксидоредуктазы. Следует отметить, что проникновение пептидов в клетки зависит от заряда. 3D-модель позволила определить заряд пептида +1. Полученные данные о заряде научно обосновывают механизмы его проникновения в клетки, которые классифицируют на энергозависимые или энергонезависимые [24]. Энергозависимые пептиды чаще взаимодействуют с определенным типом клеток [25] и не могут преодолевать многоклеточные барьеры [26]. В результате они не являются идеальными средствами доставки лекарств для 12 малых молеку л. С другой стороны, некоторые энергонезави симые пептиды могут разрушать клеточные мембраны путем образования пор. Этот токсиче ский эффект ограничивает полезность этих пептидов [2 7]. На основании классификации [25] c учетом заряда исследуемый пептид относится к энергозависимым и может проникать в кровь и любые типы клеток, что позволяет его использовать для ингибирования фермента DPP-IV, что также подтверждает его антидиабетические свойства.
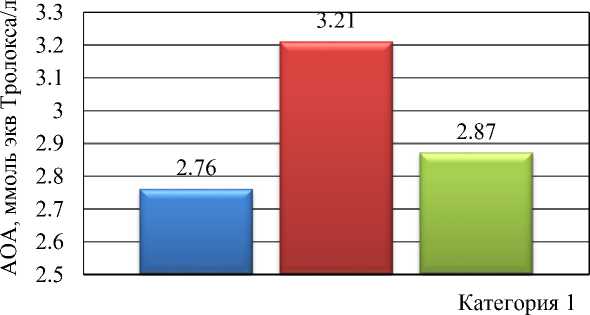
На рисунке 3 представлены результаты исследований антиоксидантных свойств пептида mpT2 in vitro.
и DPPH и ABTS и FRAP
Рисунок 3 – Антиоксидантная активность пептида
Установлено, что исследуемый пептид mpT2 обладал антиоксидантной активностью (АОА). При этом АОА пептида в зависимости от метода исследований имел разные значения. Наибольшее значение отмечалось при методе ABTS и составило 3,21 ммоль экв. тролокса/л, что выше в сравнении с методами DPPH и FRAP на 16,3 и 11,9 %.
Проведены исследования по влиянию пептида mpT2 на АОА крови крыс на модели сахарного диабета 2-го типа. Установлено, что моделирование сахарного диабета 2-го типа сопровождалось развитием гипергликемии. Через 30 сут после моделирования СД2 наблюдали увеличение уровня глюкозы до 18,1 ммоль/л и накопление гликированного гемоглобина до 10,3 % во 2-й группе животных, что выше таковых в интактной группе в 2,9 и 2,4 раза соответственно. Введение пептида молозива диабетическим животным (2-я группа) сопровождалось менее выраженной гипергликемией. Количество глюкозы и гликированного гемоглобина было выше в 1,7 и 1,6 раза соответственно по сравнению с исследуемыми показателями интактной группы.
В таблице представлены показатели оксидативного стресса на фоне развития СД2 у лабораторных животных.
Таблица
Показатели оксидативного стресса на фоне развития СД2 у крыс линии Wistar
|
Показатель |
Группа |
||
|
1 Интактные |
2 СД2 |
3 СД2+пептид mpT2 |
|
|
МДА, мкмоль/л |
1,98±0,05 |
3,54±0,01* |
2,74±0,05 * |
|
Глутатион, мкмоль/л |
22,47±2,16 |
5,68±0,71* |
24,53±3,02 |
|
Каталаза, ммоль/мин∙г |
53,48±2,73 |
87,23±1,57* |
72,25±3,11* |
* – различие с показателем интактной группы достоверно при P<0,05.
В плазме крови животных 2-й группы отмечалось достоверное увеличение МДА на фоне развития СД2 типа по сравнению с интактными животными (1-я группа) на 78,79 %, в то время как на фоне перорального применения пептида mpT2 крысам с сахарным диабетом (3-я группа) количество МДА возросло на 38,4 %.
МДА является продуктом перекисного окисления липидов в организме и обладает цитотоксичным, мутагенным и канцерогенным действием [28]. Содержание МДА во 2-й группе значительно увеличилось ( P <0,05) по сравнению с интактной группой. Напротив, содержание MДА в 3-й группе животных, обработанных антиоксидантным пептидом, увеличилось, но в меньшей степени. Это указывает на то, что антиоксидантный пептид может эффективно ингибировать перекисное окисление липидов. Полученные данные согласуются с исследованиями [29], в которых установлено, что образцы служат донорами электронов и способны реагировать со свободными радикалами, превращая их в более стабильные соединения и прекращая цепные свободно-радикальные реакции окисления.
Во 2-й группе достоверно снизилось количество глутатиона на 74,7 %, в 3-й группе достоверных изменений этого показателя не отмечено. Увеличение количества каталазы во 2-й группе на 63,1 % по сравнению с интактными животными, возможно, связано с фазностью в изменении активности антиокислительных ферментов, как и в изменении величины других неспецифических показателей: увеличение активности в начальный период развития патологии (фаза компенсации) с последующим снижением показателя при более длительном течении патологии или при более интенсивном действии повреждающего фактора (фаза декомпенсации). Компенсация в первой фазе является частичной, равновесие неустойчиво, так как количество продуктов липопероксидации неуклонно возрастает. Следует отметить, что на увеличение активности фермента каталазы оказывают влияние количество субстрата, активаторы и ингибиторы, изменяющие активность уже имеющихся молекул фермента, а также регуляторы, действующие на регуляторные гены и увеличивающие синтез ферментов. Активность каталазы определяли в эритроцитах, где синтез фермента невозможен. Наиболее вероятным фактором, влияющим на активность каталазы в эритроцитах, является также количество субстрата. Применение пептида молозива способствует приближению активности каталазы и содержания МДА к уровню нормы.
Заключение
Из ферментативного гидролизата молозива коров получен антиоксидантный пептид с аминокислотной последовательностью ILGKLLSTAAGLLSNL. Идентификация пептида по базе данных Protein NCBI и расчет Score позволили предположить его высокую сходимость с антидиабетическим пептидом «LL-16 Alytesobstetricans». Результаты компьютерного моделирования двух и трехмерной структуры пептида и оценка его физико-химических свойств (молекулярная масса, изоэлектрическая точка и др.) позволили предположить о том, что пептид обладает антиоксидантными свойствами. В исследованиях in vitro доказаны антиоксидантные свойства полученного пептида. Возможный механизм действия антиоксидантного пептида заключается в нейтрализации аминокислотными остатками молекул свободных радикалов. В эксперименте in vivo путем моделирования сахарного диабета 2-го типа, который сопровождается развитием гипергликемии и оксидативного стресса, доказано, что внутрижелудочное введение пептида mpT2 молозива ежедневно в течение 30 дней в дозе 0,9 мг/кг диабетическим крысам способствует снижению уровня гипергликемии и показателей оксидативного стресса.
Полученные данные позволяют рекомендовать использование пептида в составе пищевой продукции и биологически активных добавок для предупреждения развития свободно-радикального окисления при различных патологиях, в том числе сахарного диабета, с условием дополнительного подтверждения биодоступности, безопасности и эффективности.


