Физико-химические особенности очистки природного и техногенного рассола в производстве кальцинированной соды
Автор: Дубровина К.Р., Шакиров Т.Р., Хацринов А.И., Сулейманова А.З., Водопьянова С.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 2 (104) т.87, 2025 года.
Бесплатный доступ
Промышленное производство соды в России реализовано аммиачным способом по методу Сольве. Ежегодный выпуск товарного бикорбаната натрия достигает 2 млн т. Основной ключевой стадией производства соды является очистка рассола. Рассмотрены проблемы использования основного сырья в производстве соды. Приведены методики экспериментов. Цель работы заключалась в рассмотрении физико-химических особенностей и процессов очистки хлоридных рассолов техногенного и природного происхождения. При решении поставленных задач использовались следующие методы: химический состав исходных проб и растворов (рассолов) анализировался системой капиллярного электрофореза «Капель-205»; минеральный состав нерастворимого в воде остатка изучался с использованием рентгенофлуоресцентного спектрометра Clever C-31 и рентгенографическим количественным фазовым анализом на дифрактометре РоwDiХ 600 Adwin. По результатам экспериментов получены следующие данные, характеризующие физико-химическое влияние СаSО4 на очистку техногенного и природного хлоридных рассолов. Содово-каустический метод очистки сырого рассола эффективнее всего проводить при температуре менее 12ºC, так как при этой температуре остаточное содержание ионов кальция и магния в рассоле наименьшее. Техногенные рассолы (пластовые воды), содержащие большое количество хлорида натрия, могут служить ценным сырьем для производства кальцинированной соды. Механизм образования твердой фазы представлен образованием и ростом аморфных зародышей вследствие роста по граням кристаллизации. Второй фазой является коагуляция частиц с образованием крупных рыхлых агрегатов. Дальнейшие исследования будут продолжены по исследованию взаимной растворимости системы СаСО3-Mg(OH)2-NaCl.
Рассол, пластовая вода, хлорид натрия, каменная соль, соли кальция, соли магния, очистка, кальцинированная сода
Короткий адрес: https://sciup.org/140312488
IDR: 140312488 | УДК: 661.33 | DOI: 10.20914/2310-1202-2025-2-183-190
Текст научной статьи Физико-химические особенности очистки природного и техногенного рассола в производстве кальцинированной соды
Кальцинированная сода является многотоннажным продуктом химической промышленности и служит незаменимым сырьем для стекольной, мыловаренной, металлургической и военной промышленности. Кальцинированную соду в основном получают аммиачным способом по методу Сольве.
Однако аммиачный способ производства фактически достиг предела своего технологического совершенствования и, несмотря на ряд достоинств (легкость добычи и дешевизна исходного сырья, непрерывность производственного процесса, высокое качество конечного продукта) характеризуется крупными недостатками: низкое использование исходного сырья (натрия до 70%), большое количество отходов (8–12 м3 жидких и 250 кг твердых отходов на 1 т продукции). Все это усугубляется тем, что аммиачно-содовые заводы относятся к категории экологически вредных предприятий, из-за значительного количества хлор-кальциевых промстоков, образующих так называемые «белые моря» и наносящие вред окружающей среде [1–5].
Одним из сырьевых источников получения кальцинированной соды является хлоридный рассол, получаемый скважинным растворением каменной соли. Для содовой промышленности данный способ добычи является экономически более выгодным по сравнению с традиционным получением концентрированных рассолов из твёрдой каменной соли.
Следует отметить, что запасы «богатой» природной каменной соли истощаются и существует необходимость в поиске альтернативных источников рассолов хлорида натрия.
Крупными сырьевыми источниками техногенных рассолов, содержащих хлорид натрия, являются предприятия нефтехимической отрасли. В процессе добычи нефти попутно извлекаются пластовые воды. Пластовые воды по вещественному составу представлены преимущественно хлоридом натрия c минерализацией от 80 до 300 г/л. Также в её составе могут присутствовать Н 2 S, Fе 2 О 3 и легкие углеводороды. В процессе нефтехимической переработки нефти образуется абгазный НСl. Улавливание и нейтрализацию проводят в щелочном скруббере, при этом образуются стоки хлорида натрия с минерализацией около 280–310 г/л. Валовый ежегодный объем получаемых техногенных рассолов более 3 млн т при добыче и более [6–11].
Таким образом, проблема утилизации многотоннажных техногенных рассолов создает значительную угрозу для окружающей среды ввиду образования стоков и фильтратов, содержащих хлорид натрия. Таким образом в работе, авторами рассмотрены физико-химические исследования содово-каустического способа очистки природных и техногенных рассолов с целью дальнейшего использования их в производстве кальцинированной соды.
Материалы и методы
Технологические испытания и аналитические исследования проводились на кафедре «Технологии неорганических веществ и материалов» ФГБОУ ВО «Казанский национальный исследовательский технологический университет».
В исходных образцах и промежуточных продуктах, рассолах определялось содержания следующих компонентов: нерастворимый остаток, Са2+, Мg2+, Na+, K+, Cl-, SО 4 2-. Данные химического состава были песчитаны на солевой состав согласно методике [4]. Аналитические исследования проводились системой капиллярного электрофореза «Капель-205» и титрованием. Плотность рассолов определяли на плотномере Anton Paar DMA 4501. Твердые водонерастворимые соединения изучались с использованием рентгенофлуоресцентного спектрометра Clever C-31 и рентгенографическим количественным фазовым анализом на дифрактометре РоwDiХ 600 Adwin.
Методика очистки. Рассол очищается от ионов кальция и магния, переводя их в нерастворимые соединения (СаСО 3 и Mg(OH) 2 ) с добавлением растворов соды и щелочи [8, 13].
В работе проведены исследования по влиянию условий растворения на степень перехода в раствор SО 4 2-, Са2+. По расчетному количеству для получения сырого рассола, внесли каменную соль и воду. Растворение проводили при 25 ℃, продолжительность перемешивания составляла 60 минут. При данных условиях получен сырой рассол плотностью 1,193 г/см3 и общим содержанием NaCl 306 г/л. Рассол анализировался на содержание сульфатов и ионов кальция титриметрическим методом. Количество Са2+ = 0,24%, SО 4 2- = 0,81%. Переход СаSО 4 из твердой каменной соли в рассол составил 12,93%.
Коэффициентом перехода можно считать 1,29.
Результаты
В работе изучены следующие объекты исследования: пластовая вода и каменная соль Яр-Бишкадакского месторождения.
По химическому составу исследуемые объекты в качестве основного компонента содержали в своем составе хлорид натрия. Пластовая вода содержит NaCl – 243,54 г/л, СаSО 4 – 17,06 г/л, МgСО 3 – 3,63 г/л, содержание K+, Br-, Sr2+ составляет менее 0,5 г/л. Каменная соль Яр-Биш-кадакского месторождения содержала NaCl – 91,15%, СаSО 4 – 8,12%, SiО 2 – 0,73%.
Сырой рассол, полученный скважинным растворением или после нефтедобычи (нефтепереработки), содержит вредные примеси солей кальция и магния. Данные соединения приводят к загрязнению целевого продукта и уменьшении степени конверсии гидрокарбоната натрия. Вследствие жестких требований по составу уделено особое внимание к чистоте рассола, регламентирующего содержание ионов по ТУ 2152–008–00204872–2012 (таблица 1).
Очистка рассола хлорида натрия от примесей описывается системой NaCl-Н 2 O в зависимости от температуры [4, 8]. Фазовая диаграмма системы построена в диапазоне температур -30 ÷ 100 ℃ (рисунок 1).
Таблица 1.
Физико-химические показатели рассолов каменной соли
Table 1.
Physicochemical parameters of rock salt brines
|
Рассол | Brine Массовая концентрация Mass concentration |
Рассол сырой Raw brine |
Рассол очищенный Purified brine |
|
Хлоридов в пересчете на NaCl, г/дм3, не менее Chlorides in terms of NaCl, g/dm3, not less than |
306,00 |
302,00 |
|
Суммы кальция и магния в пересчете на Са2+, г/дм3, не более Calcium and magnesium amounts in terms of Ca2+, g/dm3, not more than |
– |
0,07 |
|
Кальция в пересчете на Са2+, г/дм3, не более Calcium in terms of Ca2+, g/dm3, not more than |
1,50 |
– |
|
Магния в пересчете на Мg2+, г/дм3, не более Magnesium in terms of Mg2+, g/dm3, not more than |
0,30 |
– |
|
Углекислого натрия, г/дм3, не более Sodium carbonate, g/dm3, not more than |
– |
0,80 |
|
Сульфатов в пересчете на SО 4 2-, г/дм3, не более Sulfates in terms of SO42-, g/dm3, not more than |
4,00 |
4,00 |
|
Аммиака в пересчете на NН 4 +, г/дм3, не более Ammonia in terms of NH 4 +, g/dm3, not more than |
5,00 |
5,00 |
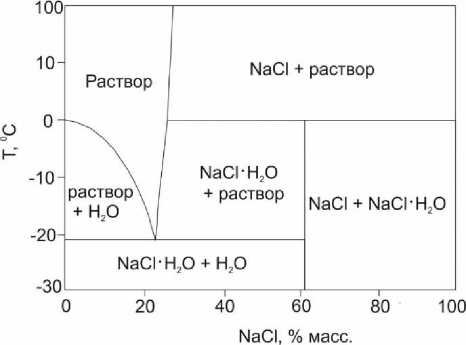
Рисунок 1. Диаграмма растворимости NaCl в зависимости от температуры и его массового содержания в рассоле
-
Figure 1. Diagram of NaCl solubility depending on temperature and its mass content in brine
Свойства хлорида натрия зависят от температуры, имеющее значение при технологических расчетах. Особый интерес представляют термическое расширение и изотермическое сжатие NaCl. При нагревании из-за ангармоничности тепловых колебаний ионов Na+ и Сl– в кристаллической решетке хлорида натрия происходит увеличение среднего равновесного расстояния между частицами, что приводит к заметному возрастанию линейных размеров и общего объема кристалла.
Очистку сырого рассола от ионов кальция и магния проводили содово-каустическим «мокрым» методом.
МgSО 4 + 2NаОН → Mg(OH) 2 ↓+ Nа 2 SО 4
СаSО 4 + Nа 2 СО 3 → СаСО 3 ↓ + 2Nа 2 SО 4
Осадки карбоната кальция и гидроксида магния отделяются от рассола с помощью осаждения и фильтрации, а также удаляются другие механические примеси.
На стадии рассолоочистки температуру рассола поддерживают не выше 22 °С.
Результаты влияния температуры на остаточное содержание ионов кальция и магния в рассоле, полученном из пластовых вод нефтяных месторождений, во время процесса очистки, представлены в таблице 2 и показывают следующее: присутствует незначительное содержание ионов кальция и магния, а также сульфат ионов.
Таблица 2.
Влияние температуры на процесс получения очищенного рассола
Table 2.
The influence of temperature on the process of obtaining purified brine
|
Температура, °С Temperature, °С |
Рассол техногенный | Technogenic brine |
Рассол природный | Natural brine |
||||||
|
Са 2+ , % |
Мg 2+ , % |
Са 2+ , % |
Мg 2+ , % |
|||||
|
до before |
после after |
до before |
после after |
до before |
после after |
до before |
после after |
|
|
12 |
2,81 |
0,020 |
0,65 |
* |
0,79 |
* |
0,17 |
* |
|
20 |
0,021 |
0,011 |
0,007 |
* |
||||
|
45 |
0,043 |
0,014 |
0,009 |
0,001 |
||||
|
75 |
0,064 |
0,026 |
0,019 |
0,001 |
||||
Примечание: * – ион не обнаружен, значение ниже порога обнаружения Note: * – ion not detected, value below detection threshold
Сопоставление остаточного содержания ионов кальция и магния в рассоле при различных температурах показывает, что температура ниже 20 °C значительно влияет на процесс очистки. При температуре 12 °C содержание ионов кальция уменьшается с 2,81 до 0,02%, а ионов магния – с 0,65 до 0% (таблица 2).
Эффективность очистки указывает на то, что более низкие температуры могут способствовать более эффективному удалению ионов кальция и магния из рассола.
Для получения сырого рассола из каменной соли использовались различные соотношения Т:Ж. Растворение пробы в дистиллированной воде проводили в течении одного часа при постоянном перемешивании при комнатной температуре. Затем полученную суспензию отфильтровали от нерастворимого остатка.
Как видно из таблицы 3, чтобы максимально извлечь в раствор хлорид натрия, необходимо поддерживать соотношение Т:Ж = 1:2,5. При данном соотношении в рассоле
Таблица 3.
Влияние Т:Ж на химический состав полученного рассола
Table 3.
The effect of T:F on the chemical composition of the resulting brine
|
Т:Ж |
Плотность, г/см 3 Density |
Состав жидкой фазы, г/л Состав жидкой фазы, г/л |
||||
|
Na + |
Сl - |
Ca |
Mg |
SО4 2- |
||
|
1:2,0 |
1,19458 |
89,5 |
144,0 |
2,3 |
0,2 |
2,3 |
|
1:2,5 |
1,19678 |
96,6 |
152,9 |
2,4 |
0,2 |
2,2 |
|
1:2,8 |
1,18187 |
89,6 |
144,0 |
2,0 |
0,2 |
2,7 |
Очистку рассола, полученного из каменной соли, проводили различными методами. Результаты очистки рассола представлены в таблице 4, которые позволяют оценить эффективность методов очистки.
Очистка рассола может проводиться с использованием различных методов, включая содово-каустический и содово-известковый.
Таблица 4.
Очистка рассола от солей кальция и магния
Table 4.
Purification of brine from calcium and magnesium salts
|
Метод очистки Purify method |
Плотность рассола, г/см 3 Brine density |
Са2+, % |
Мg2+, % |
SО 4 2-, % |
|
Содовокаустический Soda-caustic |
1,1912 |
0,016 |
0 |
0,21 |
|
Содовоизвестковый Soda-lime |
1,1960 |
0,018 |
0 |
0,22 |
Каменная соль на большинстве месторождениях содержит примеси ангидрита в виде сульфата кальция. Во время добычи каменной соли в рассол хлорида натрия переходит сульфат кальция.
Переход сульфата кальция из твердой каменной соли в рассол имеет прямую зависимость от плотности рассола. На рисунке 2 представлена растворимость сульфата кальция в растворах хлорида натрия при 25 ℃.
Наименьшее содержание СаSО 4 отмечено в продуционном рассоле с концентрацией более 280 г/л.
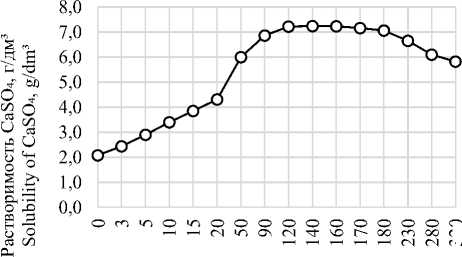
Концентрация NaCl, г/дм³ Concentration of NaCl, g/dm³
Рисунок 2. Растворимость сульфата кальция в растворах хлорида натрия при 25 ℃
-
Figure 2. Solubility of calcium sulfate in sodium chloride solutions at 25 ℃
Переход сульфата кальция можно предотвратить на стадии добычи рассола, путем добавления в раствор выщелачивания – соды. Ввод соды в раствор выщелачивания составил 0,4%. При данной концентрации переход иона кальция в раствор практически не происходит, содержание менее 0,01%.
Обсуждение
Проводится детальный анализ полученных данных в сопоставлении с данными литературы, что служит обоснованием выводов и заключений авторов.
Заключение
Таким образом, в результате проведенных экспериментов получены данные, характеризующие физико-химическое влияние на очистку техногенного и природного рассола.
Содово-каустический метод очистки наиболее эффективен при температуре 12ºC, что приводит к минимальному остаточному содержанию ионов кальция и магния в рассоле.
Техногенные рассолы с высоким содержанием хлорида натрия могут быть использованы как
Перемешивание рассола способствует интенсификации процесса кристаллизации и повышению эффективности очистки, создавая турбулентную диффузию и уменьшая расклинивающее давление.
Образование и рост аморфных зародышей, а также коагуляция частиц приводят к образованию крупных рыхлых агрегатов, что важно для понимания процесса очистки.
Намечены дальнейшие исследования по взаимной растворимости системы СаСО 3 -Mg(OH) 2 -NaCl, что может привести к более глубокому пониманию процессов, происходящих в системе.
Работа выполнена в соответствии с планом научно-исследовательских работ Института нефти, химии и нанотехнологии ФГБОУ ВО «КНИТУ».


