Физико-химические свойства и липидосвязывающая способность бактериальной целлюлозы, синтезированной на молочной сыворотке
Автор: Погорелова Н.А., Сарницкая Н.А., Полянский К.К., Дерканосова А.А., Коновалов С.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 3 (101) т.86, 2024 года.
Бесплатный доступ
Бактериальная целлюлоза (БЦ) имеет значительный потенциал применений в пищевой промышленности, в результате ее способности стабилизировать пищевые дисперсные системы. В данной работе исследовали эффективность биосинтеза БЦ на отходах молочной промышленности, изучены параметры процесса: количество субстрата, титруемая кислотность, масса синтезируемой целлюлозы. Определены физико-химические свойства и липидосвязывающая способность полученных гель пленок и дегидратированных образцов полисахарида. Бактериальную целлюлозу получали в статических условиях, на жидкой питательной среде - молочной сыворотке. Предварительно лактозу молочной сыворотки гидролизовали ферментным препаратом LACTA FREE до количества глюкозы 1.93%. Масса продуцируемой целлюлозы в статических условиях симбиотической консорциумом Medusomyces gisevii составила 3.84 г/л в течение 21-х суток при Т=31°С. Отмечена корреляция низких количеств глюкозы культуральной жидкости на 6-е сутки биосинтеза со снижением значений титруемой кислотности. Степень конверсии глюкозы ферментированной молочной сыворотки на массу продуцируемой бактериальной целлюлозы составила 22.6%. Максимальная скорость биосинтеза 0.181 г СВ/л×сут установлена на 15-е сутки процесса. Определена водоудерживающая способность синтезированных гель пленок бактериальной целлюлозы - 82.35 ± 0.63 г/г. Лиофилизированные образцы бактериальной целлюлозы характеризовались большей водопоглащающей способностью (22.44 г/г) в сравнении с дегидратированными при Т=50°С образцами (5.42 г/г). Установлено, что регидратированные образцы лиофилизированной целлюлозы обладали в 3.43 раза большим показателем отношения количества свободной и связанной влаги в сравнении с высушиваемыми образцами БЦ. Определена насыпная плотность дезагрегированной целлюлозы: лиофилизированной - 20 кг/м3, термически высушенной - 170 кг/м3. В работе дана сравнительная характеристика липидосвязывающей способности БЦ и хитозана. Определены микробиологические показатели дезагрегированной бактериальной целлюлозы.
Бактериальная целлюлоза, водоудерживающая способность, насыпная плотность, липидосвязывающая способность, пищевая добавка
Короткий адрес: https://sciup.org/140308560
IDR: 140308560 | УДК: 577.152:579.67:637.146.35 | DOI: 10.20914/2310-1202-2024-3-166-174
Текст научной статьи Физико-химические свойства и липидосвязывающая способность бактериальной целлюлозы, синтезированной на молочной сыворотке
В настоящее время природные полисахариды и их производные привлекают все большее внимание с точки зрения их практического применения. Хитозан, крахмал и целлюлоза, наиболее распространенные полисахариды, благодаря своим уникальным свойствам, таким как способность к биологическому разложению, биосовместимость и низкая токсичность делает их перспективными для производства средств медицинского назначения и пищевых добавок. Область исследований структурных и надструктурных характеристик целлюлозы бактериального происхождения дает возможность создания новых наноразмерных материалов. Химическая структура растительной и бактериальной целлюлозы одинакова, однако для последней, как показали исследования, характерна высокая степень кристалличности, большая длина и меньший диаметр волокон полимера. Образцы целлюлозы бактериального происхождения с большими значениями соотношений сторон волокон, по сравнению с их растительными аналогами, обладают большей влагоудерживающей и адсорбционной способностью, способствуют эффективной стабилизации как пен, так и эмульсий [1–4].
В работе Daniela Martins изучена стабилизирующая способность БЦ пен, образованных как животными, так и растительным белками. Пенообразующая способность белка и стабильность пены возрастала при введении в состав дисперсной системы более крупных хлопьев целлюлозы [5].
Особую роль играет бактериальная целлюлоза не только в качестве пищевой добавки, решающей технологические задачи, но и как компонент функциональных продуктов. Так окрашенные композиты БЦ, полученные при ферментации с Monascus purpureus были представлены Purwadaria в качестве сырья для производства новых функциональных продуктов питания, в основном в рецептуре искусственного мяса [6, 7].
Формирование 3d фибриллярной структуры бактериальной целлюлозы в процессе ее биосинтеза и возможность ее модификации, определяет прочностные и вязкоупругие свойства биоразлагаемого полимера, который является потенциальной альтернативой пластиковой упаковке [8, 9].
Несмотря на то, что существует множество интересных применений БЦ в производстве пищевых продуктов и их упаковки, на данный момент исследованы лишь некоторые из них, поскольку высокая стоимость синтеза БЦ является ограничивающим фактором. С другой стороны, было предложено несколько экономически эффективных питательных сред, способствующих снижению затрат на производство БЦ [10].
Тем не менее, ежегодно продолжаются фундаментальные исследования биосинтеза и применения БЦ в различных направлениях. В связи с этим наша работа посвящена исследованию производства БЦ на молочной сыворотке, тем самым мы расширяем круг природных питательных сред для биосинтеза полимера и возможности утилизации отходов молочной промышленности. Характеристика БЦ с точки зрения пищевой добавки и практическое обоснование ее применения в различных пищевых системах, может помочь технологам и ученым-диетологам в разработке новых рецептур и упаковочных материалов для пищевых продуктов [11].
Материалы и методы
Состав питательной среды и процесс биосинтеза. Симбиотический микробный консорциум Medusomyces gisevii , это устойчивое микробное сообщество, состоитоящее из 15–30 родов, представленных дрожжами (преимущественно Zygosaccharomyces sp .) и уксуснокислыми бактериями (в основном Gluconacetobacter xylinus , обычно известными как Acetobacter xylinum ). Более точный видовой состав чайного гриба культура подробно описана в других работах [12–14].
Гидролиз молочной сыворотке. Молочную сыворотку с массовой долей лактозы 4,5% использовали в качестве питательной среды для культивирования Medusomyces gisevii . Предварительно лактозу сыворотки гидролизовали ферментным препаратом (ФП) LACTA FREE «Biochem Srl» до 100% степени ее конверсии (содержания глюкозы 2,36%). Далее вносили растительный экстракт зеленого чая из расчета 4 г на 1 литр питательной среды. Объемное соотношение питательной среды и посевного материала (симбиота) составило 1:0,3. Процесс производства гель-пленок БЦ проводили в статическом режиме культивирования симбиотического консорциума Medusomyces gisevii .
Очистка и сушка целлюлозы. Каждые 3-е суток культивирования собирали и исследовали гель пленки БЦ. После окончания периода культивирования содержимое емкости интенсивно перемешивали в течение 10–15 минут, чтобы уменьшить количество прикрепившихся микробных клеток. Гель пленки БЦ на границе раздела воздух/жидкость вручную отделяли от культуральной жидкости, аккуратно отжимали и промывали деионизированной водой до достижения нейтральных значений рН. Каждый полученный образец геля отбирали и анализировали в трех экземплярах (т. е. из трех разных резервуаров для культивирования). Децеллюризацию промытого материал осуществляли в равных количествах объема 0,1 М NаОН при 28 °C в течение 3-x суток. Смену раствора щелочи повторяли четыре раза, до получения бесцветной прозрачной пленки БЦ. Полученную пленку BC нейтрализовли слабым раствором уксусной кислоты и промывали деионизированной водой до достижения нейтрального значения рН (7,0 ± 0,6). Вес целлюлозных гелевых пленок во влажном состоянии измеряли с помощью лабораторных весов. После промывки образцы целлюлозы подвергали дегидратации двумя способами: (а) предварительно замораживали при температуре – 70 °C в течение 6 ч, а затем подвергали лиофилизации (лиофилизировали) при температуре – 75 °C в течение 48 часов с использованием опытной сублимационной сушилки на полке Jaba-Lyoph-Pride (Южная Корея), и (б) БЦ давали высохнуть в комнатных условиях (температура 24 ± 2 °С, влажность 65 ± 1%) до получения постоянной массы. Далее в тексте первый и второй методы называются RT-методом (при комнатной температуре) и FD-методом (сублимационная сушка).
Определение водопоглощающей и набухающей способности. Водопоглощающую способность определяли в соответствии с монографией Британской Фармакопеи для альгинатных повязок и упаковки. Образцы гель-пленок БЦ разрезали на прямоугольники размером 2 • 4 см и взвешивали в качестве исходного веса (W 0 ). После этого образцы переносили в центрифужную пробирку, дно которой заполняли вязаной марлей для поглощения отжатой воды и подвергали центрифужной дегидратации в течение 15 мин при 1200 об / мин. Эти образцы были взвешены еще раз (W 1 ). Вес полностью высушенных образцов (W 4 ) измеряли после сушки при 105 °C до постоянной массы.
Набухающую способность высушенной гель-пленки БЦ определяли следующим образом: образцы высушивали при 50 °С или вымораживанием до постоянной массы и затем замачивали в растворе, содержащем 2,5 моль/л СаСl 2 ×2Н 2 O и 142 ммоль/л NaCl в течение 30 минут. После инкубации образцы поднимали пинцетом в течение 30 с для удаления поверхностной жидкости и взвешивали (значение W 2 ). Для определения количества жидкости, удерживаемой между фибриллами, набухшие образцы обезвоживали центрифугированием, как описано выше, и взвешивали (W 3 ). Емкость удерживания воды (WHC) и емкость поглощения воды (WAC) были высчитаны как:
WHC = (W 0 – W 4 ) / W 4 , (1)
WAC = (W 2 – W 4 ) / W 4 , (2)
где W 0 – масса гель-пленки БЦ; W 1 – масса гель-пленки БЦ после центрифужной дегидратации; W 2 – масса гель-пленки БЦ после набухания;
W 3 – масса набухшей гель-пленки БЦ после центрифугирования; W 4 – масса высушенной гель-пленки БЦ.
Жидкость, в образцах БЦ, рассматривалась как состоящая из двух частей:
-
а) удерживаемая между волокнами (W 0 –W 1 для нативных гель-пленок БЦ) и (W 2 –W 3 для дегидратированных образцов БЦ);
-
b) удерживаемая внутри отдельных волокон (W 1 -W 4 для нативных гель-плёнок БЦ) и (W 3 –W 4 для дегидратированных образцов БЦ).
Определение липидосвязывающей способности. In vitro липидсвязывающая способность (ЛСС) полисахаридов определялась трех кратно по установленной методике [15, 16].
Каждый образец полисахарида (20 мг) растворяли в 1,25 мл 0,6 моль л-1 НСl и инкубировали в течение 30 мин на водяной бане 37 °C с постоянным встряхиванием. Затем в каждую пробирку добавляли по 25 г оливкового масла, вихривали и инкубировали в одинаковых условиях в течение 2 ч. После инкубации добавляли 8 мл фосфатного буфера (рН = 7,4) и корректировали рН раствора до 6,8 с 1 моль л-1 NаОН и инкубировали снова в течение 30 мин, чтобы имитировать дуоденальные состояния. Далее пробирки центрифугировали при 697 g в течение 10 мин, а супернатант, представляющий несвязанные липиды, измеряли гравиметрически. Липидсвязывающая способность (ЛСС) образцов была рассчитана по уравнению (3):
ЛСС =
25 - mx
m 2
где 25 – масса оливкового масла, взятого для определения ЛСС, г; m 1 – масса несвязанного оливкового масла, г; m 2 – масса полисахарида, г.
Концентрацию глюкозы культуральной жидкости гидролизованной молочной сыворотки определяли тест системой «Глюкоза-GOD» производства «Вектор-Бест». Титруемую кислотность определяли по ГОСТ 33957–2016. Результаты измерения синтезированной гель-пленки БЦ, расчеты степени конверсии, скорости биосинтеза субстратов математически обработаны.
Степень конверсии (СК, %) была рассчитана по уравнению (4):
СК = mБЦ
-~7 , (4)
где m БЦ – масса синтезированной БЦ в пересчете на сухие вещества c 1 л культуральной жидкости, г СВ/л; m 1 – начальное количество глюкозы в 1 л культуральной жидкости, г; m 2 – количество глюкозы в 1 л культуральной жидкости после биосинтеза БЦ, г.
Результаты
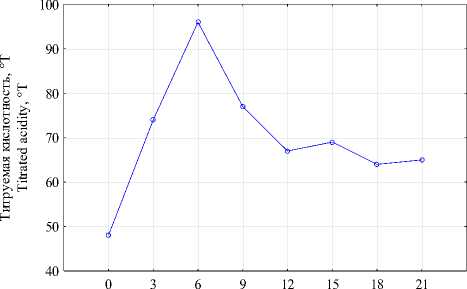
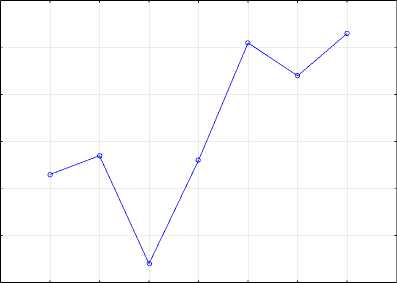
Биосинтез бактериальной целлюлозы на гидролизованной молочной сыворотке проводили в конические колбах Эрленмейера в термостатируемых условиях Т = 31 ± 0,5 °С. Начальное количество глюкозы питательной среды 1,7%, продолжительность биосинтеза 21-и сутки. Каждые 3-е суток культивирования оценивали массу полученной БЦ, определяли изменение параметров биосинтеза: титруемая кислотность, рН, количество глюкозы питательной среды (рисунок 1).
Продолжительность биосинтеза, сутки Duration of biosynthesis, day
-0,2
1,8
1,6
0 3 6 9 12 15 18 21
Продолжительность биосинтеза, сутки Duration of biosynthesis, day
Продолжительность биосинтеза, сутки Duration of biosynthesis, day
b
0,19
0,18
0,17
0,16
0,15
0,14
0,13
3 6 9 12 15 18 21
Продолжительность биосинтеза, сутки Duration of biosynthesis, day
c d
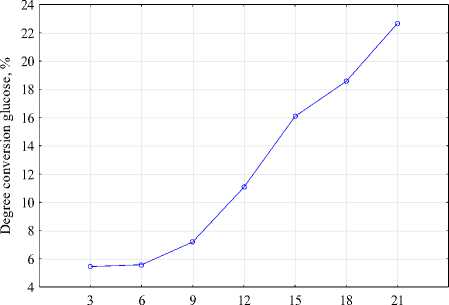
Рисунок 1. Изменение титруемой кислотности ( a ), концентрации ( b ) и степени конверсии глюкозы ( c ); скорости биосинтеза БЦ ( d ) на гидролизованной молочной сыворотке в зависимости от продолжительности процесса
Figure 1. Changes in titrated acidity ( a ), concentration ( b ) and degree of glucose conversion ( c ); the rate of BC biosynthesis ( d ) on hydrolyzed whey, depending on the duration of the process
На рисунке 1, а представлено изменение титруемой кислотности культуральной жидкости в течение 21-x суток биосинтеза. Титруемая кислотность культуральной жидкости увеличивалась в два раза в течение шести суток культивирования и достигла 96°Т, что может быть связано с развитием уксуснокислых бактерий. Интересно, что более длительный процесс биосинтеза БЦ симбиотическим консорциумом Medusomyces gisevii, на 9-е сутки и в последующем, характеризуется снижением титруемой кислотности до 65°Т. Значение активной кислотности (рН) достигало максимального значения 2,72 так же на 6-е сутки, но в отличие от показателей титруемой кислотности более длительное культивирование не приводило к снижению рН.
Определено резкое снижение количества глюкозы культуральной жидкости на 6-е сутки биосинтеза до 0,013%, что подтверждает преимущественное использование глюкозы цел-люлозосинтезирущими бактериями симбиота Medusomyces gisevii как субстрата в биосинтезе полисахарида (рисунок 1, b). Низкие значения количества глюкозы в процессе культивирования коррелируют со снижением показателя титруемой кислотности в этот период, что подтверждает возможность использования органических кислот продуцентами в биосинтезе БЦ.
Степень конверсии глюкозы культуральной жидкости первые 6-ть суток процесса не превышает 6% (рисунок 1, c). Однако начиная с 9-x суток культивирования степень конверсии, рассчитанная по глюкозе, возрастает до 22,6%, что может быть связано вовлечение в биосинтез бактериальной целлюлозы других веществ в качестве субстратов, это подтверждается и низкими значениями количества глюкозы в этот период. Степень конверсии, рассчитанная по количеству синтезированной БЦ и негидролизованной лактозы молочной сыворотки до ферментации, на 21-е сутки культивирования составила 10,5%.
Определено наименьшее значение скорости биосинтеза БЦ на 9-е сутки процесса 0,134 г СВ / л × сут, на 15-е, 21-е сутки показатели биосинтеза достигли максимальных значений 0,181 г СВ/л×сут и 0,183 г СВ/л×сут соответственно (рисунок 1, d).
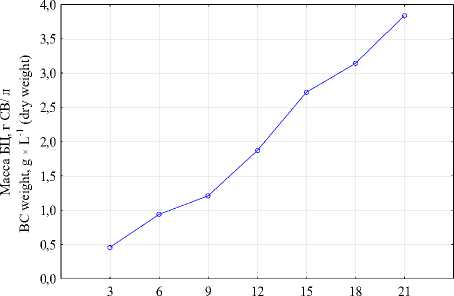
Биосинтез бактериальной целлюлозы происходил в течение 21-x суток, максимальное количество полисахарида достигло 3,84 г с 1 литра питательной среды в пересчете на сухие вещества (рисунок 2).
Продолжительность биосинтеза, сутки Duration of biosynthesis, day
Рисунок 2. Изменение массы (в пересчете на СВ) синтезированной БЦ на гидролизованной молочной сыворотки в зависимости от продолжительности процесса
Figure 2. The change in mass (in terms of dry matter) of synthesized BC on hydrolyzed whey, depending on the duration of the process

Рисунок 3. Внешний вид дезагрегированного дегидратированного образца БЦ, синтезированного на гидролизованной молочной сыворотке
Figure 3. The appearance of a disaggregated dehydrated BC sample synthesized on hydrolyzed whey
Полученные образцы гель пленок БЦ очищали от остатков культуральной среды и продуцентов в растворе гидроксида натрия, промывали дистиллированной водой до нейтральных значений рН, стерилизовали. После лиофилизации БЦ (FD) дезагрегировали на лабораторной мельницей циклонного типа TAGLER ЛМЦ-5
«Циклон» (рисунок 3) с получением сухого порошка. Дезагрегировали на мельнице так же образцы БЦ (RT) высушенные до постоянной массы на воздухе при Т = 24 °С.
Определено, что насыпная плотность порошка лиофилизированной БЦ в 8,5 раз меньше, чем высушенного на воздухе (таблица 1).
Погорелова Н.А. и др. Вестник ВГУИТ, 2024, Т. 86, №. 3, С. 166-174
По результатам исследований физикохимических свойств БЦ водоудерживающая способность синтезированных гель пленок бактериальной целлюлозы составила 82,35 ± 0,63 г/г (таблица 1).
Таблица 1.
Физико-химические параметры БЦ на гидролизованной молочной сыворотке
Table 1.
Physico-chemical parameters of BC on hydrolyzed whey
|
Физико-химические свойства Physico-chemical properties |
Значения Values |
|
Водоудерживающая способность гель-пленок БЦ Water-holding capacity of BC gel films |
82,35 ± 0,33 г/г (g/g) |
|
Водопоглощающая способность ǀ Water absorption capacity: |
|
|
Температурная сушка Temperature Drying |
5,42 ± 0,45 г/г (g/g) |
|
Сублимационная сушка Freeze - dried |
22,44 ± 0,21 г/г (g/g) |
|
Насыпная плотность ǀ Bulk density: |
|
|
Температурная сушка Temperature Drying |
170,00 ± 0,95 кг/м3 (kg/m3) |
|
Сублимационная сушка Freeze - dried |
20,00 ± 0,75 кг/м3 (kg/m3) |
|
Микробиологические показатели Microbiological indicators: |
|
|
Дрожжи, КОЕ/г (см3)* Yeast, CFU/g (cm3)* |
Не обнаружено Not detected |
|
КМАФАнМ, КОЕ/г (см3)** QMAFAnM, CFU/g (cm3)* |
1,2 × 102 |
*ГОСТ 10444.12–2013 Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества дрожжей и плесневых грибов ǀ Standard 10444.12–2013 is the national standard Microbiology of food and animal feed. Methods for detecting and counting the number of yeast and mold fungi
**ГОСТ 10444.15–94 Продукты пищевые. Методы определения количества мезофильных аэробных и факультативноанаэробных микроорганизмов ǀStandard 10444.15–94 is the national standard Food products. Methods for determining the number of mesophilic aerobic and facultative anaerobic microorganisms
Далее определяли водопоглощающую (набухающую) способность дегидратированных образцов пленок бактериальной целлюлозы RT и FD. Процесс набухания полимеров проходит в два этапа – набухание стенок фибрилл целлюлозы и разрушение слабых связей, которые образуются между макро- и микрофибриллами за счет их сближения в процессе дегидратации. Это приводит к увеличению объема и возникновению дополнительного пространства для молекул растворителя как между фибриллами, так и внутри макрофибрилл целлюлозы. Набухающая способность целлюлозы будет определяться способностью
Вода в 3d сетчатой структуре гель пленок и регидратированных образцов БЦ удерживается в межфибриллярном пространстве, это капиллярная влага. Она может перемещаться внутри пространства материала. Другой вид жидкости, находящийся в структуре БЦ, удерживается фибриллами, это связанная вода, ее количество определяет продолжительность дегидратации целлюлозы. Соотношение количества свободной и связанной влаги важный показатель БЦ при включении полисахарида в рецептуру замороженных продуктов с целю регуляции активности воды в них. Установлено, что регидратированные образцы RT целлюлозы обладали в 3,43 раза большим показателем отношения количества свободной и связанной влаги в сравнении с FD образцами.
Было доказано, что бактериальная целлюлоза имеет фибриллярное строение, длина фибрилл намного больше, чем у растительной целлюлозы при их меньшем диаметре, что определяет значительную удельную поверхность. Нерастворимость, отсутствие ферментов у человека гидролизующих целлюлозу, и большая ее удельная поверхность дает возможность полисахариду эффективно связывать жир. Считается, что связанный жир хуже усваивается in vivo и выводится с калом [15]. Способность БЦ напрямую связывать жир может определять ее общую гиполипидемическую активность. В этом исследовании оценивался жиросвязывающий потенциал порошка лиофилизированной БЦ и коммерческого препарата хитозана [16, 17].
Определена большая липидосвязывающая способность (рисунок 4) бактериальной целлюлозы – 108,1 ± 3,2 г масла на 1 г полисахарида в сравнении с хитозаном – 78,8 ± 1,8 г масла на 1 г полисахарида. Эти данных указывают на то, что бактериальная целлюлоза может оказывать гиполипидемическое действие и позитивно влиять на здоровье человека.

Рисунок 4. Исследование липидосвязывающей способности образцов ( 1 ) коммерческого хитозана, ( 2 ) дезагрегированной дегидратированной БЦ
Figure 4. Investigation of the lipid-binding method-news of samples of ( 1 ) commercial chitosan, ( 2 ) disaggregated dehydrated BC
Обсуждение
Результаты нашего исследования демонстрируют успешное применение гидролизованной молочной сыворотки в качестве питательной среды для культивирования симбиотического консорциума Me dusomyces gisevii . Несмотря на низкое количество глюкозы (1,7%) питательной среды, на основе ферментированной молочной сыворотки, масса синтезированной бактериальной целлюлозы составило 3,84 г СВ/л. Наши результаты показателей эффективности биосинтеза
Финансирование. Работа выполнена при финансовой поддержке Российского научного фонда (проект № 23–24–10052 от 20.04.2023).
Список литературы Физико-химические свойства и липидосвязывающая способность бактериальной целлюлозы, синтезированной на молочной сыворотке
- Pogorelova, N., Rogachev, E., Akimbekov, N. et al. Effect of dehydration method on the micro - and nanomorphological properties of bacterial cellulose produced by Medusomyces gisevii on different substrates // J Mater Sci. 2024. V. 59. P. 6614-6626. https://doi.org/10.1007/s10853-024-09596-3
- Pinto Nayra O.F., Bourbon A-I., Martins D., Pereira A. et al. Bacterial cellulose nanocrystals or nanofibrils as Pickering stabilizers in low-oil emulsions: A comparative study // Food Hydrocolloids. 2024. V. 157. P. 110427. https://doi.org/10.1016/j.foodhyd.2024.110427
- Calvo V., Fuentes L., Berdejo D., González-Domínguez J.M. et al. Oil-in-Water Pickering Emulsions Stabilized with Nanostructured Biopolymers: A Venue for Templating Bacterial Cellulose // Int. J. Mol. Sci. 2023. V. 24. P. 13141. https://doi.org/10.3390/ijms241713141
- Sommer A., Staroszczyk H. Bacterial cellulose vs. bacterial cellulose nanocrystals as stabilizer agents for O/W pickering emulsions // Food Hydrocolloids. 2023. V. 145. P. 109080. https://doi.org/10.1016/j.foodhyd.2023.109080
- Martins D., Khodamoradi N., Silva-Carvalho R., Gama M. et al. Effect of bacterial cellulose on the foaming properties of egg white and soy proteins // Carbohydrate Polymer Technologies and Applications. 2024. V. 7. P. 100517. https://doi.org/10.1016/j.carpta.2024.100517
- Kamal T, Ul-Islam M, Fatima A, Ullah MW, Manan S. Cost-Effective Synthesis of Bacterial Cellulose and Its Applications in the Food and Environmental Sectors // Gels. 2022. V. 8(9). P. 552. https://doi.org/10.3390/gels8090552
- Lin D., Liu Zh., Shen R., Chen S. et al. Bacterial cellulose in food industry: Current research and future prospects // International Journal of Biological Macromolecules. 2020. V. 158. P. 1007-1019. https://doi.org/10.1016/j.ijbiomac.2020.04.230
- Jang E.J., Padhan B., Patel M., Pandey J.K. et al. Antibacterial and biodegradable food packaging film from bacterial cellulose // Food Control. 2023. V. 153. P. 109902. https://doi.org/10.1016/j.foodcont.2023.109902
- Gromovykh T.I. et al. Structural organization of bacterial cellulose: The origin of anisotropy and layered structures. Carbohydrate polymers. 2020. V. 237. P. 116140. https://doi.org/10.1016/j.carbpol.2020.116140
- Azeredo H.M.C., Barud H., Farinas C.S., Vasconcellos V.M. et al. Bacterial cellulose as a raw material for food and food packaging applications // Front. Sustain. Food Syst. 2019. V. 3(7). https://doi.org/10.3389/fsufs.2019.00007
- Pogorelova N.A., Sarnitskaya N.A. Polysaccharides as food system stabilizers // BIO Web of Conferences. International Conference Scientific and Technological Development of the Agro-Industrial Complex for the Purposes of Sustainable Development (STDAIC2023). Bishkek, 2024. P. 01009. https://doi.org/10.1051/bioconf/20248301009
- Bishop P., Pitts E.R., Budner D., Thompson-Witrick K.A. Kombucha: Biochemical and microbiological impacts on the chemical and flavor profile // Food Chemistry Advances. 2022. V. 1. 100025. https://doi.org/10.1016/j.focha.2022.100025
- Diez-Ozaeta I, Astiazaran OJ. Recent advances in Kombucha tea: Microbial consortium, chemical parameters, health implications and biocellulose production // Int J Food Microbiol. 2022. V. 16(377). P. 109783. https://doi.org/10.1016/j.ijfoodmicro.2022.109783
- Wang B, Rutherfurd-Markwick K, Zhang X-X, Mutukumira AN. Kombucha: Production and Microbiological Research // Foods. 2022. V. 11(21). P. 3456. https://doi.org/10.3390/foods11213456
- Malm M., Liceaga A.M. Physicochemical properties of chitosan from two commonly reared edible cricket species, and its application as a hypolipidemic and antimicrobial agent // Polysaccharides. 2021. V. 2(2). P. 339-353. https://doi.org/10.3390/polysaccharides2020022
- May Kellie L., Tangso Kristian J., Hawley A., Boyd Ben J. et al. Interaction of chitosan-based dietary supplements with fats during lipid digestion // Food Hydrocolloids. 2020. V. 108. 105965. https://doi.org/10.1016/j.foodhyd.2020.105965
- Silva I.M.V., Machado F., Moreno M.J., Nunes C. et al. Polysaccharide Structures and Their Hypocholesterolemic Potential // Molecules. 2021. V. 26(15). P. 4559. https://doi.org/10.3390/molecules26154559
- Shavyrkina N.A. et al. Scale-up of biosynthesis process of bacterial nanocellulose // Polymers. 2021. V. 13. №. 12. P. 1920. https://doi.org/10.3390/polym13121920
- Revin V. V. et al. Characterizing bacterial cellulose produced by Komagataeibacter sucrofermentans H-110 on molasses medium and obtaining a biocomposite based on it for the adsorption of fluoride // Polymers. 2021. V. 13. №. 9. P. 1422. https://doi.org/10.3390/polym13091422
- Hamed D.A., Maghrawy H.H., Abdel Kareem H. Biosynthesis of bacterial cellulose nanofibrils in black tea media by a symbiotic culture of bacteria and yeast isolated from commercial kombucha beverage // World Journal of Microbiology and Biotechnology. 2023. V. 39. №. 2. P. 48. https://doi.org/10.1007/s11274-022-03485-0


