Физико-химические свойства экзополисахарида Lactococcus lactis
Автор: Фокина Надежда Александровна, Урядова Галина Тимофеевна, Карпунина Лидия Владимировна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-1 т.19, 2017 года.
Бесплатный доступ
Были определены физико-химические свойства экзополисахарида Lactococcus lactis В-1662: молекулярная масса, химическая природа, моносахаридный состав, относительная вязкость.
Бактерии, молочнокислые бактерии, лактококки, экзополисахариды, молекулярная масса, химическая природа, моносахаридный состав, вязкость, вacteria
Короткий адрес: https://sciup.org/148205103
IDR: 148205103 | УДК: 577.114.083
Текст научной статьи Физико-химические свойства экзополисахарида Lactococcus lactis
Среди микробных биополимеров особое место занимают экзополисахариды (ЭПС). Источником получения экзополисахаридов на сегодняшний день являются многие бактерии, в том числе молочнокислые [1-5]. Известно, что они обладают реологическими, иммунности-мулирующими, ранозаживляющими, пленкообразующими свойствами [3-5]. Однако функции этих биополимеров являются не до конца изученными. Для формирования представления о влиянии ЭПС молочнокислых бактерий на физиологические реакции в организме животных, необходимо накопление данных об их структуре, физико-химических и биологических свойствах ЭПС разных видов и штаммов.
В связи с этим, целью работы явилось изучение физико-химических свойств экзополисаха-рида Lactococcus lactis В-1662.
Молекулярную массу экзополисахари-да определяли методом аналитической гель-хроматографии [7], используя гелевый носитель TSKgel G 6000 PWXL (Япония). ЭПС идентифицировали на автоматическом анализаторе 2690 Allianse Waters. Наличие фракций ЭПС L.
Фокина Надежда Александровна, микробиолог.
lactis В-1662 определяли методом ионообменной хроматографии, используя носитель DEAE-Toyopearl 650 M [8].
Моносахаридный состав определяли с помощью тонкослойной хроматографии (ТСХ) на пластинках с целлюлозным носителем [9].
Относительную вязкость определяли с помощью стеклянного вискозиметра ВПЖ-2.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящей работе изучали физико-химические свойства ЭПС L. lactis B-1662, который был получен нами ранее из культуры L. lactis B-1662 [10]. Данный ЭПС представлял собой порошок светло-коричневого цвета, без запаха, не имеющий в своем составе белка. Для его получения культуру L. lactis B-1662 выращивали на среде A. Welman [11] с сахарозой при температуре 27 ºС, рН 5,5 в течение 48 ч на шуттель-аппарате при 180 об/мин. Очистку ЭПС проводили методом гель-фильтрации на колонке c носителем Sephadex G-10.
Молекулярную массу экзополисахарида определяли методом аналитической гель -хроматографии на колонке TSKgel G6000 PWXL. Колонку калибровали стандартными образцами сахаров с известными молекулярными массами, такими как: глюкоза 6 тыс Да, Dextran 10 тыс Да, Dextran 110 тыс Да, Dextran 2 млн Да («Fluca», Швейцария, «Merck» Германия). Экзополисаха-рид L. lactis B-1662 детектировали на автоматическом анализаторе 2690 Alliance Waters (рис. 1). Как видно из табл. 1, молекулярная масса L. lactis B-1662 была равна 10000 Да (табл. 1).
Дальнейшую очистку ЭПС L. lactis В-1662 проводили, используя метод ионообменной хроматографии на колонке с анионообменни-ком DEAE- Toyopearl 650М (20х200 мм). Элюцию проводили в два этапа: первоначально буфером 0,04 % NaN3, 0,05М КH2PO4. После отделения нейтральных фракций, элюцию осуществляли раствором NaCl в том же буфере с градиентом концентрации 1М. Фракции с колонки собирали
Таблица 1. Определение молекулярной массы ЭПС L. lactis В-1662 на колонке TSKgel тип G6000 PWXL
|
Образец |
Время выхода максимального пика, мин |
Молекулярная масса, Да |
|
Декстран |
21,73 |
2 000 000 |
|
Декстран |
23,20 |
110 000 |
|
Декстран |
24,60 |
10 000 |
|
Глюкоза |
25,76 |
6 000 |
|
ЭПС на сахарозе пики слева направо |
||
|
1 |
25,51 |
10 000 |
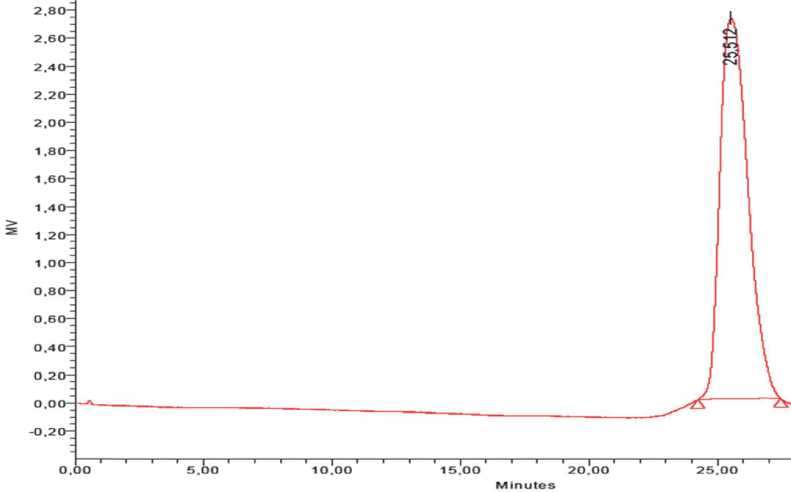
Рис. 1. Хроматограмма определения молекулярной массы ЭПС, полученного из L lactis В-1662 на сахарозе на колонке с TSKgel G6000 PWXL с помощью коллектора и затем исследовали на содержание углеводов фенол-серным методом [12]. Как видно из хроматограммы на рис. 2, образцы выходили одной фракцией соответствующей нейтральным веществам. Наличие одной нейтральной фракции было характерно и для некоторых ЭПС таких молочнокислых бактерий как Lactobacillus delbrueckii subsp. delbrueckii B-1596, L. delbrueckii B-1936 и L. delbrueckii ssp. bulgaricus [13]. Хотя в литературе имеются данные о гетерогенности ЭПС некоторых штаммов лактококка [14].
Используя метод тонкослойной хроматографии, которую проводили на пластинке с целлюлозным носителем POLIGRAM® GEL 300 с толщиной слоя 0,1мм, определяли моносахаридный состав ЭПС L. lactis B-1662. В качестве «свидетелей» использовали спиртовые растворы моносахаров (Fluca) таких как: D- глюкоза, D -галактоза, L - манноза, D - рамноза, D- глюкоуроновая кислота, D - ксилоза. Гидролиз ЭПС проводили 2 н. раствором трифторуксусной кислоты при 110° С в течение 3 часов. Элюентом являлся раствор, состоящий из этилацетата, пиридина, уксусной кислоты, воды в соотношении 5:5:1:3. В качестве проявителя использовали анилин фталат. Было определено, что в состав ЭПС входят ксилоза и глюкоза (рис. 3). Полученные результаты согласуется с литературными данными о том, что глюкоза и ксилоза, наряду с маннозой, рамнозой, галактозой могут являться структурными моносахаридами ЭПС [15,16].
В процессе исследований было установлено, что ЭПС изучаемой культуры обладал низкой вязкостью и это не позволяло определить динамическую вязкость. Относительная вязкость была определена с помощью капиллярного вискозиметра и составила 1,3 мм2/с. Значение относительной вязкости было сопоставимо с показателем вязкости ЭПС других молочнокислых бактерий – лактобацилл [14].
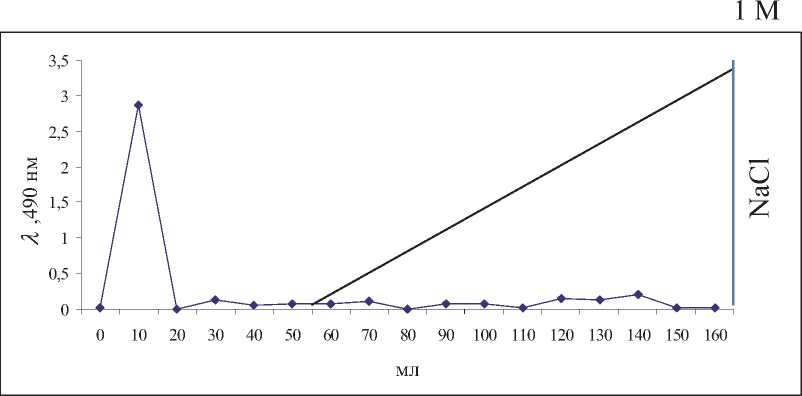
Рис. 2. Ионообменная хроматография ЭПС L. lactis В-1662 на DЕAE - Toyopearl 650M

Рис. 3. Определение моносахаридного состава ЭПС L. lactis В-1662 методом тонкослойной хроматографии
Примечание: 1,2,4 – углеводы-свидетели, 3-ЭПС
Таким образом, из культуральной жидкости L. lactis B-1662 впервые выделен ЭПС, представленный одной нейтральной фракцией с молекулярной массой 10000 Да, обладающей небольшой относительной вязкостью.
Список литературы Физико-химические свойства экзополисахарида Lactococcus lactis
- Ганина В.И., Рожкова Т.В. Анализ зарубежных исследований в области молочнокислых бактерий, синтезирующих экзополисахариды//Изв. вузов. Пищ. технол. 2005. № 5-6. С. 65-66.
- Лахтин М. В., Лахтин В.М., Алешкин А.В. Экзополимеры пробиотических лактобацилл и бифидобактерий (новые подходы и свойства)//Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2012. Т. 87. № 5. С. 257-261.
- Ботина С.Г., Рожкова И.В., Семенихина В.Ф. Использование штаммов молочнокислых бактерий, синтезирующих экзополисахариды, в производстве кисломолочных продуктов питания//Хранение и переработка сельхозсырья. 2010. № 1. С. 38-40.
- Влияние экзополисахаридов Lactobacillus delbrueckii spp.bulgaricus на цитокиновый статус лабораторных мышей/Е.В. Полукаров, Е.А. Горельникова, Л.В. Карпунина, Е.И. Тихомирова//Медицинская иммунология. 2009. №4-5. С. 309-310.
- Правдивцева М.И., Карпунина Л.В., Бухарова E.H. Влияние лаксаранов на процесс заживления ран у животных//Аграрная наука в XXI веке; проблемы и перспективы: сборник науч. статей VI Всероссийской науч. -практ. конф. Саратов, 2012. Ч.П. С. 82-84.
- Cerning J., Bouillanne C., Desmazeaud M.J. Exocellular polysaccharide production by Streptococcus thermophilus//Biotechnol. Lett. 1988. Vol. 10. P. 255-260.
- Варбанец Л.Д., Здоровенко Г.М., Книрель Ю.А. Методы исследования эндотоксинов. Киев: Наукова думка, 2006. 234 с.
- Остерман Л.А. Хроматография белков и нуклеиновых кислот. М.: Наука, 1985. 536 с.
- Шталь Э. Хроматография в тонких слоях. М.: Мир, 1965. 508 с.
- Фокина Н.А., Урядова Г.Т., Карпунина Л.В. Выделение экзополисахарида из Lасtococcus lactis при различных условиях культивирования//Аграрный научный журнал. 2016. № 12. С. 40-42.
- Welman A.D., Maddox I.S., Archer R.H. Screening and selection of exopolysaccharide-producing strains of Lactobacillus delbrueckii subsp. bulgaricus//J. Appl. Microbiol. 2003. Vol. 95. P. 1200-1206.
- Dubois M., Gilles K. A., Hamilton J.K., Rebera P.A., Smith T. Colorimetric method for determination of sugars and related substances//Anal. Chem. 1956. Vol. 28. No. 3. Р. 350-356.
- Полукаров Е.В. Экзополисахариды молочнокислых бактерий и их функциональная значимость в организме животных: дис. … канд. биол. наук. Саратов, 2009. 106 с.
- Рожкова Т.В. Биотехнология стартовых культур на основе молочнокислых бактерий, синтезирующих полисахариды. Дис. … канд. тех. наук. М., 2006. 159 с.
- De Vuyst L., Degeest B. Heteropolysaccharides from lactic acid bacteria//FEMS Microbiol Rev. 1999. Vol. 23. P. 153 -177.
- Характеристика полисахаридов, секретируемых Bifidobacterium adolescentis 94 БИМ/Г.И. Новик, Н.И. Астапович, Й. Кюблер, А. Гамьян//Микробиология. 2002. Т. 71. № 2. С. 205-210.


