Физиологические эффекты Грелина
Автор: Логинова Ольга Александровна, Орлова Екатерина Григорьевна, Ширшев Сергей Викторович
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 4, 2018 года.
Бесплатный доступ
Грелин - пептидный гормон, обладающий широким спектром эффектов в организме человека. Он принимает участие в регуляции энергетического и жирового обмена, ростовых процессов, полового созревания, половых циклов, беременности, в контроле поведенческих реакций, а также обладает выраженными иммуномодулирующими и противовоспалительными свойствами. В обзоре представлены данные о структуре грелина и его рецепторов, уровне гормона при физиологических и патологических состояниях, а также его основные биологические эффекты.
Грелин, рецептор грелина, грелин-о-ацилтрансфераза (гоат), эффекты грелина
Короткий адрес: https://sciup.org/147227053
IDR: 147227053 | УДК: 612.018.2: | DOI: 10.17072/1994-9952-2018-4-443-453
Текст научной статьи Физиологические эффекты Грелина
Дальнейшие исследования показали, что гре-лин вырабатывается у многих классов животных (млекопитающих, птиц, рыб) в различных органах и тканях, а его биологическая активность оказалась более разнообразна, чем предполагали изначально, и включает широкий спектр эндокринных и неэндокринных эффектов [Dixit, Taub, 2005; Delporte, 2013].
Синтез грелина
ми, почками, щитовидной железой, лимфоидными органами и клетками иммунной системы [Mori et al., 2000; Gualillo et al., 2001; Korbonits et al., 2001; Tena-Sempre, 2008]. Кроме этого, в аркуатных ядрах гипоталамуса, которые являются важнейшей структурой в реализации эффектов грелина, также обнаруживается небольшое число грелин-продуцирующих нейронов [Cabral et al., 2017].
У всех позвоночных грелин закодирован в ghrl гене. У человека ген ghrl находится на правом плече третьей хромосомы в регионе 3p26-p25. ghrl имеет длину 511 пар оснований и содержит 5 экзонов (зрелая молекула грелина кодируется экзонами 1 и 2) и 4 интрона. ghrl несет 2 транскрипционных старт-сайта, что приводит к экспрессии двух различных транскриптов – грелина и обестатина [Smith et al., 1997]. Образование грелина происходит в несколько этапов: на первом транслируется последовательность для препрогрелина, содержащего 117 аминокислот (ак), из которых 23 ак составляют сигнальный пептид и 94 ак – прогрелин; на втором этапе прогрелин претерпевает ряд последовательных стадий, в ходе которых происходит его модификация. Сначала в энтероэндокринных клетках происходит процесс ограниченного протеолиза (протеазой PC 1/3 в позиции Arg28/Ala29) с образованием N-концевой молекулы грелина. Затем, при участии фермента грелин-О-ацилтрансферазы (англ. Ghrelin O-acyltransferase, GOAT), катализируется связь одного n-октаноил радикала, что приводит к образованию ацилированного пептида, состоящего из 28 ак (с Arg на С-конце) с молекулярной массой 3,314 кДа и содержащего n-октановый сложный эфир на 3-сериновом остатке (Ser3). По всей видимости, биологические свойства грелина определяются его уникальной посттрансляционной модификацией, благодаря которой становится возможным его взаимодействие со своим основным рецептором – GHS-R1a [Van der Lely et al . , 2004].
Помимо грелина, в результате альтернативного сплайсинга, из препрогрелина может образовываться деацилгрелин, состоящий из 27 ак (с Pro на С-конце) и обестатин, содержащий 23 ак [Kanamoto et al., 2004; Zhang et al., 2005; Hosoda et al., 2003].
Деацилгрелин (англ. Desacylghrelin, DAG) – неацилированная изоформа гормона, был обнаружен спустя несколько лет после открытия грелина [Hosoda et al., 2000]. Эффекты деацилгрелина активно исследуются. Уже установлено, что деацил-грелин вовлечен в регуляцию энергетического гомеостаза и, как и ацилированная изоформа грели-на, способен пересекать гематоэнцефалический барьер (ГЭБ) и индуцировать активность нейронов в аркуатных ядрах гипоталамуса, активируя, как предполагается, собственные специфические ми- шени. Показано, что деацилгрелин обладает некоторой кардиопротективной и антипролифератив-ной активностью, предположительно, за счет связывания с особыми подтипами рецептора, которые на данный момент еще не обнаружены [Fernandez et al., 2016]. С другой стороны, отмечается, что деацилгрелин может иметь противоположные ацилированному грелину эффекты, в частности, оказывает анорексигенный эффект.
Таким образом, обе существующие изоформы гормона имеют широкий спектр эффектов и играют фундаментальную роль при различных физиологических процессах в организме млекопитающих, хотя в некоторых случаях могут перекрывать или оказывать противоположные друг другу эффекты [Stark et al., 2016].
Динамика уровня грелина в крови
У здоровых худощавых людей концентрация грелина пульсирующая, с циркадными (суточными) и ультрадианными (от 0.5 до 20 ч.) ритмами, с подъемом уровня ночью [Yildiz et al . , 2004; Liu et al . , 2008] (рисунок). Уровень циркулирующего в крови грелина модулируется количеством потребляемой энергии – повышается в состоянии голода и снижается через 60-120 мин. после приема пищи [Tschöp et al., 2001].
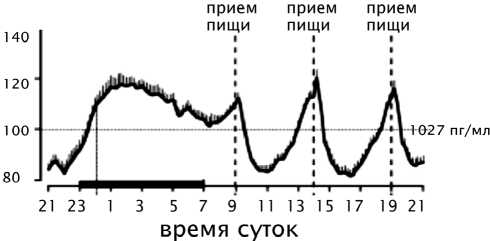
Суточные изменения общего уровня грелина (ацилгрелин+деацилгрелин) в плазме крови, % от суточного показателя [Spiegel et al . , 2011]
Кроме этого, уровень грелина в сыворотке крови находится под влиянием коротких и долгосрочных изменений в энергетическом гомеостазе, роста и полового созревания [Muccioli et al., 2011]. Исследователи отмечают увеличение уровня грелина в сыворотке крови в течение первых двух лет после рождения, с последующим понижением до завершения полового созревания и еще более заметным снижением у людей старше 70 лет. Гендерные различия по уровню циркулирующего грелина до сих пор являются спорными [De Souza et al., 2004].
Структура рецептора грелина
Как уже упоминалось ранее, первый сиротский (орфанный) рецептор для GHSs в гипофизе и гипоталамусе был открыт в 1996 г. и получил название – GHS-R [Howard et al., 1996]. На сегодняшний день известны две изоформы рецептора для ацилированного грелина – GHS-R типа 1a (GHS-R1a) и GHS-R типа 1b (GHS-R1b) [Yuan et al., 2014]. Рецепторы для деацилированной формы грелина до сих пор не идентифицированы.
Рецепторы грелина относятся к суперсемейству рецепторов, сопряженных с G-белком (англ. G-protein coupled receptors, GPCRs). GPCRs принимают участие в распознавании ароматических веществ, остатков аминокислот, нуклеотидов, пептидов, белков, а также ионов Ca2+ и света. Существует несколько механизмов, которые позволяют различным лигандам, взаимодействующим с GPCRs, активировать ядро домена, индуцируя изменение его конформации [Howard et al., 1996]. Рецепторы семейства GPCRs контролируют активность ферментов, ионных каналов и транспортных везикул посредством катализа гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ) на гетеродимерных G α-βγ -белках [Watts, Neve, 2005].
Выделяют 5 семейств GPCRs, часть из которых содержит по несколько подтипов, но все они имеют общий план строения их центральной части – трансмембранных спиралей [Bockaert, Pin, 1999]. Все рецепторы данного типа начинаются с внеклеточного N-концевого домена и заканчиваются внутриклеточным С-концевым доменом [Baldwin, 1993].
GHS-R1a состоит из 366 ак и имеет молекулярную массу 41 кДа. GHS-R1a содержит 7 трансмембранных α-спиральных гидрофобных домена, соединенных тремя внутриклеточными и тремя вне- клеточными петлями [Baldwin, 1993]. GHS-R1a связывает лиганд в полости, формируемой III-VI трансмембранными доменами [Bockaert, Pin, 1999], имеет конститутивную активность, и большинство изученных эффектов грелина осуществляется при взаимодействии именно с этим рецептором [Howard et al., 1996].
Другой рецептор грелина – GHS-R1b состоит из 289 ак. Преимущественно GHS-R1b активируется короткими пептидами, которые взаимодействуют с внеклеточными петлями и N-концевым доменом [Trumpp-Kallmeyer et al., 1995]. В состав GHS-R1b входит 5 трансмембранных доменов, его мРНК имеет широкое представление в различных тканях, но его физиологическая роль в организме изучена недостаточно [Van der Lely et al . , 2004].
GHS-R1a и GHS-R1b экспрессируются в виде сплайс-вариантов [Howard et al., 1996] и могут образовывать гетеродимеры, что предположительно позволяет им действовать как доминантнонегативный мутаген полнометражного рецептора грелина [Leung et al., 2007]. Помимо этого, GHS-R1a может образовывать гетеродимеры с рецепторами дофамина, меланокортина, серотонина, модифицируя их сигнальные пути, что приводит к развитию неклассических эффектов [Wellman, Abizaid, 2015].
Физиологические эффекты грелина
Грелин проявляет неэндокринный эффект, модулируя нейрогенез и синаптическую пластичность. Присутствие грелина может изменять морфологию нейронов и связанных с ними функций, улучшая таким образом концентрацию, процесс обучения и память. Помимо этого, установлена взаимосвязь концентрации гормона и циклами сон-бодрствование. [Pinto et al . , 2004; Dhillo et al . , 2007].
Роль грелина в регуляции энергетического гомеостаза . Основной эффект грелина реализуется через гипоталамические структуры. Грелин усиливает синтез AgRP (англ. Agouti-related protein, AgRP) и NPY (англ. Neuropeptide Y, NPY) в соответствующих орексигенных нейронах, подавляя активность анорексигенных POMC/CART (англ. Proopiomelanocortin и Сocaine amphetamine-related transcript)-нейронов [Dixit, Taub, 2005]. NPY играет первостепенную роль в реализации кратковременных эффектов грелина. Активация NPY происходит при связывании с GHS-R1a, тогда как AgRP обеспечивает реализацию как краткосрочных, так и долгосрочных эффектов гормона. AgRP усиливает аппетит при взаимодействии с рецепторами ме-ланокортина, локализованных непосредственно в головном мозге, и, таким образом, ингибирует анорексигенные влияния а-меланоцитостиму-лирующего гормона. Важно отметить – грелин может воздействовать на ЦНС различными путями: с током крови пересекать ГЭБ или передавать сигнал в ядра гипоталамуса благодаря наличию рецепторов к грелину на разветвлениях блуждающего нерва, густо опутывающих брюшную полость [Сowley et al . , 2003; Dixit, Taub, 2005].
Чистый орексигенный эффект грелина, возбуждающий аппетит, является функционально противоположным другому метаболическому гормону – лептину. Лептин подавляет активность AgRP и NPY, но стимулирует POMC/CART-нейроны, подавляя аппетит, т.е. обладает анорексигенным эффектом [Dixit, Taub, 2005; Wynne et al . , 2005]. Помимо лептина, гормон обестатин наделен функционально противоположными грелину эффектами – его воздействие необходимо для уменьшения потребления пищи, повышения массы тела и поддержания функций ЖКТ. В целом, метаболические гормоны грелин, лептин, обестатин, гастрин и др. регулируют энергетический и жировой обмен, дополняя друг друга в предоставлении информации
ЦНС о состоянии систем энергетического баланса [De Smet et al., 2007].
Роль грелина в регуляции репродуктивной системы . Грелин выступает в качестве нейроэндокринного модулятора, вовлеченного в контроль широкого спектра биологических функций, в том числе и репродуктивной [Repasi et al . , 2011]. Гре-лин принимает участие в регуляции полового созревания, половых циклов и беременности. Об этом свидетельствует экспрессия самого гормона и его рецепторов, а также наличие выраженных эффектов в репродуктивных органах и тканях [Muc-cioli et al . , 2011]. Возможность регуляции грели-ном репродуктивной физиологии крайне разнообразна и осуществляется несколькими путями: через собственные рецепторы грелин влияет на секрецию гонадотропинов – лютеинизирующего (ЛГ) и фолликулостимулирующего гормонов (ФСГ), оказывая непосредственное влияние на половые циклы и сроки полового созревания; и опосредованно – угнетая синтез гипоталамического гонадотропин-рилизинг гормона (ГнРГ) в гипофизе, что влечет за собой понижение выработки ЛГ и ФСГ клетками-гонадотрофами гипофиза [Fernández-Fernández et al . , 2004]. Еще один вариант опосредованной супрессии грелином пульсирующей секреции ЛГ происходит вследствие индуцированного грелином снижения экспрессии мРНК кисспептина, который является одним из важнейших нейроэндокринных регуляторов в системе управления репродуктивной осью и полового созревания [Muccioli et al . , 2011]. Наличие рецепторов грелина в фолликулах, желтом теле и миометрии предполагает потенциальную роль грелина в непосредственном управлении овариальной функцией. Показано, что в культуре человеческих гранулезных лютеиновых клеток грелин оказывает тормозящее влияние на стерои-догены (прогестерон и эстрадиол), причем независимо от присутствия хорионического гонадотропина человека, действуя через свои функциональные рецепторы [Viani et al . , 2008].
Беременность сопровождается значительным изменением уровня грелина, поскольку гормон синтезируется и плацентой. Это обусловлено усилением потребности матери и плода в питательных веществах и энергии. Максимальный уровень гре-лина отмечается в середине II триместра, затем его уровень начинает плавно снижаться, и вскоре после родов достигает своих обычных значений [Fuglsang et al., 2005]. При этом известно, что нарушения жирового обмена приводят к прерыванию беременности [Tena-Sempre, 2008]. Снижение относительного уровня грелина на 30–40% при беременности может сопровождается угрозой невынашивания и спонтанными абортами иммунного генеза [Шестопалов и др, 2011]. С другой стороны, и относительное повышение уровня грелина в I триместре беременности, например, при голодании, может приводить к нарушению имплантации и ограничению инвазии трофобласта. Во II триместре грелин стимулирует пролиферацию клеток плаценты [Nakahara et al., 2006], а физиологическое снижение его уровня в III триместре связывают с подготовкой организма к родам [Muccioli et al., 2011]. Кроме того, грелин – небольшая молекула, способная преодолевать маточно-плацентарный барьер. При этом ткани плода также секретируют гре-лин, обеспечивая развитие тканей и органов [Cha-noine, Wong, 2004].
Роль грелина в регуляции клеток иммунной системы . Как известно, клетки иммунной системы очень чувствительны к изменениям эндокринного фона и обмена веществ. Гормоны и питательные вещества могут влиять на иммунный ответ и экспрессию цитокинов, и наоборот, провоспа-лительные цитокины и различные факторы роста, вырабатываемые во время воспаления или в ответ на повреждение, распространяясь по всему телу, оказывают влияние на секрецию гормонов, нейроэндокринные функции и метаболизм [Gregori, 2011].
В некоторых случаях, изменения уровня грели-на сопровождаются глубокими нарушениями иммунитета, что предполагает значимую роль гормона в их патогенезе. Известно, что уровень грелина и количество GHS-R регулируются в состояниях острого и хронического воспаления, а также при аутоиммунных процессах [Hattori, 2001; Nagaya et al., 2001; Muccioli et al . , 2002; Baatar et al . , 2011; Colldén et al . , 2017]. В связи с этим, повышение уровня грелина в плазме или сыворотке крови рассматривается некоторыми исследователями как признак, связанный с тяжестью заболевания и/или наличием осложнений [Dixit et al . , 2004].
Рецепторы грелина экспрессированы на Т-лимфоцитах (в том числе на регуляторных Т-клетках, Treg), В-лимфоцитах, NK-клетках (англ. Natural killer, NK), нейтрофилах, макрофагах, моноцитах и дендритных клетках [Gnanapavan et al., 2002; Hattori, 2009]. При активации клеток отмечается увеличение количества рецепторов грелина, что подтверждает предположение о возможности регуляции грелином иммунного ответа, клеточного развития и дифференцировки [Dixit et al., 2004]. Кроме того, грелин ингибирует экспрессию рецепторов к лептину на Т-клетках человека, что может вызывать дозозависимое подавление индуцированной лептином продукции цитокинов. Это свидетельствует о существовании реципрокной системы регуляции, в которой лептин и грелин активируют клетки иммунной системы и регулируют вос- паление [Романцова, Волкова, 2005; Шестопалов и др., 2011].
Грелин может регулировать развитие иммунных реакций за счет подавления выработки активированными Т-клетками провоспалительных цитокинов, таких, как интерлейкин (англ. Interleukin, IL) -1 β , фактор некроза опухоли- α , IL-6, IL-17, IL-12, гранулоцитарно-макрофагальный колониестимулирующий фактор; за счет угнетения транскрипционного фактора NF- κ B (англ. Nnuclear factor κB), ответственного за их синтез [Dixit et al., 2004; Романцова, Волкова, 2005; Dixit, Taub, 2005]. В том числе, противовоспалительные эффекты грелина связывают с подавлением продукции IL-8 и активных форм кислорода, а также с ограничением миграции нейтрофилов, макрофагов и моноцитов в очаг воспаления, что в совокупности с усилением продукции IL-10 и трансформирующего фактора роста опухоли- β 1 дендритными клетками, способствуют формированию и поддержанию пула Treg [Романцова, Волкова, 2005; Gon-zalez-Rey et al . , 2006; El-Eter et al . , 2007; Орлова, Ширшев, 2010]. Показано, что грелин, в концентрации отражающей его уровень при беременности, может усиливать формирование регуляторных NK-клеток и их миграцию в плаценту, а также усиливать экспрессию рецептора к IL-7 (CD127) и продукцию IL-4 CD4+-клетками, за счет чего будет способствовать формированию Т-хелперов (Th) 2 типа [Орлова, 2011; Орлова, Ширшев, 2012; Шир-шев и др, 2012, 2014]. Кроме этого, показано, что грелин играет важную роль при дифференцировке тимоцитов за счет стимуляции продукции IL-4 и апоптоза CD4+ и CD8+ клеток и контролирует формирование Treg [Орлова, Ширшев, 2013].
Экспериментальные исследования энцефаломиелита и рассеянного склероза у мышей показали, что введение гормона уменьшает выраженность воспалительного процесса в ЦНС и периферической крови, где отмечается уменьшение численности аутореактивных Th1-клеток и IL-17-продуцирующих Т-хелперов [Souza-Moreira et al . , 2013].
Исследования нескольких групп показали, что грелин играет важную роль в регуляции структуры и функций тимуса. Это связано с тем, что рецепторы к грелину экспрессируются как на монопози-тивных CD4+- и CD8+ - клетках, так и на дубльпо-зитивных, которые несут двойной набор GHS-R. При этом количество GHS-R на тимоцитах уменьшается с возрастом и соответствует темпам возрастной инволюции тимуса, а введение гормона стареющим мышам способствует изменению структурно-функциональных показателей тимуса – уменьшению процента жировой ткани с восстановлением нормально функционирующих зон, усилением дифференцировки тимоцитов и мигра- ции общих лимфоидных предшественников из костного мозга [Dixit et al., 2004, 2007].
Таким образом, на уровне иммунной системы грелин оказывает выраженный противовоспалительный эффект за счет регуляции процессов дифференцировки, пролиферации, апоптоза и продукции цитокинов [Van der Lely et al . , 2004; Орлова, Ширшев, 2010, 2013; Baatar et al . , 2011].
Перспективы использования грелина в медицинской практике . Изменения уровня грелина, наблюдаемые при некоторых патологических состояниях, открывают перспективы использования эндогенного гормона для их коррекции. Особый интерес представляет возможность лечения грели-ном нейродегенеративных расстройств, таких, как рассеянный склероз, болезнь Альцгеймера и болезнь Паркинсона, а также замедления старения в целом.
В сосудистой ткани, где широко распространены рецепторы грелина, гормон оказывает прямое воздействие. Внутривенное введение грелина здоровым людям вызывает расширение кровеносных сосудов и увеличивает сердечный выброс, а у больных с хронической сердечной недостаточностью улучшает работу сердца и снижает среднее артериальное давление, не влияя на частоту сердечных сокращений и не вызывая побочных эффектов в почках [Colldén et al . , 2017].
Еще одно важное свойство грелина заключается в подавлении инсулинрезистентности кардиомиоцитов (индуцированной глюко- и липотоксич-ностью), что свидетельствует о возможной эффективности грелина для лечения болезней миокарда при сахарном диабете [Iglesias et al . , 2004].
Работа выполнена в рамках государственного задания; номер госрегистрации темы: 01201353248.
Список литературы Физиологические эффекты Грелина
- рлова Е.Г. Регуляция лептином и грелином индукции Т-регуляторных лимфоцитов // Вестник Уральской медицинской академической науки. 2011. Т. 35, № 2/1. С. 55-56.
- Орлова Е.Г., Ширшев С.В. Регуляция грелином функциональной активности моноцитов человека в модели in vitro // Доклады Академии наук. 2010. Т. 434(6). С. 821-824.
- Орлова Е.Г., Ширшев С.В. Регуляция лептином и грелином продукции интерферона-гамма и интерлейкина-4 в системе in vitro // Вестник Пермского университета. 2012. Вып. 3. С. 81-83.
- Орлова Е.Г., Ширшев С.В. Роль лептина и грелина в индукции дифференцировки ИЛ17-продуцирующих и Т-регуляторных лимфоцитов // Бюллетень экспериментальной биологии и медицины 2013. Т. 156, № 12. С. 786-791.
- Романцова Т.И., Волкова Г.Е. Лептин и грелин: антагонизм и взаимодействие в регуляции энергетического обмена // Ожирение и метаболизм. 2005. № 2. С. 2-9.
- Шестопалов А.В. и др. Грелин и соматотропный гормон при физиологически протекающей беременности // Журнал акушерства и женских болезней. 2011. № 2. С. 68-72.
- Ширшев С.В. и др. Гормональная регуляция продукции IFN-g и IL-4 тимоцитами // Вестник Уральской медицинской академической науки. 2012. № 4(41). С. 76-77.
- Ширшев С.В. и др. Роль гормонов, ассоциированных с гестацией, в регуляции экспрессии молекул, отвечающих за функциональную активность NK-клеток // Доклады Академии наук. 2014. Т. 457, № 5. C. 618-621.
- Baatar D. et al. The effects of ghrelin on inflammation and the immune system // Molecular and Cellular Endocrinology. 2011. Vol. 340. P. 44-58.
- Baldwin J.M. The probable arrangement of the helices in G protein-coupled receptors // The EMBO Journal. 1993 Vol. 12. P. 1693-1703.
- Bockaert J., Pin J.P. Molecular tinkering of G protein-coupled receptors: An evolutionary success // The EMBO Journal. 1999. Vol. 18. P. 1723-1729.
- Bowers C.Y. On a peptidomimetic growth hormonereleasing peptide // The Journal of Clinical Endocrinology & Metabolism 1994. Vol. 79. P. 940-942.
- Cabral A. et al. Is ghrelin synthesized in the central nervous system? // International Journal of Molecular Sciences. 2017. Vol. 15, № 18 (3). ppi. E638.
- Cekic C. et al. Evaluation of the relationship between serum ghrelin, Creactive protein and interleukin-6 levels, and disease activity in inflammatory bowel diseases // Hepatogastroenterology. 2008. Vol. 61, № 133. P. 1196-1200.
- Chanoine J.P., Wong A.C. Ghrelin gene expression is markedly higher in fetal pancreas compared with fetal stomach: effect of maternal fasting // Endocrinology. 2004. Vol. 145. P. 3813-3820.
- Collden G. et al. Therapeutic Potential of Targeting the Ghrelin Pathway // International Journal of Molecular Sciences. 2017. Vol. 18(4). pii: E798.
- Cowley M.A. et al. The distribution and mechanism of action of ghrelin in the CNS demonstrates a novel hypothalamic circuit regulating energy homeostasis // Neuron. 2003. Vol. 37. P. 649-661.
- De Smet B. et al. Effect of peripheral obestatin on gastric emptying and intestinal contractility in rodents // Neurogastroenterology &Motility. 2007. Vol. 19. P. 211-217.
- De Souza M.J. et al. Fasting ghrelin levels in physically active women: relationship with menstrual disturbances and metabolic hormones // The Journal of Clinical Endocrinology & Metabolism. 2004. Vol. 89. P. 3536-3542.
- Delporte C. Structure and Physiological Actions of Ghrelin // Scientifica. 2013. 25 p.
- Dhillo W.S. et al. The neuroendocrine physiology of kisspeptin in the human // Reviews in Endocrine and Metabolic Disorders. 2007. Vol. 8. P. 41-46.
- Dixit V.D. et al. Ghrelin inhibits leptin- and activation-induced proinflammatory cytokine expression by human monocytes and T cells // The Journal of Clinical Investigation. 2004. Vol. 1. P. 57-66.
- Dixit V.D. et al. Ghrelin promotes thymopoiesis during aging // The Journal of Clinical Investigation. 2007. Vol. 117, № 10. P. 2778-2790.
- Dixit V.D., Taub D.D. Ghrelin and immunity: a young player in an old field // Experimental gerontology. 2005. Vol. 40. P. 900-910.
- Diz Chaves Y. et al. GH responses to GHRH and GHRP-6 in Streptozotocin (STZ)-diabetic rats // Life Science. 2003. Vol. 14, № 73(26). P. 3375- 3385.
- El-Eter E. et al. In vivo and in vitro antioxidant activity of ghrelin: Attenuation of gastric ischemic injury in the rat // Journal of Gastroenterology and Hepatology. 2007. Vol. 22, № 11. P. 1791-1799.
- Fernandez G. et al. Des-acyl ghrelin directly targets the arcuate nucleus in a ghrelin-receptor independent manner and impairs the orexigenic effect of ghrelin // Neuroendocrinolology. 2016. Vol. 28, № 2. P. 205-219.
- Fernández-Fernández R. et al. Novel signals for the integration of energy balance and reproduction // Molecular and Cellular Endocrinology. 2006. Vol. 25, № 254-255. P. 127-132.
- Fernández-Fernández R. et al. Ghrelin effects on gonadotropin secretion in male and female // Neuroscience Letters. 2004. Vol. 362, № 2. P.103-107.
- Fuglsang J. et al. Ghrelin and its relationship to growth hormones during normal pregnancy // Clinical Endocrinology. 2005. Vol. 62. P. 554-559.
- Gnanapavan S. et al. The tissue distribution of the mRNA of ghrelin and subtypes of its receptor, GHS-R, in humans // The Journal of Clinical Endocrinology & Metabolism. 2002. Vol. 87. P. 2988.
- Gonzalez-Rey E. et al. Therapeutic action of ghrelin in a mouse model of colitis // Gastroenterology. 2006. Vol. 30. P. 1707-1720.
- Granado M. et al. Anti-inflammatory effect of the ghrelin agonist growth hormone-releasing peptide-2 (GHRP-2) in arthritic rats // American Journal of Physiology-Endocrinology and Metabolism. 2005. Vol. 288. P. 486-492.
- Gray P.C. et al. Regulation of ion channels by cAMPdependent protein kinase and A-kinase anchoring proteins // Current Opinion in Neurobiology. 1998. Vol. 8, № 4. P. 330-334.
- Gregori S. Dendritic cells in networks of immunological tolerance // Tissue Antigens. 2011. Vol. 77. P. 89-99.
- Gualillo O. et al. Ghrelin, a novel placental-derived hormone // Endocrinology. 2001. Vol. 142. P. 788-794.
- Hattori N. Expression, regulation and biological actions of growth hormone (GH) and ghrelin in the immune system // Growth Hormone & IGF Research. 2009. Vol. 19. P. 187-197.
- Hattori N. et al. GH, GH Receptor, GH Secretagogue Receptor, and Ghrelin Expression in Human T Cells, B Cells, and Neutrophils // The journal of Clinical Endocrinology & Metabolism. 2001. Vol. 86. P. 4284-4291.
- Hosoda H. et al. Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue // Biochemical and Biophysical Research Communications. 2000. Vol. 279, Iss. 3. P. 909-913.
- Hosoda H. et al. Structural divergence of human ghrelin. Identification of multiple ghrelin-derived molecules produced by post-translational processing // The Journal of Biological Chemistry. 2003. Vol. 278. P. 64-70.
- Howard A.D. et al. A receptor in pituitary and hypothalamus that functions in growth hormone release // Science. 1996. Vol. 16, I.8. P. 974-977.
- Kanamoto N. et al. Genomic structure and characterization of the 5'-flanking region of the human ghrelin gene // Endocrinology. 2004. Vol. 145, № 9. P. 4144-4453.
- Koch A. et al. Regulation and prognostic relevance of serum ghrelin concentrations in critical illness and sepsis // Critical Care. 2010. Vol. 14. P. 94- 98.
- Kojima M. et al. Ghrelin is a growth-hormonereleasing acylated peptide from stomach // Nature. 1999. Vol. 402. P. 656-660.
- Kojima M., Kangawa K. Ghrelin: structure and function // Physiology Review. 2005. Vol. 85, № 2. P. 495-522.
- Korbonits M. et al. Presence of ghrelin in normal and adenomatous human pituitary // Endocrine. 2001. Vol. 14. P. 101-104.
- Korbonits M. et al. Ghrelin - a hormone with multiple functions // Frontiers in Neuroendocrinology. 2004. Vol. 25. P. 27-68.
- Leung P.K. et al. The truncated ghrelin receptor polypeptide (GHS-R1b) acts as a dominant-negative mutant of the ghrelin receptor // Cellular Signaling. 2007. Vol. 19. P. 1011-1022.
- Liu J. et al. Novel ghrelin assays provide evidence for independent regulation of ghrelin acylation and secretion in healthy young men // The Journal of Clinical Endocrinology & Metabolism. 2008. Vol. 93. P. 1980-1987.
- Mori K. et al. Kidney produces a novel acylated peptide, ghrelin // FEBS Letter. 2000. Vol. 486. P. 213-216.
- Muccioli G. et al. Beyond the metabolic role of ghrelin: a new player in the regulation of reproductive function // Peptides. 2011. Vol. 32. P. 2514-2521.
- Muccioli G. et al. Neuroendocrine and peripheral activities of ghrelin: implications in metabolism and obesity // European Journal of Pharmacology. 2002. Vol. 440. P. 235-254.
- Nagaya N. et al. Hemodynamic and hormonal effects of human ghrelin in healthy volunteers // American journal of physiology. Regulatory, integrative and comparative physiology. 2001. Vol. 280. P. 1483-1487.
- Nakahara K. et al. Maternal ghrelin plays an important role in rat fetal development during pregnancy // Endocrinology. 2006. Vol. 147. P. 1333- 1342.
- Petersenn S. Structure and regulation of the growth hormone secretagogue receptor // Minerva Endocrinologica. 2002. Vol. 27. P. 243-256.
- Pinto S. et al. Rapid rewiring of arcuate nucleus feeding circuits by leptin // Science. 2004. Vol. 304. P. 110-115.
- Repasi A. et al. Ghrelin and reproductive disorders // Molecular and Cellular Endocrinology. 2011. Vol. 340. P. 70-79.
- Smith R.G. et al. Peptidomimetic regulation of growth hormone secretion // Endocrine Reviews. 1997. Vol. 5. P. 621-645.
- Soriano-Guillén L. et al. Ghrelin levels in obesity and anorexia nervosa: effect of weight reduction or recuperation // The Journal of Pediatrics. 2004. Vol. 144, № 1. P. 36-42.
- Souza-Moreira L. et al. Therapeutic effect of ghrelin in experimental autoimmune encephalomyelitis by inhibiting antigen-specific Th1/Th17 responses and inducing regulatory T cells Brain // Behavior and Immunity. 2013. № 30. P. 54-60.
- Spiegel K. et al. Twenty-four-hour profiles of acylated and total ghrelin: relationship with glucose levels and impact of time of day and sleep // The journal of Clinical Endocrinology & Metabolism. 2011. Vol. 96, № 2. P. 486-493.
- Stark R. et al. Des-acyl ghrelin and ghrelin Oacyltransferase regulate hypothalamic-pituitaryadrenal axis activation and anxiety in response to acute stress // Endocrinology. 2016. Vol. 157, № 10. P. 3946-3957.
- Stasi C., Milani S. Functions of ghrelin in brain, gut and liver // CNS Neurological. Disorders - Drugs and Targets. 2016. Vol. 15, № 8. Р. 956-963.
- Tena-Sempere M. Ghrelin as a pleotrophic modulator of gonadal function and reproduction // Nature clinical practice. Endocrinology & metabolism. 2008. Vol. 4, № 12. P. 666-674.
- Tena-Sempere M. Ghrelin: novel regulator of gonadal function // Journal of. Endocrinology Investigation. 2005. Vol. 28, Suppl. 5. P. 26-29.
- Trumpp-Kallmeyer S. et al. Towards understanding the role of the first extracellular loop for the binding of peptide hormones to G-protein coupled receptors // Pharmaceutica Acta Helvetiae. 1995. Vol. 70, № 3. P. 255-262.
- Tschöp M. et al. Post-prandial decrease of circulating human ghrelin levels // Journal of Endocrinology Investigation. 2001. Vol. 24. P. 19-21.
- Van der Lely A.J. et al. Biological, physiological, pathophysiological, and pharmacological aspects of ghrelin // Endocrine Reviews. 2004. Vol. 25. P. 426-457.
- Viani I. et al. Ghrelin inhibits steroid biosynthesis by cultured granulosa-lutein cells // Journal of Clinical Endocrinology and Metabolism. 2008. Vol. 93. P. 1476-1481.
- Watts V.J., Neve KA. Sensitization of adenylate cyclase by G-alpha i/o-coupled receptors // Pharmacology & Therapeutics. 2005. Vol. 106, № 3. P. 405-421.
- Wellman M., Abizaid A. Growth Hormone Secretagogue Receptor Dimers: A New Pharmacological Target // eNeuro. 2015. Vol. 2 (2). P. e005314.2015 1-16.
- Wynne K. et al. Appetite control // Endocrinology. 2005. Vol. 184, № 2. P. 291-318.
- Yildiz B.O. et al. Alterations in the dynamics of circulating ghrelin, adiponectin, and leptin in human obesity // Proceedings of the National Academy of Sciences USA. 2004. Vol. 101, № 28. P. 10434- 10439.
- Yuan M.J. et al. Potential new role of the GHSR-1amediated signaling pathway in cardiac remodeling after myocardial infarction (Review) // Oncology Letters. 2014. Vol. 8, № 3. P. 969-971.
- Zhang J.V.O. et al. Obestatin, a peptide encoded by the ghrelin gene, opposes ghrelin's effects on food intake // Science. 2005. Vol. 310. P. 996-999.


