Физиологические особенности гемоцитов Therea olegrandjeani
Автор: Гребцова Е.А., Присный А.А.
Статья в выпуске: 1 т.257, 2024 года.
Бесплатный доступ
Цель исследования заключалась в составлении гемоцитарной формулы имаго Therea olegrandjeani, изучении устойчивости каждого гемоцитарного типа к осмотической нагрузке и общей жизнеспособности клеток. Фагоциты проявляют стойкость к изменению осмолярности среды благодаря резерву плазмалеммы и мембранным органеллам. Прогемоциты ввиду отсутствия складчатости мембраны способны противостоять лишь кратковременному воздействию гипотонических условий, активируя чувствительные к объему пути переноса ионов. Гранулоциты и сферулоциты обладают механизмами регуляторного уменьшения объема, что позволяет возвращать размеры к исходному состоянию. Жизнеспособность клеток стремительно снижается после 10 минут пребывания в условиях, отличных от физиологически нормальных.
Гемолимфа, гемоциты, мембранный резерв клеток, осмотическая нагрузка
Короткий адрес: https://sciup.org/142240443
IDR: 142240443 | УДК: 591.111.1: | DOI: 10.31588/2413_4201_1883_1_257_55
Текст научной статьи Физиологические особенности гемоцитов Therea olegrandjeani
Способность к саморегуляции объема является важным условием для поддержания функциональной активности гемоцитов. Мембранный резерв представляет собой один из важнейших параметров клеток. Способность противостоять осмотической нагрузке может достигаться различными механизмами в зависимости от рассматриваемого гемоцитарного типа. Преобладание микровозвышений на поверхности плазмалеммы, обилие везикул и лизосом в цитоплазме позволяют фагоцитам демонстрировать устойчивость к осмотическому стрессу и выполнять свою прямую функцию – захват инородных объектов [1, 2].
Использование современных подходов в изучении физиологии клетки позволяет выявить ряд закономерностей, которые могут характеризовать сравнительные аспекты реализации функций клеток лимфоидного ряда в филогенезе. Одним из актуальных направлений исследований является изучение гемоцитарных реакций беспозвоночных животных в условиях экспериментального осмотического стресса.
Цель данного исследования – составить гемоцитарную формулу имаго Therea olegrandjeani, изучить устойчивость каждого гемоцитарного типа к осмотической нагрузке и определить общую жизнеспособность клеток гемолимфы.
Материал и методы исследований. Гемолимфу получали нелетальным способом из кончика усика, делили на 3 равных объема (20 мкл) и помещали в разные условия: изотоническую (0,97 % NaCl), гипертоническую (1,50 % NaCl) и сильно гипотоническую (0,25 % NaCl) среды. Определяли жизнеспособность с помощью автоматического счетчика клеток в каждой группе, спустя 3, 10 и 30 минут инкубации посредством окрашивания трипановым синим. Для регистрации морфологических изменений в эти же временные точки проводили наблюдения с помощью световой микроскопии (Nikon Eclipse Ti-E) с добавлением нейтрального красного красителя в режиме реального времени. Фиксировали исчезновение гемоцитарных типов, нарушение целостности мембран, размеры клеток, характер распределения гранул в клетке. Эксперимент проводили в трех повторностях.
Рассчитаны показатели абсолютного и относительного мембранного резерва. При вычислении площади круглых клеток использовали формулу площади круга, в случае клеток с неправильной формой, принимали их форму за эллипс и использовали формулу площади эллипса.
Рассчитывали абсолютную величину мембранного резерва (∆S) как разность между площадью клетки в сильно гипотоническом растворе и площадью клетки в изотонической среде [3].
AS = S(Cr) - S(И) , (1)
где AS - резерв плазмалеммы (gm2); S(Cr) - площадь клетки, после инкубации в сильно гипотонической среде (gm2); S(H) – площадь клетки, после инкубации в изотонической среде (µm2).
С целью сравнения использования мембранного резерва в сильно гипотоническом растворе гемоцитами насекомых определяли относительный мембранный резерв (MR) с использованием формулы [3]:
MR = (AS/Б(СГ))-100 % , (2)
где MR – доля используемого мембранного резерва (%); AS - резерв плазматической мембраны (gm2); S(Cr) -площадь клетки, после инкубации в сильно гипотонической среде (µm2).
Результат исследований.
Гемоцитарная формула имаго T. olegrandjeani представлена прогемоцитами (11 %), плазмоцитами (23 %), гранулоцитами (44 %), сферулоцитами (16 %), коагулоцитами (6 %).
Линейные параметры прогемоцитов и их ядер после трех минут пребывания в растворе с пониженной осмолярностью сохранились прежними. Спустя 10 минут наблюдения гемоциты погибали из-за разрыва плазмалеммы без предварительного увеличения объема. Ввиду изначально сглаженного микрорельефа прогемоцитов [1], они способны противостоять гипоосомотическому стрессу лишь короткое время.
Отсутствие значимого увеличения размеров прогемоцитов в условиях пониженного осмотического давления, указывает на то, что клетки способны компенсировать отклонение от оптимального физиологического состояния. В этот период активируются механизмы транспорта ионов, реагирующие на малейшее изменение объема клеток, и обеспечивают уменьшение прогемоцитов до прежних размеров [4].
Размеры и морфология плазмоцитов не изменились по истечении трех минут инкубации в условиях пониженной осмолярности. Спустя 10 минут зафиксировано отсутствие псевдоподий и утрата подвижности. При дальнейшем наблюдении в режиме live зафиксировано повреждение лизосомальных мембран – в присутствии нейтрального красного цвет переходил от красного к бурому. Впоследствии происходили видимые разрывы плазмалеммы.
К 10 минуте гранулоциты значительно увеличились в размерах (Рисунок 1), однако ризоподии на поверхности все еще присутсвовали. Окрашенные нейтральным красным красителем клетки сохраняли красный оттенок. К 15-20 минуте площадь 83 % гранулоцитов достигла максимальных значений, у большинства гранулоцитов наблюдали частичное разрушение гранул и отсутствие псевдоподий. Однако в популяции этих гемоцитов оставались клетки меньшего размера без признаков нарушения внутриклеточных мембран. Это свидетельствует о том, что гранулоцитам в отличие от прогемоцитов требуется некоторое время для активации механизмов, позволяющих удалить избыток воды.
По истечении 10 минут диаметр сферулоцитов увеличился всего на 7-10 %. К концу экспериментального периода зафиксировано увеличение линейных параметров клеток на 23 %. Способность компонентов внутриклеточных мембран встраиваться в плазмалемму обеспечивает целостность сферулоцитов.
При попадании в гипотонический раствор коагулоциты немедленно набухали, наблюдались множественные повреждения мембраны и выход содержимого цитоплазмы во внешнюю среду.
Прижизненное окрашивание клеток трипановым синим позволило проанализировать жизнеспособность клеток в условиях осмотического стресса. Контрольный образец гемолимфы инкубировали в изотоническом растворе. Процент живых клеток составил 92,0 %.
Доля неповрежденных гемоцитов после трехминутной инкубации в сильно гипотонической среде составила 75,7 %. Отмеченная неустойчивость прогемоцитов и коагулоцитов позволяет предположить, что именно они оказались в числе погибших клеток. Спустя 10 минут инкубации количество живых клеток не превышало 71 %. К 30 минуте инкубации процент мертвых гемоцитов достиг 73 % (Рисунок 2).
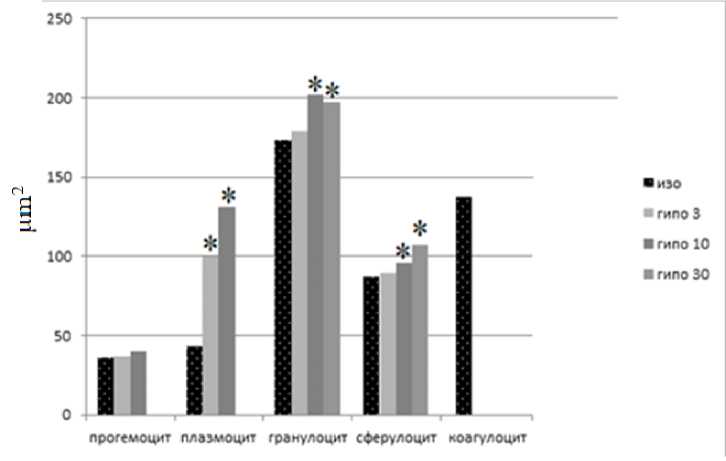
Рисунок 1 – Динамика изменения площади гемоцитов в условиях пониженного осмотического давления. Примечание: * – статистически достоверные различия между значениями параметров гемоцитов в условиях изотонии и при осмотической нагрузке по критерию Стьюдента при P<0,05
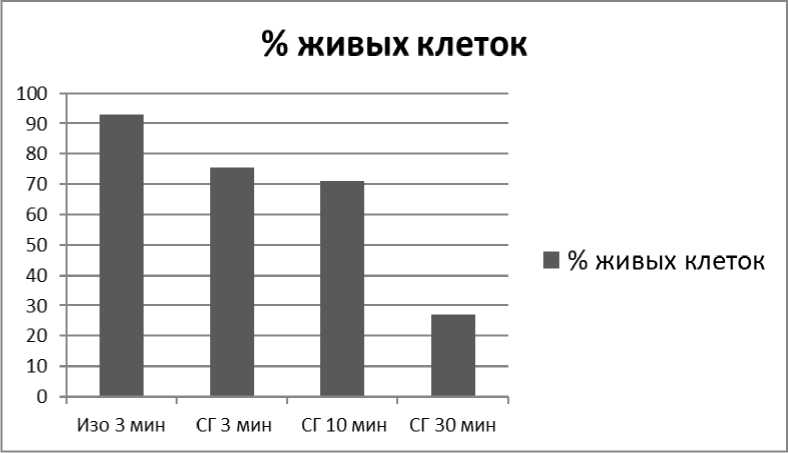
Рисунок 2 – Динамика жизнеспособности клеток при длительной гипоосмотической
нагрузке. «Изо» – изотонический раствор, «Сг» – сильно гипотонический раствор
При определении мембранного резерва учитывали максимальную площадь, зафиксированную для каждого гемоцитарного типа. Мгновенное разрушение коагулоцитов свидетельствует об отсутствии складчатости мембран (Таблица 1).
Таблица 1 – Показатели абсолютного ∆S и относительного мембранного резерва MR гемоцитов
|
Тип клеток |
∆S (µm2) |
MR (%) |
|
прогемоциты |
3,68 |
9,2 |
|
плазмоциты |
87,48 |
66,77 |
|
гранулоциты |
61,87 |
26,27 |
|
сферулоциты |
29,39 |
25,24 |
|
коагулоциты |
0 |
0 |
Значительное уменьшение линейных параметров прогемоцитов было хорошо заметно уже в первые минуты пребывания в условиях повышенной осмолярности. К 10 минуте клетки теряли округлые очертания, приобретали неправильную угловатую форму.
После трехминутной инкубации в гипертонической среде диаметр ядер плазмоцитов уменьшился на 8-13 %, лобоподии клеток сменились игольчатыми выростами. По истечении 10 минут происходило дальнейшее уменьшение гемоцитов, их контуры становились нечеткими, ядро не идентифицировалось.
Постепенное уменьшение площади гранулоцитов не привело к снижению жизнеспособности спустя 10 минут пребывания в гипертонической среде. Однако уже к 30 минуте только 32 % гранулоцитов не имели серьезных повреждений и увеличили свои линейные параметры до состояния 93 % от первоначальных размеров (Рисунок 3). Это свидетельствует о запуске процесса регуляторного восстановления объема. Оставшиеся клетки окрашивались трипановым синим.
К 30 минуте пребывания в среде с повышенной осмолярностью отмечено уменьшение размеров сферулоцитов, что привело к более плотному расположению гранул,
Коагулоциты к 10-ой минуте инкубации в гипертонической среде погибали.
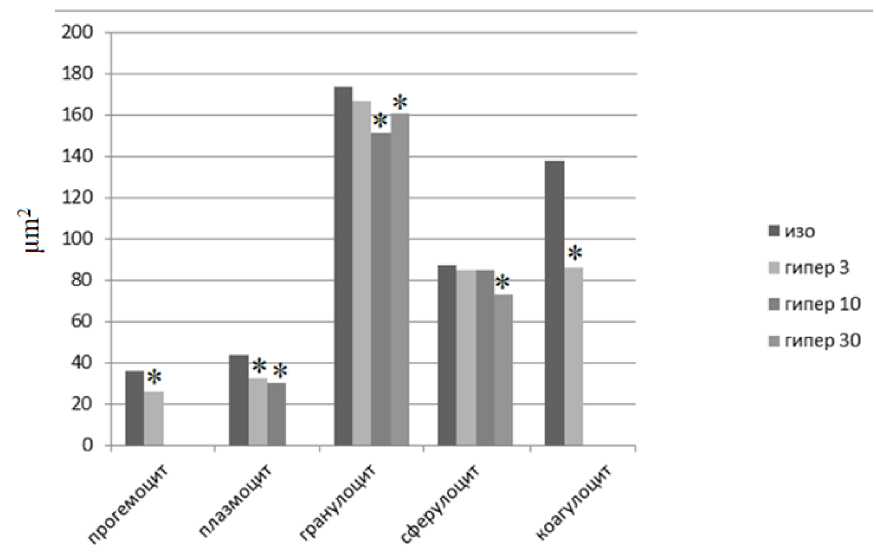
Рисунок 3 – Динамика изменения площади гемоцитов в условиях повышенного осмотического давления. Примечание: * – статистически достоверные различия параметров гемоцитов в условиях изотонии и при осмотическом стрессе по критерию Стьюдента при P<0,05
Сферулоциты и некоторые клетки из популяции гранулоцитов T. olegrandjeani проявляют устойчивость в условиях осмотической нагрузки благодаря запуску механизмов регуляторного восстановления объема. При набухании в гипотонической среде клетки могут задействовать элементы микрорельефа поверхности и сеть внутриклеточных мембран для предотвращения повреждений плазмалеммы. Возвращение размеров клеток к физиологической норме обеспечивается активацией путей переноса ионов [2, 4].
В условиях гипертонической нагрузки регуляторное увеличение объема происходит в ответ на малейшее отклонение размеров клеток от физиологической нормы. При оценке общей жизнеспособности в условиях гипертонической нагрузки к третьей минуте инкубации количество живых клеток составило – 91,3 %, к 10 минуте – 57,6 %, к 30 минуте – 32,3 %.
Заключение. В гемолимфе имаго T. olegrandjeani представлено пять гемоцитарных типов. Плазмоциты и гранулоциты играют главную роль в осуществлении защитных реакций. Высокие показатели мембранного резерва связаны с повышенной складчатостью плазмалеммы, что позволяет не только обеспечивать реакции фагоцитоза, но и противостоять пониженному осмотическому давлению. Кроме того, гранулоциты обладают механизмами регуляторного уменьшения объема. Максимальную устойчивость к осмотической нагрузке продемонстрировали сферулоциты. Клетки проявили наибольшую жизнеспособность при десятиминутном воздействии гипотонической среды, нежели гипертонической. Однако спустя 30 минут и в тех, и в других условиях значения выровнялись, и число живых клеток в обоих случаях не превышало 33 %.
Список литературы Физиологические особенности гемоцитов Therea olegrandjeani
- Гребцова Е. А. Морфофункциональная характеристика и осморегуляторные реакции гемоцитов представителей отряда Dictyoptera: диссертация.. кандидата биологических наук: 03.03.01 / Гребцова Елена Александровна; [Место защиты: Белгород. гос. аграр. ун-т им. В.Я. Горина]. - Белгород, 2017. - 184 с. EDN: OWUEPF
- Зацепина Г. Н. Изменение адаптационной способности и кинетики адаптации Т-лимфоцитов к гипотонии в патологических состояниях организма млекопитающих / Г. Н. Зацепина, С. В. Егудина, О. В. Тарнопольская // Биофизика. - 1992. - Т. 37. - Вып. 1. - С. 142-148.
- Орлов, С. Н. Регуляция объема клеток: механизмы, сопряженные клеточные реакции и патофизиологическое значение / С. Н. Орлов, К. Н. Новиков, // Физиологический журнал им. И М. Сеченова. - 1996. - Т. 82. - № 8-9. - С. 1-15.
- Орлов, С. Н. Механизмы активации ионного транспорта при изменении объема клеток / С. Н. Орлов, Т. Г. Гурло // Цитология. -1991. - Т. 33. -№ 11. - С. 101-110.
- Mc Manus, M. L. Regulation of Cell Volume in Health and Disease / M. L. Mc Manus, K. B. Churchwell [et. al.] // The New England Journal of Medicine. -1995 - № 19. - P. 123-134.
- Sardini, A. Cell Volume Horneostasis: The Role of Volurne-Sensitive Chloride Channels, Editor(s): E. Edward Bittar, Michael Pusch / A. Sardini // Advances in Molecular and Cell Biology, Elsevier -2006 - V. 38 - P. 199-214.


