Физиологические признаки перспективных штаммов бактерий родов Bacillus и Pseudomonas - продуцентов микробиопрепаратов
Автор: Асатурова А.М.
Статья в выпуске: 2 (141), 2009 года.
Бесплатный доступ
С целью разработки лабораторного регламента массовой наработки микробиопрепаратов были изучены физиологические признаки перспективных штаммов бактерий-антагонистов родов Bacillus и Pseudomonas в условиях периодического культивирования. На основе полученных данных установлены оптимальные температура культивирования и кислотность среды, а также источники углеродного и азотного питания штаммов-продуцентов микробиопрепаратов.
Бактерии-антагонисты, микробиопрепарат, периодическое культивирование, физиологические признаки, температура культивирования, кислотность среды (рн), источники углерода и азота
Короткий адрес: https://sciup.org/142150910
IDR: 142150910
Текст научной статьи Физиологические признаки перспективных штаммов бактерий родов Bacillus и Pseudomonas - продуцентов микробиопрепаратов
Введение. Известно, что основной стадией любого микробиологического производства является производственное культивирование соответствующего микроорганизма, проводимое либо с целью увеличения микробной массы – биомассы, либо для получения продуктов метаболизма растущей популяции микроорганизмов [1]. Для разработки производства биофунгицидов комплексного действия необходимо получение жидкой культуры (ЖК) с оптимальной плотностью микробных клеток и концентрации антифунгальных веществ. Для этого были изучены физиологические признаки перспективных штаммов бактерий родов Bacillus и Pseudomonas : условия культивирования и кислотность среды, а также источники углеродного и азотного питания.
Материалы и методы. Объектом исследований служили штаммы бактерий-антагонистов Fa 4-1 Bacillus subtilis , D 7-1 B. subtilis , Sgrc-1 Pseudomonas fluorescens и Oif 2-1 Pseudomonas sp.
Для определения оптимальной температуры культивирования штаммы выращивали на жидких питательных средах Кинга В [2] (для штаммов Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. ) и Тайлона 3 [3] (для штаммов Fa 4-1 B. subtilis и D 7-1 B. subtilis ) при температурах 20, 25, 30 и 35 °С.
Оптимальную кислотность среды определяли, выращивая штаммы на вышеуказанных жидких питательных средах при оптимальных температурах. Добавлением лимонной кислоты или щелочи (NaOH) pH среды устанавливали в пределах 3, 6, 8, и 10.
Для определения оптимальных источников углеродного и азотного питания штаммы Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. выращивали на жидкой питательной среде Кинга В, а штаммы Fa 4-1 B. subtilis и D 7-1 B. subtilis – Чапека для бактерий [4]. Источниками углерода служили глюкоза, сахароза, меласса и глицерин. При изучении углеродных источников неизменными компонентами азотного питания для бацилл был азотнокислый натрий, а для псевдомонад – пептон. Азотсодержащие вещества (азотнокислый натрий, пептон, дрожжевой и кукурузный экстракты) добавляли в среды в качестве единственного источника азота с неизменными источниками углеродного питания: глюкоза (для бактерий рода Bacillus ) и глицерин (для бактерий рода Pseudomonas ).
Бактерии культивировали в течение двух суток на термостатированных качалках (195 об/мин) в колбах Эрленмейера (750 мл) с объемом питательной среды 150 мл и предварительным внесением посевной (маточной) культуры (2 % от объема питательной среды).
По окончании культивирования определяли численность бактериальных клеток. Для определения численности бактериальных клеток в ЖК использовали метод Коха [5]. Определение числа клеток этим методом включает три этапа: приготовление разведений, посев на питательную среду в чашку Петри (ЧП) и подсчет выросших колоний.
Для приготовления разведений стерильную водопроводную воду разливали по 9 мл в пробирки. Затем 1 мл исследуемой суспензии пипеткой переносили в колбу с 99 мл стерильной воды. Затем отбирали 1 мл суспензии и переносили в пробирку с 9 мл воды. Полученное разведение тща- тельно перемешивали, несколько раз вбирая в пипетку и выпуская из нее полученную суспензию. Таким же образом готовили все последующие разведения. Высев исследуемой ЖК осуществляли глубинным способом. Для этого по 1 мл из соответствующего разведения переносили в стерильные ЧП. Затем заливали в чашки по 15-20 мл среды, расплавленной и остуженной до 45-50 °С, и смешивали питательную среду с посевным материалом легкими вращательными движениями, после чего чашки оставляли на горизонтальной поверхности до застывания среды. Колонии бактерий подсчитывали через пять-семь суток инкубации. Количество клеток в 1 мл исследуемой ЖК вычисляли по формуле:
Т = a х 10n ,
V где Т – количество колониеобразующих единиц (КОЕ) в 1 мл;
а – среднее число колоний, выросших после посева из данного разведения;
-
V – объем суспензии, взятый для посева;
-
10n – коэффициент разведения.
Математическую обработку опытных данных проводили с использованием стандартных компьютерных программ.
Определение оптимальной температуры и реакции среды для культивирования штаммов бактерий-антагонистов
Существенное значение для роста микроорганизмов имеет такой фактор внешней среды как температура. Результаты проведенных опытов показали, что отношение к температуре у изучаемых штаммов неодинаково.
Высокая плотность клеток штаммов бацилл-антагонистов обнаруживалась только при температурном режиме 30-35 °С. При этом анализ опытных образцов показал, что оптимальной температурой, при которой происходит максимальное накопление микробной массы и практически полная утилизация питательной среды, для штамма D 7-1 B. subtilis является 30 °С, а для штамма Fa 4-1 B. subtilis – диапазон 30-35 °С (рис. 1).
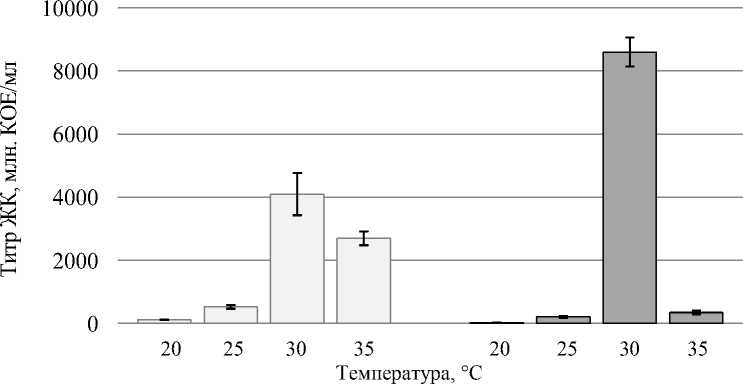
Fa 4-1 B. subtilis D 7-1 B. subtilis
Рисунок 1 – Рост штаммов бактерий-антагонистов рода Bacillus при различных температурах в процессе периодического культивирования
Существенным достоинством штаммов псевдомонад по сравнению с бациллярными бактериями была способность к активному росту при более низких температурах: 20-25 °С (рис. 2).
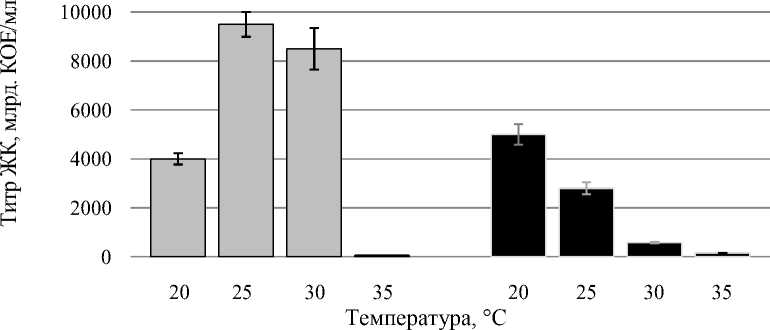
Sgrc-1 P. fluorescens Oif 2-1 Pseudomonas sp.
Рисунок 2 – Рост штаммов бактерий-антагонистов рода Pseudomonas при различных температурах в процессе периодического культивирования
Несмотря на то, что титр клеток оставался высоким вне зависимости от температурного режима и составлял 2,8-9,5 × 1012 КОЕ/мл при 20-25 °С и от 6,0 × 1010 до 8,5 × 1012 КОЕ/мл при 3035 °С, повышение температуры культивирования до 30-35 °С приводило к появлению клеток с отсутствием желто-зеленого внеклеточного пигмента, что связано с потерей клетками антифунгаль-ной активности (рис. 3) [6].
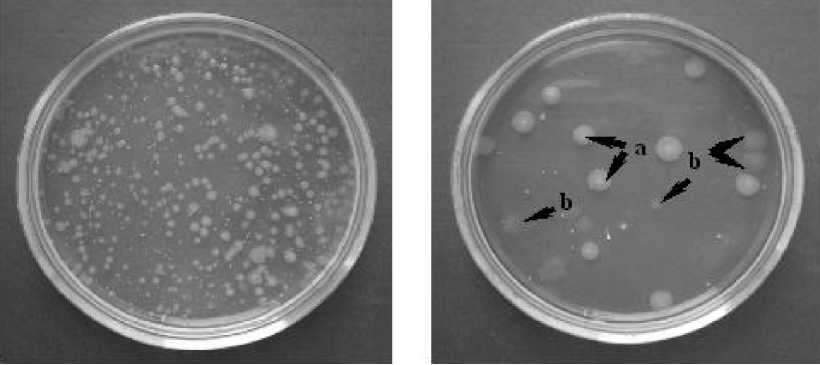
1 2
Рисунок 3 – Влияние температуры на пигментообразующую способность штаммов бактерий-антагонистов рода Pseudomonas (ориг.)
1 – типичные клетки с желто-зеленым внеклеточным пигментом (культивирование при температуре 20-25 °С);
2 – типичные (а) и нетипичные (b) клетки с отсутствием желто-зеленого внеклеточного пигмента (культивирование при температуре 35 °С).
Следовательно, оптимальной для роста штаммов флюоресцирующих бактерий Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. является температурный диапазон 20-25 °С.
Одним из важных факторов, определяющих нормальный рост бактерий, является реакция среды. При изменении ее в неблагоприятную сторону микроорганизм перестает расти даже в тех случаях, если все остальные условия окружающей среды будут оптимальными [7].
При определении оптимальной кислотности среды у всех исследованных штаммов отмечался достаточно высокий титр ЖК при рН среды 6 и 8. Лимитирующими рост бактерий-антагонистов оказались значения реакции среды 3 и 10 (рис. 4, 5).
У штаммов Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. при указанных уровнях рН практически не обнаруживалось роста клеток, а в случае с бациллярными штаммами были получены ЖК с низкой плотностью бактериальных клеток: 1,4-4,0 х 106 КОЕ/мл при рН 3 и 4,75,6 ×106 КОЕ/мл при рН 10. Однако, принимая во внимание полученный титр (для штаммов Fa 4-1 B. subtilis , D 7-1 B. subtilis 8,5×108 и 2,3×109 КОЕ/мл соответственно) и объем посевной культуры (3 мл на 150 мл питательной среды), можно сделать вывод о том, что при рН среды 3 и 10 бактерии рода Bacillus не размножались, а находились в состоянии покоя, сохраняя жизнеспособность благодаря наличию споровой стадии (рис. 4).
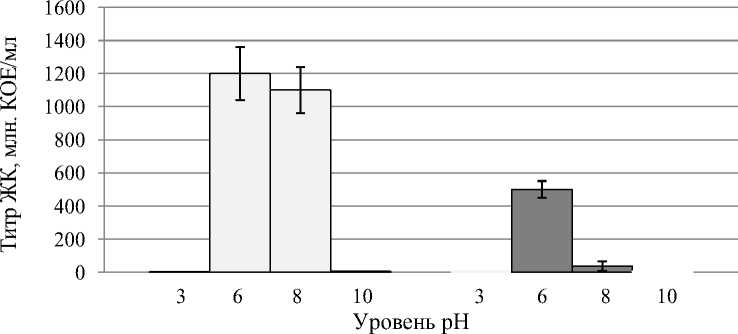
Fa 4-1 B. subtilis D 7-1 B. subtilis
Рисунок 4 – Рост штаммов бактерий-антагонистов рода Bacillus при различных уровнях рН в процессе периодического культивирования
В отличие от бацилл штаммы бактерий рода Pseudomonas не формируют спор и других форм покоя, поэтому при рН среды 3 полностью погибали, а при рН 10 выживали лишь единичные клетки (рис. 5).
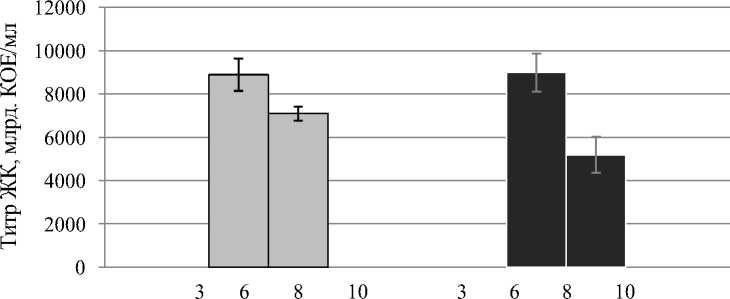
Уровень рН
Sgrc-1 P. fluorescens Oif 2-1 Pseudomonas sp.
Рисунок 5 – Рост штаммов бактерий-антагонистов рода Pseudomonas при различных уровнях рН в процессе периодического культивирования
Следовательно, для перспективных биоагентов Fa 4-1 B. subtilis , Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. оптимальным диапазоном реакции среды является 6-8, а для штамма D 7-1 B. subtilis – рН 6. Именно при данных значениях реакции среды отмечена высокая плотность популяций бактерий и максимальная утилизация питательной среды.
Определение оптимальных источников углеродного и азотного питания для культивирования штаммов бактерий-антагонистов
Эффективность использования штаммами-антагонистами источников углерода и азота определялась также по количеству колониеобразующих единиц.
Максимальная плотность клеток штамма Fa 4-1 B. subtilis отмечалась на среде, где в качестве источников углерода были меласса и глюкоза (1,3-1,6 × 109 КОЕ/мл), а для штамма D 7-1 B. subtilis – меласса и сахароза (1,9-2,8 × 109 КОЕ/мл) (рис. 6).

Fa 4-1 B. subtilis
D 7-1 B. subtilis
Рисунок 6 – Рост штаммов бактерий-антагонистов рода Bacillus в зависимости от источников углерода в процессе периодического культивирования
Минимальный титр штаммов Fa 4-1 B. subtilis и D 7-1 B. subtilis отмечен на питательной среде с добавлением в качестве источника углеродного питания глицерина (1,1 × 107 и 8,7 × 106 КОЕ/мл соответственно). Это указывает на неспособность бациллярных бактерий использовать данное соединение. Несмотря на присутствие всех остальных компонентов среды, а также оптимальные температуру и реакцию среды, данные количественного учета свидетельствуют о том, что размножения бактерий с данным источником углерода не происходило.
Штаммы пигментирующих бактерий оказались более пластичными и активно использовали весь спектр испытываемых источников углерода, что наглядно показал анализ образцов ЖК штаммов. Максимальный титр для штамма Sgrc-1 P. fluorescens отмечен в вариантах с добавлением сахарозы, глюкозы и глицерина (2,9-4,8 × 1012 КОЕ/мл), а для штамма Oif 2-1 Pseudomonas sp. – глицерина и глюкозы (2,6-4,9 × 1012 КОЕ/мл) (рис. 7).
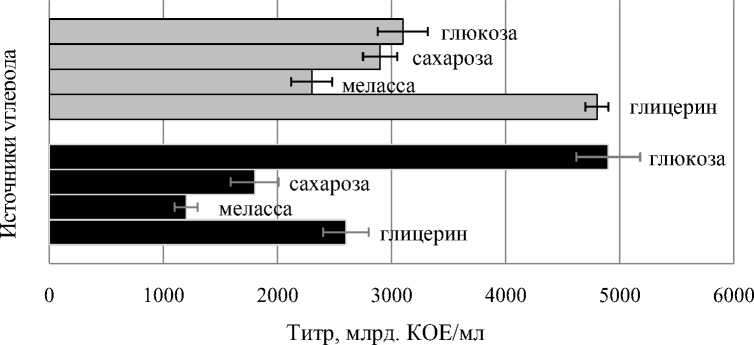
Sgrc-1 P. fluorescens
Oif 2-1 Pseudomonas sp.
Рисунок 7 – Рост штаммов бактерий-антагонистов рода Pseudomonas в зависимости от источников углерода в процессе периодического культивирования
Высокий титр штамма Fa 4-1 B. subtilis наблюдался на питательных средах, где в качестве источников азота использовались кукурузный экстракт, азотнокислый натрий и пептон (2,3-5,4×108 КОЕ/мл). Тогда как штамм D 7-1 B. subtilis оказался более требовательным к источникам азота, хорошая плотность популяции данной бактерии отмечалась только с добавлением в качестве источника азота кукурузного экстракта (1,5×108 КОЕ/мл) (рис. 8).

Рисунок 8 – Рост штаммов бактерий-антагонистов рода Bacillus в зависимости от источников азота в процессе периодического культивирования

Fa 4-1 B. subtilis

D 7-1 B. subtilis
Практически непригодными для утилизации в качестве источников азотного питания для штамма Fa 4-1 B. subtilis оказался дрожжевой экстракт (4,3 × 106 КОЕ/мл), а для штамма D 7-1 B. subtilis – пептон (2,0 × 106 КОЕ/мл).
Для обоих штаммов флюоресцирующих бактерий был отмечен хороший рост при добавлении следующих азотсодержащих веществ: азотнокислый натрий, дрожжевой экстракт и пептон. Титр ЖК с указанными азотсодержащими веществами составлял от 7,7 × 1011 до 8,6 × 1012 КОЕ/мл (рис. 9) . Минимальный титр штаммов Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. отмечен на питательной среде с добавлением кукурузного экстракта (4,4-6,1 × 105 КОЕ/мл). Указанные биоагенты оказались неспособными использовать данный источник азота.
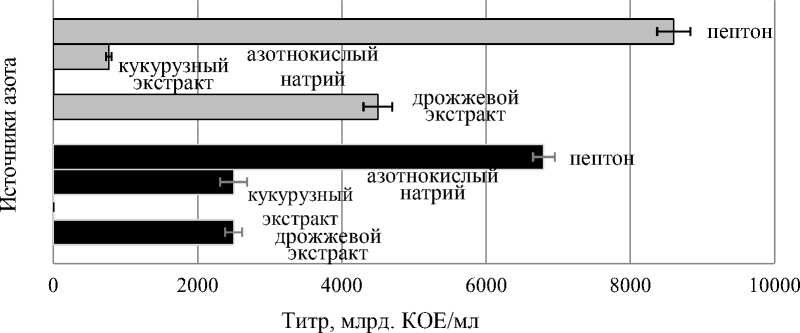
Sgrc-1 P. fluorescens Oif 2-1 Pseudomonas sp.
Рисунок 9 – Рост штаммов бактерий-антагонистов рода Pseudomonas в зависимости от источников азота в процессе периодического культивирования
Выводы. 1. Выявлен температурный оптимум для культивирования перспективных штаммов бактерий: Fa 4-1 B. subtilis – 30-35 °С, D 7-1 B. subtilis – 30 °С, Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. – 20-25 °С.
-
2. Определен оптимум рН для культивирования перспективных штаммов бактерий: D 7-1 B. subtilis – 6, Fa 4-1 B. subtilis , Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. – 6-8.
-
3. Установлены оптимальные источники углерода: для штамма Fa 4-1 B. subtilis меласса и глюкоза, для штамма D 7-1 B. subtilis – меласса и сахароза, для штаммов Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. – глюкоза, сахароза, меласса и глицерин.
-
4. Оптимальным источником азота для всех биоагентов был азотнокислый натрий, для штамма Fa 4-1 B. subtilis также пептон и кукурузный экстракт, для D 7-1 B. subtilis – дрожжевой и кукурузный экстракты, а для штаммов Sgrc-1 P. fluorescens и Oif 2-1 Pseudomonas sp. – пептон и дрожжевой экстракт.
-
5. Полученные экспериментальные данные впоследствии могут быть использованы для разработки элементов технологии производства микробиопрепаратов на основе перспективных штаммов бактерий родов Bacillus и Pseudomonas .
Работа выполнена при финансовой поддержке гранта РФФИ № 08-04-99010-р_офи.


