Физиология детского сердца и патогенетические механизмы, оказывающие влияние на процесс роста и развития сердечно-сосудистой системы у рожденных преждевременно: современный взгляд на проблему
Автор: Павлюкова Е.Н., Колосова М.В., Неклюдова Г.В., Алексеева Е.О., Карпов Р.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 4 т.39, 2024 года.
Бесплатный доступ
Цель представленного аналитического обзора: изучение состояния тканевого гомеостаза сердца в процессе онтогенеза в условиях недоношенности в свете современных фундаментальных знаний по биологии стволовых клеток сердца, строению кардиомиоцитов, паракринным механизмам регуляции и другим патогенетическим механизмам, влияющим на рост, развитие и ремоделирование сердечно-сосудистой системы в детском возрасте и в отдаленной перспективе.Стратегия поиска литературы. Поиск исследований и аналитических обзоров литературы проведен в базах данных Cochrane library, MEDLINE, Академия Google, PubMed и других базах в основном за период с января 2018 до декабря 2023 гг. Для включения независимым образом отбирались публикации / исследования, отражающие различные аспекты физиологии детского сердца у рожденных преждевременно (клинические и экспериментальные аспекты). Предпочтение отдавалось рандомизированным контролируемым исследованиям.Результаты. На основании современных представлений о до- и постимплантационном (постнатальном) развитии и росте детского сердца дан анализ процессам постнатального роста и развития сердца детей, рожденных здоровыми доношенными и недоношенными при спонтанном естественном зачатии. Проведен анализ основных патогенетических механизмов, влияющих на рост и развитие детского сердца во внутриутробный и постнатальный период.Заключение. Экспериментальные и клинические данные обоснованно требуют осознанной ревизии фундаментальных теоретических постулатов о регенеративных возможностях миокарда в различные периоды детского возраста, включая клиническую группу рожденных недоношенными, и практических установок по ведению беременности при угрозе прерывания и бесплодии (мероприятия в доимплантационный период при использовании вспомогательных репродуктивных технологий), по проводимой комбинированной / интенсивной (в том числе респираторной) терапии в неонатальный период, по длительному наблюдению в амбулаторных условиях за рожденными преждевременно с низкой, очень низкой и экстремально низкой массой тела детьми и взрослыми с целью профилактики, скрининга и лечения потенциальных последствий для здоровья сердечно-сосудистой системы на протяжении всей жизни.
Недоношенность, детское сердце, контрактильность, биология стволовых клеток сердца, кардиомиоциты
Короткий адрес: https://sciup.org/149147170
IDR: 149147170 | УДК: 612.17-053.32:616.1 | DOI: 10.29001/2073-8552-2024-39-4-26-37
Текст обзорной статьи Физиология детского сердца и патогенетические механизмы, оказывающие влияние на процесс роста и развития сердечно-сосудистой системы у рожденных преждевременно: современный взгляд на проблему
Поскольку около 9% новорожденных во всем мире рождаются недоношенными, возрастает необходимость дальнейших исследований оптимальных режимов, образа жизни и клинических мероприятий, которые могут благотворно влиять и изменять морфологию и функцию сердечно-сосудистой системы в этой растущей популяции [1]. Среди факторов риска раннего развития ишемической болезни сердца патология детей периода новорожденности традиционно не рассматривается. Однако опубликованные результаты крупного национального когортного исследования, проведенного в Швеции, содержат ряд принципиальных выводов, позволяющих по-новому взглянуть на проблему и расширить известную группу факторов риска, включив гестационный возраст при рождении, обратно коррелирующий с риском развития ишемической болезни сердца во взрослом возрасте; факторы «недоношенность» и «преждевременные роды» [2, 3]. Установлены признаки ремоделирования сердца, проявления систолической и диастолической дисфункций, ремоделирования сосудов (аорты, сонных артерий, коронарных артерий) в детском и взрослом возрастах у добровольцев, рожденных недоношенными, по сравнению с доношенными сверстниками. Полученные результаты подтверждают гипотезу о чрезвычайной значимости фактора риска «преждевременные роды» для раннего дебюта заболеваний сердечно-сосудистой системы [4].
Неблагоприятные воздействия до и после родов, с которыми сталкиваются недоношенные дети, могут повлиять на структуру и функцию сердца в дальнейшем – например, использование необходимых для выживания недоношенных детей глюкокортикоидов [5].
Так как для проявления сердечно-сосудистых заболеваний при недоношенности требуется много десятилетий, то весьма вероятно их ускоренное формирование у взрослых людей, рожденных с низкой, очень низкой и экстремально низкой массой тела. Преждевременные роды следует признать хроническим состоянием / заболеванием, требующим длительного наблюдения для профилактики, скрининга и лечения потенциальных последствий для здоровья потомства на протяжении всей жизни [2–4].
Цель представленного обзора: исследование взаимосвязей формирующихся специфических морфофункциональных особенностей детского сердца в условиях недоношенности с состоянием тканевого гомеостаза в период внутриутробного развития и постнатального онтогенеза в свете современных фундаментальных знаний по строению кардиомиоцитов, биологии стволовых клеток сердца, действию паракринных мехнизмов регуляции и другим патогенетическим механизмам, влияющим на рост, развитие и ремоделирование сердечно-сосудистой системы в детском возрасте и в отдаленной перспективе.
Обновление кардиомиоцитов в ткани сердца: актуальное состояние вопроса
В отличие от классической точки зрения данные современной литературы свидетельствуют о том, что сердце не является постмитотическим органом; оно сохраняет свою способность обновления всех типов клеток [6–8], способность генерировать новые кардиомиоциты на протяжении всей взрослой жизни [9, 10]. Современные представления о количестве кардиомиоцитов и их характеристиках у детей и взрослых отражены в таблице 1 [6, 11–15].
Таблица 1. Количество кардиомиоцитов
Table 1. Number of cardiomyocytes
|
Количество кардиомиоцитов |
Клиническая группа |
Источник литературы |
|
Кардиомиоциты |
||
|
3,2 ± 0,75 млрд клеток |
Левый желудочек, ребенок в возрасте 1 месяц |
Lázár E. et al., 2017 [14] |
|
0,8–1,09 × 109 клеток |
Ребенок при рождении |
Mollova M. et al., 2013 [13] |
|
1,0–1,29 × 109 клеток |
Ребенок в возрасте 2 месяца |
|
|
0,8–1,59 × 109 клеток |
Ребенок в возрасте 3 месяца |
|
|
1,8–2,09 × 109 клеток |
Ребенок в возрасте 2,5 года –5 лет |
|
|
3,7 млрд клеток, 5,6 млрд ядер кардиомиоцитов |
Взрослые люди |
|
Окончание табл. 1
End of table 1
|
Количество кардиомиоцитов |
Клиническая группа |
Источник литературы |
|
9,5 млрд ядер кардиомиоцитов |
Взрослые люди |
Tang Y. et al., 2009 [15], Dell’Era P. et al., 2015 [26] |
|
на 20 г ткани сердца образование 6,9 × 107 новых кардиомиоцитов в год |
Дети, подростки |
Lewellyn L. et al., 2011, Mollova M. et al., 2013 [13] |
|
11,223 клеток ± 2460 на мм2 |
Новорожденные |
Popescu L. et al., 2015 [6] |
|
28,567 клеток ± 5920 на мм2 |
Дети |
|
|
24,817 клеток ± 3260 на мм2 |
Взрослые люди |
Применение метода стереологии позволило сделать заключение: количество кардиомиоцитов на первом году жизни ребенка составило приблизительно 1 млрд, а у взрослых – 4 млрд. Кардиомиоциты генерированы, по-ви-димому, в результате делений клеток [16].
Измерение объема отдельных кардиомиоцитов установило гипертрофию кардиомиоцитов только через два года после рождения ребенка, что делает актуальным вопрос о том, как сердце растет в возрасте до 2 лет, если не за счет увеличения количества кардиомиоцитов у младенцев и детей раннего возраста [16]. Расчетами установлено обновление около 50% кардиомиоцитов у человека в течение его жизни [17, 18].
В качестве источника происхождения новых кардиомиоцитов широко обсуждаются: костномозговые предшественники, которые через кровоток доставляются в поврежденный миокард и дифференцируются в кардиомиоциты, эндотелиальные и гладкомышечные клетки сосудов; зрелые кардиомиоциты; резидентные миокардиальные мультипотентные стволовые клетки, способные дифференцироваться в основные типы клеток сердца (кардиомиоциты, эндотелиальные и гладкомышечные клетки сосудов) [19–28]. Характеристики кардиомиоцитов в процессе созревания показаны в таблице 2 [24].
Теоретический постулат о росте детского и подросткового сердца, безусловно, сопряжен с положением фундаментального характера об обновлении кардиомиоцитов. Термин «обновление кардиомиоцитов» определяется как способность заменять потерянные кардиомиоциты новыми (term «cardiomyocyte renewal» is defined as the ability to replace lost cardiomyocytes by new ones) [29–31]. Согласно современным представлениям, реализация данного положения связана с рядом таких механизмов, обеспечивающих увеличение массы миокарда после рождения, как гипертрофия кардиомиоцитов, образованных в пренатальный период; пролиферация и гипертрофия кардиомиоцитов, присутствующих при рождении; генерация новых кардиомиоцитов вследствие активации стволовых клеток сердца; сочетание выше-обозначенных процессов. Первый и второй сценарии не требуют участия стволовых клеток сердца [29–32]. Закономерности формирования контрактильно-ротационных механизмов левого желудочка, механика камер сердца в целом на фоне продолжающихся процессов роста сердца и сосудов у детей раннего и дошкольного возраста, рожденных недоношенными при спонтанном зачатии, безусловно, определяются тканевым гомеостазом миокарда [6, 19, 28–31, 33–36].
Таблица 2. Характеристика незрелых кардиомиоцитов и кардиомиоцитов взрослых
Table 2. Characteristics of immature cardiomyocytes and adult cardiomyocytes
|
Морфология |
Параметры |
Незрелые кардиомиоциты |
Кардиомиоциты взрослых |
|
Форма |
Форма |
Округлая |
Вытянутая, палочковидная |
|
Емкостные свойства мембраны, pF |
17,5 |
150 |
|
|
Саркомер |
Структура |
Дезорганизованная |
Высокоорганизованная |
|
Длина, мкм |
1,6 |
2,2 |
|
|
Контрактильные белки, изоформы |
Титин |
N2BA |
N2B |
|
Тропонин |
cTnI |
ssTnI |
|
|
Миозин |
β > α |
β > α |
|
|
Т-канальцы |
Сформированность |
Нет |
Есть |
|
«Gap» контакты |
Локализация |
По окружности клетки |
В интеркалированных дисках |
|
Митохондрии |
Локализация в клетке |
Нерегулярная сеть в цитоплазме |
Равномерно распределяются |
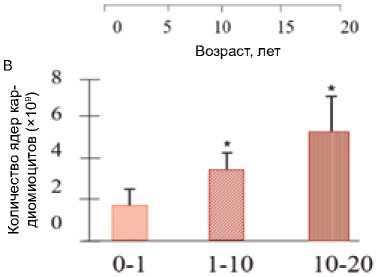
Считается, что новые кардиомиоциты непрерывно рождаются в сердце взрослого млекопитающего. Люди генерируют новые кардиомиоциты во временном промежутке между рождением и 20 годами жизни, пока сердце не достигнет размеров взрослого. Самый высокий процент кардиомиоцитов в состоянии митоза и цитокинеза зафиксирован у младенцев и детей; обнаружены доказательства цитокинеза кардиомиоцитов до 20-летнего возраста. Процент митоза снижался до минимального уровня, а цитокинез – до нуля к взрослому возрасту. Скорость активности клеточного цикла кардиомиоцитов оказалась самой высокой также у младенцев, уменьшаясь до очень низких, но измеримых уровней у взрослых [10, 16]. Обновление популяции кардиомиоцитов, при котором рождение новых клеток уравновешивается их гибелью, поддерживает постоян- ное количество кардиомиоцитов на протяжении всей взрослой жизни человека [14, 17].
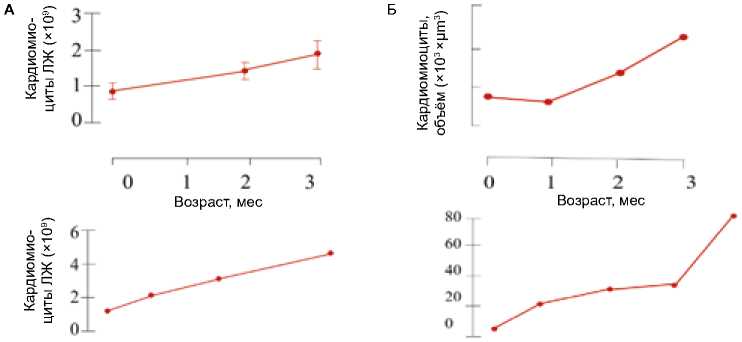
Количество кардиомиоцитов у взрослых людей (согласно данным расчета методом стереологии) составляет примерно 3,7 млрд или 5,6 млрд ядер кардиомиоцитов [13] (рис. 1 А–В). Количество ядер кардиомиоцитов у взрослых людей должно составлять порядка 9,5 млрд [15, 26]. Известно, что в норме апоптоз кардиомиоцитов в сердце человека встречается с частотой не более 28 ядер на миллион кардиомиоцитов, а длительность апоптоза составляет несколько часов (для завершения апоптоза может потребоваться от 20 мин до 24 ч) [37, 38]. У практически здоровых лиц интенсивность клеточной смерти посредством апоптоза не включает процессы некроза клеток [39, 40]. При вовлечении сердца в патологический процесс помимо апоптоза могут реализовываться иные программы клеточной гибели: некроз, митохондриально-опосредованный некроз, некроптоз, ферроптоз (железозависимая форма регулируемой клеточной гибели, опосредованной перекисным окислением липидов клеточных мембран), партанатоз (гиперактивация PARP-1 с последующей фрагментацией ДНК ), пироптоз (образование пор в плазматической мембране; подвержены некардиомиоциты, клетки костного мозга, рекрутируемые в сердце, сердечные фибробласты), иммуногенная гибель клеток [40]. Следовательно, для сохранения массы сердца и его функции необходим уровень регенерации миоцитов, значительно превышающий уровень потерь [41]. Кардиомиоциты способны в четыре раза увеличить объем путем «оборота» своих цитоплазматических белков, при этом митохондрии модулируют возраст кардиомиоцитов и механическое поведение. Есть мнение, что кардиомиоциты могут жить и функционировать почти 100 лет или дольше [36].
Для морфогенеза миокарда, оптимального роста и развития сердца в значительной степени важна пролиферация кардиомиоцитов [42, 43]. Скорость образования новых кардиомиоцитов в сердце колеблется, по данным разных авторов, от 0,5–1,0% [17, 44, 45] до 2,0%, уменьшаясь с возрастом [45, 46]. Клеточное ремоделирование миокарда представляет собой явление, протекающее в течение жизни, однако замена большей доли кардиомиоцитов (сardiomyocyte exchange) постнатально происходит именно в первое десятилетие жизни. Математически установлен наиболее интенсивный уровень постнатального оборота кардиомиоцитов левого желудочка в первом десятилетии жизни, который снижается до 0,8% в год в возрасте 20 лет и до 0,3% в год в возрасте 75 лет [17]. Количество кардиомиоцитов возрастает в неонатальный период [9, 30, 47], повышается двукратно в течение первого года жизни, далее до 20 лет количество кардиомиоцитов увеличивается [13, 16, 17] (рис. 1 А–В). Есть мнение, что количество кардиомиоцитов в левом желудочке сердца ребенка в возрасте 1 мес. достигает значения 3,2 ± 0,75 млрд клеток [14].
Между первым годом жизни и 20-летним возрастом количество кардиомиоцитов в левом желудочке увеличивается в 3,4 раза, подтверждая факт возможности регенерации миокарда у детей и подростков. Зафиксирована и аномальная пролиферация кардиомиоцитов при заболеваниях сердца, влияющих на популяцию кардиомиоцитов [12, 13, 30].
О 5 10 15 20
Возраст, лет
Возраст, лет
Рис. 1. Характеристика кардиомиоцитов человека после рождения. Количество (А) , средний объем (Б|) кардиомиоцитов левого желудочка сердца, количество ядер кардиомиоцитов (В)
Fig. 1. Characteristics of human cardiomyocytes after birth. Number (A), average volume (Б|) of cardiomyocytes of the left ventricle of the heart, the number of nuclei of cardiomyocytes (В)
Средний клеточный объем кардиомиоцитов в возрасте от 0 до 1 года составлял 5 854 ± 818 мкм3, а между 10– 20 годами он достигал 50 564 ± 7,398 мкм3 (увеличение в 8,6 раза, p < 0,05), следовательно, как пролиферация, так и увеличение кардиомиоцитов способствуют постнатальному росту сердца у людей [13].
О. Bergmann и соавт. считают, что замена существующих кардиомиоцитов в растущих сердцах происходит весьма интенсивно; в течение жизни примерно 35% всех кардиомиоцитов подвергаются обновлению постнатально, но при этом большинство кардиомиоцитов образуется уже при рождении и в первые годы жизни [17, 45]. Примерно 80% кардиомиоцитов в течение жизни никогда не будут заменены после 10 лет [17]. Ранний постнатальный кар- диомиогенез правого и левого желудочков различен; за заметное расширение камеры миокарда левого желудочка ответственна быстрая пролиферация кардиомиоцитов [47].
Теоретические расчеты показывают, что на 20 г ткани сердца человека генерируется порядка 6,9 × 107 новых кардиомиоцитов в год, что эквивалентно 1,9% дополнительных кардиомиоцитов [13]. Незрелые сократительные кардиомиоциты, пролиферирующие в перинатальный период (рис. 2 А, Б) [6], обычно мононуклеарные или диплоидные [9]. Мостики хроматина между делящимися ядрами кардиомиоцитов в ткани сердца человека, свидетельствующие о неудачном митозе и подтверждающие возможность реплицикации, показаны в стареющей клетке на рис. 2 В–Д [30].
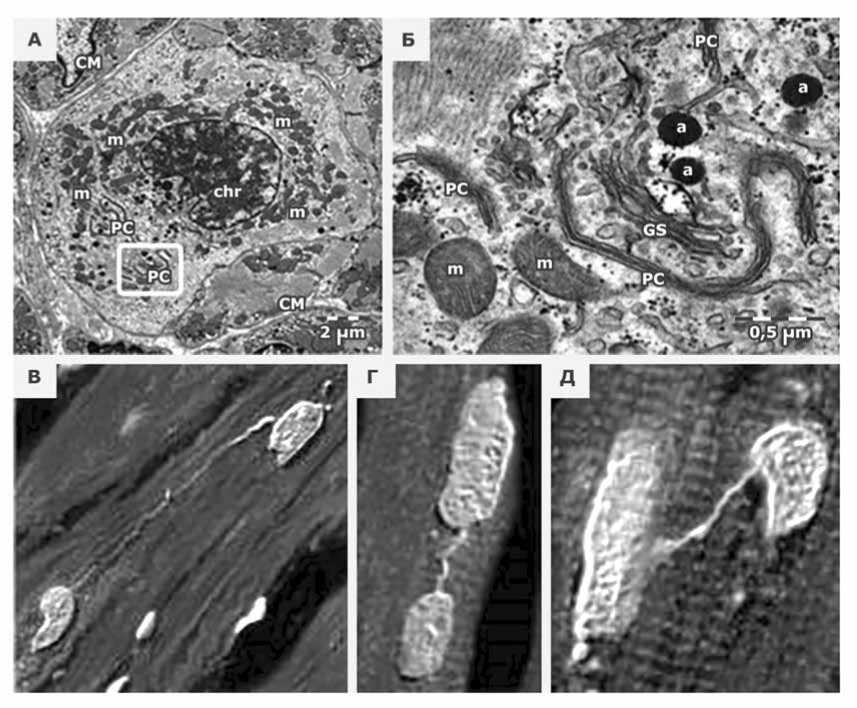
Рис. 2. Tрансмиссионная электронная микроскопия ткани предсердий новорожденного ребенка (возраст 17 дней). Продемонстрированы кардиомиоциты, находящиеся в состоянии митоза (А). Ядерный хроматин (chr) интенсивно «слипается» в ядре и цистернах (РС) ядерной оболочки. Кардиомиоцит в состоянии митоза имеет большое количество митохондрий (m) и мало миофиламентов (*). (Б) увеличение выделенной области показывает характерную черту для профазы: фрагменты ядерной оболочки расположены параллельно цистернам эндоплазматического ретикулума в цитоплазме (РС); система GS – комплекс Golgi. (В–Д) Мостики хроматина между делящимися ядрами кардиомиоцитов в ткани сердца человека свидетельствуют о неудачном митозе и подтверждают возможность реплицикации в стареющей клетке
Fig. 2. Transmission electron microscopy of atrial tissue of a newborn baby (age 17 days). Cardiomyocytes in the state of mitosis have been demonstrated (A). Nuclear chromatin (chr) intensively “sticks together” in the nucleus and cisterns (RS) of the nuclear envelope. A cardiomyocyte in a state of mitosis has a large number of mitochondria (m) and few myofilaments (*). (Б) enlargement of the highlighted area shows a characteristic feature for prophase: fragments of the nuclear envelope are located parallel to the endoplasmic reticulum cisterns in the cytoplasm (RS); GS system - Golgi complex. Chromatin bridges between dividing cardiomyocyte nuclei in human heart tissue indicate failed mitosis and confirm the possibility of replication in an aging cell (B–Д)
Популяции кардиомиоцитов плода человека (75– 80% от общего числа клеток) демонстрируют профиль α-MHC+/cTnIHigh/VimLow. Для популяции некардиомиоци-тов, составляющей 20-25% от общего числа клеток сердца, характерен профиль α-MHC/cTnILow/VimHigh. Профиль маркеров и пропорции в популяции клеток плода отличаются от таковых во взрослом сердце [48].
Естественное обновление и пролиферация кардиомиоцитов после трансплантации сердца или костного мозга (химеризм) с несоответствием пола у пациентов с терминальной стадией сердечной недостаточности дают возможность экспериментально установить обновление кардиомиоцитов, происходящее из внесердечных источников. Уровень химеризма кардиомиоцитов после трансплантации с несоответствием пола составляет < 1% (средний процент Y-позитивных кардиомиоцитов колебался в диапазоне от ≈0,02% до 0,005%–0,07%) и может возникать, по крайней мере частично, в результате событий слияния (объединение плазматических мембран и генетического материала) [31, 49]. В настоящее время подтверждены три основных типа взаимодействия кардиомиоцитов и стволовых прогениторных клеток, связанные с трансдифференцировкой, – слияние клеток, образование межклеточных контактов (щелевые «gap»-контакты) и туннельных нанотрубочек, основная задача которых дифференцироваться и интегрироваться в миокард реципиента [49].
В области атриовентрикулярного соединения (область митрального клапана) отмечена неоднородность размеров кардиомиоцитов, указывающая на различные стадии развития кардиомиоцитов ниже области с повышенной экспрессией маркеров стволовых клеток. Размер кардиомиоцитов увеличивался с увеличением расстояния от клапана до миокарда. Маленькие кардиомиоциты присутствовали только на границе, что можно интерпретировать как раннюю стадию развития кардиомиоцитов, происходящих из соседних ниш, или различные стадии развития кардиомиоцитов. Кроме того, граница с миокардом оказалась наиболее активным участком экспрессии маркера пролиферации Ki67. В этой области были обнаружены клетки Ki67+/PCM1+/cTnT+, указывая на пролиферативную способность субпопуляции маленьких кардиомиоцитов взрослого человека в области атриовентрикулярного соединения (область митрального клапана) [7]. Пониманию значимости установленного факта и переосмыслению фундаментальных закономерностей роста и старения сердца способствует изложенный в работе M. Rota и со-авт. теоретический постулат о «возникновении и существовании неоднородного пула кардиомиоцитов миокарда, состоящего из популяции клеток разного возраста с различными механическими и электрическими свойствами, которые структурно интегрированы и сосуществуют одновременно в различных анатомических отделах». При этом молодые кардиомиоциты, имея небольшие размеры, демонстрируют превосходную способность к контрактильности и могут частично противостоять сниженной механике гипертрофированных «старых» кардиомиоцитов. В нормальных условиях существует физиологический баланс между популяциями новых (молодых) и старых (стареющих) кардиомиоцитов. Появление дисбаланса между пулами кардиомиоцитов приводит к непропорциональному накоплению «стареющих» клеток, неблагоприятному ремоделированию желудочков и в конечном итоге к формированию сердечной недостаточности [50].
Воздействие гипероксии в неонатальный период приводит к продукции активных форм кислорода, окислительному повреждению ДНК и снижению пролиферации кардиомиоцитов [10, 51]. В то же время в локализованных в сердце взрослого человека гипоксических нишах, защищенных от окислительного повреждения, идентифицирована популяция пролиферирующих мононуклеар-ных кардиомиоцитов [10], временной диапазон продолжительности М-фазы митоза которых составляет порядка 1,8 ± 0,3 ч [13].
О высокой регенеративной активности сердца новорожденного свидетельствуют клинические данные, подтверждающие возможность полного функционального восстановления детского сердца после реперфузии миокарда у новорожденного ребенка с массивным инфарктом миокарда [12]. Определена обратная корреляция между уровнями гормонов щитовидной железы (в частности Т4) в плазме и содержанием диплоидных кардиомиоцитов. Продемонстрировано, что уровни гормонов щитовидной железы в плазме повышаются более чем в 50 раз в течение неонатального периода, когда кардиомиоциты выходят из клеточного цикла и теряют свой регенеративный потенциал. В совокупности эти результаты свидетельствуют о способности гормонов щитовидной железы подавлять регенеративную способность сердца во время постнатального развития [52].
После повреждений сердца у новорожденных происходит ряд событий на клеточном уровне, запускающих регенерацию ткани, важную роль в реализации которой играют эндогенные макрофаги. Увеличению числа резидентных макрофагов сердца способствует гипоксия. Истощение пула макрофагов ухудшает регенерацию миокарда после травм, приводит к образованию рубцов. У новорожденных в ответ на повреждение сердца увеличивается популяция резидентных кардиальных макрофагов эмбрионального происхождения с прорепаратив-ным фенотипом (М2), которые вызывают минимальное воспаление и выделяют многочисленные растворимые факторы (онкостатин М), способствующие пролиферации кардиомиоцитов новорожденных и ангиогенезу [16, 53]. Кардиомиоциты, в которых протекают интенсивные метаболические процессы, частично решают проблемы «накопления отходов жизнедеятельности» путем выброса митохондрий и другого материала во внутриклеточных пузырьках (везикулах). Резидентные макрофаги сердца (CD45+ CD11b+ F4/80+) эффективно поглощают эти везикулы через рецептор Mertk, поддерживая оптимальный режим для сердца и предотвращая внеклеточное накопление отходов жизнедеятельности кардиомиоцитов, активацию инфламмасом и блокировку аутофагии [53].
Иммунные клетки, такие как макрофаги, естественные клетки-киллеры и тучные клетки, влияют на поведение стволовых клеток сердца. Макрофаги способствуют пролиферации и дифференцировке стволовых клеток сердца в кардиомиоциты и эндотелиальные клетки. Миграция макрофагов направляется VEGF, TGF-взаимодействие между стволовыми клетками сердца и естественными клетками-киллерами улучшает регенерацию сердца, снижая токсичность последних путем переключения секреции цитокинов в противовоспалительное состояние. Взаимодействия между стволовыми клетками сердца и тучными клетками, вероятно, происходят через паракринные механизмы, поскольку прямой контакт с клетками не описан; тучные клетки продуцируют несколько цитокинов, факторов роста и ангиогенных факторов, участвующих в восстановлении сердца [54, 55].
Поскольку эмбриональный морфогенез сердца физиологически протекает при невысоком напряжении кислорода, то относительная гипоксия в данный период является необходимым условием пролиферации клеток и роста тканей сердца, особенно при ремоделировании сердечной трубки и росте коронарных сосудов. В то же время внутриутробная гипоксия плода, накопление активных форм кислорода [16] оказывают выраженное негативное действие на развивающееся сердце, так как кардиомиоциты имеют высокую метаболическую активность [55]. У новорожденных, перенесших внутриутробную гипоксию, отмечено снижение показателей ДНК-синтетической активности кардиомиоцитов, уменьшение количества ядрышкообразующих зон хромосом, что в раннем онтогенезе способно нарушить формирование структурного резерва миокарда, обеспечивающего функционирование сердца в отдаленные возрастные периоды.
«В сердце подвергнутых внутриутробной гипоксии новорожденных развивается окислительный стресс, и значительно (более чем в 2 раза) возрастает уровень экспрессии белка beclin-1, свидетельствуя об активации аутофагии. Не исключено, что аутофагия кардиомиоцитов имеет негативные последствия в варианте их гибели и уменьшении структурного резерва сердца» (цит.) [55].
Анализ полярных карт значений продольной деформации в каждом сегменте по схеме «бычий глаз» у детей, рожденных с очень низкой массой тела и экстремально низкой массой тела, в возрасте от одного года до пяти лет (собственные данные), позволяет идентифицировать области миокарда левого желудочка со сниженной сегментарной продольной деформацией на фоне ранее диагностированных признаков ремоделирования левого желудочка (рис. 3 А, Б).
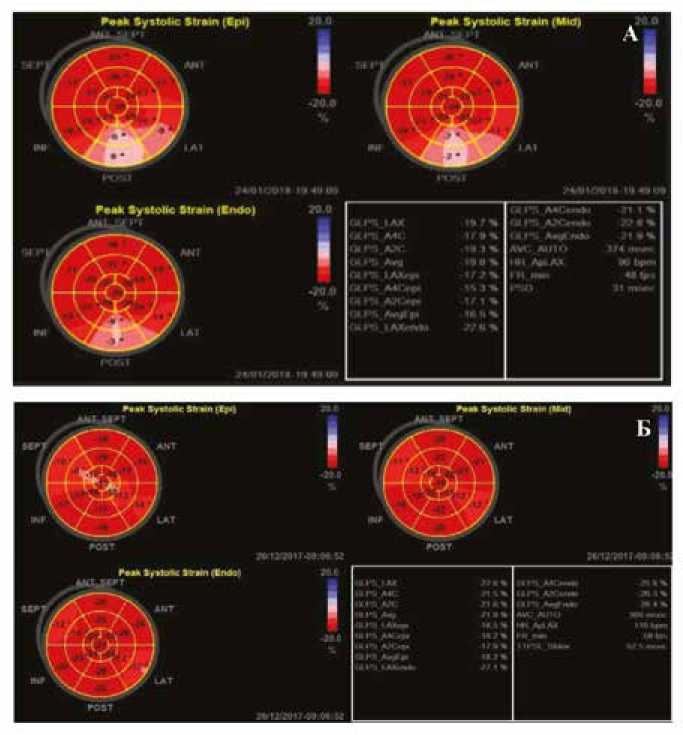
Рис. 3. Полярные карты значений продольной деформации в каждом сегменте по схеме «бычий глаз» А) ребенка Т.А., 4 года. Вес при рождении – 1140 г, срок родов – 28 недель, искусственная вентиляция легких, респираторная терапия в неонатальный период, анемия недоношенных, искусственное вскармливание до года. Фракция выброса – 76%, 3-й тип скручивания левого желудочка («детский» – движение апикальных и базальных сегментов левого желудочка «против часовой стрелки»).
Б) ребенка С.Р., 4 года. Вес при рождении – 800 г, срок родов – 26 недель, респираторная терапия в неонатальный период, анемия недоношенных, смешанное вскармливание до года. Открытый артериальный проток закрыт, нарушений функции щитовидной железы не выявлено. Фракция выброса левого желудочка – 78%, 3-й тип скручивания левого желудочка («детский») (собственные данные).
Fig. 3. Polar maps of longitudinal strain values in each segment according to the “bull’s eye” diagram A) child T.A., 4 years old. Birth weight 1140 grams, due date 28 weeks, mechanical ventilation, respiratory therapy in the neonatal period, anemia of prematurity, artificial feeding for up to a year. Ejection fraction 76%, type 3 of LV torsion (“childish” -movement of the apical and basal segments of the LV “counterclockwise”). Б) child S.R., 4 years old. Birth weight 800 grams, due date 26 weeks, respiratory therapy in the neonatal period, anemia of prematurity, mixed feeding for up to a year. The PDA is closed, no thyroid dysfunction was detected. LV ejection fraction 78%, type 3 LV torsion (“children’s”) (own data).
Природа возникновения областей миокарда левого желудочка со сниженной сегментарной продольной деформацией в свете изложенной выше информации не исключает вклад в процесс постнатального роста и развития сердца ребенка в условиях недоношенности в анамнезе феномена «гетерогенности (неоднородности) пула кардиомиоцитов детского сердца, структурно интегрированных, сосуществующих одновременно в различных анатомических отделах, обладающих различными механическими свойствами» [7, 10, 50]; вклад специфического анатомического участка – атриовентрикулярного соединения сердца, содержащего кардиомиоциты различных стадий развития с признаками пролиферации [7,
10]; влияние на сократимость левого желудочка процесса дедифференцировки зрелых кардиомиоцитов [56] и / или формирующегося интерстициального фиброза у некоторых детей [4].
Особый интерес для понимания генеза снижения сегментарной продольной деформации миокарда левого желудочка детского сердца в период постнатального роста и развития в условиях недоношенности, проиллюстрированного на полярных картах (собственные исследования), помимо современных знаний об обороте кардиомиоцитов, представляют данные: а) об установленном присутствии в области атриовентрикулярного соединения сердца гипоксических ниш стволовых клеток сердца; клеток, экспрессирующих ранние эмбриональные маркеры; клеток-предшественников, мигрирующих во время регенерации [7, 10], б) о выделенных из ткани желудочков детского сердца кардиосферах (cardiospheres (C-spheres), являющих собой смешанную популяцию клеток на разных стадиях развития, способных генерировать различные типы клеток, включая эндотелиальные и сосудистые гладкомышечные клетки, фибробласты и кардиомиоциты). Вышеизложенное свидетельствует и о наличии эндогенных стволовых клеток, и о бесспорном регенеративном потенциале, максимально выраженном в неонатальный период и в младенческом возрасте [56].
Очевиден вклад клеток-предшественников сердца c-kit+ в кардиомиогенез и ангиогенез у новорожденных, отмеченный в эксперименте, в дополнение к пролиферации кардиомиоцитов. Подтверждена способность пула клеток-предшественников сердца поддерживать регенерацию в период новорожденности [10, 43]. Весьма обоснованным и логичным выглядит заключение о корреляции содержания стволовых клеток в соответствующем желудочке детского сердца, независимо от возраста или диагноза, с эхокардиографическими данными, устанавливающими их функции. Выявленные признаки истощения пула клеток-предшественников и минимальная выработка C-spheres / количества клеток-предшественников сердца в случае формирования тяжелой бивентрикуляр-ной дисфункции у детей [56] также подтверждают гипотезу о роли стволовых клеток сердца и клеток-предшественников [7, 43, 56] в формировании контрактильности, в том числе при условии наличия информации о преждевременных родах в анамнезе.
Дедифференцировка кардиомиоцитов
В последние несколько лет акцент в процессах восстановления ткани сердца был смещен в сторону концепции, подразумевающей образование новых кардиомиоцитов путем дедифференцировки и пролиферации зрелых кардиомиоцитов [10, 33–35]. Морфологические изменения, в совокупности называемые «дедифференцировкой», характеризуются потерей организации миофибрилл, возвращением к состоянию незрелости, экспрессией эмбриональных генов и маркеров стволовых клеток. Индукцию процесса дедифференцировки сердца включает множество регуляторных молекул: микроРНК, паракринные факторы (например, семейства интерлейкинов-6 (IL-6), эндогенная продукция которых в основном зависит от типов стромальных клеток сердца [57]. У людей существует короткий период регенерации сердца после рождения, в течение которого кардиомиоциты могут подвергаться дедифференцировке / пролиферации в ответ на травму или инфаркт миокарда. Данная регенеративная способность теряется у млекопитающих после неонатальной стадии. Дедифференцированным кардиомицитам требуется некоторое время для восстановления саркомеров и повторной дифференцировки в функциональные клетки [57].
На процесс дедифференцировки кардиомиоцитов ребенка влияют регуляторные Т-клетки (Tregs) матери, выделяющие цитокины (TNF 11 (Tnfsf11 или RANKL), интерлейкин-33 (IL33), инсулиноподобный фактор роста 2 (IGF2), цистатин F (Cst7), фибриногеноподобный фактор 2 (Fgl2) и матрилин 2 (Matn2) [16]. Противовоспалительные цитокины – интерлейкин-4 (IL4, который секретируется макрофагами М2), и интерлейкин-13 (IL13) также оказывали положительный эффект на пролиферацию кардиомиоцитов. Несколько противовоспалительных цитокинов, таких как интерлейкин-1β (IL1β), интерлейкин-33 (IL33), интерлейкин-6 (IL6), онкостатин (OSM) и слабый индуктор апоптоза, связанный с TNF (TWEAK, Tnfsf12), могут инициировать дедифференцировку и / или пролиферацию кардиомиоцитов, в большинстве случаев способствуя благоприятному эффекту в краткосрочной перспективе [16].
Роль микроРНК в процессах тканевого гомеостаза детского сердца
Известно, что мРНК и микроРНК могут попадать во внеклеточное пространство либо в растворимой форме, либо упакованными во внеклеточные везикулы. Паракринные факторы, генерируемые стволовыми клетками, подавляют воспаление и апоптоз, стимулируют ангиогенез, усиливают пролиферацию и дифференцировку резидентных стволовых клеток сердца [35]. МикроРНК регулируют посттранскрипционную экспрессию генов. Несколько классов микроРНК связаны с пролиферацией кардиомиоцитов [16, 51, 57] , определяют развитие и регенерацию сердца. Так, пролиферации и дедифференцировке кардиомиоцитов способствуют miR-18a, miR-19a/19b [51], miR-21-5p [58], miR-23b, miR-30e, miR-33b, miR-199a, miRNA-204, miR-222, miR302–367, miR-373, miR-509, miR-548c, miR-1248, miR-1825. Микро-РНК, включая miR-31a-5p, miR-199a, miR-590, miR-708, признаны критически важными для роста и деления кардиомиоцитов новорожденных in vitro [16, 35, 43, 51].
MiRNA-204 способствует пролиферации кардиомиоцитов как у взрослых, так и у новорожденных in vitro [16]. Семейство miR-15, miR-195 и кластер miR-17~92 являются важными регуляторами постнатальной остановки митоза кардиомиоцитов [43]. MiR-195, miR-128, miR-34a, miR-15 признаны ингибиторами пролиферации и дедифференцировки кардиомиоцитов [10, 16, 51, 57]. Функциональное восстановление миокарда задерживается вследствие развившегося фиброза при нарушении межклеточных контактов между кардиомиоцитами [57], а miR-21-5p ограничивает активацию провоспалительных макрофагов в сердце после ишемического поражения, снижая выработку цитокинов воспаления макрофагами. МiR-375-3p тоже подавляет выработку провоспалитель-ных цитокинов макрофагами сердца, усиливает поляризацию в направлении М2 фенотипа макрофагов.
Полученные из мезенхимальных стволовых клеток экзосомы, содержащие большое количество miR-182, ослабляют повреждение миокарда посредством смещения пула макрофагов в сердце в направлении M2 фенотипа. Экспрессия miR-155 в макрофагах способствует формированию воспаления миокарда, обеспечивая дисфункциональную активацию Т-клеток, воспалительную инфильтрацию моноцитами / макрофагами и поляризацию пула сердечных макрофагов в направлении M1 фенотипа [59]. Кардиомиоциты новорожденных обогащены miR-708, но в стволовых / клетках-предшественниках c-kit+ выявлен более низкий уровень miR-708 по сравнению с другими клетками. Сверхэкспрессия miR-708 индуцировала дифференцировку кардиомиоцитов сердечными стволовыми / клетками-предшественниками. Доставка miR-708 в липидных наночастицах in vivo обеспечивала защиту кардиомиоцитов новорожденных от индуцированного стрессом апоптоза [35, 51, 60].
Заключение
Таким образом, согласно современным научным парадигмам, сердце состоит из «гетерогенной популяции миоцитов, подвергающихся постоянной гибели и обновлению, что согласуется с постулатом поддержания «динамического устойчивого состояния миокарда». Образование кардиомиоцитов является важным механизмом в тканевом гомеостазе и в ответ на действие неблагоприятных факторов, и в ответ на гемодинамический стресс [30].
Внутренние механизмы, регулирующие регенерацию миоцитов, к которым относят пролиферацию и дедифференцировку кардиомиоцитов, дифференцировку эндогенных прогениторных клеток, необходимы и достаточны для сохранения целостности взрослого и детского органа.
Индукция пролиферации кардиомиоцитов представляет собой многообещающий и перспективный исследо-
Список литературы Физиология детского сердца и патогенетические механизмы, оказывающие влияние на процесс роста и развития сердечно-сосудистой системы у рожденных преждевременно: современный взгляд на проблему
- Huckstep O.J., Williamson W., Telles F., Burchert H., Bertagnolli M., Herdman C. et al. Physiological stress elicits impaired left ventricular function in preterm-born adults. J. Am. Coll. Cardiol. 2018;71(12):1347- 1356. https://doi.org/10.1016/j.jacc.2018.01.046.
- Crump C., Howell E.A., Stroustrup A., McLaughlin M.A., Sundquist J., Sundquist K. Association of preterm birth with risk of ischemic heart disease in adulthood. JAMA pediatrics. 2019;173(8):736-743. https://doi.org/10.1001/jamapediatrics.2019.1327.
- Crump C., Sundquist J., Winkleby M. A., Sundquist K. Gestational age at birth and mortality from infancy into mid-adulthood: a national cohort study. Lancet Child Adolesc. Health. 2019;3(6):408-417. https://doi.org/10.1016/ S2352-4642(19)30108-7.
- Lewandowski A.J. Cardiac remodeling in preterm-born adults: Longterm benefits of human milk consumption in preterm neonates. Breastfeeding Med. 2018;13(S1):S3-S4. https://doi.org/10.1089/bfm.2018.29071.ajl.
- Vrselja A., Pillow J.J., Black M.J. Effect of Preterm Birth on Cardiac and Cardiomyocyte Growth and the Consequences of Antenatal and Postnatal Glucocorticoid Treatment. J. Clin. Med. 2021;10(17):3896. https://doi.org/10.3390/jcm10173896.
- Popescu L.M., Curici A., Wang E., Zhang H., Hu S., Gherghiceanu M. Telocytes and putative stem cells in ageing human heart. J. Cell. Mol. Med. 2015;19(1):31-45. https://doi.org/10.1111/jcmm.12509.
- Vukusic K., Sandstedt M., Jonsson M., Jansson M., Oldfors A., Jeppsson A., Dellgren G., Lindahl A., Sandstedt J. The atrioventricular junction: A potential niche region for progenitor cells in the adult human heart. Stem Cells Dev. 2019;28(16):1078-1088. https://doi.org/10.1089/scd.2019.0075.
- Herrero D., Albericio G., Higuera M., Herranz-López M., GarcíaBrenes M.A., Cordero A. et al. The vascular niche for adult cardiac progenitor cells. Antioxidants (Basel). 2022;11(5):882. https://doi.org/10.3390/antiox11050882.
- Jonker S.S., Louey S., Giraud G.D., Thornburg K.L, Faber J.J. Timing of cardiomyocyte growth, maturation, and attrition in perinatal sheep. FASEB J. 2015;29(10):4346-4357. https://doi.org/10.1096/fj.15-272013.
- Günthel M., Barnett P., Christoffels V.M. Development, proliferation, and growth of the mammalian heart. Mol. Ther. 2018;26(7):1599-1609. https://doi.org/10.1016/j.ymthe.2018.05.022.
- Ellison G.M., Torella D., Karakikes I., Nadal-Ginard B. Myocyte death and renewal: modern concepts of cardiac cellular homeostasis. Nat. Clin. Pract. Cardiovasc. Med. 2007;4(Suppl. 1):S52-S59. https://doi.org/10.1038/ncpcardio0773.
- Payan S.M., Hubert F., Rochais F. Cardiomyocyte proliferation, a target for cardiac regeneration. Biochim. Biophys. Acta Mol. Cell Res. 2020;1867(3):118461. https://doi.org/1016/j.bbamcr.2019.03.008.
- Mollova M., Bersell K., Walsh S., Savla J., Das L.T., Park S.Y. et al. Cardiomyocyte proliferation contributes to heart growth in young humans. Proc. Natl. Acad. Sci. USA. 2013;110(4):1446-1451. https://doi.org/10.1073/pnas.1214608110.
- Lázár E., Sadek H. A., Bergmann O. Cardiomyocyte renewal in the human heart: insights from the fall-out. Eur. Heart J. 2017;38(30):2333- 2342. https://doi.org/10.1093/eurheartj/ehx343.
- Tang Y., Nyengaard J.R., Andersen J.B., Baandrup U., Gundersen H.J.G. The application of stereological methods for estimating structural parameters in the human heart. Anat. Rec. (Hoboken). 2009;292(10):1630- 1647. https://doi.org/10.1002/ar.20952.
- Eschenhagen T., Bolli R., Braun T., Field L.J., Fleischmann B.K., Frisén J. et al. Cardiomyocyte regeneration: A consensus statement. Circulation. 2017;136(7):680-686. https://doi.org/10.1161/CIRCULATIONAHA.117.029343.
- Gong H., Wang T., Xu Q. Resident stem cells in the heart. Med. Rev. 2021;1(1):10-13. https://doi.org/10.1515/mr-2021-0003.
- Velichko V., Nemkov A., Belostotskaya G., Kriventsov A., Komok V., Bunenkov N. et al. Study of heart stem cells in cardiac surgery patients of different ages. Aorta. 2022;10(S1):A066. https://doi.org/10.1055/s-0042-1750975.
- Belostotskaya G., Sonin D., Galagudza M. Intracellular development of resident cardiac stem cells: An overlooked phenomenon in myocardial self-renewal and regeneration. Life. 2021;11(8):723. https://doi.org/10.3390/life11080723.
- Belostotskaya G., Hendrikx M., Galagudza M., Suchkov S. How to stimulate myocardial regeneration in adult mammalian heart: Existing views and new approaches. biomed research international. 2020;2020:7874109. https://doi.org/10.1155/2020/7874109.
- Leri A., Kajstura J., Anversa P. Role of cardiac stem cells in cardiac pathophysiology: A paradigm shift in human myocardial biology. Circ. Res. 2011;109(8):941-961. https://doi.org/10.1161/CIRCRESAHA.111.243154.
- Olivetti G., Abbi R., Quaini F., Kajstura J., Cheng W., Nitahara J.A. et al. Apoptosis in the failing human heart. New Engl. J. Med. 1997;336(16):1131-1141. https://doi.org/10.1056 /NEJM199704173361603.
- Kajstura J., Gurusamy N., Ogórek B., Goichberg P., Clavo-Rondon C., Hosoda T. et al. Myocyte turnover in the aging human heartnovelty and significance. Circ. Res. 2010;107(11):1374-1386. https://doi.org/10.1161/CIRCRESAHA.110.231498.
- Omland T., De Lemos J.A., Sabatine M.S., Christophi C.A., Rice M.M., Jablonski K.A. et al. Prevention of events with Angiotensin Converting Enzyme Inhibition (PEACE) trial investigators. A sensitive cardiac troponin T assay in stable coronary artery disease. N. Engl. J. Med. 2009;361(26):2538-2547. https://doi.org/10.1056 /NEJMoa0805299.
- Del Re D. P., Amgalan D., Linkermann A., Liu Q., Kitsis R.N. Fundamental mechanisms of regulated cell death and implications for heart disease. Physiol. Rev. 2019;99(4):1765. https://doi.org/10.1152/physrev.00022.2018.
- Anversa P., Kajstura J., Rota M., Leri A. Regenerating new heart with stem cells. J. Clin. Invest. 2013;123(1):62-70. https://doi.org/10.1172/JCI63068.
- Sedmera D., Thompson R.P. Myocyte proliferation in the developing heart. Dev. Dyn. 2011;240(6):1322-1334. https://doi.org/10.1002/dvdy.22650.
- Porrello E.R., Olson E.N. A neonatal blueprint for cardiac regeneration. Stem Cell Res. 2014;13(3):556-570. https://doi.org/10.1016/j.scr.2014.06.003.
- Senyo S.E., Steinhauser M.L., Pizzimenti C.L., Yang V.K., Cai L., Wang M. et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 2013;493(7432):433-436. https://doi.org/10.1038/nature11682.
- Bergmann O., Bhardwaj R.D., Bernard S., Zdunek S., Barnabé-Heider F., Walsh S. et al. Evidence for cardiomyocyte renewal in humans. Science. 2009;324(5923):98-102. https://doi.org/10.1126/science.1164680.
- Bruyneel A.A., Sehgal A., Malandraki-Miller S., Carr C. Stem cell therapy for the heart: blind alley or magic bullet? J. Cardiovasc. Transl. Res. 2016;9(5-6):405-418. https://doi.org/10.1007/s12265-016-9708-y.
- Vagnozzi R.J., Molkentin J.D., Houser S.R. New myocyte formation in the adult heart: endogenous sources and therapeutic implications. Circ. Res. 2018;123 (2):159-176. https://doi.org/10.1161/CIRCRESAHA.118.311208.


