Физиолого-генетические компоненты устойчивости к сосудистому бактериозу у линий удвоенных гаплоидов Brassica rapa L
Автор: Артемьева А.М., Игнатов А.Н., Волкова А.И., Кочерина Н.В., Коноплева М.Н., Чесноков Ю.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические и физиологические основы селекции
Статья в выпуске: 1 т.53, 2018 года.
Бесплатный доступ
В отдельные годы сосудистый бактериоз поражает до 80 % посевов капусты, репы, рапса, горчицы, в том числе в России. Предотвратить распространение сосудистого бактериоза трудно, а бороться с патогеном, проникшим в восприимчивое растение, практически невозможно. У Brassica rapa L. болезнь наиболее опасна для корнеплодных реп и листовых культур. Сведения о расположении локусов, определяющих расоспецифическую устойчивость растений B. rapa к сосудистому бактериозу, пока крайне ограничены. Нами впервые проведена оценка устойчивости линий удвоенных гаплоидов двух картирующих популяций B. rapa - DH38 (♀Р175 x ♂P143) и DH30 (♀P115 x ♂Р143) к штаммам четырех рас Xanthomonas campestris pv. campestris (Pam.) Dow. (PHW231, раса 1; HRI5212, раса 3; HRI1279а, раса 4; В-32, раса 6), вызывающих сосудистый бактериоз у растений семейства Brassicaceae, на основании чего идентифицированы и локализованы на хромосомах группы сцепления и QTL (quantitative trait loci), вовлеченные в формирование физиологической устойчивости B. rapa к четырем расам X. campestris pv. campestris, для трех из которых картирования QTL ранее не проводились. В результате исследований выявлены линии, показывающие устойчивость или реакцию сверхчувствительности к четырем различным расам возбудителя сосудистого бактериоза. Отмечено преимущественно моногенное несцепленное наследование признака устойчивости ко всем четырем расам X. campestris pv. campestris. Существенная корреляция была обнаружена между реакцией на индивидуальные штаммы и суммарной пораженностью растений. Проведенный QTL-анализ позволил найти для популяции DH30 13 QTL, контролирующих признаки устойчивости к четырем расам возбудителя сосудистого бактериоза, для популяции DH38 - 19 QTL. При этом в течение 2 лет наблюдений все выявленные локусы стабильно сохраняли свою позицию. Наиболее важные генетические локусы, отвечающие за проявление признака физиологической устойчивости к различным расам этого патогена у DH30 B. rapa, располагались в группах сцепления A01, А03 и А07, а наиболее существенные локусы устойчивости к сосудистому бактериозу у линий DH38 - в А03, А06 и А08. С помощью молекулярно-генетических маркеров, выявленных в группах сцепления, провели SSR-анализ контрастных по устойчивости к отдельным расам сосудистого бактериоза линий картирующих популяций, в результате которого были обнаружены микросателлитные маркеры локусов устойчивости к нескольким расам возбудителя сосудистого бактериоза. Выявлены эффективные молекулярно-генетические дескрипторы вида по устойчивости к сосудистому бактериозу (к каждой расе отдельно и к патогену в целом). Полученные данные представляют интерес для понимания основ физиолого-генетического взаимодействия «ген-на-ген» и механизмов устойчивости B. rapa к различным расам X. campestris pv. campestris, вызывающим сосудистый бактериоз.
Устойчивость к сосудистому бактериозу, картирование qtl, ssr маркеры, молекулярно-генети-ческий скрининг
Короткий адрес: https://sciup.org/142214115
IDR: 142214115 | DOI: 10.15389/agrobiology.2018.1.157rus
Текст научной статьи Физиолого-генетические компоненты устойчивости к сосудистому бактериозу у линий удвоенных гаплоидов Brassica rapa L
Работа выполнена при частичной финансовой поддержке РФФИ (грант ¹ 10-04-00446).
розы на листьях, некроз и потемнение жилок листа, а также проводящих тканей внутри стебля. У вида Brassica rapa L. болезнь наиболее опасна для корнеплодных реп и листовых культур (5), включая широко распространенную пекинскую капусту (6).
Вид репа B. rapa объединяет важные масличные, овощные и кормовые сельскохозяйственные культуры и служит модельным объектом для генетических и молекулярных исследований. Несмотря на высокую значимость этого вида для питания человека, число публикаций о генетической природе и наследовании морфологических, физиологических, иммунологических и других хозяйственно ценных признаков у B. rapa невелико. Так, было изучено географическое и таксономическое распределение расоспецифической устойчивости к фитопатогенным ксантомонадам у образцов B. rapa и B. napus (7). Выявлена высокая частота устойчивости к расе 4 среди подвидов B. rapa центральноазиатского и японского происхождения и B. napus . Впервые обнаружены доноры комплексной устойчивости B. rapa ко всем использованным расам патогена и источники устойчивости к расам 1 и 3 среди образцов B. rapa и B. napus . Идентификация QTL (quantitative trait loci) с помощью RFLP (restriction fragment length polymorphism) и RAPD (random amplified polymorphic DNA) маркеров показала, что реакция растений связана с несколькими аддитивными локусами в разных группах сцепления (8). Ген устойчивости к расе 4 Xсс у пекинской капусты ( B. rapa ) находится на расстоянии около 3 сМ от локуса устойчивости к киле крестоцветных (9). Изучено наследование устойчивости к трем расам Xсс с использованием гибридов от скрещивания устойчивых и восприимчивых линий B. oleracea , B. carinata и B. napus (10). Выполнено картирование единичного доминантного локуса Xca4 (устойчивость к расе 4) у линий удвоенных гаплоидов, которые использовались для создания RFLP карты. Xca4 локус локализовали в группе сцепления N5 генома A у вида B. napus , тем самым подтвердив, что устойчивость унаследована от B . rapa . Xca4 был первым картированным главным локусом, контролирующим расоспецифическую устойчивость к Xсс у видов Brassica . Английские и испанские ученые (11) изучали наследование устойчивости к двум наиболее распространенным расам 1 и 4 Xсс в расщепляющемся поколении F2 от скрещивания образца пекинской капусты B162 с неспецифической устойчивостью и восприимчивой инбредной линии R-o-18 . Они создали генетическую карту сцепления общей длиной 664 cM на основе 223 AFLP (amplified fragment length polymorphism) и 23 микросателлитных маркеров. Устойчивость к обеим расам коррелировала. Авторы локализовали кластер высокозначимых QTL устойчивости, определяющих 24-64 % изменчивости признака, в группе сцепления A06. Два дополнительных минорных QTL устойчивости к расе 4 обнаружили в группах сцепления A02 и A09. Ранее мы изучили две картирующие популяции B. rapa с целью идентификации QTL, определяющих морфологические и фенологические признаки (12-15). Выявлены позиции QTL (главным образом в группах сцепления А02, А03, А06, А07 и А09), где один локус контролирует несколько признаков, что свидетельствует о важной роли этого локуса в развитии растения.
В то же время сведения о расположении локусов, определяющих расоспецифическую устойчивость растений B. rapa к сосудистому бактериозу, пока крайне ограничены. В представленном исследовании мы впервые идентифицировали хромосомные локусы, контролирующие устойчивость к четырем наиболее распространенным расам возбудителя сосудистого бактериоза, у линий удвоенных гаплоидов в двух картирующих популяциях B. rapa 158
и обнаружили среди этих линий новых доноров устойчивости.
Целью нашей работы было выявление и картирование генетических компонент, вовлеченных у Brassica rapa в физиолого-генетические механизмы взаимоотношений «ген-на-ген» между растением и различными расами возбудителя сосудистого бактериоза.
Методика. Изучали две картирующие популяции линий удвоенных гаплоидов (ЛУГ) B. rapa — DH38 (?Р175 х ^P143) и DH30 ($P115 х ^Р143), полученных в Университете Вагенингена (Нидерланды) методом культуры микроспор единственного растения F1 в каждой комбинации скрещивания трех основных различающихся фенотипически подвидов вида: масличного желтого сарсона (исходный образец YS-143, к-FIL500, мужской родитель ЛУГ P143), листовой/черешковой китайской капусты (PC-175, сорт Nai Bai Cai, первый материнский родитель ЛУГ P175) и корнеплодной репы (VT-115, сорт Kairyou Hakata, второй материнский родитель ЛУГ P115) (15). Линии картирующих популяций DH30 и D38 генотипированы соответственно 299 и 294 AFLP и SSR маркерами. Для SSR-анализа были использованы 100 маркеров, разработанных при выполнении Международного проекта по геному Brassica (Multinational Brassica Genome Project — MBGP) .
Для искусственного заражения использовали штаммы четырех рас Xanthomonas campestris pv. campestris (Pam.) Dow. (далее Xcc ) — PHW231 (раса 1), HRI5212 (раса 3), HRI1279а (раса 4), В-32 (раса 6) (штаммы любезно предоставлены д-ром J. Vicente и д-ром N.W. Schaad). Бактерии хранили при -84 °С, инокулюм (10 6 кл/мл) получали из 2-суточной культуры на модифицированной среде Кинга Б.
Оценку 64 линий удвоенных гаплоидов картирующих популяций (26 линий популяции DH30 и 38 линий популяции DH38) и их родительские формы на устойчивость к Xcc проводили в течение 2 лет. Растения выращивали в вазонах диаметром 10 см в теплице при 20/16 °С (день/ночь) и 16-часовом фотопериоде до стадии 3-4 настоящих листьев. Три настоящих листа на каждом растении инокулировали примерно в 10 точках, прищипывая половинку листа возле жилок в 2-3 мм от его границы хирургическим пинцетом, смоченным в бактериальной суспензии (16). Каждое растение инокулировали всеми изолятами ксантомонад. После инокуляции растения помещали на 24 ч во влажную камеру, затем на 2 нед в теплицу при температуре 24 °С (день/ночь). Первые признаки сосудистого бактериоза появлялись через 10 сут после инокуляции. Учет проводили по 4балльной шкале: 0 — отсутствие реакции, 1 — некроз вокруг точки инокуляции (реакция сверхчувствительности, РСЧ); 2 — некроз вокруг точки инокуляции и хлороз до 0,5 см в диаметре; 3 — развитие типичных V-образных некрозов. Ежегодно проводили 3 независимых испытания в разные сроки, c 2 повторами для каждого образца. Устойчивые образцы инокулировали дополнительно для подтверждения результата.
Для изучения характера наследования реакции на патоген в условиях зимней теплицы сравнили 33 комбинации возвратных скрещиваний растений, контрастных по устойчивости к определенной расе. Скрещивания выполняли в 3-кратной повторности, используя принудительное опыление с нанесением пыльцы на кастрированные бутоны за 3-4 сут до распускания цветков. После автогамного опыления растений F1 получали потомство F2, в котором оценивали расщепление по устойчивости к штаммам патогена.
Достоверность различий между образцами по доле растений, устойчивых к каждой расе, определяли методом дисперсионного анализа с использованием критерия / -квадрат при уровне статистической значимости 159
95 % (17). Взаимозависимость между реакцией образцов на разные расы патогена устанавливали методом корреляционного анализа по Пирсону (18) с помощью программы Statistica 6.0 («StatSoft, Inc.», США).
QTL-анализ 64 линий удвоенных гаплоидов двух картирующих популяций B. rapa DH38 и DH30 выполняли согласно описанию (15), используя программу MAPQTL 6.0 (19), с помощью которой устанавливали присутствие и расположение локусов-кандидатов в группе сцепления (интервал картирования 5 сМ), значения LOD (logarithm of odds) (P = 0,05) и степени варьирования признаков устойчивости к разным расам, которые объясняются этими QTL, для каждого показателя устойчивости и каждой популяции. Значимость каждого LOD устанавливали методом пермутации (1000 повторений). Для установления количества и точного расположения выявленных QTL на генетической карте применяли интервальное картирование, основанное на гипотезе, что в интервале между сцепленными друг с другом маркерами с определенной степенью рекомбинации существует один QTL (12). С целью эффективного определения групп сцепления и установления их числа использовали интегрированную генетическую карту B. rapa общей длиной 1068 сМ, насыщенную молекулярными AFLP и SSR маркерами (15). Благодаря нейтральности AFLP и SSR (12, 14) маркеры покрывают весь геном B. rapa со средним расстоянием между маркерами 2,27 сМ. Генетические значения каждого из возможных генотипов в двух маркерных локусах выражали как функцию значений этого QTL, также определяли частоту рекомбинации между QTL и фланкирующими его маркерами. При переводе данных по рекомбинации в расстояния на группах сцепления использовали функцию Косамби (20).
Для проверки ассоциаций маркер—признак линии генотипировали с помощью SSR маркеров, разработанных в рамках MBGP, для которых нами была выявлена связь с устойчивостью к определенным расам Xcc: BRMS-014, BRMS-043, BRMS-050, BRMS-051, BRMS-096 (Япония), SSR-87 и SSR-89 (Китай), Na10D09, Na12E02, Na12H09 и Ra2E12 (Великобритания) . ДНК для ПЦР-анализа выделяли из молодых зеленых листьев растений согласно описанию (21). ПЦР проводили в смеси объемом 12,5 мкл: 10½ инкубационный буфер (1,25 мкл), 0,25 мкл смеси dNTP (10 мM), по 0,25 мкл каждого из рекомендуемых праймеров (10 пмоль/мкл), 0,1 мкл Taq ДНК-полимеразы (5 U/мкл) («QBiogene», Германия) и 20 нг геномной ДНК. Амплификацию осуществляли в термоциклере С-1000 («Bio-Rad», США). Режим ПЦР: 94 °С 3 мин; 30 циклов — 94 °С 30 с, 55 °С 30 с, 72 °С 30 с; заключительная элонгация 75 °С 7 мин; далее 4 °С без ограничения времени. Продукты амплификации разделяли электрофорезом в 1,8 % агарозном геле, окрашивали бромистым этидием и документировали с помощью системы BioDoc («Bio-Rad», США).
Результаты . Исследуемые линии (табл. 1) демонстрировали реакцию от устойчивости до высокой восприимчивости. В целом в разные сезоны были получены близкие результаты, хотя более высокую восприимчивость некоторых растений отмечали в весенний период. Выделились генотипы, проявляющие иммунность или реакцию сверхчувствительности ко всем четырем расам патогена: в DH30 — линии 35А, 69B, 98Е, в DH38 — линии 1g, 32d, 97а, 172a. В популяции DH30 в наибольшей степени коррелировали реакции на заражение штаммами B-32 (раса 6) и 1279а (раса 4) ( r = 0,64), а также HRI5212 (раса 3) и PHW231 (раса 1) ( r = 0,43). Наблюдалась существенная корреляция ( r от 0,54 до 0,73) между реакцией на индивидуальные штаммы и суммарной пораженностью растений. Ко всем 160
штаммам патогена оказались устойчивы три линии. При инокуляции расам 3, 4 и 6 линии чаще проявляли восприимчивость. Распределение линий по реакции на заражение расами 1 и 3 ближе всего соответствовало моногенно-му наследованию признака. Сильнее всего от ожидаемого отклонялось расщепление по реакции на штамм В-32 наиболее вирулентной расы 6 (увеличение числа восприимчивых линий). В популяции DH38 обнаружили существенную взаимосвязь между реакцией на штаммы B-32 (раса 6) и 1279а (раса 4) ( r = 0,52), PHW231 (раса 1) ( r = 0,4), реакцией на отдельные штаммы и общим поражением ( r от 0,58 до 0,78). Ко всем испытанным штаммам патогена были устойчивы 4 линии. Сильнее всего от ожидаемого отклонялось расщепление для реакции на штамм PHW231 (увеличение числа восприимчивых линий в популяции DH38). Распределение линий по чувствительности к расе 4 ближе всего соответствовало моногенному наследованию признака (см. табл. 1).
При изучении характера наследования чувствительности растений к
-
1. Результаты искусственного заражения растений картирующих популяций линий удвоенных гаплоидов Brassica rapa штаммами Xanthomonas campestris pv. campestris (Pam.) Dow.
Линия
Осенне-зимний период
Сумма баллов по годам
Весенний период
В-32 1279а 5212 231
В-32 1279а 5212 231
По
пуляц
ия
DH30 ( $ P115
x ^ Р143)
P1 115
0
1,0
2,0
0
3/4
0
2,0
2,0
0
Р2 175
0
1,0
0
0
1/6
2,0
2,0
0
2,0
Р3 143
0
0
2,0
0
2/2
0
0
2,0
0
6А
2,0
2,0
1,0
2,0
7/8
2,0
2,0
2,0
2,0
18М 2
1,0
0
0
0
1/4
2,0
1,0
1,0
0
28А
2,0
1,0
1,0
0
4/7
2,0
2,0
2,0
1,0
35А
1,0
0
0
0
1/4
1,0
1,0
1,0
1,0
38В
1,0
1,0
2,0
2,0
6/6
1,0
1,0
2,0
2,0
44A-V2
3,0
3,0
1,0
1,0
8/8
3,0
3,0
1,0
1,0
67
2,0
0
2,0
2,0
6/6
2,0
0
2,0
2,0
69В-1
1,0
1,0
1,0
0
3/3
1,0
1,0
1,0
0
79С-2
1,0
1,0
2,0
0
4/4
1,0
1,0
2,0
0
97
3,0
3,0
1,0
1,0
8/8
3,0
3,0
1,0
1,0
98Е-2
1,0
1,0
1,0
1,0
4/4
1,0
1,0
1,0
1,0
110А-3
2,0
1,0
2,0
0
5/5
2,0
1,0
2,0
0
127c
1,0
1,0
3,0
3,0
8/10
2,0
2,0
3,0
3,0
160А
1,0
2,0
1,0
1,0
5/8
2,0
2,0
2,0
2,0
163А-2
2,0
2,0
1,0
2,0
7/7
2,0
2,0
1,0
2,0
164А-Аh
2,0
2,0
2,0
1,0
7/3
2,0
0
0
1,0
178А
2,0
1,0
0
1,0
4/7
2,0
2,0
1,0
2,0
189-А
2,0
1,0
3,0
3,0
9/10
2,0
2,0
3,0
3,0
206Аh
2,0
2,0
3,0
1,0
8/8
2,0
1,0
2,0
3,0
215с-1
3,0
2,0
2,0
2,0
9/9
3,0
2,0
2,0
2,0
238А
1,0
2,0
1,0
1,0
5/6
1,0
2,0
2,0
1,0
251-1
1,0
2,0
2,0
1,0
6/6
1,0
2,0
2,0
1,0
94
3,0
3,0
1,0
нд
7/8
3,0
3,0
2,0
0
113 i
3,0
3,0
2,0
нд
8/10
3,0
3,0
2,0
2,0
188А-3
1,0
2,0
1,0
нд
4/6
1,0
2,0
1,0
2,0
192H-1h
3,0
3,0
3,0
нд
9/12
3,0
3,0
3,0
3,0
Устойчивые : восприимчивые
11:15
11:15
14:12
14:8
8:18
10:16
10:16
13:13
По
пуляц
ия
DH38 ( $ Р175
x J P143)
1g-2
1,0
0
0
1,0
2/2
1,0
0
0
1,0
13а-VI
1,0
1,0
1,0
2,0
5/5
1,0
1,0
1,0
2,0
15в-3
0
0
2,0
1,0
3/3
0
0
2,0
1,0
23а-VI
2,0
1,0
2,0
2,0
7/7
2,0
1,0
2,0
2,0
25а-VI
2,0
1,0
1,0
2,0
6/6
2,0
1,0
1,0
2,0
32d-1
1,0
1,0
0
0
2/2
1,0
1,0
0
0
36с-3
3,0
3,0
2,0
2,0
10/10
3,0
3,0
2,0
2,0
40с-1h
3,0
3,0
3,0
3,0
12/12
3,0
3,0
3,0
3,0
44а-1
3,0
2,0
2,0
0
7/7
3,0
2,0
2,0
0
51 f-1
1,0
2,0
2,0
2,0
7/7
1,0
2,0
2,0
2,0
52a-1
3,0
1,0
1,0
3,0
8/8
3,0
1,0
1,0
3,0
55h-1
2,0
1,0
2,0
1,0
6/6
2,0
1,0
2,0
1,0
57d-V3
0
0
1,0
2,0
3/3
0
0
1,0
2,0
58d-1
2,0
3,0
2,0
2,0
9/9
2,0
3,0
2,0
2,0
-
2. Распределение в потомстве F2 от скрещивания растений с контрастной устойчивостью, отобранных в картирующих популяциях линий удвоенных гаплоидов Brassica rapa при искусственном заражении Xanthomonas campestris pv. campestris (Pam.) Dow.
Комбинация скрещивания
Число растений
В-32
1279a
5212
231
Популяция DH30 ( $ В115 х ^ Р143)
206(у) ½ 192(в)
56
0:56
42:14а, *
0:56
0:56
192(в) ½ 206(у)r
64
0:64
50:14а, * 49:15а, *
0:64
164(у) ½ 192(в)
48
0:48
32:16а 37:11а, *
0:48
192(в) ½ 164(у)
36
0:36
26:10а, * 24:12
0:36
Популяция DH38 ( $ Р175 х J P143)
80(в) ½ 64(у)
36
0:36
28:8а, * 26:10а, *
3:33
64(у) ½ 80(в)
42
1:41
31:11а, * 28:14а
1:41
62(в) ½ 59(у)r
40
32:8*
26:14а
0:40
0:40
59(у) ½ 62(в)
28
0:28
0:28
0:28
0:28
40(в) ½ 64(у)
48
0:48
0:48 30:18а
0:48
64(у) ½ 40(в)
64
0:64
49:15а, * 50:14а, *
0:64
62(в) ½ 136(у)
20
0:20
0:20
0:20
0:20
136(у) ½ 62(в)
20
0:20
16:4а, *
0:20
0:20
80(в) ½ 169(у)r
24
0:24
20:4а
0:24
0:24
169(у) ½ 80(в)
20
0:20
0:20
0:20
0:20
62(в) ½ 64(у)
56
0:56
0:56
0:56
0:56
64(у) ½ 62(в)r
60
0:60
0:60 45:15а
0:60
62(в) ½ 103(у)
24
0:24
18:6а
0:24
0:24
103(у) ½ 62(в)
35
0:35
28:7а, *
1:34
2:33
169(у) ½ 62(в)r
27
0:27
18:9а
0:27
0:27
62(в) ½ 169(у)
18
0:18
0:18
0:18
0:18
78(в) ½ 59(у)
28
0:28
0:28
0:28
20:8а, *
59(у) ½ 78(в)r
49
0:49
40:9а
0:49
35:14а
78(в) ½ 103(у)
56
0:56
40:16а
0:56
43:13а, *
103(у) ½ 78(в)
68
0:68
50:18а, *
0:68
48:20а
Примечание.
В-32 — штамм В-32, раса 6; 1279а
— штамм
HRI1279а, раса 4; 5212 — штамм HRI5212, раса 3; 231 — штамм
Продолжение таблицы 1
|
59a-2h |
2,0 |
3,0 |
1,0 |
2,0 |
8/6 |
2,0 |
0 |
2,0 |
2,0 |
|
62a-2h |
2,0 |
3,0 |
3,0 |
3,0 |
11/12 |
3,0 |
3,0 |
3,0 |
3,0 |
|
64-b-V-2h |
3,0 |
1,0 |
2,0 |
2,0 |
8/6 |
3,0 |
0 |
0 |
3,0 |
|
65a-2 |
3,0 |
2,0 |
1,0 |
2,0 |
8/8 |
3,0 |
2,0 |
1,0 |
2,0 |
|
72a-VI |
2,0 |
2,0 |
1,0 |
1,0 |
6/6 |
2,0 |
2,0 |
1,0 |
1,0 |
|
75a-1 |
1,0 |
1,0 |
2,0 |
2,0 |
6/6 |
1,0 |
1,0 |
2,0 |
2,0 |
|
76в-1 |
1,0 |
2,0 |
1,0 |
1,0 |
5/8 |
3,0 |
3,0 |
1,0 |
1,0 |
|
78a-1 |
2,0 |
2,0 |
3,0 |
3,0 |
10/9 |
2,0 |
3,0 |
3,0 |
1,0 |
|
80a-1h |
2,0 |
2,0 |
2,0 |
2,0 |
8/12 |
3,0 |
3,0 |
3,0 |
3,0 |
|
92в-1 |
3,0 |
2,0 |
1,0 |
1,0 |
7/7 |
3,0 |
2,0 |
1,0 |
1,0 |
|
95а-1 |
3,0 |
1,0 |
3,0 |
2,0 |
9/9 |
3,0 |
1,0 |
3,0 |
2,0 |
|
97а-3 |
0 |
0 |
1,0 |
1,0 |
2/2 |
0 |
0 |
1,0 |
1,0 |
|
103аh |
3,0 |
3,0 |
0 |
2,0 |
8/7 |
3,0 |
0 |
1,0 |
3,0 |
|
123а |
1,0 |
2,0 |
2,0 |
2,0 |
7/7 |
1,0 |
2,0 |
2,0 |
2,0 |
|
124а-1 |
1,0 |
3,0 |
2,0 |
2,0 |
8/8 |
1,0 |
3,0 |
2,0 |
2,0 |
|
127а-1 |
3,0 |
2,0 |
2,0 |
2,0 |
9/9 |
3,0 |
2,0 |
2,0 |
2,0 |
|
134а-4 |
3,0 |
1,0 |
2,0 |
2,0 |
8/8 |
3,0 |
1,0 |
2,0 |
2,0 |
|
136VI |
0 |
3,0 |
3,0 |
3,0 |
9/8 |
1,0 |
1,0 |
3,0 |
3,0 |
|
142b-2 |
1,0 |
1,0 |
2,0 |
2,0 |
6/6 |
1,0 |
1,0 |
2,0 |
2,0 |
|
151а-2 |
1,0 |
1,0 |
1,0 |
2,0 |
5/5 |
1,0 |
1,0 |
1,0 |
2,0 |
|
154в |
0 |
0 |
2,0 |
2,0 |
4/4 |
0 |
0 |
2,0 |
2,0 |
|
160с |
0 |
0 |
2,0 |
1,0 |
3/3 |
0 |
0 |
2,0 |
1,0 |
|
169а-1h |
2,0 |
1,0 |
2,0 |
2,0 |
7/6 |
2,0 |
0 |
2,0 |
2,0 |
|
172а |
0 |
0 |
1,0 |
0 |
1/1 |
0 |
0 |
1,0 |
0 |
|
Устойчивые: восприимчивые |
17:21 |
20:18 |
15:22 |
11:26 |
16:22 |
23:25 |
15:23 |
12:26 |
П р и м еч а ни е. В-32 — штамм В-32, раса 6; 1279а — штамм HRI1279а, раса 4; 5212 — штамм HRI5212, раса 3; 231 — штамм PHW231, раса 1. Оценка чувствительности: 0 — нет реакции, 1 — реакция сверхчувствительности, 2 — слабая восприимчивость (зона поражения менее 5 мм или хлороз), 3 — восприимчивость, развитие типичных симптомов. h — линии, использованные для гибридизации.
PHW231, раса 1; у — устойчивая родительская линия, в — восприимчивая родительская линия, r — комбинации с реципрокным эффектом на реакцию растений при заражении патогеном; а — комбинации с расщеплением, близким к 3:1.
٭ Достоверность расщепления, соответствующего ожидаемому 3:1, 95 % по критерию х -квадрат.
патогену для гибридизации отобрали 20 линий — 7 восприимчивых ко всем штаммам патогена, 13 — устойчивых только к одной расе и восприимчивых к остальным (табл. 2). Скрещивание проходило легко, формировались стручки, содержащие 15-20 семян. Линии с пониженной самосовместимо-стью, которые завязывали при автогамном опылении 6-7 семян на стручок, отбраковывали. Все растения F1 обеих картирующих популяций проявили устойчивость как минимум к одной расе патогена из 4 использованных. После автогамного опыления растений F1 получили 20 популяций потомства F2 от линий картирующей популяции DH38 и 4 потомства F2 — от линий популяции DH30, в которых определили расщепление по устойчивости к четырем штаммам патогена. Наблюдаемое соотношение устойчивых и восприимчи-
вых форм в F2 и последующий анализ гибридов отобранных устойчивых и восприимчивых линий показали, что расоспецифическая устойчивость преимущественно определялась одним доминантным локусом (см. табл. 2).
Три из четырех популяций F2 DH30 проявили моногенную устойчивость к расе 4 (штамм HRI1279a) и к расе 3 (штамм HRI5212), одна — устойчивость с возможным отклонением от моногенной (сдвиг в сторону восприимчивости). Интересно, что родительские линии 206 и 164 (см. табл. 1) были устойчивы только к расе 1. Среди 20 популяций F2 от скрещивания линий картирующей популяции DH38 10 имели моногенную устойчивость к расе 4 (штамм HRI1279a), включая устойчивость с отклонением от расщепления 3:1, 5 — моногенную устойчивость к расе 3 (штамм HRI5212), 4 — моногенную устойчивость к расе 1 (штамм PHW231), 1 — моногенную устойчивость к расе 6 (штамм B-32). Очевидно, что устойчивость к расе 4, доминирующая в популяциях вида B. rapa (7), сохранила значение при скрещивании родительских линий (даже при наличии у родителя реакции восприимчивости). У 8 из 12 пар родителей проявился реципрокный эффект скрещивания, что дает возможное объяснение появлению устойчивости в потомстве двух исходных родительских линий, восприимчивых к расе, при получении F1. Из этих восьми пар шесть были с реципрокной асимметрией реакции на заражение расой 4, три — расой 3, одна пара проявляла реципрокную асимметрию в отношении расы 6; асимметрию реакции на расу 1 не наблюдали.
3. Результаты QTL-анализа устойчивости к Xanthomonas campestris pv. cam-pestris (Pam.) Dow. в картирующих популяциях линий удвоенных гаплоидов Brassica rapa при искусственном заражении
|
Штамм (раса) |
Группа сцепления |
LOD-оценка (минимальная-максимальная) |
Варьирование процента фенотипической изменчивости признака, % Expl. |
|
PНW231 (раса 1) |
Популяция А03, А07 |
DH30 ( $ P115 x ^ Р143) 1,09-1,14 |
19,7-21,1 |
|
HRI5212 (раса 3) |
А01, А03, А06, А07 |
1,16-2,35 |
19,9-36,3 |
|
HRI1279а (раса 4) |
А02, А03, А05 |
0,77-3,08 |
13,7-44,6 |
|
В-32 (раса 6) |
А01, А03, А04, А05, А07, А09 |
1,02-1,82 |
17,8-29,5 |
|
PНW231 (раса 1) |
Популяция А02, А04, А06, А08 |
DH38 ( $ Р175 x J P143) 0,75-2,31 |
9,7-26,9 |
|
HRI5212 (раса 3) |
А01, А05, А10 |
0,72-1,81 |
9,3-21,8 |
|
HRI1279а (раса 4) |
А03, А06 |
1,06-2,93 |
13,4-32,7 |
|
В-32 (раса 6) |
А01, А03, А04, А06, А08 |
0,66-3,44 |
8,5-37,2 |
QTL-анализ (табл. 3, рис. 1) (рис. 1 см. в online версии статьи на сайте выявил в популяции DH30 13 QTL, контролирующих устойчивость к четырем расам сосудистого бактериоза. При этом 10 локусов стабильно сохраняли локализацию в оба года исследований (LOD 0,77-3,80; обычно выделяли локусы с LOD > 1,1). Это локусы вверху групп сцепления А01 и А03, контролирующие устойчивость к расе 3 патогена, 2 локуса внизу А03, контролирующие устойчивость к расам 3, 4 и 6, в средине А05 (контроль устойчивости к расе 4, в весенний период — также к расе 6), два QTL в нижней части А07 (устойчивость к расе 3, в осенне-зимний период — также к расе 6, а в весенний — также к расе 1). В средине групп сцепления А01 и А04 и в нижней половине А09 были обнаружены QTL устойчивости к расе 6 (позиция QTL в А09 различалась по годам на 7 сМ). Изменчивость, объясняемая найденными QTL, составляла от 13,7 до 44,6 %. Эффекты генов во всех установленных локусах были аддитивными. Самыми высокими и стабильными по годам исследований LOD характеризовались три QTL, расположенные в верхней части А01 и внизу 163
А03 и А07. Таким образом, наиболее важные локусы, отвечающие за проявление устойчивости к разным расам возбудителя сосудистого бактериоза у DH30 B. rapa , находились в группах сцепления А01, А03 и А07.
Для популяции DH38 были найдены 19 QTL (см. табл. 3), при этом все локусы стабильно сохраняли локализацию по годам исследований (LOD 0,66-3,44). По 6 QTL контролировали устойчивость к расам 1 и 4, 4 — к расе 3, 8 — к расе 6. При этом в средней и нижней части группы А03 располагались четыре локуса устойчивости к расам 4 и 6, в средней и нижней части группы А06 — три локуса устойчивости к расам 1, 4 и 6, в верхней части группы А08 — три локуса устойчивости к расам 1 и 6. То есть наиболее существенные локусы устойчивости к сосудистому бактериозу у линий DH38 располагались в группах сцепления А03, А06 и А08. Вверху А10 был найден картированный ранее CAPS маркер локуса устойчивости к расе 5212-I FLC1 , связанный также со многими важными физиологическими и биохимическими признаками (время перехода в генеративную фазу, содержание аскорбиновой кислоты и каротина) (15).
QTL, контролирующие устойчивость к расам 3 и 6, у линий обеих картирующих популяций располагались в близких позициях в А01, к расам 4 и 6 — внизу группы А01, к расе 6 — в средине группы А04. Для обеих картирующих популяций наиболее важное значение для генетического контроля устойчивости к ксантомонадам имели локусы из А03. Отметим, что внизу группы А03 находился картированный ранее локус BrFLC5 , контролирующий важнейшие признаки — время перехода к цветению, продуктивность, биохимический состав (15).
BRMS-043 BRMS-050 SSR-89
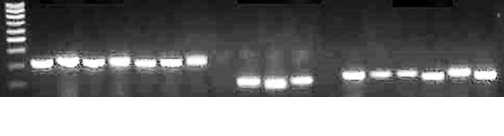
Рис. 2. Пример ПЦР-анализа восприимчивых (+) и устойчивых ( - ) к Xanthomonas cam-pestris pv. campestris (Pam.) Dow. линий картирующих популяций DH30 ( ? P115 X J P143) и DH38 ( ? Р175 x J P143) Brassica rapa с маркерами BRM-
S043, BRMS-050 и SSR-89: 1 — DH30/18 ( - ), 2 — DH30/97 (+), 3 — DH30/35 ( - ), 4 — DH38/1 ( - ), 5 — DH38/36 (+), 6 — DH38/62 (+), 7 — DH38/160 ( - ); 9 — DH30/17 (+), 10 — DH30/178 ( - ), 11 — DH30/192 (+); 13 — DH30/35 ( - ), 14 — DH30/192 (+), 15 — DH30/238 ( - ), 16 — DH30/18 ( - ), 17 — DH30/160 ( - ), 18 — DH30/206 (+); крайняя левая дорожка — маркер молекулярной массы 100 bp (10 фрагментов от 100 до 1000 bp) («СибЭнзим», Россия). Ожидаемый размер ампликона для BRMS-043 — 318 п.н., для BRMS-050 — 164 п.н., для SSR-89 — 199 п.н.
SSR-анализ контрастных по устойчивости линий обеих картирующих популяций (рис. 2) показал, что молекулярный маркер BRMS-043, связанный с устойчивостью к расе 4 у популяции DH30 и к трем расам у популяции DH38, присутствовал в ожидаемой позиции (318 п.н.) у устойчивых линий DH38 и в позиции, близкой к ожидаемой, у устойчивых линий DH30 (216 п.н.). Размер ампликона у восприимчивой линии 97 популяции DH30 составил 321 п.н., у восприимчивых линий 36 и 62 популяции DH38 — 312 п.н. Маркер BRMS-050, связанный с устойчивостью к расе 3 у популяции DH30, присутствовал в ожидаемой позиции (164 п.н.) у устойчивой линии 178, в то время как у восприимчивых линий 127 и 192 длина выявленного фрагмента равнялась 180 п.н. Маркер SSR-89, ассоциированный с локусом устойчивости к расе 3 и (с незначительным LOD) расе 6 у популяции DH30, выявлялся в ожидаемой позиции (199 п.н.) у устойчивых линий 18 и 35. У восприимчивых линий 192 и 206 (балл поражения 3), а также линии 238, предварительно оцененной как устойчивая, имелся фрагмент 204 п.н., а у предварительно устойчивой линии 160 — фрагмент 210 п.н. Однако следует отметить, что устойчивые линии 18 и 35 164
не проявляли никаких признаков поражения, а линии со спорными результатами показали реакцию сверхчувствительности. Маркер локуса устойчивости к расе 5212 у популяции DH30 BRMS-051 находился в ожидаемой позиции 262 п.н. у устойчивой линии 18 и на 5 п.н. выше — у устойчивой линии 69 с реакцией сверхчувствительности; у восприимчивой линии 206 размер фрагмента составил 150 п.н. Восприимчивая линия 44 популяции DH38 несла маркер Na12E02, связанный с локусом контроля устойчивости к расам 4 и 6 (ожидаемая длина фрагмента 132 п.н.). Устойчивая линия 160 и линия 52 с реакцией сверхчувствительности к расе 4 и восприимчивостью к расе 6, этого маркера не имели.
Таким образом, нами обнаружены микросателлитные маркеры локусов устойчивости B. rapa к нескольким расам возбудителя сосудистого бактериоза. В большинстве случаев устойчивые генотипы, не имеющие признаков поражения, несли маркер в ожидаемой позиции. Следует отметить, что влияние материнской цитоплазмы на проявление устойчивого фенотипа, впервые выявленное нами у B. rapa в этой работе, по всей видимости, может существенно сказываться на локализации и эффекте действия идентифицированных хромосомных QTL, но пока не существует признанной методики учета взаимодействия ядерных и цитоплазматических генов при картировании устойчивости у растений.
Сосудистый бактериоз особенно вредоносен для капусты огородной Brassica oleracea L. (1), хотя поражает практически все виды рода Brassica , включая сорные крестоцветные и декоративные растения и приводит к значительным ежегодным экономическим потерям. Однако мало что известно о генетических компонентах и физиологических механизмах устойчивости к этому заболеванию у растений. Поскольку фитопатогенные бактерии взаимодействуют с растениями по принципу «ген-на-ген», они представляют собой удобный объект для молекулярно-генетических исследований взаимоотношений в системе патоген—растение. На практике знание таких механизмов важно для создания устойчивых сортов — наиболее экономичного и экологически чистого метода борьбы с заболеванием.
Получение устойчивых генотипов осложняется существованием, как минимум, девяти рас патогена. Широко распространенные расы 1 и 4 наиболее опасны для вида B. oleracea (22, 23), поэтому устойчивость к этим двум расам — минимально необходимое условие для контроля над распространением сосудистого бактериоза у капустных растений. В результате проведенных исследований образцов вида B. oleracea J.D. Taylor с коллегами (3) выяснили, что устойчивость к расам 1 и 4 была очень низкой или вообще отсутствовала, в то время как устойчивость к менее распространенным расам 2, 3 и 6 встречалась относительно часто. В противоположность этому расоспецифическая устойчивость к расам 1 и 4 широко представлена у других видов рода Brassica — B. rapa , B. carinata (3, 9), B. napus и B. nigra (24-26). Однако генетический контроль и механизмы устойчивости к различным расам ксантомонад у этих видов до сих пор плохо изучены. Кроме того, до сих пор не было проведено ни одного исследования по выявлению и установлению хромосомной локализации локусов количественных признаков, определяющих устойчивость к отдельным расам Xсс , у такого хозяйственно ценного вида, как B. rapa — объекта наших исследований.
Известно, что бактерии используют белки-эффекторы, доставляемые в растительную клетку секреторной системой 3-го типа (Type 3 Secretion System, T3SS), для подавления конституционной устойчивости, стимулируемой микроб-ассоциированным метаболитным профилем (MAMPs). Вариабельность присутствия, экспрессии и аминокислотной последовательности 165
эффекторов T3SS зависит от расы фитопатогена и отражает его специализацию в отношении растений (2). Соответствующие гены устойчивости растений реагируют на такое подавление экспрессией устойчивости. Бактериальные гены, отвечающие за взаимодействие с растением, способны влиять на общие физиологические и генетические процессы в бактерии. К сожалению, механизмы взаимодействия физиолого-генетических систем растения и фитопатогенных бактерий до сих пор во многом не раскрыты. Это обусловлено, в первую очередь, отсутствием информации о естественном полиморфизме в популяции фитобактерий и простой модельной системы для анализа такого взаимодействия, что не позволяло установить хромосомную локализацию генов и/или локусов, определяющих количественную устойчивость к заболеваниям.
У B. napus PI199947, позднее идентифицированного как B. carinata (23, 27), описана доминантная расоспецифическая устойчивость к возбудителю сосудистого бактериоза, которая широко распространена среди растений с геномом В (3, 6). Расоспецифическая устойчивость обычно связана с реакцией сверхчувствительности в месте проникновения несовместимой расы Xсс через гидатоды, но часто наблюдается лишь частичная РСЧ (23). Идентификация QTL с помощью RFLP и RAPD маркеров показала, что реакция растений связана с несколькими аддитивными локусами в разных группах сцепления (8). Ранее российские ученые (9) установили, что ген устойчивости к расе 4 у пекинской капусты ( B. rapa ) находится на расстоянии около 3 сМ от локуса устойчивости к киле крестоцветных. Картирован также ген устойчивости Rxc4 у B. napus (10).
При полногеномном секвенировании генома B. oleracea обнаружены три минорных и один основной QTL, определяющие в потомстве устойчивость к одной расе Xсс (28). У форм родительских инбредных линий авторы выявили 674521 SNP, не указав, однако, ни инбредность поколения, ни того, из скольких индивидуальных растений каждой из родительских форм выделяли ДНК для установления SNP. При этом не учитывалось, что все особи семейства, полученного от одной особи F2, после n поколений генетически идентичны друг другу (за исключением оставшейся гетерозиготной в поколении n -1), и ДНК для полногеномного секвенирования выделяли не из единичного растения. Очевидно, из-за этого доля созданных авторами dCAPS маркеров, пригодных для анализа, составила всего 70 %, и из них только половин могла использоваться для насыщения существующей базовой карты B. oleracea . Кроме того, для создания генетической карты и картирования QTL корейские исследователи (27) использовали популяцию F2 со средним интервалом между маркерами 3,88 сМ, что на 1,61 сМ превышает среднее расстояние между маркерами картирующих популяций линий удвоенных гаплоидов B. rapa в наших исследованиях. Поскольку корейские коллеги для построения карты использовали совокупную ДНК растений F3, не указывая, что растения F3 получены в результате индивидуального самоопыления в F2, то в этом случае для одного локуса ожидаемое расщепление не 1:2:1, а 3:2:3, поскольку гетерозигоный локус в F2 имеет лишь один шанс из двух быть зафиксированным в F3. Линии удвоенных гаплоидов полностью лишены этих недостатков и к тому же могут быть отнесены к так называемым, «бессмертным» популяциям, поскольку их не нужно создавать заново и каждый раз насыщать молекулярными маркерами при картировании QTL, особенно если оно проводится в разные годы и/или в разных эколого-географических точках (12). Следует также отметить, что нам не известно ни одной работы, в которой бы рассматривались вопросы стабильности SNP с учетом частоты как естествен-166
ного, так и искусственного мутагенеза, рекомбиногенеза (прежде всего на уровне единичного нуклеотида) и степени вырожденности генетического кода в кодирующих и некодирующих участках генома. На наш взгляд, это позволило бы точнее установить границы применимости молекулярных маркеров такого типа. Наконец, картирование локусов хромосом, определяющих специфическую устойчивость растений к каждой из четырех рас ксантомонад, до настоящей работы тоже описано не было.
Мы обнаружили хромосомные локусы устойчивости к расам 1 и 4 патогена в группе сцепления А06 у линий картирующей популяции DH38 и дополнительно — к расе 4 А02 у DH30, что подтверждает результаты картирования QTL устойчивости к расам 1 и 4 X. campestris в популяции F2 от скрещивания высокоинбредной линии желтого сарсона R-o-18 и самоопылен-ного образца пекинской капусты В162 (11). На сегодняшний день это единственное известное нам исследование, в котором определено точное число и местоположение QTL, определяющих устойчивость к двум расам Xanth-omonas . В наших исследованиях идентифицированы и картированы QTL устойчивости к четырем расам ксантомонад, для трех из которых картирование QTL ранее не проводилось. Кроме того, нами установлен эффект действия каждого QTL и процент фенотипической изменчивости, обусловленной каждым из идентифицированных QTL для каждой расы патогена. Гибридологическим анализом установлено преимущественно моногенное наследование устойчивости. Выявлено блочное строение отдельных частей генома и блочный характер наследования признака. Показано, что один геномный блок (QTL) может отвечать за устойчивость к разным расам патогена. Идентифицированы молекулярные маркеры, генетически сцепленные с локализованными QTL. Проведен скрининг ЛУГ B. rapa и выявлены эффективные молекулярно-генетические дескрипторы вида по устойчивости к сосудистому бактериозу (к каждой расе отдельно и к патогену в целом).
Итак, нами впервые идентифицированы и локализованы группы сцепления и локусы хромосом, вовлеченные в формирование физиологической устойчивости Brassica rapa к четырем расам Xanthomonas campestris pv. campestris. Выявлены линии удвоенных гаплоидов, устойчивые ко всем исследованным расам возбудителя сосудистого бактериоза. Эти линии могут быть включены в научные и селекционные программы в качестве источников устойчивости. Полученные данные важны для понимания механизма расоспецифической устойчивости B. rapa , а в перспективе могут послужить основой для точной количественной оценки эффектов avr/pth генов и идентифицированных QTL, а также совершенствования методологии подобной работы с другими признаками.
Список литературы Физиолого-генетические компоненты устойчивости к сосудистому бактериозу у линий удвоенных гаплоидов Brassica rapa L
- Williams P.H. Black rot: a continuing threat to world crucifers. Plant Dis., 1980, 64: 736-742 ( ) DOI: 10.1094/PD-64-736
- Vicente J.G., Holub E.B. Xanthomonas campestris pv. campestris (cause of black rot of crucifers) in the genomic era is still a worldwide threat to brassica crops. Mol. Plant Pathol., 2013, 14: 2-18 ( ) DOI: 10.1111/j.1364-3703.2012.00833.x
- Taylor J.D., Conway J., Roberts S.J., Astley D., Vicente J.G. Sources and origin of resistance to Xanthomonas campestris pv. campestris in Brassica genomes. Phytopathology, 2002, 92: 105-111 ( ) DOI: 10.1094/PHYTO.2002.92.1.105
- Singh D., Dhar S., Yadava D.K. Genetic and pathogenic variability of Indian strains of Xanthomonas campestris pv. campestris causing black rot disease in crucifers. Curr. Microbiol., 2011, 63(6): 551-60 ( ) DOI: 10.1007/s00284-011-0024-0
- Vicente J.G. A podridao negra das cruciferas/G. Lopes (ed.): COTHN Centro Operativo e Tecnologico Hortofruticola, Alcobaca, 2004.
- Ignatov A., Kuginuki Y., Hida K. Distribution and inheritance of race-specific resistance to Xanthomonas campestris pv. campestris in Brassica rapa and B. napus. Journal of Russian Phytopathological Society, 2000, 1: 83-87.
- Игнатов А.Н., Артемьева А.М., Чесноков Ю.В., Политыко В.А., Матвеева Е.В., Ораевский А.А., Шаад Н.В. Устойчивость к возбудителю сосудистого бактериоза и листовой пятнистости у Brassica rapa L. и B. napus L. Сельскохозяйственная биология, 2011, 1: 85-91.
- Camargo L.E.A., Williams P.H., Osborn T.C. Mapping of quantitative trait loci controlling resistance of Brassica oleracea to Xanthomonas campestris pv. campestris in the field and greenhouse. Phytopathology, 1995, 85(10): 1296-1300 ( ) DOI: 10.1094/Phyto-85-1296
- Ignatov A.N., Kuginuki Y., Suprunova T.P., Pozmogova G.E., Seitova A.M., Dorokhov D.B., Hirai M. RAPD markers linked to locus controlling resistance for race 4 of the black rot causative agent, Xanthmonas campestris pv. campestris (Pamm.) Dow. in Brassica rapa L. Russian Journal of Genetics, 2000, 36: 281-283.
- Vicente J.G., Taylor J.D., Sharpe A.G., Parkin I.A.P., Lydiate D.J., King G.J. Inheritance of race-specific resistance to Xanthomonas campestris pv. campestris in Brassica genomes. Phytopathology, 2002, 92(10): 1134-1141 ( ) DOI: 10.1094/PHYTO.2002.92.10.1134
- Soengas P., Hand P., Vicente J.G., Pole J.M., Pink D.A.C. Identification of quantitative trait loci for resistance to Xanthomonas campestris pv. campestris in Brassica rapa. Theor. Appl. Genet., 2007, 114(4): 637-645 ( ) DOI: 10.1007/s00122-006-0464-2
- Tanksley S.D. Mapping polygenes. Annu. Rev. Genet., 1993, 27: 205-233 ( ) DOI: 10.1146/annurev.ge.27.120193.001225
- Artem’eva A.M., Rudneva E.N., Zhao J., Bonnema G., Budahn H., Chesnokov Yu.V. Accosiations search of molecular markers with determinant of blossom-time in natural and artificial population of Brassica rapa L. Agricultural Biology, 2012, 1: 21-32 ( ) DOI: 10.15389/agrobiology.2012.1.21eng
- Artemyeva A.M., Rudneva E.N., Volkova A.I., Kocherina N.V., Chesnokov Y.V. Detection of chromosome loci determined morphological and black rot resistance traits in Brassica rapa L. Acta Horticulturae, 2013, 1005: 105-109 ( ) DOI: 10.17660/ActaHortic.2013.1005.8
- Artemyeva A.M., Solovjova A.E., Kocherina N.V., Berensen F.A., Rudneva E.N., Chesnokov Yu.V. Mapping of chromosome loci determined manifestation of morphological and biochemical traits of quality in Brassica rapa L. crops. Russian Journal of Plant Physiology, 2016, 63: 259-272 ( ) DOI: 10.1134/S1021443716020047
- Ignatov A., Kuginuki Y., Hida K. Pathotypes of Xanthomonas campestris pv. campestris in Japan. Acta Phytopathologica et Entomologica Hungarica, 1999, 34: 177-181 ( ) DOI: 10.1139/cjb-77-3-442
- Anscombe F.J. The validity of comparative experiments. J. R. Stat. Soc. Ser. A-G, 1948, 111: 181-211 ( ) DOI: 10.2307/2984159
- Yule G.U. Notes of Karl Pearson's lectures on the theory of statistics, 1884-96. Biometrika, 1938, 30(1-2): 198-203 ( ) DOI: 10.1093/biomet/30.1-2.198
- Van Ooijen J.W. MapQTL®6.0, software for the mapping of quantitative trait loci in experimental populations of diploid species. Kyazma B.V., Wageningen, Netherlands, 2009.
- Kosambi D.D. The estimation of map distance from recombination values. Annals of Eugenics, 1944, 12: 172-175 ( ) DOI: 10.1111/j.1469-1809.1943.tb02321.x
- Дорохов Д.Б., Клоке Э. Быстрая и экономичная технология RAPD анализа растительных геномов. Генетика, 1997, 33: 358-365.
- Rubel M.H., Robin A.H.K., Natarajan S., Vicente J.G., Kim H.T., Park J.I., Nou I.S. Whole-genome re-alignment facilitates development of specific molecular markers for races 1 and 4 of Xanthomonas campestris pv. campestris, the cause of black rot disease in Brassica oleracea. Int. J. Mol. Sci., 2017, 18(12): 2523 ( ) DOI: 10.3390/ijms18122523
- Ignatov A., Kuginuki Y., Hida K. Race-specific reaction of resistance to black rot in Brassica oleracea. Eur. J. Plant Pathol., 1998, 104(8): 821-827 ( ) DOI: 10.1023/A:100864282
- Guo H., Dickson M.H., Hunter J.E. Brassica napus sources of resistance to black rot in crucifers and inheritance of resistance. Hortscience, 1991, 26(12): 1545-1547.
- Westman A.L., Kresovich S., Dickson M.H. Regional variation in Brassica nigra and other weedy crucifers for disease reaction to Alternaria brassicicola and Xanthomonas campestris pv. campestris. Euphytica, 1999, 106(3): 253-259 ( ) DOI: 10.1023/A:1003544025146
- Singh D., Rathaur P.S., Vicente J.G. Characterization, genetic diversity and distribution of Xanthomonas campestris pv. campestris races causing black rot disease in cruciferous crops of India. Plant Pathol., 2016, 65(9): 1411-1418 ( ) DOI: 10.1111/ppa.12508
- Visente J.G., Conway J., Roberts S.J., Taylor J.D. Identification and origin of Xanthomonas campestris pv. campestris races and related pathovars. Phytopathology, 2001, 91(5): 492-499 ( ) DOI: 10.1094/PHYTO.2001.91.5.492
- Lee J., Izzah N.K., Jayakodi M., Perumal S., Joh H.J., Lee H.J., Lee S.-C., Park J.Y., Yang K.-W., Nou I.-S., Seo J., Yoo J., Suh Y., Ahn K., Lee J.H., Choi G.J., Yu Y., Kim H., Yang T.-J. Genome-wide SNP identification and QTL mapping for black rot resistance in cabbage. BMC Plant Biology, 2015, 15: 32 ( ) DOI: 10.1186/s12870-015-0424-6


