Формирование биопленок уропатогенными штаммами Escherichia coli на различных абиотических поверхностях
Автор: Гизатуллина Ю.С., Кузнецова М.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
Изучено формирование биопленок клиническими уропатогенными штаммами Escherichia coli (UPEC) на полистироле и абиотических поверхностях медицинского назначения - латексе, поливинилхлориде (ПВХ), силиконе. Биопленки были массивнее на полистироле, чем на катетерах из ПВХ (W-test: р=0.028) и силикона (р=0.027), но не латекса (р>0.05). Сформированные на поверхности урологических катетеров биопленки UPEC были массивнее на латексе (латекс vs ПВХ p=0.028; латекс vs силикон р=0.019). С увеличением гидрофильности атакованной поверхности, проанализированной по адсорбции нафталина, снижалась эффективность ее колонизации бактериями (латекс > полистирол > ПВХ > силикон). Выявленная сильная положительная связь между биомассой биопленки и гидрофобностью клеточной стенки на гидрофобных носителях (латекс: rs=0.675; полистирол: rs=0.713) уменьшалась на более гидрофильных поверхностях (ПВХ: rs=0.334; силикон: rs=0.371). Число бактерий UPEC в составе биопленки было различно на всех поверхностях, максимальное количество жизнеспособных клеток обнаружено на полистироле и силиконе. Показано, что самые массивные биопленки были сформированы на полистироле при концентрации глюкозы 3.5% и при pH 6.0 и 7.0.
Уропатогенная escherichia coli (upec), биопленка, полистирол, латекс, поливинилхлорид, силикон, гидрофобность
Короткий адрес: https://sciup.org/147204823
IDR: 147204823 | УДК: 579.61
Текст научной статьи Формирование биопленок уропатогенными штаммами Escherichia coli на различных абиотических поверхностях
фекций являются биопленочные ассоциации бактерий [Abdallah et al., 2011].
Широкое применение в урологической практике био- и искусственных материалов, на поверхности которых формируются бактериальные биопленки, повышает риск персистенции возбудителя в организме [Перепанова и др., 2013; Сергевнин, Ключарева, 2016]. Катетер-ассоциированные инфекции мочевыводящих путей (ИМП) чаще всего вызваны штаммами уропатогенной Escherichia coli (UPEC) как в монокультуре, так и в составе поли-микробных ассоциаций с фекальной микробиотой [Бондаренко и др., 2004; Степанов и др., 2014; Nicolle, 2014; Grabe et al., 2015].
Отличительной особенностью большинства представителей последней является их способность изменять рН окружающей среды, продуцируя уреазу, что еще больше способствует биопленкообразо-ванию [Stickler, 2008]. При ИМП важным фактором развития условно-патогенной микробиоты является уровень глюкозы в моче [Grabe et al., 2015]. В связи с этим актуально исследование бактериальной адгезии штаммов ведущего этиопатогена ИМП в экспериментах in vitro на различных типах уретральных катетеров, наиболее востребованных в урологической практике.
Цель работы – изучить биопленкообразующую способность уропатогенных штаммов E. coli в зависимости от структуры абиотической поверхности и некоторых физико-химических факторов.
Объекты и методы исследования
Объектами исследования являлись бактериальные культуры E. coli Ampr, выделенные от пациентов с инфекциями мочевыводящих путей (n=6) из стационаров г. Перми и референс-штамм E. coli К12 TG1 Ampr [Данилов и др., 2002]. Все клинические изоляты идентифицированы согласно Приказу МЗ СССР № 535 от 22.04.1985 года в бактериологических лабораториях лечебных учреждений.
Гидрофобность поверхности бактериальных клеток оценивали по их относительному распределению между водной фазой и фазой органического растворителя гексадекана (BATH-тест) [Rosenberg et al., 1980]. Расчет осуществляли по формуле (1), где АС – ОП 540 суспензии до обработки гексадеканом, AГ – ОП 540 суспензии после обработки гексадеканом.
г = Сас -aD/ac* ioo(i) .
Определение уровня неспецифической адгезии проводили в стеклянных пенициллиновых флаконах (гидрофильная поверхность) и в лунках полистиролового 96-луночного плоскодонного планшета («Медполимер», Россия) (гидрофобная поверхность) согласно Ю.А. Николаеву [2000]. Показатель адгезии (%) рассчитывали по формуле (2), где
ОП НАЧ и ОП МИН – оптическая плотность (ОП 540 ) в момент засева и через 1 ч, соответственно.
А = (ОПнач — ОПмян)/ОПаач * 100 (2) .
Биопленки формировали на полистироле, латексе, поливинилхлориде (ПВХ) и силиконе в среде Луриа-Бертани (LB-среда) в течение 24 ч, так как именно на этот срок зафиксирована максимальная биомасса у штаммов UPEC, которая не изменяется со временем [Adamus-Białek et al., 2015]. Использовали 96-луночный плоскодонный иммунологический планшет (полистирол), а также фрагменты катетеров (1 см): Фолея 2-ходовой (латекс) и Нелатона (имплантационнонетоксичный медицинский поливинилхлорид и силикон) («Apexmed International BV», Нидерланды), предназначенных для однократной катетеризации мочевого пузыря.
Биомассу биопленки оценивали согласно O`Toole [O`Toole, Kolter, 1998]. Измеряли оптическую плотность спиртовых растворов после экстракции генци-анвиолета на планшетном ридере Tecan infinite M200 (Tecan, Швейцария) при длине волны 570 нм в ОЕ.
Количество жизнеспособных клеток в биопленках оценивали по числу колониеобразующих единиц (КОЕ/см2), для чего их дважды отмывали физиологическим раствором, затем добавляли его (100 мкл для полистирола и 1 мл для катетеров) и 5 раз по 1 мин обрабатывали планшеты ультразвуком (Elma Ultrasonic 30S, Германия). Полученную суспензию бактерий разводили децимально в круглодонных иммунологических планшетах и высевали на агаризованную LB-среду с ампициллином.
Биомассу биопленок и число адгезированных жизнеспособных клеток сравнивали с учетом площади поверхности (в пересчете на 1 см2). Площадь лунки полистиролового планшета принята равной 0.6 см2. Площадь фрагментов катетеров рассчитывали по формуле (3) для ПВХ, (4) для латекса и (5) для силикона, где R 1 – наружный радиус, R 2 , R 3 – внутренние радиусы, a,b – стороны прямоугольного хода (для силикона), h – длина фрагмента:
5 = 2л±1 * (RL+- R:) + 2ж * (R[ - RPt3);
S = 2-rrh • (RL4-Ri4-R3) + 2и * (R[—R:—R3) (4);
S = 2irh * (RL-HRg-HR^-H 2 « Cab +- ah + bh) 4
2 * (nRi - nRz — nRg - ab) (5) .
Гидрофобность атакованной поверхности определяли по количеству нафталина, адсорбированного из насыщенного водного раствора этого вещества [Коваленко и др., 2009]. Количество нафталина (в мкг/см2) в начале эксперимента и после адсорбции определяли по величине оптической плотности при длине волны 220 нм. Количество адсорбиро- ванного нафталина рассчитывали по убыли его содержания в растворе с учетом адсорбции нафталина на стеклянной поверхности лабораторной посуды (для катетеров).
Изучение влияния на формирование биопленок глюкозы (0.5, 1.5, 2.5, 3.5%) и кислотности среды (pH 5.0; 6.0; 7.0; 8.0) проводили с использованием минимальной среды ММ (г/л): (NH 4 ) 2 SO 4 – 1.0; K 2 HPO 4 – 10.5; KH 2 PO 4 – 4.5; Na 3 C 6 H 5 O 7 × 5H 2 O – 0.5 (0.2% глюкозы). Для получения градиента концентрации глюкозы использовали 40%-ный раствор C 6 H 12 O 6 , изменение рН среды производили путем добавления NaOH (1M) и HCl (1M).
Статистическую обработку полученных данных проводили с использованием программы STATISTICA 10. Показатели представлены в виде среднего арифметического и его ошибки (M±σ). Достоверность различий средних величин зависимых выборок определяли с помощью критерия Вилкоксо-на ( W -test). Результат считался статистически достоверным при p<0.05. Для изучения связи двух признаков вычисляли непараметрический коэффициент корреляции Спирмана (rs), статистическая достоверность рассчитывалась при уровне значимости p=0.05. Степень корреляции оценивали в зависимости от значения коэффициента |r|<0.3 – слабая, 0.3<|r|<0,7 – умеренная, |r|<0,7 – сильная корреляция.
Результаты и их обсуждение
Ключевым этапом формирования биопленки является адгезия клеток микроорганизма к колонизируемой поверхности. Одной из определяющих характеристик данного процесса является гидро- фобность клеточной стенки бактерий, а также способность материала адсорбировать вещества из своего окружения. При этом для прокариот выявлена четкая корреляция гидрофобных и адгезивных свойств [Van Loosdrecht et al., 1987].
Проведена оценка гидрофобности клеточной стенки, адгезивной и биопленкообразующей способности клинических штаммов E. coli . Максимальный показатель гидрофобности бактерий составил 4.04±3.17%. Средний показатель адгезии клеток для всей выборки штаммов к гидрофобной поверхности составил 7.70±4.48%, а к гидрофильной – 7.23±5.96% и достоверно не различался ( W- test: p=0.621) (таблица). Биопленки, образованные клиническими штаммами в лунках полистиролового планшета, имели невысокий показатель биомассы: оптическая плотность варьировала от 0,094±0,013 до 0,141±0,024 ОЕ. Массивность биопленки референтного штамма E. coli К12 TG1, по-видимому, обусловлена наличием F-плазмиды, которая, как известно, может положительно влиять на формирование биопленки [Ghigo, 2001]. При этом связи между адгезивными свойствами и массивностью биопленок не выявлено. Таким образом, отобранные штаммы UPEC характеризовались низкой гидрофобностью поверхности, невысокой адгезивной и биопленкообразующей активностью на полистироле. Полученные результаты согласуются с данными, представленными ранее для клинических штаммов E. coli , выделенных из урогенитального тракта и желчевыводящей системы человека [Гриценко и др., 2012].
Показатели гидрофобности клеточной стенки, адгезивной и биопленкообразующей способности штаммов E. coli
|
Штаммы E. coli |
Показатель, M±σ |
|||
|
гидрофобность, % |
адгезия к гидрофобной поверхности, % |
адгезия к гидрофильной поверхности, % |
биомасса биопленки, ОП 570 |
|
|
K12TG1 |
1.81±1.68 |
6.68±8.86 |
8.30±9.32 |
0.428 ± 0.136 |
|
50yn |
1.31±1.44 |
6.45±4.02 |
8.52±7.87 |
0.097±0.008 |
|
1021 |
4.04±3.17 |
6.64±2.33 |
4.08±4.03 |
0.141±0.024 |
|
1038 |
2.55±2.32 |
8.38±5.51 |
8.48±7.45 |
0.101±0.019 |
|
1046 |
2.93±1.40 |
10.24±4.67 |
8.81±7.51 |
0.095±0.009 |
|
1063 |
1.04±0.04 |
5.20±4.16 |
5.98±6.47 |
0.094±0.013 |
|
1068 |
0.98±0.02 |
9.30±6.18 |
7.52±2.43 |
0.097±0.013 |
Показано, что микроорганизмы формируют на катетерах более массивные пленки по сравнению с другими абиотическими поверхностями [Коробов и др., 2010]. L. Ferrières [2007] обнаружил, что штаммы UPEC в большей степени образуют биопленки на урологических катетерах, тогда как штаммы E. coli , выделенные при бессимптомной бактериурии, – на стекле и полистироле, что свидетельствует о конкурентном преимуществе более вирулентных штаммов UPEC. По результатам данного исследования средняя биомасса биопленок
UPEC на полистироле составила 0.173±0.025 ОЕ, в то время как на латексе она была 0.177±0.103 ОЕ, на ПВХ – 0.045±0.018 ОЕ, а на силиконе – 0.036±0.004 ОЕ (рис. 1, а). Сформированные биопленки были достоверно массивнее на полистироле, чем на ПВХ (W-test: р=0.028) или силиконе (W-test: р=0.027). Между полистиролом и латексом различий в биомассе не было, при этом, выявлена сильная положительная корреляция между данными показателями (rs=0.811). Сравнение биомассы биопленок UPEC на поверхности урологических катетеров из латекса, ПВХ и силикона показало, что бактериальные биопленки были массивнее в первом варианте: показатель оптической плотности был достоверно выше на латексе (W-test: латекс vs ПВХ p=0.028; латекс vs силикон р=0.019). Эти данные отличаются от исследований J.C. Russell [2000], в которых не было обнаружено различий в биомассе биопленок E. coli, образованных на латексе и ПВХ.
а
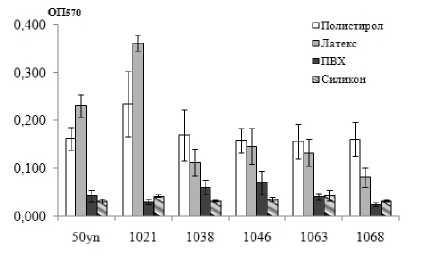
б
□Полистирол
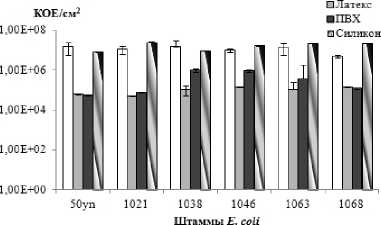
Рис. 1 . Биомасса биопленок (а) и количество жизнеспособных клеток в биопленках (б), сформированных клиническими штаммами E. coli на различных поверхностях.
Данные представлены в пересчете на 1 см2
Согласно предыдущим работам, повышение гидрофильности адгезируемой поверхности препятствует биопленкообразованию микроорганизмов [Cerca et al., 2005; Pagedar et al., 2010; Немец и др., 2013]. Поэтому было сделано предположение, что гидрофильно-гидрофобные свойства поверхности катетера влияют на эффективность адгезии бактерий. По результатам теста с адсорбцией нафталина, колонизируемые материалы расположены в порядке уменьшения гидрофобности: полистирол, латекс, ПВХ, силикон (рис. 2). Обнаружена сильная связь между показателем биомассы биопленки и гидрофобностью поверхности (rs=0.687). Как видно из гистограммы, увеличение гидрофильности поверхности действительно снижает эффективность ее колонизации уропатоген-ными штаммами E. coli. Ранее показано, что величина адсорбции клеток на гидрофобном адсорбенте тем выше, чем больше гидрофобность клеточной стенки [Зорина, Максимова, 2015]. Выявлена сильная положительная связь между биомассой биопленки и гидрофобностью клеток на гидрофобных носителях (латекс: rs=0.675; полистирол: rs=0.713), которая уменьшалась на более гидрофильных поверхностях (ПВХ: rs=0.334; силикон: rs=0.371). Интересно, что корреляция между показателями, характеризующими биомассу биопленок, образованных на различных поверхностях, не вы-
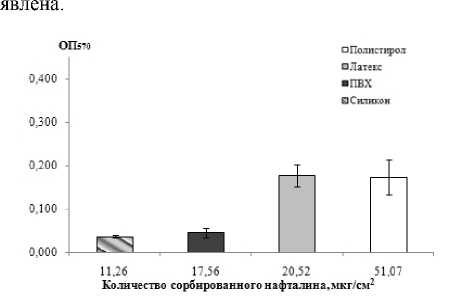
Рис. 2 . Зависимость биомассы биопленок (ОП 570 ) UPEC от гидрофобности поверхности.
Данные представлены в пересчете на 1 см2
Для персистенции бактерий в организме большое значение имеет количество жизнеспособных клеток в образовавшейся биопленке. Число клеток E. coli в биопленках составило 1.13E+07±6.61Е+06 КОЕ/см2 на полистироле, 1.02Е+05±3.40E+04 КОЕ/см2 на латексе, 4.26E+05±2.94Е+05 КОЕ/см2 на ПВХ и 1.71E+07±6.52E+05 КОЕ/см2 на силиконе. Наибольшее число жизнеспособных бактерий было обнаруженона поверхности полистирола и силикона (рис. 1, б).
Следует отметить, что число жизнеспособных адгезированных клеток на латексе оказалось значительно меньше, чем на остальных поверхностях, тогда как биопленки на нем были самые массивные. На поверхности катетера из силикона обнаружена абсолютно противоположная тенденция: минимальная биомасса биопленок при большом числе входящих в них бактерий. Возможно, это связано с тем, что ультразвуковая дезинтеграция в данном режиме не обеспечивает максимальный выход клеток из более массивных биопленок. Тем не менее, обнаруженные тенденции для двух типов поверхности могут служить объяснением, наряду с другими факторами, почему в клинической практике продолжают использовать натуральный, нередко вызывающий аллергические реакции латекс, и не происходит его полной замены на силикон.
Известна способность некоторых микроорганизмов изменять рН окружающей среды биотопа. Такие представители, как Pseudomonas aeruginosa , Klebsiella pneumoniae , Staphylococcus aureus и некоторые штаммы собственно E. coli продуцируют уреазу – фермент, расщепляющий мочевину с образованием свободного аммиака, что повышает щелочность среды, способствуя осаждению кальция фосфата, магния фосфата и аммония [Romeo,
2008; Коган и др., 2011]. Было показано, что в течение 4–5 дней просвет катетера может быть полностью блокирован микробной биопленкой, в которой повышен уровень содержания данных минералов [Stickler, 2008; Пинегина и др., 2013]. Изменение pH мочи может оказать влияние на формирование биопленки другими видами бактерий в случае смешанной инфекции.
По результатам эксперимента можно отметить, что максимальная биомасса биопленок штаммов UPEC была зарегистрирована в диапазоне pH 6.0– 7.0 (рис. 3, а). При нейтральной реакции среды массивность биопленки была достоверно выше, чем при pH 5.0 и 8.0 ( W -test: p ≤ 0.05). Различий в биомассе биопленок, сформированных в слабокислой (pH 5.0) и слабощелочной (pH 8.0) среде не было обнаружено. В литературе встречаются противоречивые данные относительного уровня кислотности среды для биопленкообразования кишечной палочки, тогда как оптимум роста E. coli находится в диапазоне pH 6.0–8.0 [Schilling, 2008]. Так, в исследовании, проведенном J.C.M. Costa с соавт. [2014], биомасса биопленок E. coli , изолированных при маститах, была выше в диапазоне pH от 7.5 до 8.5, чем при pH 6.5 и 7.5, что возможно обусловлено их адаптивными свойствами [Costa et al., 2014].
а
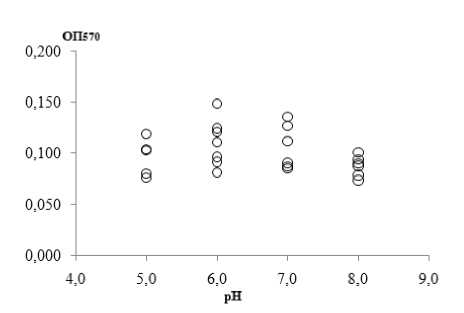
б
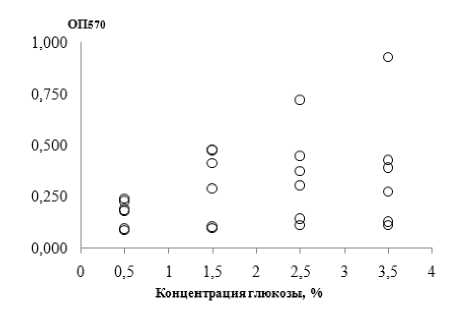
Рис. 3 . Биомасса биопленок клинических штаммов E. coli , сформированных при различных pH (а) и концентрациях глюкозы (б)
Уровень глюкозы в среде является важным фактором, определяющим эффективность размно- жения бактерий [Costa et al., 2014]. Известно, что у людей с сахарным диабетом выше риск развития ИМП из-за повышенной концентрации глюкозы в моче [Melecos, Naber, 2000; Grabe et al., 2015]. При увеличении количества основного питательного субстрата клетки E. coli, предположительно, должны формировать более массивные биопленки. Действительно, максимальная биомасса биопленок была выявлена при культивировании клинических штаммов E. coli в среде с концентрацией глюкозы 3.5% (0.376±0.300 ОЕ), а минимальная (0.168±0.065 ОЕ) – при 0.5% (рис. 3, б). Массивность сформированных биопленок достоверно различалась между концентрациями глюкозы 0.5 vs 1.5; 0.5 vs 2.5; 0.5 vs 3.5 (W-test: p≤0.05). При сравнении показателей биомассы биопленок, образованных при росте UPEC на богатой LB и минимальной ММ средах, выявлены существенные различия как для большинства штаммов, так и в группах. Так, биомасса биопленок была значительно выше в вариантах ММ + глюкоза в концентрации 1.5% (W-test: p=0.046), 2.5% (W-test: p=0.27) и 3.5% W-test: p=0.027), чем при росте на LB-среде. Ранее показано, что в минимальной среде увеличивалось удельное биопленкообразование UPEC, вероятно, обусловленное клеточным голоданием, индуцирующим формирование биопленки как механизма сохранения популяции [Adamus-Białek et al., 2015].
Заключение
Несмотря на то, что не все материалы в биомедицинской практике одинаково подвержены колонизации бакт ериями , любой катетер, не зависим о от срока его эксплуатации, является дополнительным фактором риска развития инфекции [Grabe et al., 2015]. Поиск и модификация материалов катетеров для предотвращения формирования бактериальных биопленок на их поверхности ведутся постоянно. С этой целью были созданы уретральные катетеры с серебряным и гидрогелевым покрытием, обработанные фосфорилхолином, импрегниро-ванные антибиотиками [Ahearn, 2000; Russell, 2000; Pickard et al., 2012], но их клиническая и экономическая эффективность окончательно не доказана.
Оценка биопленкообразования клиническими штаммами UPEC на полистироле и абиотических поверхностях медицинского назначения – латексе, поливинилхлориде (ПВХ), силиконе показала, что биопленки были массивнее на полистироле, чем на ПВХ и силиконе. Сформированные на поверхности урологических катетеров биопленки были массивнее на латексе, чем на ПВХ или силиконе. Гид-рофилизация атакованной поверхности приводила к снижению эффективности ее колонизации бактериями. Выявленная сильная положительная связь между биомассой биопленки и гидрофобностью клеточной стенки на гидрофобных носителях; она уменьшалась на более гидрофильных поверхностях. При этом корреляции между адгезивными свойствами и массивностью сформированных биопленок не выявлено, что может свидетельствовать о том, что влияние адгезинов имеет значение, в основном, при инициации процесса биопленкооб-разования. Кроме того, отсутствие связи между показателями, характеризующими биомассу биопленок, образованных на различных по гидрофильно-гидрофобным свойствам поверхностях, указывает на отсутствие универсального механизма биопленкообразования для UPEC. Число бактерий UPEC в составе биопленки было различно на всех поверхностях, максимальное количество жизнеспособных клеток обнаружено на полистироле и силиконе. Показано, что самые массивные биопленки были сформированы при концентрации глюкозы 3.5% и слабокислой или нейтральной pH.
Полученные результаты по колонизационной активнос ти UPEC в отношении ряда наиболее вос требованных в отечественн ой у рологической практике катетеров могут быть полезны для разработки способа профилактики катетер-ассоциированных ИМП.
Список литературы Формирование биопленок уропатогенными штаммами Escherichia coli на различных абиотических поверхностях
- Бондаренко В.М. и др. Генетические детерминанты патогенности Escherichia coli, изолированных из мочи и фекалий детей с различными клиническими вариантами инфекции мочевой системы//Журнал микробиологии, эпидемиологии и иммунобиологии. 2004. № 4. С. 3-7
- Grabe M. et al. Инфекции мочевыводящих путей у пациентов с почечной недостаточностью, после трансплантации почки, с сахарным диабетом и иммуносупрессией. Рекомендации Европейской ассоциации урологов//Урология и нефрология. Избранные вопросы нефрологии. 2015. № 6. С. 4-14
- Гриценко В.А. и др. Анализ взаимосвязи серорези-стентности и физико-химических свойств эшери-хий с их способностью образовывать биопленки//Курский научно-практический вестник «Человек и его здоровье». 2012. № 1. С. 10-13
- Данилов В.С. и др. Сенсорные биолюминесцентные системы на основе lux-оперонов разных видов люминесцентных бактерий//Вестник МГУ. Биология. 2002. № 3. С. 20-24
- Зорина А. С., Максимова Ю. Г. Иммобилизованные нитрилгидролизующие бактерии для систем биофильтрации//Российский иммунологический журнал. 2015. Т. 9(18), № 2(1). С.733-735
- Карпова Е.П. В фокусе -биопленки!//Детская оториноларингология. 2013. № 1. C. 34-35
- Коган М.И. и др. Микробный спектр мочи при ко-ралловадном нефролитиазе//Саратовский научно-медицинский журнал. 2011. № 3. С. 717
- Коваленко Г.А. и др. Приготовление и исследование нанопористых углеродных носителей на катализаторе Ni/сибунит//Кинетика и катализ. 2009. Т. 50, № 4. С. 618-626
- Коробов В.П. и др. Анализ чувствительности процессов формирования биопленок Staphylococcus epi-dermidis 33 к некоторым факторам внешней среды//Вестник Пермского университета. Сер. Биология. 2010. Вып. 1(1). С. 59-63
- Немец Е.А. и др. Образование биопленок штаммами госпитальной флоры, выделенными из биологических субстратов пациентов, на поверхности материалов и изделий медицинского назначения//Вестник трансплантологии и искусственных органов. 2013. Т. 15, № 4. С. 92-97
- Николаев Ю.А. Регуляция адгезии у бактерий Pseudomonas fluorescens под влиянием дистантных межклеточных взаимодействий//Микробиология. 2000. Т. 69, № 3. С. 356-361
- Перепанова Т.С. и др. Мочевая инфекция и биопленки//Эффективная фармакотерапия. Урология и нефрология. 2013. № 4. С. 26-30
- Пинегина О.Н. и др. Видовой состав микроорганизмов, образование биопленок и колонизация центральных венозных и уретральных катетеров//Проблемы медицинской микологии. 2013. Т. 15, № 4. С. 81-85
- Плакунов В.К., Николаев Ю.А. Микробные биопленки: перспективы использования при очистке сточных вод//Вода: химия и экология. 2008. № 5. С. 11-13
- Сергевнин В.И., Ключарева Н.М. Факторы риска и профилактика внутрибольничных катетер-ассоциированных инфекций мочевыводящих путей//Заместитель главного врача. 2016. № 4 (119). С. 82-85
- Степанов А.А. и др. Сканирующая электронная микроскопия биопленок уретральных и венозных катетеров//Проблемы медицинской микологии. 2014. Т. 16, № 4. С. 32-37
- Abdallah И.М.А et al. Biofilm forming bacteria isolated from urinary tract infection, relation to catheterization and susceptibility to antibiotics//International Journal Biotechnology Molecular Biology Research. 2011. Vol. 2. Р. 172-178
- Adamus-Biaiek W. et al. Analysis of uropathogenic Escherichia coli biofilm formation under different growth conditions//Acta Biochimica Polonica. 2015. Vol. 62, № 4. Р. 765-771
- Ahearm D. G. et al. Effect of hydrogel/silver coating on in vitro adhesion to catheters of bacteria associated with urinary tract infections//Current Microbiology. 2000. Vol. 41. Р. 120-125
- Cerca N. et al. Quantitative analysis of adhesion and biofilm formation on hydrophilic and hydrophobic surfaces of clinical isolates of Staphylococcus epi-dermidis//Research in Microbiology. 2005. Vol. 156 (4). P. 506-514
- Costa J. C.M. et al. Increase in biofi lm formation by Escherichia coli under conditions that mimic the mastitic mammary gland//Ciencia Rural. 2014. Vol. 44, №. 4. P. 666-671.
- Costerton J. W. et al. Microbial biofilms//Annual. Review Microbiology. 1995. Vol. 49. P. 711-745
- Ferrieres L. Escherichia coli strains during catheter-associated biofilm formation//FEMS Immunology and Medical Microbiology. 2007. Vol. 51 (1). Р. 212-219
- Ghigo J.M. Natural conjugative plasmids induce bacterial biofilm development//Nature. 2001. Vol. 412. P. 442-445
- Melecos M.D., Naber K.G. Complicated urinary tract infections//International Journal Antimicrobial Agents. 2000. Vol. 15. P. 247-256
- Nicolle L.E. Catheter associated urinary tract infections//Antimicrobial Resistance Infection Control. 2014. Vol. 3. P. 1-8
- O'Toole G.A., Kolter R. Flagellar and twitching mo-tility are necessary for Pseudomonas aeruginosa biofilm development//Molecular Microbiology. 1998. Vol. 30. P. 295-304
- Pagedar A. et al. Surface hydrophobicity, nutritional contents affect Staphylococcus aureus biofilms and temperature influences its survival in preformed biofilms//Journal of basic microbiology. 2010. Vol. 50. P. 98-106
- Pickard R. et al. Types of urethral catheter for reducing symptomatic urinary tract infections in hospitalised adults requiring short-term catheterisation: multicentre randomised controlled trial and economic evaluation of antimicrobial-and antiseptic-impregnated urethral catheters (the CATHETER trial)//Health Technology Assessment. 2012. № 16 (47). P. 1-197
- Romeo T. (ed.) Bacterial biofilms. Hidelberg: Springer, 2008. 295 р
- Rosenberg М. et al. Adherence of bacteria to hydrocarbons: A simple method for measuring cell surface hydrophobicity//FEMS Microbiology Letters. 1980. Vol. 9. P. 9-33
- Russell J.C. Bacteria, biofilm and devices: the role of Phosphorylcholine (pc) materials//Journal En-dourology. 2000. Vol. 14 (1). P. 39-42
- Schilling А.Т. The effect of pH on the bacterium E. coli. California State Science Fair, 2008
- Stickler D. Bacterial biofilms in patients with indwelling urinary catheters//Natural Clinical Practice Urology. 2008. Vol. 5, № 11.Р. 598-608
- Van Loosdrecht M. C.M et al. The role of bacterial cell wall hydrophobicity in adhesion//Applied Environmental Microbiology. 1987. Vol. 53 (8). P. 1893-1897


