Формирование кристаллов систем NH4C1+H20 и NH4CI+CuSO4+H2O
Автор: Фокин Андрей Владимирович, Брызгалов Александр Николаевич, Волков Петр Вячеславович
Рубрика: Физика
Статья в выпуске: 30 (206), 2010 года.
Бесплатный доступ
Экспериментально исследованы закономерности формирования кристаллов систем NH4Cl+H2O и NH4Cl+CuSO4+H2O. Выявлен переход кристаллов дендритной формы к ограненной путем замещения ионов (NH4)+ на Сu2+.
Кристалл, фрактал, кластер, мономер, размерности евклидовая и фрактальная
Короткий адрес: https://sciup.org/147158639
IDR: 147158639
Текст научной статьи Формирование кристаллов систем NH4C1+H20 и NH4CI+CuSO4+H2O
Среди множества кристаллов разной формы встречаются дендритные, обладающие высокой чувствительностью к воздействию среды. В данном случае рассматриваются кристаллы хлористого аммония с разветвленной дендритной формой при введении примесей двухвалентных ионов системы железа. По вопросу механизмов формирования указанных кристаллов имеются неоднозначные мнения. Для решения данного вопроса в кристаллы дендритной формы вводятся ионы двухвалентной меди Си2+, посредством которой изменяется структура и их физические свойства.
Из кристаллов дендритной формы следует выделить фрактальные кристаллические структуры. Теория фрактальной геометрии создана Бенуа Мандельбротом [1], в основу которой положены уравнения с параметрами фрактальной и евклидовой геометрии.
Термодинамический закон формирования ограненных кристаллов определяется уравнением
Кюри-Вульфа
Рис. 1. Завершение кристаллизации NH4CI
^ сгД = min, где а; - удельная поверхностная энергия, St - площадь /-й грани.
В процессе роста кристалл ограняется плоскостями с минимальной поверхностной энергией, а при достижении равновесия относительно среды определяется уравнением
Дендритные кристаллы фрактальной формы составлены из элементов подобных себе и формируются из кластера. По мере роста они раз ветвляются, суммарная площадь поверхности и энергия увеличиваются, а плотность уменьшается (рис. 1):
Р^; R^DrD"E где р(г) - плотность кластера, 7?о - радиус мономера, г - радиус кластера, Е, D - евклидовая и фрактальная размерности соответственно. Параметр Е для ограненных кристаллов определяется целым числом, a D - для фрактальных кристаллов дробным числом.
В данной работе возможность перехода фрактального кристалла в ограненный представлена экспериментально.

Рис. 2. Начало кристаллизации NH4CI
Эксперимент
Кристаллы системы NH4CI+H2O (рис. 2) получены из раствора путем испарения [2]. Ветви кристаллов в капле раствора распространяются от края к центру в направлении градиента концентрации. Имеются основные ветви с боковыми побегами.
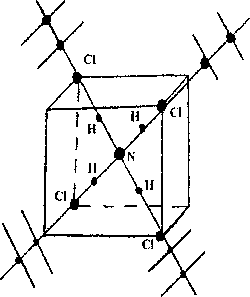
На рис. 3 представлена элементарная ячейка кристалла NH4CI кубической симметрии. В центре располагается ион МН4, в четырех вершинах ионы хлора [3]. Ионы хлора соединяются с ионами азота через водородные связи. В направлении больших диагоналей куба распространяются основные ветви кристалла с боковыми поверхностями под углом 89°. Для определения фрактального параметра D использовался клеточный метод: от центрального кластера проводились дуги с возрастающим радиусом до конца кристалла. В выделенных участках определялась плотность элементов кристалла. Плотность ветвей с удалением от центра уменьшалась в зависимости от концентрации примеси CuSO4. Для кристалла без примесей D: 1,52 ± 0,18. Согласно дробному значению параметра/), полученный дендрит является фрактальным, к которому можно применить формулы фрактальной геометрии.
Формирование кристаллов в системе Рис. 3. Элементарная ячейка кристалла
NH4C1+CuSO4+H2O NH4CI кубической симметрии
Ион NH4CI имеет тетраэдрическую координацию со гласно sp3-гибридизации электронных оболочек, что определяет положение окружающих его ионов СГ (рис. 3). В растворе CuSO4 разделяется на ионы Си2+ и SO4\ Ионы Си2+ замещают ионы МН4+ в тетраэдрической координации при расщеплении d-уровней иона Си2+ в кристаллическом поле по схеме:
d

dz2 d(x2 - y2)
dxy dzy dxz
При этом несколько изменяются положения ионов С1 и ветвей дендритов в ячейке.
Результаты эксперимента
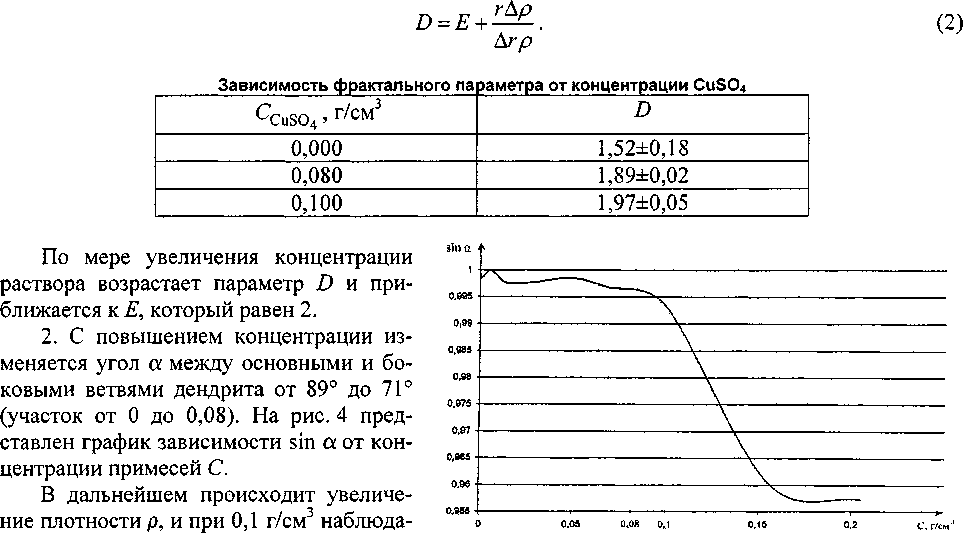
1. Изменения параметра D с концентрацией примесей ионов CuSO4 (см. таблицу) рассчитываются по формуле (2), полученной из формулы (1):
ем плотную скелетную структуру дендрита (рис. 5), затем - мономеры (рис. 6).
На участке от 0,15 до 2 проявляется
Рис. 4. Зависимость синуса угла между ветвями дендрита от концентрации примеси CuSO»
переход к ограненным кристаллам одной из кубической сингонии (рис. 7).
Фокин А.В., Брызгалов А.Н., Волков П.В.
Формирование кристаллов систем NH4CI*H2O и NH4CI+CuSO4+H2O
Системы NH4CI+CUSO4+H2O представляют собой твердый раствор примеси Си2+ в NH4C1

Рис. 5. Скелетная структура хлористого аммония, концентрация примеси 0,1 г/см3

Рис. 6. Мономер хлористого аммония при концентрации примеси 0,15 г/см3
Выводы
-
1. Рассмотрена структура и закономерности формирования дендритных кристаллов в системе NH4C1+H2O. Установлено, что дендритные кристаллы этой системы относятся к фрактальным.
-
2. Экспериментально показано, что в системе NH4CI+CUSO4+H2O происходит замещение центрального иона NR/ на ион Си2+.
-
3. По мере увеличения концентрации Си2+ в полученном твердом растворе меняется решетка кристалла, начиная с углов между дендритами, увеличивается плотность дендритов и постепенно фрактальный параметр D из дробного приближается к целому евклидовому Е.

Рис. 7. Кристалл хлористого аммония при концентрации примеси 0,2 г/см3
-
4. Согласно уравнению Мандельброта и экспериментальным результатам, представленным на графике (рис. 4), наблюдаем последовательное преобразование дендритного кристалла в ограненный.
Список литературы Формирование кристаллов систем NH4C1+H20 и NH4CI+CuSO4+H2O
- Mandelbrot, В. The Fractal Geometry of Nature/В. Mandelbrot. -N.-Y.: 1980. -237 p.
- Vassell, M. Electro-Optic Effect in NH4Cl/M. Vassell, E. Conwell//Phys. Rev. -1965. -V. 140.-A2110.
- Зарипов, М.М. Изменение ближайшего окружения ионов Сu2+ от концентрации в NH4Cl/М.М. Зарипов, Г.К. Чиркин, Л.А. Щербакова//Кристаллография. -1966. -Москва. -С. 457-459.


