Формы периодической кататонии при расстройствах шизофренического спектра: различия в уровнях активности тромбоцитарных ферментов
Автор: Бокша Ирина Сергеевна, Савушкина Ольга Константиновна, Прохорова Татьяна Андреевна, Терешкина Елена Борисовна, Воробьева Елена Анатольевна, Пискарв Михаил Валерьевич, Бурбаева Гульнур Шингожиевна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 2 (123), 2024 года.
Бесплатный доступ
Актуальность. Приступы периодической кататонии при шизофрении и других расстройствах шизофренического спектра представляют проблему для разработки дифференцированных индивидуальных терапевтических подходов. Цель исследования: сравнительный анализ уровней активности тромбоцитарных ферментов глутаматного, энергетического и глутатионового метаболизма у пациентов с различными клиническими формами приступов (гипо-, пара- и мультикинетической) периодической кататонии, формирующимися при шизофрении и расстройствах шизофренического спектра. Материал и методы. Исследование выполнено сотрудниками отдела по изучению пограничной психической патологии и психосоматических расстройств и лаборатории нейрохимии ФГБНУ НЦПЗ. В исследование включены пациенты (n=39) основной группы, из них 16 мужчин и 23 женщины, с гипокинетической, паракинетической и мультикинетической формами приступов периодической кататонии при шизофрении и расстройствах шизофренического спектра (шизоаффективном или шизотипическом) и добровольцы без диагностированных психических расстройств (n=22, 9 мужчин и 13 женщин) контрольной группы. Уровни активности ферментов (цитохром с-оксидазы, глутаматдегидрогеназы, активируемой фосфатом глутаминазы, глутатионредуктазы, глутатион-S-трансферазы) в экстрактах тромбоцитов пациентов основной группы и добровольцев контрольной группы определяли спектрофотометрическими кинетическими методами.
Расстройства шизофренического спектра, шизофрения, периодическая кататония, цитохром с-оксидаза, глутаматдегидрогеназа, активируемая фосфатом глутаминаза, глутатионредуктаза, глутатион-s-трансфераза, тромбоциты
Короткий адрес: https://sciup.org/142241566
IDR: 142241566 | УДК: 616.895.84-055.1-055.2,465?16/?57,:616-008.831 | DOI: 10.26617/1810-3111-2024-2(123)-13-23
Текст научной статьи Формы периодической кататонии при расстройствах шизофренического спектра: различия в уровнях активности тромбоцитарных ферментов
Анализ зарубежных и отечественных результатов нейрохимических исследований, в том числе проведенных в ФГБНУ НЦПЗ, показывает, что нарушение метаболизма нейромедиаторов, включая глутамат, вносит ключевой вклад в патогенез шизофрении и расстройств шизофренического спектра (РШС) [1, 2, 3, 4]. Кроме того, в качестве существенной составляющей патогенеза шизофрении рассматриваются митохондриальные аномалии (в аспектах нарушений энергетической и антиоксидантной систем) [5].
Однако прямые исследования патофизиологических механизмов в мозге при психических заболеваниях затруднены, поэтому в качестве биохимической модели рассматриваются тромбоциты периферической крови. Действительно, в тромбоцитах содержатся элементы глутаматной метаболической системы [6, 7], представленные её центральными ферментами глутаматдегидрогеназой и активируемой фосфатом глутаминазой, а также присутствуют ферменты митохондриальной дыхательной цепи, в том числе цитохром с- оксидаза. В работах сотрудников ФГБНУ НЦПЗ продемонстрирована информативность определения уровней активности тромбоцитарных ферментов - глутаматдегидрогеназы и цитохром с- оксидазы при расстройствах шизофренического спектра для индивидуальной предикции эффективности антипсихотической терапии больных эндогенными психозами [1, 8]. Помимо того, в тромбоцитах присутствуют ферменты - компоненты антиоксидантной глутатион-зависимой системы - глутатионредуктаза и глутатион-S-трансфраза. Глутатионредуктаза играет важную роль в поддержании пула восстановленного глутатиона, служащего субстратом глутатион-S-трансферазы. Глутатион-S-трансфераза представлена семейством ферментов, обезвреживающих ксенобиотики, а также эндогенные метаболиты, в том числе продукты перекисного окисления, конъюгируя их с восстановленным глутатионом. Устойчивость и чувствительность организма к любому воздействию, в частности к фармакотерапии, зависит от активности глутатион-S-трансферазы в совокупности с другими ферментами глутатионового обмена, включая глутати-онредуктазу. Отечественными [9] и зарубежными исследователями [10] обнаружена связь полиморфизма Р1-варианта гена, кодирующего глута-тион-S-трансферазу, с развитием тардивной дискинезии у больных шизофренией. Уровень глута-тион-S-трансферазы в спинномозговой жидкости снижен у больных шизофренией [11], таким образом, её активность может играть определенную роль в патогенезе, клинической картине РШЗ и в чувствительности к антипсихотической фармакотерапии. Ранее в исследовании, выполненном на базе лаборатории нейрохимии НЦПЗ, обнаружено снижение активности тромбоцитарных глутатионредуктазы и глутатион-S-трансферазы у больных с ультравысоким риском развития психоза (первые юношеские депрессии с аттенуированными симптомами шизофрении) [12], у пациентов с первым психотическим приступом [13], хронически текущей шизофренией и расстройствами шизофренического спектра [14] по сравнению с соответствующими контрольными группами.
Определение связей между уровнями активности цитохром с-оксидазы, глутаматдегидрогеназы, глутатион-S-трансферазы, глутатионредукта-зы в клетках крови и резистентностью / чувствительностью к антипсихотической терапии проводятся в ФГБНУ НЦПЗ при обследовании пациентов с РШС различных половозрастных групп, однако ранее внимание не было сосредоточено на синдроме кататонии, присутствующем у большинства пациентов с шизофренией и РШС. В ФГБНУ НЦПЗ проведены клинические исследования и разработана клиническая систематика форм приступов периодической кататонии (ФППК) при шизофрении и РШС [15, 16]. Так, двигательные расстройства при гипокинетической форме приступов периодической кататонии манифестируют в структуре затяжных депрессий с преобладанием тревожных и обсессивнокомпульсивных дименсий, реализующихся в клиническом континууме шизотипического расстройства. При паракинетической ФППК моторные феномены манифестируют в клинической картине психогенно спровоцированных затяжных истероаффективных психозов, дебютирующих в рамках шизоаффективного расстройства или приступообразной шизофрении. При мультикине-тической ФППК развитие выраженных клинических проявлений моторных расстройств наблюдается в структуре кататоно-параноидных и катато-но-онейроидных приступов в процессе течения параноидной шизофрении.
В свете новой предложенной клинической систематики ФППК представляет интерес поиск связи уровней активности ферментов крови (глутаматдегидрогеназа, глутатионредуктаза, глута-тион-S-трансфераза, активируемая фосфатом глутаминаза, цитохром с-оксидаза) с клиническими особенностями ФППК у больных шизофренией и РШС. В настоящей работе измерялись уровни активности ферментов глутаматного метаболизма - глутаматдегидрогеназы и активируемой фосфатом глутаминазы, энергетического метаболизма -цитохром с-оксидазы, глутатионовой антиоксидантной системы - глутатионредуктазы и глута-тион-S-трансферазы в тромбоцитах крови пациентов с шизофренией и РШС с тремя различными ФППК. Оценка активности этих ферментов в тромбоцитах крови больных, страдающих приступами периодической кататонии, проводилась впервые.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Сравнительный анализ уровней активности тромбоцитарных ферментов глутаматного, энергетического и глутатионового метаболизма у пациентов с различными ФППК (гипокинетической, паракинетической и мультикинетической), формирующимися при шизофрении и РШС.
МАТЕРИАЛЫ И МЕТОДЫ
Сравнительное клинико-биологическое обследование проведено совместно сотрудниками отдела по изучению пограничной психической патологии и психосоматических расстройств и лаборатории нейрохимии ФГБНУ НЦПЗ.
В основную группу исследования включены пациенты (n=39), из них 16 мужчин и 23 женщины, в возрасте 16-57 лет, медиана возраста 21 год [19; 27], с разными ФППК: гипокинетической, паракинетической и мультикинетической [16]. В основу классификации положена психопатологическая структура кататонических расстройств, коррелирующая со степенью тяжести двигательных симптомокомплексов.
Критерии включения: соответствие диагнозов рубрикам МКБ-10 шизофрения, шизоаффективное расстройство или шизотипическое расстройство (F20, F25, F21), приступообразное течение эндогенного заболевания, наличие в структуре текущего эпизода симптомов кататонии, которые определяли при помощи шкалы Буша-Френсиса для оценки тяжести моторных расстройств (BFCRS).
Критерии исключения: проявления тяжелого органического поражения ЦНС, психические нарушения вследствие употребления алкоголя или других психоактивных веществ, наличие тяжелой соматической патологии в стадии декомпенсации, наличие выраженных экстрапирамидных нарушений на момент поступления в стационар на фоне приема антипсихотических препаратов.
Практически у половины больных (n=19, 49%) из 39 было диагностировано шизотипическое расстройство, более чем у трети (n=14, 36%) - шизофрения, у 6 (15%) - шизоаффективное расстройство. Оценка выраженности кататонических расстройств и тяжести состояния проводилась перед началом курса фармакотерапии. Для количественной балльной оценки тяжести психического состояния и эффективности терапии были использованы шкалы PANSS и BFCRS.
В контрольную группу, соответствующую основной группе пациентов по возрастно-половому составу, вошло 22 добровольца без диагностированных психических расстройств (9 мужчин и 13 женщин) от 19 до 53 лет (медиана 25 лет).
Кровь на биохимические анализы отбирали до начала курса фармакотерапии больных. Выделение тромбоцитов из образцов венозной крови, взятой в вакутейнеры с цитратом натрия, и приготовление экстрактов из них проводили методами, описанными ранее [12].
Активность всех перечисленных ферментов определяли спектрофотометрическими кинетическими методами с использованием планшетного спектрофотометра xMark (Bio-Rad, США).
Активности глутаматдегидрогеназы (суммарная активность изоформ ГДГ I+II) и цитохром с-оксидазы определяли собственными оригинальными методами, описанными нами ранее [1].
Активность активируемой фосфатом глутаминазы в тромбоцитах определяли с использованием реакции гидролиза глутамина до глутамата, концентрацию которого измеряли в сопряженной реакции глутаматдегидрогеназы с восстановлением НАД+ по возрастанию оптической плотности при 340 нм [17].
Активности глутатионредуктазы и глутатион-S-трансферазы определяли описанными ранее методами: глутатионредуктазы - по окислению НАДФН в реакции восстановления окисленного глутатиона [13], глутатион-S-трансферазы - по скорости ферментативного образования конъюгатов глутатиона с 1-хлор-2,4-динитробензолом [12]. После определения концентрации белка по методу Лоури (с набором реактивов Bio-Rad, США) для всех ферментов рассчитывали удельную активность.
Первичные результаты наблюдения клиникопсихопатологической динамики у пациентов с шизофренией и РШС и биохимических исследований вносили в базу данных. Для статистической обработки данных использовали программное обеспечение Statistica 10.0 (Statsoft), непараметрический модуль (U-критерий Манна-Уитни), многомерный разведочный анализ (кластерный анализ методом каппа-средних). Различия и корреляции считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ
На первом этапе по клиническим признакам РШС (шизофрения, шизоаффективное и шизотипическое расстройства) сформированы группы пациентов, в которых проведено сравнение выявленных уровней активности ферментов. В соответствии с клиническими проявлениями симптомов кататонии выделены группы больных с тремя ФППК - гипокинетической (n=13), паракинетиче-ской (n=11) и мультикинетической (n=15).
В таблице 1 приведены медианы и квартили удельной активности ферментов (выраженные в ед/мг белка) в основной группе пациентов с тремя разными формами приступов периодической кататонии и в контрольной группе.
При парном сравнении с использованием U-критерия Манна-Уитни уровней активности ферментов у пациентов основной группы с каждой из ФППК и у добровольцев контрольной группы обнаружено, что активность цитохром с-оксидазы статистически значимо не различалась. Активность глутаматдегидрогеназы статистически значимо (p<0,05) снижена при всех трех ФППК, активность активируемой фосфатом глутаминазы снижена только при паракинетической форме.
Активности глутатионредуктазы и глутатион-S-трансферазы были статистически значимо (p<0,05) снижены только при гипокинетической форме, а активность глутатион-S-трансферазы статистически значимо (p<0,005) снижена также и при мультикинетической ФППК.
Таблица 1. Сравнительное распределение уровней активности тромбоцитарных ферментов в основной группе пациентов с разными формами приступов кататонии и в контрольной группе
|
Тро мбоцитарный ферме нт. сд/м г |
Форма приступов кататонии |
Контрольная группа(п=22) |
||
|
Гипокинетическая (п=!3) |
Паракинетическая (п=11) |
Мультикинетическая (п=15) |
||
|
Цитохром с-оксидаза |
4,7 [4,1; 5,61 |
4,4|4,3;5,2| |
4,8|3,7;6,4] |
5,2 (4,9; 6,3] |
|
Активируемая ^юсфатом глутаминаза |
24,9 |22,1; 38,7] |
21.9* [18.8: 29,3[ |
23,1 114,3;33,8| |
30.8 123.3; 44.11 |
|
Глута матде гидрогеназа |
5.0* [2,9; 6,2] |
5.5* [4,5; 6,1] |
5.8* [4,6; 6,4| |
6.4 [5,5; 7,4] |
|
Глутатионредуктаза |
7,6* [5,8; 8,0] |
9.4 |7,5; 11.8| |
8,2 (6.7; 10,0] |
9.1 [7.9; 11.11 |
|
Глу тат ио и S -тра нс (]) сраза |
12,3* [8,9; 15,8] |
12,9 |10.5: 17,0| |
12.2** [11.2; 13,9| |
16,6 113,4; 17,31 |
При м с ч а н и е. Статистически значимые различия: * - р<0,05, ** - р<0,01 (U-критерий Манна-Уитни).
На втором этапе исследования за основу были взяты показатели биохимического исследования. С применением кластерного анализа выделены кластеры пациентов.
Уровни удельной активности ферментов у пациентов основной группы продемонстрировали значительную вариабельность, значения находились в существенно различающихся диапазонах, поэтому перед проведением кластерного анализа полученные данные нормировали по максимуму активности каждого фермента в выборке [18]. Кластерный анализ основной группы пациентов включал кластеризацию случаев, осуществляемую по 5 признакам - нормированным уровням активности ферментов, таких как глутаматдегидрогеназа, глутатионредуктаза, глутатион-S-трансфераза, активируемая фосфатом глутаминаза, цитохром с -оксидаза).
По итогам кластеризации с предустановленным числом кластеров, равным 2, получены два кластера К1 (n=18) и К2 (n=21), сравнимые между собой по численности пациентов.
На рисунке 1 приведены средние нормированные значения активности каждого фермента для К1 и К2.
На рисунке 2 представлены диаграммы с ненормированными уровнями активности (выраженными в ед/мг) каждого из пяти ферментов в кластерах К1 и К2 у пациентов основной группы и добровольцев контрольной группы.
В выделенных кластерах К1 и К2 у пациентов основной группы по сравнению с контрольной группой обнаружено статистически значимое снижение уровней активности ферментов: в К1 -цитохром с -оксидазы и активируемой фосфатом глутаминазы (p<0,05), в К2 - глутаматдегидрогеназы, глутатионредуктазы и глутатион-S-трансферазы (p<0,001).
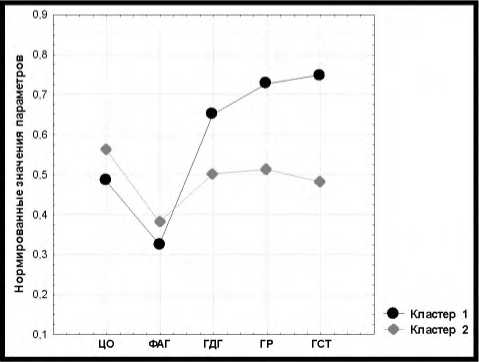
Рисунок 1. Средние значения нормированных биохимических параметров в кластерах
Оценено распределение пациентов с тремя различными ФППК по кластерам К1 и К2 (табл. 2).
Критерий х2 показал высокий уровень статистической значимости неравномерного распределения только для пациентов с гипокинетической и паракинетической ФППК (х2=12,3, р<0,004 с поправкой Йетса). То есть пациенты с гипокинетической ФППК статистически значимо чаще попадали в К2 (с активностями глутаматдегидрогеназы, глутатионредуктазы и глутатион-S-трансферазы, значимо сниженными относительно добровольцев контрольной группы). Пациенты с паракинетической ФППК значимо чаще попадали в К1 со сниженными активностями цитохром с-оксидазы и активируемой фосфатом глутаминазы по сравнению с добровольцами контрольной группы. В то время как пациенты с мультикине-тической ФППК равномерно распределились между кластерами К1 и К2.
Активность цитохром с-оксидазы, Ед/мг
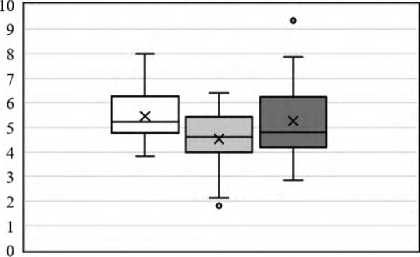
□ Контроль □ Кластер 1 ■ Кластер 2
.Активность глутаминазы.
активируемой фосфатом, Ед/мг
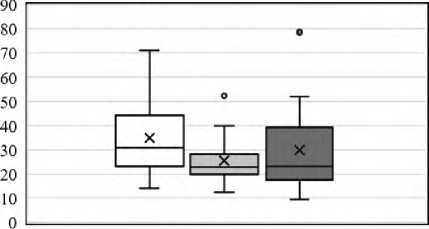
□ Контроль □ Кластер 1 ■ Кластер 2
Активность глутаматдегидрогеназы, Ед/мг
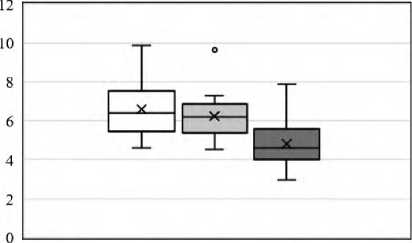
□ Контроль □ Кластер 1 ■ Кластер 2
Активность глутатионредуктазы, Ед/мг
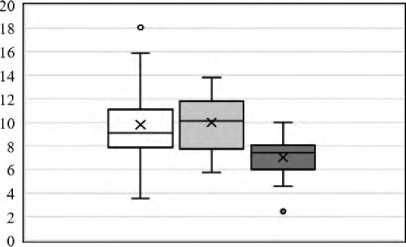
□ Контроль □ Кластер 1 □ Кластер 2
Активность глутатион S-трансферазы, Ед/мг
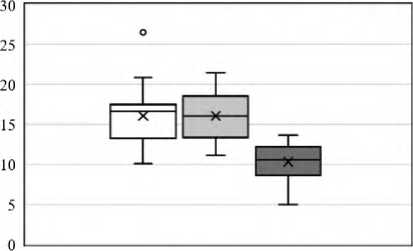
□ Контроль □ Кластер I ■ Кластер 2
Рисунок 2. Активность тромбоцитарных ферментов у больных основной группы с разными формами кататонических приступов и у добровольцев контрольной группы
Таблица 2. Сравнительное распределение пациентов основной группы с разными формами приступов кататонии по кластерам К1 и К2
|
Кластер |
Форма приступов кататонии (число пациентов и % от их числа в кластере) |
||
|
Г и по кинетическая (п=13) |
Пара кинетическая (п=! 1) |
Мульти кинетическая (11=15) |
|
|
К1 (11=18) |
п=4 (22%) |
11=7 (39%) |
11=7 (39%) |
|
К2 (п=21) |
п=9 (43%) |
п=4 (19%) |
п=8 (38%) |
ОБСУЖДЕНИЕ
По материалам собственного исследования впервые удалось обнаружить вариативную картину биохимических изменений (относительно контрольной группы) в тромбоцитах при разных ФППК. Это удалось сделать с использованием двух подходов: 1) выделение трех групп пациентов с учетом клинико-психопатологической симптоматики РШС, оцениваемой в динамике, и обнаружение биохимических отклонений в группах пациентов с разными ФППК от значений в контрольной группе; 2) выделение двух групп пациентов по биохимическим признакам и обнаружение асимметричного неравномерного распределения пациентов в зависимости от ФППК.
Кроме того, в настоящем исследовании при сравнении группы больных с РШС в целом и контрольной группы добровольцев было обнаружено статистически значимое снижение уровней активности глутаматдегидрогеназы в тромбоцитах крови, что согласуется с полученными ранее данными при обследовании больных шизофренией без фокуса на кататонию. Действительно, нарушения функционирования глутаматергической системы занимают важнейшее место в патогенезе шизофрении [4], а глутаматдегидрогеназа является ключевым ферментом метаболизма глутамата, причем уровень активности тромбоцитарной глутаматдегидрогеназы может служить биомаркером, не только связанным с клинико-психопатологической симптоматикой, но и её изменением под действием фармакотерапии [1]. Так, ранее нами установлено снижение активности глутаматдегидрогеназы в тромбоцитах больных шизофренией с хроническим течением заболевания в период обострения психотической симптоматики [1]. Обнаружено снижение уровней активности глутаматдегидрогеназы и у больных с юношескими депрессиями с аттенуированными симптомами шизофрении [12] по сравнению с соответствующими контрольными группами.
Исследования по изучению активности активируемой фосфатом глутаминазы в тромбоцитах у пациентов с РШС и периодической кататонией ранее не проводились. В соответствии с полученными данными можно констатировать статистически значимое снижение активности активируемой фосфатом глутаминазы как в общей группе больных, так и в группе пациентов с паракинети-ческой кататонией. С другой стороны, при распределении больных на кластеры по биохимическим признакам в кластер К1, характеризующийся сниженной активностью активируемой фосфатом глутаминазы, выявлена статистически значимо более высокая частота пациентов с паракине-тической формой кататонии.
В ряде исследований зарегистрированы изменения активности различных компонентов дыхательной цепи митохондрий в тромбоцитах у пациентов с шизофренией. Так, в ранее опубликованных работах в тромбоцитах пациентов с шизофренией было обнаружено повышение активности митохондриального комплекса I, но не цитохром с-оксидазы (комплекса IV) [19]. Другие исследователи выявили разнонаправленное изменение активности комплекса I в тромбоцитах пациентов, а именно статистически значимое повышение в остром состоянии и снижение его активности у пациентов с резидуальными симптомами [20]. Ранее мы обнаружили снижение активности цитохром с-оксидазы тромбоцитов в острой психотической фазе заболевания у пациентов с хроническим течением шизофрении в сравнении с контрольной группой [21], в то же время в недифференцированной группе больных с юношескими депрессиями с аттенуированными симптомами шизофрении активность цитохром с -оксидазы значимо не отличалась от контрольной группы [12].
Хотя в настоящем исследовании в недифференцированной группе пациентов в целом мы не обнаружили значимых изменений в активности цитохром с -оксидазы по сравнению с контрольной группой, однако при выделении кластера К1 активность цитохром с -оксидазы в нем оказалась статистически значимо пониженной. Это может быть связано с тем, что в этот кластер статистически значимо чаще попадали пациенты с пара-кинетической ФППК. Фактически при выделении по клиническому признаку группы пациентов с паракинетической ФППК медиана активности цитохром с -оксидазы в данной группе (4,4 ед/мг) оказалась ниже, чем в контрольной (5,2 ед/мг), но различие не достигло статистической значимости. Мы считаем настоящее исследование пилотным ввиду малочисленности группы с паракинетиче-ской ФППК (11 пациентов), что представляет ограничение исследования. Окончательный вывод о снижении активности цитохром с -оксидазы при паракинетической ФППК можно будет сделать при условии увеличения группы.
Еще одним фактором развития многих психических заболеваний, в том числе и шизофрении, признан окислительный стресс. В настоящем исследовании в недифференцированной группе больных РШС с периодической кататонией оказались статистически значимо сниженными уровни активности глутатион-зависимых ферментов глутатионредуктазы и глутатион-S-трансферазы по сравнению с контрольной группой, что указывает на участие окислительного стресса в развитии патологического процесса. Ранее мы уже наблюдали снижение активности глутатион-зависимых ферментов в тромбоцитах у больных с РШС [13] и параноидной шизофренией с хроническим течением заболевания [22], а в настоящем исследовании обнаружены особенности изменений активности глутатионредуктазы и глутатион-8-трансферазы в зависимости от ФППК. Так, у больных с гипокинетической кататонией снижена активность глутатионредуктазы и глу-татион-S-трансферазы, с мультикинетической формой - только активность глутатион-8-трансферазы, в то же время у пациентов с пара-кинетической ФППК уровни активности обоих ферментов не отличаются от уровня контрольной группы. С другой стороны, в кластер К2 со сниженными активностями обоих ферментов вошло значимо больше пациентов с гипокинетической ФППК.
Неоднородность периодической кататонии представляет проблему как для терапии, так и для прогноза состояния пациентов, что весьма важно, учитывая возможную резистентность пациентов. Представляется актуальным выделение более гомогенных групп (классификации внутри выборки в целом) больных на основе биохимических параметров крови (активности ферментов тромбоцитов) с целью разработки индивидуальных подходов к терапии больных с РШС, страдающих приступами периодической кататонии.
ЗАКЛЮЧЕНИЕ
При разных ФППКнаблюдается гетерогенная степень отклонения активности тромбоцитарных ферментов от контрольных диапазонов. Параки-нетическая и гипокинетическая ФППК, по-видимому, ассоциированы с разными картинами изменений активности изученных ферментов глутаматного, энергетического и глутатионового метаболизма. Дальнейшее исследование активности ферментов крови у пациентов с кататоническими расстройствами является перспективным для выявления специфических биомаркеров различных ФППК.
В статье приведено сокращенное обозначение терминов: РШС - расстройства шизофренического спектра, ФППК - формы приступов периодической кататонии.
Список литературы Формы периодической кататонии при расстройствах шизофренического спектра: различия в уровнях активности тромбоцитарных ферментов
- Savushkina OK, Tereshkina EB, Prokhorova TA, Boksha IS, Burminskii DS, Vorobyeva EA, Morozova MA, Burbaeva GS. Platelet glutamate dehydrogenase activity and efficacy of antipsychotic therapy in patients with schizophrenia. J Med Biochem. 2020 Jan 10;39(1):54-59. doi: 10.2478/jomb-2019-0018. PMID: 32549778; PMCID: PMC7282235.
- Egerton A, Grace AA, Stone J, Bossong MG, Sand M, McGuire P. Glutamate in schizophrenia: Neurodevelopmental perspectives and drug development. Schizophr Res. 2020 Sep;223:59-70. doi: 10.1016/j.schres.2020.09.013. Epub 2020 Oct 16. PMID: 33071070.
- Dogra S, Conn PJ. Metabotropic Glutamate Receptors As emerging targets for the treatment of schizophrenia. Mol Pharmacol. 2022 May;101(5):275-285. doi: 10.1124/molpharm.121.000460. Epub 2022 Mar 3. PMID: 35246479; PMCID: PMC9092465.
- Uno Y, Coyle JT. Glutamate hypothesis in schizophrenia. Psychiatry Clin Neurosci. 2019 May;73(5):204-215. doi: 10.1111/pcn.12823. Epub 2019 Mar 6. PMID: 30666759.
- Rajasekaran A, Venkatasubramanian G, Berk M, Debnath M. Mitochondrial dysfunction in schizophrenia: pathways, mechanisms and implications. Neurosci Biobehav Rev. 2015 Jan;48:10-21. doi: 10.1016/j.neubiorev.2014.11.005. Epub 2014 Nov 15. PMID: 25446950.
- Asor E, Ben-Shachar D. Platelets: A possible glance into brain biological processes in schizophrenia. World J Psychiatry. 2012 Dec 22;2(6):124-33. doi: 10.5498/wjp.v2.i6.124. PMID: 24175178; PMCID: PMC3782191.
- Baier PC, Koch JM, Seeck-Hirschner M, Ohlmeyer K, Wilms S, Aldenhoff JB, Hinze-Selch D. A flow-cytometric method to investigate glutamate-receptor-sensitivity in whole blood platelets ‒ results from healthy controls and patients with schizophrenia. J Psychiatr Res. 2009 Mar;43(6):585-91. doi: 10.1016/j.jpsychires.2008.07.005. Epub 2008 Aug 20. PMID: 18718602.
- Прохорова Т.А., Бокша И.С., Савушкина О.К., Терешкина Е.Б., Воробьева Е.А., Помыткин А.Н., Каледа В.Г., Бурбаева Г.Ш. Активность тромбоцитарной глутаматдегидрогеназы у больных с эндогенными психозами. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016. Т. 116, № 3. С. 44-48. doi: 10.17116/jnevro20161163144-48.
- Иванова С.А., Бойко А.С., Федоренко О.Ю., Щигорева Ю.Г., Рудиков Е.В., Бородюк Ю.Н., Семке А.В., Бохан Н.А. Полиморфизм гена фермента глутатион-S-трансферазы двигательные нарушения у больных шизофренией. Фундаментальные исследования. 2013. № 9 (часть 4). С. 650-654.
- Kang SG, Lee HJ, Choi JE, An H, Rhee M, Kim L. Association study between glutathione S-transferase GST-M1, GST-T1, and GST-P1 polymorphisms and tardive dyskinesia. Hum Psychopharmacol. 2009 Jan;24(1):55-60. doi: 10.1002/hup.988. PMID: 19051221.
- Do KQ, Trabesinger AH, Kirsten-Krüger M, Lauer CJ, Dydak U, Hell D, Holsboer F, Boesiger P, Cuénod M. Schizophrenia: glutathione deficit in cerebrospinal fluid and prefrontal cortex in vivo. Eur J Neurosci. 2000 Oct;12(10):3721-8. doi: 10.1046/j.1460-9568.2000.00229.x. PMID: 11029642.
- Савушкина О.К., Бокша И.С., Омельченко М.А., Терешкина Е.Б., Прохорова Т.А., Воробьева Е.А., Бурбаева Г.Ш. Активность ферментов глутаматного, энергетического и глутатионового обмена при первых юношеских депрессиях с аттенуированными симптомами шизофрении. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022. Т. 122, № 8. С. 136-144. doi: 10.17116/jnevro2022122081136.
- Прохорова Т.А., Терешкина Е.Б., Савушкина О.К., Бокша И.С., Воробьева Е.А., Омельченко М.А., Помыткин А.Н., Каледа В.Г., Бурбаева Г.Ш. Активность ферментов глутатионового обмена в форменных элементах крови у пациентов с высоким риском манифестации эндогенных психозов и больных с первым психотическим приступом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019. Т. 119, № 4. С. 47-54. doi:10.17116/jnevro201911904147.
- Терешкина Е.Б., Савушкина О.К., Бокша И.С., Прохорова Т.А., Воробьева Е.А., Омельченко М.А., Помыткин А.Н., Каледа В.Г., Бурбаева Г.Ш. Глутатионредуктаза и глутатион-S-трансфераза в форменных элементах крови при шизофрении и расстройствах шизофренического спектра. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019. Т. 119, № 2. С. 61-65. doi:10.17116/jnevro201911902161.
- Пискарёв М.В., Лобанова В.М., Румянцева Е.Б. Кататония в структуре аффективных и шизоаффективных расстройств послеродового периода. Психиатрия. 2023. Т. 21, № 3. С. 54-63. doi:10.30629/2618-6667-2023-21-3-54-63.
- Пискарев М.В., Лобанова В.М., Ильина Н.А. Периодическая кататония при расстройствах шизофренического спектра. Журнал неврологии и психиатрии им. С.С. Корсакова 2023. Т. 123, № 8. С. 98-106. doi.org/10.17116/jnevro202312308198.
- Curthoys NP, Weiss RF. Regulation of renal ammoniagenesis. Subcellular localization of rat kidney glutaminase isoenzymes. J Biol Chem. 1974 May 25;249(10):3261-6. PMID: 4364420.
- Смородинский С.С., Батин Н.В. Методы анализа и принятия решений в слабоструктурированных задачах: учебное пособие по курсу «Методы и системы принятия решений» для студентов специальности «Автоматизированные системы обработки информации». Минск: Изд-во «Белорусский государственный университет информатики и радиоэлектроники», 2002. 116 с.
- Ben-Shachar D, Zuk R, Gazawi H, Reshef A, Sheinkman A, Klein E. Increased mitochondrial complex I activity in platelets of schizophrenic patients. Int J Neuropsychopharmacol. 1999 Dec;2(4):245-253. doi: 10.1017/S1461145799001649. PMID: 11285140.
- Dror N, Klein E, Karry R, Sheinkman A, Kirsh Z, Mazor M, Tzukerman M, Ben-Shachar D. State-dependent alterations in mitochondrial complex I activity in platelets: a potential peripheral marker for schizophrenia. Mol Psychiatry. 2002;7(9):995-1001. doi: 10.1038/sj.mp.4001116. PMID: 12399953.
- Burbaeva G Sh, Boksha I S, Turishcheva M S, Savushkina O K, Beniashvili A G, Rupchev GE, Morozova MA. Platelet cytochrome c-oxidase activity in patients with acute schizophrenia in the course of their treatment with risperidone. Health. 2011Jan; 3(1):13-19. doi: 10.4236/health.2011.31003
- Савушкина О.К., Бокша И.С., Прохорова Т.А., Терешкина Е.Б., Бурминский Д.С., Морозова М.А., Воробьева Е.А., Бурбаева Г.Ш. Активность эритроцитарных и тромбоцитарных глутатионредуктазы и глутатион-S-трансферазы при параноидной шизофрении. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018. Т. 129, № 11. С. 48-52. doi:10.17116/jnevro201811811148.


