Фрагментация фосфопептидов методом ECD / ETD в современной тандемной масс-спектрометрии
Автор: Краснов Илья Александрович, Гаврик М.А., Подольская Е.П., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия
Статья в выпуске: 1 т.23, 2013 года.
Бесплатный доступ
В работе изложены возможности и указаны области применения методов фрагментации пептидов в тандемной масс-спектрометрии, в особенности фрагментации фосфопептидов методами CID, ECD и ETD, а также их комбинациями. Проанализированы механизмы образования фрагментов, методики пробоподготовки и ввода пробы применительно к методу ECD/ETD. Показана возможность использования общих баз данных по фрагментам пептидов для решения задач фосфопротеомики. Сделан вывод об эффективности применения комбинации методов фрагментации CID/ETD для расширения возможностей по восстановления аминокислотных последовательностей фосфопептидов.
Масс-спектрометрия, тандемная масс-спектрометрия, источник ионов, фрагментация, фосфопептиды, протеомика
Короткий адрес: https://sciup.org/14264843
IDR: 14264843 | УДК: 543.51;
Текст обзорной статьи Фрагментация фосфопептидов методом ECD / ETD в современной тандемной масс-спектрометрии
В работе изложены возможности и указаны области применения методов фрагментации пептидов в тандемной масс-спектрометрии, в особенности фрагментации фосфопептидов методами CID, ECD и ETD, а также их комбинациями. Проанализированы механизмы образования фрагментов, методики пробоподготовки и ввода пробы применительно к методу ECD/ETD. Показана возможность использования общих баз данных по фрагментам пептидов для решения задач фосфопротеомики. Сделан вывод об эффективности применения комбинации методов фрагментации CID/ETD для расширения возможностей по восстановления аминокислотных последовательностей фосфопептидов.
Кл. сл. : масс-спектрометрия, тандемная масс-спектрометрия, источник ионов, фрагментация, фосфопептиды, протеомика
ВВЕДЕНИЕ фрагментации. Для фрагментных ионов пептидов принята классификация, предложенная в 1984 г.
Масс-спектрометрия на сегодняшний день является одним из наиболее востребованных инструментальных методов анализа во многих областях науки. Масс-спектрометры (МС) как основной инструмент метода нашли самое широкое применение во многих областях современных наук — химии (биохимия, нефтехимия, аналитическая химия), фармацевтике, медицине, криминалистике, металлургии, защите окружающей среды и многих других. Широкое применение масс-спектрометрия нашла в различных аспектах "науки о жизни" (life science), которая включает в себя технологические аспекты молекулярной биологии и биотехнологии, что хорошо представлено в целом ряде книг и обзоров, например [1, 2].
Отдельно можно выделить тандемные масс-спектрометры (МС-МС), состоящие из двух или более масс-спектрометров, которые широко применяются в области протеомики [3]. В каждый момент времени из всех ионов, образующихся в источнике, для последующей фрагментации отбираются ионы только с одного соединения с заданным отношением массы к заряду. Такая селекция производится при помощи специально разработанных алгоритмов (Data Dependent Acquisition, DDA) на основе обработки данных масс-спектра родительских ионов. Данные одного МС-МС-анализа, как правило, содержат множество фраг-ментных масс-спектров, каждый из которых характеризует фрагменты только одного соединения. Состав фрагментов отражает структуру анализируемого вещества и напрямую зависит от способа в работе [4], в соответствии с которой фрагменты, содержащие N-концевую аминокислоту, в зависимости от разорванной связи обозначают латинскими буквами a, b и c. Подобно этому фрагменты C-конца обозначены x, y и z.
Несмотря на успехи тандемной МС в области протеомики, классические методы фрагментации пептидных ионов зачастую не позволяют получать полную информацию о посттрансляционных модификациях (ПТМ) белков и пептидов. Именно эта информация в настоящее время становится важной для исследований многих биологических процессов. В частности, фосфорилирование белков регулирует межклеточные взаимодействия, пролиферацию, дифференциацию и апоптоз клеток. Последствиями дефектов в процессах фосфорилирования-дефосфорилирования часто становятся различные заболевания, что также повышает важность расширения понимания процессов фосфорилирования. Альтернативным методом фрагментации пептидов, сохраняющим ПТМ в интактном состоянии, является диссоциация с захва-том/переносом электрона, применение которой имеет некоторые особенности, обсуждаемые в представленном обзоре.
ИНСТРУМЕНТАЛЬНЫЕ ОСНОВЫ ТАНДЕМНОЙ МАСС-СПЕКТРОМЕТРИИ
Первые спектры аминокислот, полученные группой Бимана (Biemann) в 1958 г., подтвердили возможность использования методов масс-спек- трометрии для анализа простых пептидов и аминокислот [5]. Дальнейшее развитие масс-спектрометрии пептидов пошло по пути внедрения новых на тот момент методов ионизации — химической ионизации (ХИ, CI), полевой десорбции (ПД, PD), полевой ионизации (ПИ, FI) и электронного удара (ЭУ, EI) в комбинации с газовой хроматографией (ГХ, GC) [6].
Источники ионов с ЭУ давали богатые фраг-ментные спектры, позволяющие получить информацию о структуре вещества, сравнивая информацию с библиотечными спектрами органических соединений. Данный метод позволял получать информацию вплоть до расшифровки отдельных последовательностей белков, подвергнутых гидролизу и переводу в летучее состояние с помощью химической модификации [7]. Источники ионов с ХИ позволяли получать пики протонированных молекулярных ионов аминокислот, проводя их уверенную идентификацию [8], а фрагментация носит индивидуальный характер и зависит от структуры самой аминокислоты и температуры источника. Возможности методов ХИ сильно ухудшаются при переходе к полипептидам, поскольку те отличаются высокой термолабильностью и различные виды дериватизации помогают процессу идентификации только простых цепочек аминокислот [9].
Серьезный прорыв в анализе пептидов и белков был достигнут только с разработкой методов мягкой ионизации. Исторически одним из первых методов мягкой ионизации стал метод плазменной десорбции (ПД) [10]. Этот метод позволял проводить уверенную идентификацию одиночных белков при получении отрицательных молекулярных ионов и даже отдельных нуклеотидов. Делались и множественные попытки адаптировать метод вторично-ионной масс-спектрометрии (ВИМС, Secondary Ion Mass Spectrometry, SIMS) для нужд анализа органических соединений [11]. Однако распространения этот метод не получил вследствие деформации поверхностной кристаллической решетки анализируемого вещества при бомбардировке ионами и уступил место созданному в 80-х гг. более совершенному методу ионизации пептидов бомбардировкой быстрыми атомами (ББА) [12], который фактически стал первым методом, позволявшим определять последовательность аминокислот без дериватизации.
Методы анализа пептидов и белков вышли на новый уровень с развитием действительно мягких методов ионизации, таких как матричная лазерная десорбционная ионизация (МЛДИ, MALDI) [13] и электрораспыление (ЭРИАД, ESI) [14, 15]. Эти методы позволили достигнуть рекордных показателей по чувствительности (уровень аттомолей), работать с гетерогенными образцами, определять белки массой 100 000 Да с погрешностью менее 0.5 % (МЛДИ), а также обеспечить хорошую стыковку с ЖХ, получать многозарядные ионы пептидов и белков весом в миллионы дальтон (ЭРИАД).
Исторически первые тандемные МС-МС приборы пришли из атомной физики, где использовались для исследований точного изотопного состава [16]. Конструктивно они представляли собой каскад из двух анализаторов — магнитного и секторного с ячейкой фрагментации с разреженным газом между ними. Родительские ионы выделялись в магнитном каскаде прибора, а затем, проходя через ячейку фрагментации, анализировались по массе в электростатическом каскаде. Дальнейшее увеличение чувствительности метода МС-МС-анализа (до аттомольного уровня) стало возможно с появлением в 70-х гг. прибора, построенного по системе 3 квадруполей (тройной квадруполь, 3Q) [17], и позднее — ионной ловушки (ion trap, ITMS) [18], включая более позднюю разновидность — линейную ионную ловушку (linear ion trap, LIT) [19]. Данные тандемные приборы позволяли не только получать спектр родительских и дочерних ионов, но и проводить структурные исследования за счет оценки потерь нейтральных частиц при прохождении фрагментации во втором квадруполе. Несмотря на некоторые недостатки (достаточно узкий массовый диапазон, небольшой динамический диапазон, низкие массовую точность и разрешающую способность), тройной квадруполь и ионная ловушка являются одними из самых распространенных приборов для решения задач протеомики.
Для увеличения разрешающей способности и массовой точности был предложен другой тип тандемного МС, в котором в приборе с тройным квадруполем последний квадруполь был заменен на времяпролетный масс-анализатор (ВПА) [20]. Прибор получил название Q-ВПМС (Q-TOF). Такая замена преследовала несколько целей — увеличить скорость записи спектров второй ступенью (до 20 спектров в секунду), повысить разрешающую способность (до 20000–40000) и массовую точность (до 2–3 ppm). Повышение разрешения позволило снизить пороги обнаружения, маскируемые химическим фоном, и улучшить скорость и достоверность идентификации в несколько раз. Замена первой ступени на ВПА-анализатор привела к созданию тандемного прибора ВПА-ВПА (TOF-TOF) с МЛДИ-источником [21]. Этот тип тандемного МС характеризуется умеренной чувствительностью (до одного фемтомоля) и невысокой селекцией в первой ступени (порядка 100), однако хорошо совместим с источниками типа МЛДИ. Дальнейшее развитие TOF-TOF приборов привело к созданию тандемного МС из двух ВПА [22, 23], в котором реализован принципиально но- вый режим "вложенных времен": медленное разделение родительских ионов в первом анализаторе происходит на миллисекундной временнóй шкале, а быстрая фрагментация и быстрый масс-анализ фрагментов во втором анализаторе — на микросе-кундной шкале. Режим вложенных времен позволяет осуществлять так называемый "параллельный анализ" фрагментных спектров для всех родительских ионов в рамках единичного цикла разделения в первом ВПА.
Наиболее высокоразрешающими тандемными приборами в настоящий момент являются МС, использующие преобразование Фурье: ион-циклотронного резонанса ИЦР (ICR FTMS) [24] и масс-анализатора с орбитальным удержанием ионов в электростатическом поле коаксиальных электродов, или "Орбитрэп" (Orbitrap) [25]. ИЦР-анализатор позволяет достигать рекордного значения разрешающей способности, порядка 1000 000 и более, и предела обнаружения менее 1 аттомоль. В тандемном МС с анализатором "Орбитрэп" можно получить разрешающую способность порядка 100000 с высокой массовой точностью порядка 1–2 ppm. В обоих МС ловушка используется для выделения, фрагментации, получения спектра родительских ионов и удаления наиболее интенсивных пиков в спектре, а анализатор — для получения спектра дочерних ионов высокого разрешения (100 000–500 000) с высокой массовой точностью порядка 1 ppm. Вместе с тем к недостаткам приборов данного класса можно отнести высокую стоимость, большие габариты (особенно ИЦР-анализаторы) и длительное время записи спектров в полном массовом диапазоне.
На сегодняшний день для анализа сложных смесей пептидов и белков применяется целый ряд тандемных МС с двумя основными типами источников ионов — МЛДИ и электроспрей. В каждом из этих МС возможна реализация нескольких типов фрагментации первичных ионов в зависимости от выбранной стратегии анализа.
ОСНОВНЫЕ МЕТОДЫ ФРАГМЕНТАЦИИ ИОНОВ В ТАНДЕМНЫХ МС
Индуцированная поверхностью диссоциация (SID)
В методе индуцированной поверхностной диссоциации (surface-induced dissociation, SID) фрагментация происходит при столкновение пучка родительских ионов с поверхностью, при которой происходит образование структурно значимых фрагментных ионов [26, 27]. Степень фрагментации в данном методе может легко регулироваться энергией подаваемого пучка родительских ионов (10–200 эВ). Особенностью метода является высо- кая эффективность конвертирования кинетической энергии во внутреннюю, что позволяет проводить исследования механизмов фрагментации ионов благодаря точному контролю всех параметров эксперимента [28]. Однако в рутинной работе приборы, оснащенные SID-ячейками, применения не нашли. Отчасти это вызвано частичной нейтрализацией родительских ионов при столкновении с фрагментирующей поверхностью, а также образованием заряженных фрагментов поверхности [29].
Фрагментация в источнике ионов (in-source СID)
Фрагментация в источнике ионов (in-source collision-induced dissociation, isCID) — вариант низкоэнергетической фрагментации в источнике ионов "электроспрей", основанный на передаче дополнительной энергии фрагментируемым ионам при их переходе из области атмосферного давления в область низкого вакуума [30]. Установлено, что при повышении напряженности электрического поля в области интерфейса ввода образца в МС увеличивается степень фрагментации исследуемых ионов [31]. Регулировать степень диссоциации можно, изменяя разницу потенциалов между капилляром и скиммером (отбирающим электродом), а в случае улучшенной системы скиммера — между соплом и скиммером [32]. С помощью данного вида фрагментации были получены фраг-ментные масс-спектры пестицидов, лекарственных соединений и пептидов [33]. Дальнейшие работы показали, что дочерние ионы, образующиеся в данном методе, для конкретных соединений аналогичны получаемым в тандемных МС c ячейками фрагментации на основе столкновительной диссоциации (collision-induced dissociation, CID) [34]. Достоинством данного метода является возможность получения фрагментных ионов внутри источника без дополнительной ячейки фрагментации, что позволяет применять его и на обычных, не тандемных МС.
Фрагментация в источнике ионов была применена при анализе сложных биологических образцов, согласно принципам "Шот ган протеомики" (Shotgun Proteomics) с применением длительного ВЭЖХ-разделения [35]. Данный метод реализуем во всех МС, оборудованных источниками ионов "электроспрей", однако широкого распространения не получил.
Столкновительная диссоциация (CID)
Метод фрагментации пептидов "столкнови-тельная диссоциация" (collision-induced dissociation, CID) на данный момент является наиболее распространенным в тандемной МС [36]. В данном методе протонированные пептиды ускоряют- ся электромагнитным полем в вакуумной области МС, а затем подвергаются столкновению с молекулами инертного газа (обычно гелием, азотом или аргоном). Кинетическая энергия пептидного иона частично конвертируется во внутреннюю посредством столкновений. Избыток внутренней энергии перераспределяется в пептидной молекуле, ослабляя и разрывая внутримолекулярные связи, в результате чего образуются фрагментные ионы и нейтральные частицы. Фрагментация пептидов обычно происходит по пептидным связям с получением набора b- и y-ионов, несущего информацию об аминокислотной последовательности пептида [4, 37]. Окончательный спектр фраг-ментных ионов зависит от аминокислотной последовательности и зарядового состояния родительского пептида, времени фрагментации и детектирования. На сегодняшний день наиболее полной моделью диссоциации протонированных пептидов является механизм "направляемой зарядовой фрагментации" [38]. При повышении внутренней энергии молекулы протон становится "мобильным" и может заселять энергетически менее выгодные сайты протонирования (концевая аминогруппа, азот и кислород амидных групп, группы боковых радикалов аминокислот) [39]. Протонирование азотного атома амидогруппы ослабляет пептидную связь, что приводит к ее расщеплению при достаточном уровне внутренней энергии. Т. к. одновременно существует несколько протонированных вариантов одного пептида, образуется набор фрагментных ионов, несущий информацию об аминокислотной последовательности пептида. В общем случае распределение сайтов фрагментации не происходит случайным образом, т. к. боковые радикалы некоторых аминокислот оказывают влияние на локализацию протона [38, 40]. Также энергетически более выгодными могут быть альтернативные пути фрагментации с образованием а- и b-ионов и нейтральными потерями.
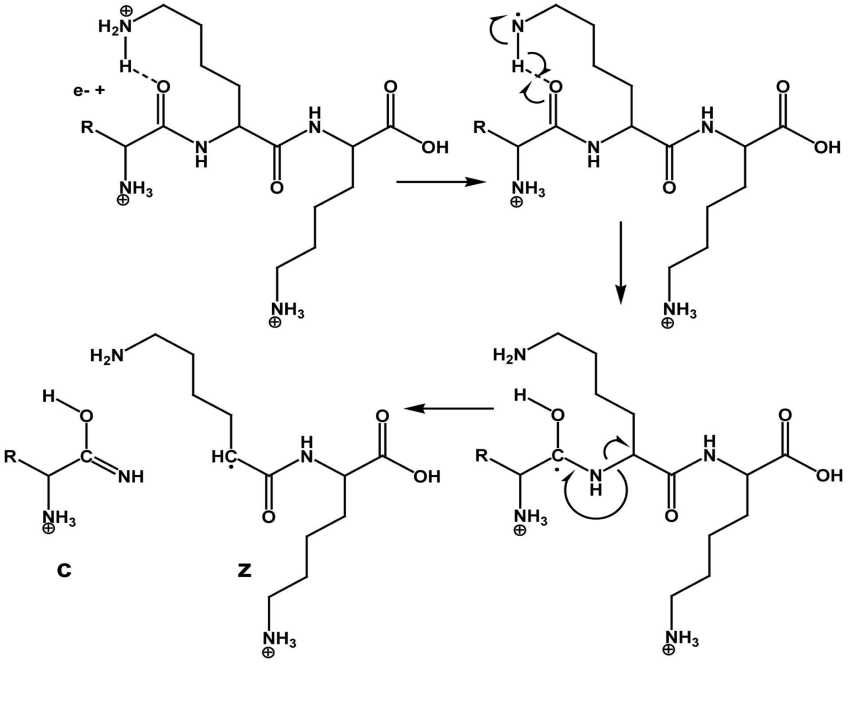
Рис. 1. Предполагаемый механизм ECD- (ETD-) фрагментации.
Присоединение электрона к основному остатку, затем перенос водородного радикала на атом кислорода амидной группы [44]
Фрагментация с захватом электрона (ECD)
Альтернативным методом фрагментации пептидов является диссоциация с захватом электрона (electron-capture dissociation, ECD), предложенная Зубаревым с коллегами в 1998 году. Суть метода заключается во взаимодействии родительского пептида с низкоэнергетическими "тепловыми" электронами, например, в ячейке ИЦР МС, с последующей "мягкой" фрагментацией без передачи пептиду колебательной энергии, как это происходит в случае с методом CID. Однако данный метод фрагментации не может быть использован в МС, использующих радиочастотный захват ионов, из-за кинетического влияния переменного электрического поля на тепловые электроны [41]. Также для получения качественных масс-спектров необходимо усреднение большого количества единичных спектров за большой промежуток времени, что не позволяет использовать ECD в сочетании с ЖХ для анализа сложных смесей.
Диссоциация с переносом электрона (ETD) и ее особенности
В дальнейшем метод ECD был модифицирован [42] и получил название диссоциации при переносе электрона (electron-transfer dissociation, ETD). В таком варианте метод может быть использован в целом ряде тандемных МС, например в МС с радиочастотным квадруполем в качестве ионной ловушки, которые сравнительно недороги, широкодоступны и не требуют больших затрат в обслуживании. Также такие МС позволяют проводить исследования ЖХ-МС в режиме "он-лайн".
В методе ETD протонированные пептиды фрагментируются вследствие переноса электрона (ПЭ) от анион-радикала (например, флуорантена) [42]. В отличие от метода CID в методе ETD происходит разрыв N–Cα связей с образованием серий c- и z-фрагментных ионов (рис. 1). По сравнению с CID в ETD посттрансляционные модификации остаются интактными; таким образом, сохраняется вся информация, необходимая для надежной идентификации пептида [43].
Метод ETD позволяет фрагментировать длинные (более 20 а.к.) многозарядные пептидные ионы, что дает возможность использовать в качестве лизирующих ферментов эндопептидазы Lys-C и Arg-C. В случае использования метода ионизации "электроспрей" полученные пептиды имеют заряд 3–6, что делает их идеальными кандидатами для ETD-фрагментации.
ОСОБЕННОСТИ МЕХАНИЗМА МЕТОДА ДИССОЦИАЦИИ С ПЕРЕНОСОМ ЭЛЕКТРОНА (ETD)
В ион-ионных реакциях перенос электрона от аниона к катиону всегда конкурирует с переносом протона от катиона к аниону [45]. Таким образом, ключевым моментом в ETD является подбор и получение анион-радикалов с минимальным сродством к электрону. По результатам проведенных на сегодняшний день исследований [46] предпочтительным реагентом для ETD является флуорантен, несмотря на то что эффективность переноса электрона для него составляет ~40 %. Таким образом, поиск соединений, обладающих низким сродством к электрону и максимально простой структурой (плоской в идеале), является актуальной задачей в области ETD.
В первых коммерческих МС с ETD в качестве реакционной ячейки и масс-анализатора использовалась линейная квадрупольная ионная ловушка, а в качестве источника анион-радикалов использовалась химическая ионизация (ХИ). Ввод анион-радикалов производился с конца ловушки, противоположного входу положительно заряженных пептидных ионов (метод "back-end") (рис. 2).
Линейная ионная ловушка
Рис. 2. Схема ввода анион-радикалов в линейную ионную ловушку (метод "back-end") [42]
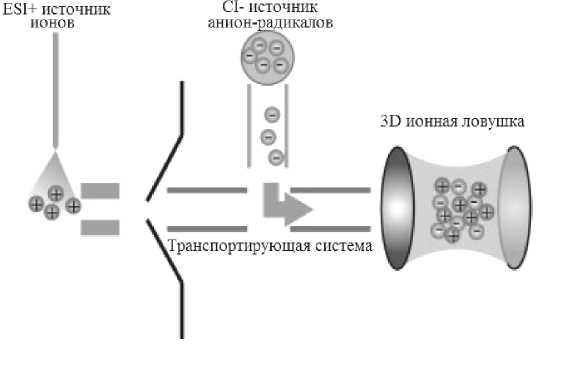
Рис. 3. Схема МС с ETD-фрагментацией и вводом анион-радикалов непосредственно перед ионной ловушкой (в реализации Bruker Daltonics )
В данном варианте метода на получение единичного фрагментного спектра затрачивалось сравнительно малое время (~300 мс), что сделало реальным ЖХ-МС-МС-анализ с высокой производительностью. Однако "задний" ввод анион-радикалов не позволял использовать гибридные варианты распространенных МС (LTQ-Orbitrap, Q-TOF) с дополнительным анализатором высокого разрешения. В обход этого ограничения были разработаны импульсные методы ионизации с последующей активацией реагента-предшественника в CID-ячейке [47]. Так, в методе "двойной импульсный электроспрей" использовалась пара электро-спрей-эмиттеров, один из которых подавал раствор образца, а второй — реагент-предшественник анион-радикалов. Для получения анион-радика-лов в таком варианте метода затрачивалось около 800 мс (200 мс на ввод анионов и по 300 мс на каждое переключение полярности) [48]. Несмотря на это, подобные системы позволили получить фраг-ментные ETD-масс-спектры высокого разрешения (более 60000) и высокой массовой точности (2 ppm). В дальнейшем усовершенствование метода ионизации "двойной электроспрей" привело к уменьшению времени переключения поляризации до 30 мс [49]. Также был предложен метод ввода анион-радикалов в ионную ловушку в средней части ионного тракта непосредственно перед ловушкой, что привело к минимизации временн ы х затрат на получение единичного фрагментного масс-спектра (рис. 3).
Особенности оптимизации механизма ECD
В общем виде механизм фрагментации ETD может быть разделен на два основных канала реакции: перенос протона (proton transfer, PT) и перенос электрона (electron transfer, ET). Перенос PT от мультипротонированных образцов к одноза- рядным анионам проходит легко и является конкурентным процессом по отношению к переносу ET [50]. Продукты PT могут быть обнаружены в виде ионов с редуцированным зарядом, т. к. их фрагментация затруднена. Для получения фраг-ментных ионов таких предшественников с редуцированным зарядом был предложен дополнительной этап активации с помощью модифицированного метода CID (charge-reduced species CID, CRCID). В результате такого дополнительного воздействия образуется фрагментный паттерн, характерный для ETD [51].
Низкую эффективность ETD часто связывают с нековалентными ион-ионными взаимодействиями в ионной ловушке. Дополнительное столкнови-тельное воздействие на такие ионные комплексы вызывает образование непарноэлектронных с- и парноэлектронных z-ионов [52]. Однако сдвиг на 1 Да, вызванный перераспределением атома водорода с с- на z-ион, усложняет анализ получаемых фрагментных масс-спектров [53]. В качестве альтернативного подхода был предложен метод активированных ионов (activated ions, AI) применительно к фрагментации ETD, в котором увеличение внутренней энергии пептидных ионов происходит за счет облучения инфракрасными фотонами [54]. Данный подход похож на ранее разработанную технологию активированных ионов AI ECD, где подобным методом была увеличена эффективность ECD-фрагментации за счет повышения внутренней энергии и, как следствие, ослабления вторичной структуры пептидов [55]. Метод AI ETD резко увеличивает эффективность фрагментации пептидов, благодаря чему количество идентифицированных пептидов становится сравнимо с суммой удачных идентификаций при раздельном использовании методов CID и ETD [54]. Другим преимуществом AI ETD-метода является отсутствие потребности в дополнительном времени на фрагментацию, т. к. все процессы происхо- дят в одном пространстве в одно время.
Также в качестве воздействия, разрушающего нековалентные ион-ионные взаимодействия в линейной ловушке, может быть использовано повышение температуры [56]. Было показано [57], что в случае коротких пептидов (≤ 7 а.к.) возможно полное восстановление их аминокислотной последовательности по сигналам фрагментных ионов при комнатной температуре. Однако перекрытие последовательностей пептидов среднего (8– 11 а.к.) и большого (≥ 14 а.к.) размеров при такой температуре составляет 46 и 23 % соответственно. При повышении температуры эти показатели увеличиваются до 67 и 63 %.
Побочным эффектом данной технологии является появление продуктов термофрагментации, таких как y- и b-ионы, затрудняющих интерпретацию данных. С другой стороны, при использовании МС с точным определением массы наличие дополнительных y- / b- или c- / z-ионных пар облегчает ручное секвенирование пептидов de novo . Повышенный шум детектора также является недостатком метода, делающим невозможным обработку низкоуровневых сигналов [57].
Алгоритм пробоподготовки при использовании метода фрагментации ETD
CID-анализ пептидов, несущих большой заряд, затруднен вследствие резко возрастающего числа сигналов фрагментных ионов, это также делает невозможным комплементарный CID-ETD-анализ. В ходе реакций переноса протонов, проходящих в столкновительной ячейке, может происходить уменьшение зарядности пептидов, но значение m / z получаемых ионов часто не попадает в массовый диапазон МС [42]. В результате стандартного метода обработки белков трипсином основная часть получаемых пептидов несет заряд +2 или +3, что отменяет данную проблему в CID-анализе. Однако эффективность ETD-фрагментации зависит от зарядового состояния родительского иона и становится приемлемой при заряде +3 и выше. Таким образом, одной из задач, стоявших перед исследователями, была разработка пробоподготовки с получением пептидов с зарядом ≥ +3 [44]. Формально пробоподготовка состоит из нескольких фаз.
-
1 . Использование альтернативных протеаз. Одним из подходов является использование альтернативных протеаз, таких как Lys-C и Asp-N, которые расщепляют белок на бóльшие фрагменты (20–25 а.к.), чем трипсин (10–15 а.к.). С увеличением числа основных аминокислотных остатков в составе пептида увеличивается и их заряд. Также уменьшается количество ложнопозитивных результатов, т. к. с увеличением длины пептида уменьшается количество возможных
-
2. Дериватизация пептидов. С помощью N-гидроксисукциниминового эфира 4-триметил-аммоний бутирата можно дериватизировать первичные амины пептидов. Из-за того что заряды на таких модифицированных пептидах фиксированы, эффективность их фрагментации снижается. Однако при этом сильно увеличивается интенсивность фрагментных ионов, получаемых при расщеплении дисульфидных связей, по сравнению с интактными пептидами, что делает данный метод пригодным для исследования цистиновых мостиков в белках [60].
-
3. Модификации растворителя. В качестве агента, вызывающего увеличение среднего зарядового состояния молекулярных ионов в газовой фазе (генерируемых в электроспрее), может быть использован m-нитробензиловый спирт (NBA) [61]. Способность NBA увеличивать заряд анали-тов связывают с низким давлением пара в сочетании с высоким поверхностным натяжением данного соединения. Эти свойства препятствуют достижению рэлеевского предела, после достижения которого капли, образующиеся в методе ионизации "электроспрей", испытывают кулоновский взрыв. Большая плотность зарядов в таких каплях в итоге трансформируется в большее среднее значение заряда анализируемых соединений.
вариантов, которым может соответствовать данная аминокислотная последовательность (при работе с базами данных).
В последнее время были разработаны два методических подхода в пробоподготовке для ETD МС-анализа. Первый основан на неферментативном расщеплении белков с помощью микроволнового излучения, специфически разрывающего С-терминальную связь остатка аспарагиновой кислоты. Данный метод позволяет получать пептиды размером 15–25 а.к. остатков с зарядом z > +3. Микроволновое расщепление белка происходит в течение нескольких минут (< 6 мин). Получаемые пептиды могут быть успешно фрагментированы с помощью ETD для получения полного набора c- / z-ионов, необходимых для уверенной идентификации. Быстрота и совместимость метода с ETD делают его идеальным инструментом для протеомики [58].
Во втором подходе используется обработка белка протеазой Lys-N с получением двухзарядных пептидов, при этом заряд локализован на N-конце аминокислотной последовательности. Таким образом, одиночный заряд несут только с-ионы, z-ионы нейтральны и не могут быть детектированы в масс-анализаторе. Эффективность ETD-фрагментации Lys-N пептидов достаточно высока и позволяет получать полные наборы с-ионов для de novo секвенирования [59].
Воздействие NBA на зарядовое состояние пептидов также было исследовано в [62]. Отмечено возрастание среднего зарядового состояния триптических пептидов сывороточного альбумина быка (BSA) с +2.2 до +2.6 при добавлении NBA в растворитель до конечной концентрации 0.1 %. Большая часть пептидов BSA в таком варианте электроспрея несла заряд +3. Эффективность фрагментации таких пептидов значительно выше по сравнению с фрагментацией триптических пептидов в обычном растворителе, что увеличивало возможность идентификации по базе данных белков Mascot в среднем на 68 %.
Данный подход может быть легко реализован добавлением 0.1 % NBA в элюенты при хроматографическом разделении пептидов или присоединением Т-образного сплиттера непосредственно перед источником ионов. Другим преимуществом NBA является совместимость с методом триптического гидролиза белков. Стоит, однако, иметь в виду, что молекула NBA имеет гидрофобные свойства и при добавлении в подвижную фазу уменьшает время удерживания пептидов на обращенно-фазовых колонках (линейная зависимость от концентрации NBA в подвижной фазе).
В среднем заряд различных пептидов после обработки NBA увеличивается на 0.25. Триптические фосфопептиды редко несут заряд более +2, их однозначная идентификация и локализация фосфогруппы затруднены в условиях ETD. При добавлении NBA к образцу заряды фосфопептидов возрастают в среднем примерно на 0.5 зарядовой единицы.
ВОЗМОЖНОСТИ АНАЛИЗА ФОСФОРСОДЕРЖАЩИХ ПЕПТИДОВ С ПОМОЩЬЮ ТАНДЕМНЫХ МС
С CID- И ETD-МЕТОДАМИ ФРАГМЕНТАЦИИ
Одним из важнейших преимуществ ETD-технологии в протеомике является возможность локализации точного сайта посттрансляционной модификации (ПТМ) белков, что не всегда доступно в случае CID.
Обратимое фосфорилирование белков является одним из наиболее распространенных механизмов регуляции процессов, происходящих в клетке. Этот механизм регулирует такие биологические процессы, как межклеточная коммуникация, клеточный рост, размножение, дифференциация и апоптоз [63]. Фосфорилирование влияет на основные свойства белков, модулируя фолдинг, активность, белок-белковые взаимодействия, внутриклеточную локализацию и деградацию белка. Низкая стехиометричность фосфопептидов в сочетании с отрицательным зарядом фосфогруппы делает их анализ в режиме регистрации положительных ионов затруднительным. При анализе с помощью CID-фрагментации остаток фосфотирозина довольно стабилен, в то время как остатки фосфосерина и фосфотреонина лабильны, т. е. об их наличии можно судить только по нейтральным потерям, соответствующим массе фосфорной кислоты (сдвиг на 98 Да) [64].
В отличие от CID, ETD-фрагментация позволяет получить практически полные серии c- и z-ионов (рис. 4), делая возможным протеомный анализ фосфопептидов.

Рис. 4. CID (а) и ETD (b) фрагментные спектры трехзарядного протонированного синтетического пептида ENIMRS*ENSESQLTSK, имеющего фосфатную модификацию ( * ).
Спектры получены с помощью МС LTQ XL ( Thermo Scientific ) [44]
Первые эксперименты с использованием ETD-фрагментации для исследования фосфопептидов проводились на дрожжевых клетках. Исследователи использовали эндопептидазу Lys-C, получая большие и многозарядные пептиды. В результате одного эксперимента с использованием нанопото-ковых систем в 20 мкг клеточного лизата было идентифицировано 1252 сайта фосфорилирования в 629 белках, включая нестабильные остатки фосфогистидина [65].
Недавно группа Молино с сотрудниками идентифицировали 1435 фосфопептидов из клеток 293Т почек эмбриона человека, из них 80 % не были описаны ранее. В данном исследовании было проведено сравнение результатов, полученных с использованием CID и ETD. В случае использования ETD-фрагментации количество идентифицированных фосфопептидов было на 60 % больше, чем при использовании CID [43]. Для расщепления полипептидной цепи применялась эндопептидаза Lys-C, т. к. использование трипсина слегка уменьшало статистику идентификаций. Также было обнаружено, что при использовании трипсина среднее количество пропущенных сайтов гидролиза (1.1) и длина получаемых пептидов (16) в случае фосфопептидов выше, чем в случае нефосфо-рилированных (ср. количество пропущенных сайтов расщепления 0.3, средняя длина пептидов 12).
Множественные сайты фосфорилирования, расположенные рядом в а.к.-последовательности, требуют полного набора серий фрагментных ионов для определения точного сайта модификации. Преимущества сочетания методов CID и ETD проявляются при анализе фосфопептидов, чьи сайты модификации расположены рядом с пролином. ETD-фрагментация не позволяет расщеплять такие химические связи, а CID может быть использована для получения активированных родительских ионов. Недавние исследования с использованием статистической обработки крупномасштабных экспериментов, в которых для фрагментирования элюируемых с нано-ВЭЖХ колонок пептидов поочередно использовались CID и ETD [66], показывают, что при идентификации фосфопептидов, несущих двойные модификации, получаемые данные сильно различаются в зависимости от метода фрагментации и дополняют друг друга. Так, между группами идентифицированных с помощью CID (141) и ETD (79) пептидов наблюдается пересечение лишь в 8 % (17) от общего числа идентифицированных. Стоит отметить, что у пептидов, идентифицированных обоими методами, различия в определении сайта модификации наблюдались только в трех случаях. Причем причиной таких различий было низкое качество фрагментных масс-спектров, обнаруживаемое при анализе "вручную". Также авторы отмечают отсутствие признаков перераспределения фосфогрупп между несколькими возможными сайтами модификации в монофосфорилированных пептидах, что предполагалось ранее для CID-фрагментации [67].
ОСОБЕННОСТИ ИНТЕРПРЕТАЦИИ ДАННЫХ И БАЗЫ ДАННЫХ ФОСФОПЕПТИДОВ ПРИ ИСПОЛЬЗОВАНИИ МЕТОДА ETD
Ранние исследования с применением ETD-фрагментации основывались на ручной обработке МС-МС-спектров с разметкой c- и z-ионов. На данный момент разработано несколько алгоритмов для проведения автоматической интерпретации масс-спектрометрических данных и локализации сайтов фосфорилирования: MASCOT [68], OMSA [69], SEQUEST, Specrum Mill, X!Tandem [70]. Для обработки данных, полученных с использованием метода ETD, наиболее применимыми считаются Spectrum Mill и MASCOT [71]. Protein Prospector также показал эффективность обработки данных после оптимизации системы подсчета [72].
При фрагментации методом ETD пептиды, полученные обработкой белка эндопептидазой Lys-N, в основном образуют фрагментные ионы с-типа [59, 79]. На основе данной особенности был создан алгоритм LysNDeNovo для de novo секвенирования таких пептидов [73]. Для обработки ETD-МС-МС-данных был разработан отдельный алгоритм поиска по существующим базам данных — Z-core. Этот алгоритм показал минимальное преимущество по отношению к OMSA при идентификации пептидов [74]. Основные инструменты и базы данных фосфопротеомов представлены в таблице (см. Приложение).
Хотя на данный момент для метода ETD разработаны алгоритмы поиска в уже существующих базах данных (Z-core, MS-GFDB, pFind 2.1) и секвенирования de novo (CompNovo, LysNDeNovo), есть ряд методов, в которых применимость таких алгоритмов невозможна. Например, в случае использования CID- и ETD-методов фрагментации последовательно в течение одного МС-МС-анализа [75].
ВЫВОДЫ
В данном обзоре изложены возможности и ограничения методов фрагментации фоcфопептидов в тандемной масс-спектрометрии с использованием столкновительной диссоциации CID и диссоциации с переносом электрона ETD. На данный момент масс-спектрометрические методы проте-омного анализа в достаточной мере сформированы для приборов, использующих CID-фрагментацию. В то время как CID-фрагментация хорошо зареко- мендовала себя при работе с короткими и средними пептидами (до 11 а.к.), метод фрагментации ETD показывает наилучшие результаты при анализе длинных (> 14 а.к.) и высокозаряженных (z ≥ +3) пептидов. В этом случае для гидролиза белков рекомендуется использовать альтернативные трипсину протеазы, такие как Lys-C, Asp-N, Lys-N, либо проведение неферментативного гидролиза белков с помощью микроволнового излучения. Результатом таких вариантов гидролиза белков становятся пептиды с длиной аминокислотной цепи 15–25 остатков, что увеличивает количество сайтов протонирования и приводит к повышенному зарядовому числу. В случае электро-спрей-ионизации возможно использование моди-фикантов растворителя, также увеличивающих среднее зарядовое число пептидов гидролизата. Оба метода пробоподготовки обеспечивают эффективную фрагментацию в случае использования ETD. Использование метода фрагментации ETD приводит к получению фрагментных ионов "c" и "z" (в отличие от метода фрагментации CID, дающего b- и y-ионы), что приводит к использованию существенно другого подхода к обработке данных фрагментных масс-спектров. В настоящее время продолжается активная разработка алгоритмов интерпретации фрагментных масс-спектров, полученных с помощью метода ETD, в том числе с использованием существующих электронных баз данных по фосфопротеомике, что видно из представленной таблицы (Приложение).
Проведенный анализ опубликованных данных показывает, что при решении задач протеомики результаты, получаемые с применением методов фрагментации CID и ETD, комплементарны. Кроме того, сохранение в интактном состоянии посттрансляционных модификаций белков и пептидов при использовании метода фрагментации ETD позволяет получить больше информации о состоянии биологических образцов. Таким образом, большим преимуществом тандемных МС, использующих оба метода фрагментации CID / ETD, является значительное увеличение информативности единичного эксперимента, а следовательно, расширение возможностей по восстановлению аминокислотных последовательностей. Стоит ожидать, что в ближайшем будущем ETD станет общепринятым методом тандемной масс-спектрометрии для решения задач протеомики в одном ряду с CID.
Приложение
Доступные протеомные инструменты и базы данных фосфопептидов
Прогнозирование сайтов модифицирования Название URL Описание Ссылка NetPhos services/NetPhos/ Прогнозирование сайтов модифицирования белков эукариот по серину, треонину и тирозину с помощью нейронных сетей [76] NetPhosK services/NetPhosK/ Прогнозирование киназ-зависимого фосфорилирования белков эукариот с помощью нейронных сетей [77] NetPhos Yeast services/NetPhosYeast / Прогнозирование сайтов фосфорилирования по серину и треонину дрожжевых белков [78] Протеомные инструменты Protein Prospector edu/prospector/ Протеомные инструменты для поиска в базах данных белковых последовательностей совпадений с результатами МС-эксперимента [78]
Продолжение таблицы
Локализация и оценка корректности назначения сайтов фосфорилирования Название URL Описание Ссылка APIVASE software/ API- Автоматическая идентификация и валидация SEQUEST. Корректность идентификации проводится сравнением информации, полученной обработкой спектров МС2 и соответствующих спектров нейтральных потерь МС3 [79] Ascore Оценка вероятности корректного определения сайта фосфорилирования по наличию и относительной интенсивности сигналов в МС-МС-спектре [80] SLoMo slomo Расчет гипотетических CID или ETD/ECD фрагментных ионов на основе базы данных ранее определенных модификаций UniMod [81] MSQuant http://msquant. Количественное определение белков на основании интенсивностей родительских ионов (SILAC/ICAT/ICPL); МС3-скоринг идентификации пептидов; ПТМ-скоринг вероятности локализации сайта модификации [82] ProPhosSI http://www.compbio. prophossi/bin/ Валидация совпадения экспериментального спектра фосфопептида с имеющимися в базе данных [83] Базы данных P3DB База данных фосфорилированных белков и пептидов растений (Plant Protein Phosphorylation Database) [84] Peptide Atlas http://www. Публично доступная база данных пептидов, обнаруженных МС-МС-методами в различных организмах [85] Phosida http://www.phosida. com/ Каталогизация, структурные и эволюционные исследования, прогнозирование сайтов фосфорилирования; данные по фосфорилированию, ацетилированию и N-гликозилированию белков [86] Phospho ELM org/ База данных экспериментально подтвержденных S/T/Y сайтов фосфорилирования эукариот [87] PhosphoGRID http://www. База данных экспериментально подтвержденных сайтов фосфорилирования почкующихся дрожжей Saccharomyces cerevisiae [88]
Продолжение таблицы
Название URL Описание Ссылка PhosphoNET http://www. База данных по сайтам фосфорилирования человека; оценка эволюционной консервативности; теоретический подбор возможных киназ, действующих по конкретному сайту PhosphoPep http://www. Проект по поддержке системных исследований биологического сигналинга. Предоставляются данные, полученные МС-методом, по объектам: Drosophila melanogaster, Homosapiens, Caenorhab-ditiselegans, Saccharomyces cerevisiae [89] PhosPhAt http://phosphat. База данных по сайтам фосфорилирования Arabidopsis [90] PhosphoPoint http://kinase. База данных по киназам и фосфопептидам человека [91] PhosphoSitePlus http://www. Фосфопротеомика и прочие ПТМ [92] RESID Database RESID; /RESID Сборник аннотаций и структур и модификаций (пре-, ко- и посттрансляционных) пептидов [93]


