Функция эндотелия у беременных с хронической артериальной гипертензией и абдоминальным ожирением
Автор: Захарко А. Ю., Митьковская Н. П., Картун Л. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.35, 2020 года.
Бесплатный доступ
Цель: выявить особенности эндотелиальной функции у беременных с хронической артериальной гипертензией (ХАГ) и абдоминальным ожирением (АО).Материал и методы. Обследованы 30 беременных с ХАГ + АО (группа I), 28 беременных с ХАГ с нормальным индексом массы тела ИМТ (группа IIа), 27 беременных с АО без ХАГ (группа IIб) и 33 беременные без ХАГ и АО (контрольная группа - Кгр). Проведены проба с реактивной гиперемией, изучение уровня эндотелина-1 и гомоцистеина в сыворотке крови, анализ исходов беременности и родов.Результаты. Значения эндотелийзависимой вазодилатации (ЭЗВД) в группах беременных I (ХАГ и АО), IIа (ХАГ) и IIб (АО) были сопоставимы и составили 6,7 (3,2-9,1); 7,0 (3,9-11,4) и 7,2 (4,4-10,8)% соответственно. Выявлены статистически значимые различия показателей ЭЗВД между вышеперечисленными группами и Кгр - 12,5 (10,5-13,9)%, р
Беременность, хроническая артериальная гипертензия, абдоминальное ожирение, эндотелиальная функция, гомоцистеин, эндотелин-1
Короткий адрес: https://sciup.org/149126157
IDR: 149126157 | УДК: 618.2-06:616.12-008.331.1-036.12-056.257:611.018.74 | DOI: 10.29001/2073-8552-2020-35-1-100-106
Текст научной статьи Функция эндотелия у беременных с хронической артериальной гипертензией и абдоминальным ожирением
–106
Хроническая артериальная гипертензия (ХАГ) является наиболее распространенным заболеванием сердечно-сосудистой системы у беременных, регистрируется у 5–30% беременных и влечет за собой тяжелые нарушения здоровья матери и плода [1–4].
Согласно клинической классификации гипертензивных расстройств, у беременных выделяют следующие виды нарушений: хроническая (предшествующая) артериальная гипертензия (ХАГ), гестационная (индуциро- ванная беременностью) АГ (ГАГ), преэклампсия (ПЭ), ПЭ на фоне ХАГ, эклампсия [3, 5, 6]. Ожирение рассматривается как хроническое, прогрессирующее при естественном течении заболевание различной этиологии, характеризующееся избыточным отложением жировой ткани в организме. В аспекте развития акушерских осложнений абдоминальное ожирение (АО) – значимый независимый фактор риска развития гестационного сахарного диабета (ГСД), ПЭ, преждевременных родов, экстренного родоразрешения, макросомии плода, асфиксии новорожденного, синдрома внезапной смерти плода и младенческой смертности [7, 8]. В послеродовом периоде у женщин с ожирением чаще регистрируются кровотечения, гнойно-воспалительные осложнения, инфекции мочевыводящих путей, нарушения психосоматического состояния [9]. Новорожденные с массой тела, превышающей 90-й перцентиль, имеют высокий риск развития ожирения в последующей жизни, таким образом, формируется замкнутый круг в патогенезе ожирения [10].
Эндотелиальная дисфункция – это патологическое состояние, характеризующееся дисбалансом между веществами с вазодилатирующими, антитромбогенны-ми свойствами и веществами с сосудосуживающими, протромбогенными и пролиферативными характеристиками [11]. Существует много исследований, доказывающих взаимосвязь между эндотелиальной дисфункцией и риском сердечно-сосудистых заболеваний, прогрессированием атеросклероза, развитием осложнений беременности. Учитывая, что дисфункция эндотелия является системным проявлением, функциональные показатели эндотелия периферических артерий коррелируют с коронарными артериями [8, 9]. Измерение эндотелийзависимой вазодилатации (ЭЗВД) является «золотым» стандартом в выявлении эндотелиальной дисфункции [10]. Увеличение эндотелиальной функции во время беременности является ожидаемым, так как вазодилатация считается необходимым условием для физиологического течения беременности [11]. В то же время нет однозначного мнения по поводу величины ЭЗВД у беременных по сравнению с небеременными женщинами [12, 13]. Нет единой точки зрения на динамику ЭЗВД у беременных с гипертензивными расстройствами по сравнению со здоровыми беременными женщинами: одни исследователи указывают на снижение уровня ЭЗВД [14, 15], другие – на то, что ЭЗВД не ослабляется [16]. Существует мнение, что при развитии гипертензивных расстройств на фоне уже имеющейся до беременности АГ эндотелиальная функция изменяется в большей степени, чем при ГАГ и ПЭ [17].
Эндотелин-1 (ЭТ-1) синтезируется преимущественно эндотелиальными клетками и является мощным вазоконстрикторным фактором, осуществляющим свой эффект через рецептор эндотелина A (EТА), расположенный в гладкомышечных клетках сосудов. Основными индукторами синтеза ЭТ-1 являются гипоксия, ишемия, окислительный стресс, гипергликемия, гиперлипидемия, гемодинамические перегрузки. ЭТ-1 вызывает рост гладкомышечных клеток сосудов, что приводит к их утолщению и вазоконстрикции, обладает антидиуре-тическим действием, усиливает симпатическую активацию и эффекты других вазоконстрикторов, способствует развитию и прогрессированию атеросклероза [18].
Считается, что наиболее мощным провоцирующим фактором для синтеза ЭТ-1 во время беременности является снижение биодоступности оксида азота в результате ишемии плаценты. У пациенток с гипертензивными осложнениями обнаружен повышенный уровень этого пептида, причем его уровень коррелировал с тяжестью симптомов, хотя не все исследователи согласны с этими данными [19]. Ожирение также связано с увеличением вазоконстрикции, вызванной ЭT-1, и опосредованным ЭT-1 сокращением эндотелийзависимой вазорелаксации.
Гомоцистеин – серосодержащая аминокислота, являющаяся метаболитом незаменимой аминокислоты, метионина. Повреждающее действие гомоцистеина осуществляется за счет прямого действия на клетки и косвенного влияния супероксидного аниона и пероксида водорода (продуктов окисления гомоцистеина) на эндотелий сосудов [4, 19, 20]. Среди биологических эффектов гипергомоцистеинемии описаны повреждение эндотелия, активация маркеров воспаления, атерогене-за, нарушение синтеза и биодоступности оксида азота с развитием эндотелиальной дисфункции, активация прокоагулянтных факторов и ингибирование антикоагулянтной и фибринолитической систем [15, 19]. При изучении концентрации гомоцистеина на протяжении физиологической беременности выявлено ее постепенное увеличение с прогрессированием беременности [18, 19]. Установлено, что гипергомоцистеинемия является фактором риска сердечно-сосудистых заболеваний и тромбоэмболических оcложнений [15]. При беременности отмечены ассоциации высокого уровня гомоцистеина с привычным невынашиванием беременности, ПЭ, синдромом задержки развития плода, преждевременными родами, преждевременной отслойкой нормально расположенной плаценты, врожденными пороками сердца у плода [18]. По некоторым данным уровень гомоцистеина коррелирует со степенью АГ, степенью тяжести проявлений гипертензивных осложнений [18, 20]. Высокие уровни гомоцистеина после беременности, осложненной ПЭБ, могут сохраняться в течение нескольких десятилетий и вносить свой вклад в риски сердечно-сосудистых заболеваний [17, 19].
Цель исследования: выявить особенности эндотелиальной функции у беременных с ХАГ и АО.
Материал и методы
Обследованы 118 беременных женщин в возрасте 28 (25–32) лет в сроке гестации 28–36,6 нед. Пациентки включались в исследование методом сплошной выборки после получения добровольного информированного согласия.
В основную группу (I) вошли 30 беременных с сочетанием ХАГ + АО, группу сравнения IIа составили 28 беременных с ХАГ и нормальным индексом массы тела (ИМТ), группу сравнения IIб – 27 беременных с АО без ХАГ; контрольную группу (Кгр) – 33 беременные без ХАГи и АО. Критерии включения в основную группу I (ХАГ + АО) – беременность, окружность талии (ОТ) ≥ 80 см, диагностированная АГ, срок беременности на момент исследования 28–36,6 нед. Критериями включения в группу сравнения IIа (ХАГ) явились беременность в сроке гестации 28–36,6 нед., наличие АГ, ОТ < 80 см. В группу IIб (АО) вошли беременные с ОТ ≥ 80 см.
Использованный дизайн: продольное проспективное сравнительное исследование «случай – контроль».
Измерение ОТ и диагностика АГ осуществлялись в первом триместре беременности.
Критерии исключения из исследования: отказ женщины от участия в исследовании, многоплодная беременность, беременность после использования вспомогательных репродуктивных технологий, эндокринологические заболевания с гипо- или гиперфункцией, соматическая патология в стадии декомпенсации, острые инфекционные заболевания, обострение хронических воспалительных заболеваний, употребление психоактивных веществ. Пациентки получали терапию согласно действующим клиническим протоколам наблюдения беременных, рожениц, родильниц, диагностики и лечения в акушерстве и гинекологии.
Средний возраст обследуемых составил 28,0 (25,0– 32,0) лет, в группе I (АГ + АО) – 28,0 (25,0–32,0) лет, в группе IIа (ХАГ) – 29,0 (24,0–32,0) лет, в группе IIб (АО) – 29,0 (25,0–33,0) лет, в Кгр – 28,0 (23,0–33,0). В группе I (ХАГ + АО) значение ИМТ составило 31,6 (30,3–33,9) кг/ м2 и статистически значимо не отличалось от группы
IIб (АО) – 30,7 (28,5–35,4) кг/м2. Значение ИМТ в группе сравнения IIа (ХАГ) составило 21,5 (20,3–22,8) кг/м2, беременные группы IIа и Кгр имели сопоставимые показатели ИМТ, ни одна из пациенток указанных групп не имела АО. У 19 (63,3%; 95% ДИ: 43,9-80,1) женщин основной группы и 12 (42,9%; 95% ДИ: 17,7-71,1) пациенток группы сравнения Iа ХАГ была диагностирована в первом триместре беременности и соответствовала умеренной степени, х 2 = 2,44; Р = 0,11. Средняя длительность течения ХАГ, диагностированной до беременности, у пациенток с АО составила 2 (13) года, в группе сравнения Ia – 2 (12,5) года, U = 434; Z = 0,4; р = 0,9. АГ второй степени была зарегистрирована до гестации у двух пациенток основной группы (ХАГ + АО) и у двух – в группе IIа (ХАГ). Медианы систолического (САД) и диастолического артериального давления (ДАД) при постановке на учет по беременности в группах исследования указаны в таблице. В момент постановки на учет по беременности ни одна из пациенток не получала антигипертензивную терапию.
Таблица. Характеристика обследуемых лиц
Table. Characteristics of the subjects
|
Признаки Characteristics |
Группа I (ХАГ + АО) I (CH + AO) n = 30 |
Группа IIa (ХАГ) IIa (CH) n = 28 |
Группа IIб (АО) IIб (AO) n = 27 |
Кгр Control group n = 33 |
Уровень значимости Significance level |
|
Возраст, лет, Me (25–75%) Аge, years, Me (25–75%) |
28,0 (25,0–32,0) |
29,0 (24,0–32,0) |
29,0 (25,0–33,0) |
28,0 (23,0–33,0) |
р > 0,05 |
|
Срок гестации на момент исследования, дни, Me (25–75%) Gestational age at the time of the study; days, Me (25–75%) |
250 (240–255) |
254 (248–256) |
248 (232–252) |
256 (254–258) |
р > 0,05 |
|
ИМТ, кг/м2, Me (25–75%) BMI, kg/m2, Me (25–75%) |
31,6 (30,3–33,9) |
30,7 (28,5–35,4) |
21,9 (21,2–23,0) |
20,9 (20,2–22,8) |
р i-iiб< 0,05 р i-кгр < 0,05 р iiа-iiб < 0,05 р iia-iiб< 0,05 |
|
САД при постановке на учет, мм рт. ст., Me (25–75%) SBP in the first trimester, mmHg, Me (25–75%) |
130 (120–135) |
132 (120–135) |
110 (100–130) |
110 (100–120) |
р i-iiб< 0,05 р i-кгр< 0,05 р iiа-iiб < 0,05 р iia-iiб < 0,05 |
|
ДАД при постановке на учет, мм рт. ст., Me (25–75%) DBP in the first trimester, mmHg, Me (25–75%) |
85 (80–95) |
80 (80–90) |
70 (65–80) |
70 (60–85) |
р i-iiб< 0,05 р i-кгр < 0,05 р iiа-iiб< 0,05 р iia-iiб < 0,05 |
|
Первородящие, n, ( p %; 95% ДИ) Primiparous, n, ( p %; 95% ДИ) |
18 (60%; 95% ДИ: 40,6–77,3%) |
13 (46,4%; 95% ДИ: 27,5–66,1%) |
14 (57,85%; 95% ДИ: 31,95–71,33%) |
16 (48,5%; 95% ДИ: 30,8–66,5%) |
р > 0,05 |
Всем пациенткам выполнен перечень клинических, инструментальных, лабораторных исследований, согласно клиническим протоколам Министерства здравоохранения Республики Беларусь, проведено анкетирование по разработанному авторами опроснику, дана экспертная оценка данных индивидуальных карт беременных и родильниц. Взвешивание осуществляли на стандартизированных весах при постановке на учет по беременности. ИМТ (индекс Кетле) рассчитывали по формуле:
ИМТ = вес (кг)/рост (м2).
Для выявления типа ожирения измеряли ОТ в положении стоя на середине расстояния между вершиной гребня подвздошной кости и нижним краем реберной дуги сантиметровой лентой. Вазомоторную функцию эндотелия оценивали по результатам пробы с реактивной гиперемией (методика D.S. Celermajer, 1992). Исследование проводилось на приборе Philips iE 33 линейным датчиком 7,5 МГц с использованием М-модального и двухмерного исследований, а также цветного и импульсного допплеровского измерений. Степень эндотелийза-висимой вазодилатации (ЭЗВД) рассчитывали по формуле:
пиковый диаметр – базовый диаметр артерии
ЭЗВД (%) =
артерии
базовый диаметр артерии
× 100%
При отсутствии прироста диаметра плечевой артерии в ответ на реактивную гиперемию больше чем на 10% или при появлении парадоксальной вазоконстрикции регистрировалась вазомоторная дисфункция эндотелия.
Исследование уровня ЭТ-1 проводили с помощью иммуноферментного анализа (набор Human endothelin I; DRG International, Inc., США), уровня гомоцистеина с использованием коммерческого набора ЕIA2925 (DRG International, Inc., США).
Статистическая обработка результатов осуществлялась с помощью статистических пакетов Excel, STATISTICA (версия 10.0, StatSoft, Inc., USA, серийный номер BXXR207F383402FA-V). Использовались непараметрические методы анализа. Для описания количественных признаков вычисляли медиану ( Me ), интерквартильный размах (25- и 75-й процентили), данные представляли в виде Me (25–75%). Для описания качественных признаков применяли долю ( p %) и 95% доверительный интервал (ДИ), рассчитанный по методу Клоппера – Пирсона ( p %; 95% ДИ). Парное межгрупповое сравнение признаков определяли по критерию Манна – Уитни ( U ). При множественных сравнениях использовали поправку Бонферрони для р -уровня статистической значимости. Для сравнения трех и более независимых групп по количественному признаку и качественному порядковому признаку применяли непараметрический однофакторный дисперсионный анализ с использованием метода рангового анализа вариаций по Краскелу – Уоллису и медианного теста.
Общее межгрупповое различие для качественных признаков рассчитывали с помощью критерия хи-квадрат (χ2) с поправкой Йейтса на непрерывность. Для определения взаимосвязи двух количественных признаков выполнялся корреляционный анализ метод Спирмена ( r s). Различия в группах считались значимыми при вероятности безошибочного прогноза не менее 95,5% ( р < 0,05).
Результаты
Значения ЭЗВД в группах беременных I (ХАГ и АО), IIа (ХАГ) и IIб (АО) были сопоставимы и составили 6,7 (3,2–9,1)%; 7,0 (3,9–11,4)% и 7,2 (4,4–10,8)%. Выявлены статистически значимые различия показателей ЭЗВД между вышеперечисленными группами и Кгр 12,5 (10,5–13,9)%, р < 0,05. Вазомоторная дисфункции эндотелия была зафиксирована у 18 (60%; 95% ДИ: 40,677,3%) беременных с ХАГ и АО и у 9 (27,3%; 95% ДИ: 13,3–45,5%) пациенток Кгр (χ2 = 5,6 с поправкой Йейтса; р = 0,018). В группах IIa и IIб доля пациенток со сниженной и парадоксальной реакцией на пробу была сопоставима и составила 13 (46,4%; 95% ДИ: 27,5–66,1%) и 15 (55,6%; 95% ДИ: 35,3–74,5%), χ2 = 0,46; р = 0,5. У пациенток с АО в два раза чаще выявлялись нарушения вазомоторной функции эндотелия по сравнению с Кгр (χ2 = 4,95; р = 0,027).
Корреляционный анализ показал наличие обратной связи между значениями ЭЗВД и ИМТ ( r s= –0,23), ОТ ( r s = –0,26), уровнями САД ( r s= –0,37), ДАД ( r s= –0,41), p < 0,05. Концентрация ЭТ-1 и гомоцистеина была определена у 81 пациентки, из них 30 женщин входили в группу I (ХАГ + АО), 21 – в группу IIа (ХАГ), 16 – в группу IIб (АО) и 14 – в Кгр. Медиана концентрации ЭТ-1 у беременных с ХАГ и АО составила 14,0 (10,3–17,5) пг/мл, что статистически значимо выше, чем в группе беременных с ХАГ и нормальным ИМТ – 7,5 (6,8; 13,7) пг/мл ( U = 149,5; Z = 2,6; р < 0,05 с учетом поправки Бонферрони) и Кгр 5,8 (4,5; 8,5) пг/мл ( U = 39,5; Z = 4,5; р < 0,05 с учетом поправки Бонферрони). У пациенток с АО уровень ЭТ-1 в два раза превышал значение Кгр ( U = 41,5; Z = 2,9; р < 0,05 с учетом поправки Бонферрони). Отмечены статистически значимые различия между пациентками групп Ia (ХАГ) и Кгр ( U = 63,5; Z = 2,0; р < 0,05 с учетом поправки Бонферрони, см. рис. 1).
У пациенток исследуемых групп уровень ЭТ-1 коррелировал с ИМТ ( r s = 0,31; р < 0,05), ОТ ( r s = 0,31; р < 0,05), уровнями САД ( r s = 0,30; р < 0,05) и ДАД ( r s= 0,35; р < 0,05).
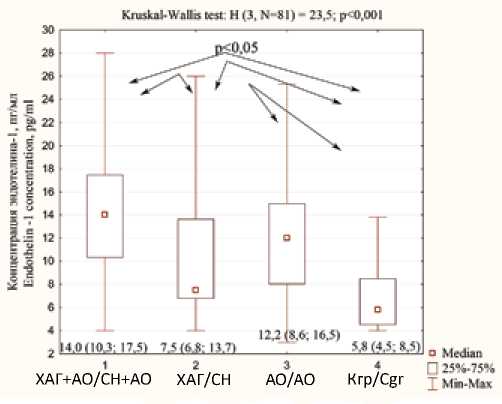
Рис. 1. Концентрация ЭТ-1 в группах исследования
Fig. 1. Endothelin-1 concentrations in study groups
При анализе гомоцистеинемии в группах исследования выявлены статистически значимые различия между Кгр и группами ХАГ + АО ( U = 85,0; Z = 3,5; p < 0,05 с поправкой Бонферрони), ХАГ без ГР ( U = 62,5; Z = 2,2; p < 0,05 с учетом поправки Бонферрони), АО ( U = 61; Z = 2,1; p < 0,05 с учетом поправки Бонферрони). Данные об уровне гомоцистеина в группах исследования представлены на рисунке 2.
Корреляционный анализ показал наличие связей умеренной силы между концентрацией гомоцистеина и ИМТ ( r s = 0,39; р < 0,05), ОТ ( r s = 0,4; р < 0,05), уровнями САД ( r s= 0,30; р < 0,05) и ДАД ( r s= 0,39; р < 0,05).
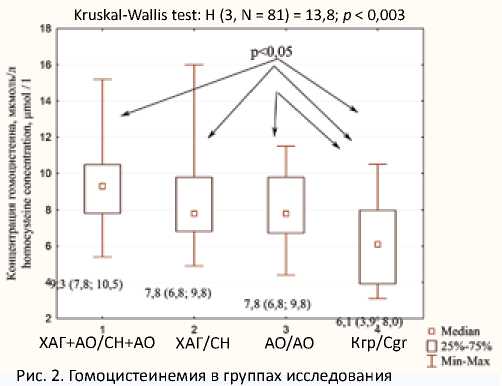
Fig. 2. Homocysteine concentrations in study groups
Среди пациенток группы ХАГ + АО у 14 (46,7%; 95% ДИ: 28,3–65,7%) женщин были зафиксированы неблагоприятные исходы беременности, такие как индуциро- ванные преждевременные роды, связанные с развитием тяжелой ПЭ, кровотечения в последовом и раннем послеродовом периоде, декомпенсация плацентарной недостаточности, асфиксия новорожденного, что выше, чем в группе женщин с ХАГ (17,9%; 95% ДИ: 6,1–36,9%), χ2 = 4,3 с поправкой Йейтса; р = 0,04; у беременных с АО (11,1%; 95% ДИ: 2,3–29,2%), χ2 = 6,9 с поправкой Йейтса; р = 0,009 и в Кгр (15,2%; 95% ДИ: 5,1–31,9%), χ2 = 5,9 с поправкой Йейтса; р = 0,015.
Заключение
У беременных с ХАГ и АО выявлено нарушение функции эндотелия, что подтверждалось более низкими значениями ЭЗВД, большей распространенностью сниженной и парадоксальной реакции на пробу с реактивной гиперемией, более высокими значениями эндотелинемии и гомо-цистеинемии, что вносило вклад в развитие осложнений гестации и приводило к развитию неблагоприятных исходов беременности по сравнению с беременными с изолированными проявлениями ХАГ, АО и пациентками Кгр.
Список литературы Функция эндотелия у беременных с хронической артериальной гипертензией и абдоминальным ожирением
- Захарко А.Ю., Митьковская Н.П., Доронина О.К. Акушерские проблемы у беременных с метаболическим синдромом. Известия Национальной академии наук Беларуси. Серия медицинских наук. 2018;15(2):151-159. DOI: 10.29235/1814-6023-2018-15-2-151-159.
- Хирманов В.Н. Актуальные вопросы ведения пациентов с гипертоническими кризами. Неотложная кардиология и кардио-васкулярные риски. 2018;2(2):312-322.
- Hauspurg A., Countouris M.E., Catov J.M. Hypertensive disorders of pregnancy and future maternal health: How can the evidence guide postpartum management? Curr. Hypertens. Rep. 2019;21(12):96. DOI: 10.1007/s11906-019-0999-7.
- Zeng Y., Li M., Chen Y., Wang S. Homocysteine, endothelin-1 and nitric oxide in patients with hypertensive disorders complicating pregnancy. Int. J. Clin. Exp. Pathol. 2015;8(11):15275-15279.
- Martínez-Hortelano J.A., Cavero-Redondo I., Álvarez-Bueno C., Sanabria-Martínez G., Poyatos-León R., Martínez-Vizcaíno V. Inter-pregnancy weight change and hypertension during pregnancy: A systematic review and meta-analysis. Obstet. Gynecol. 2020;135(1):68-79. DOI: 10.1097/A0G.0000000000003573.
- Poon L.C., Shennan A., Hyett J.A., Kapur A., Hadar E., Divakar H. et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention. Int. J. Gynаecol. Obstet. 2019;145(1):1-33. DOI: 10.1002/ijgo.12802.
- Хромылев А.В. Метаболический синдром и беременность. Ожирение и метаболизм. 2014;11(2):3-7. DOI: 10.14341/OMET201423-7.
- Arabin B., Stupin J.H. Overweight and obesity before, during and after pregnancy: Part 2: evidence-based risk factors and interventions. Geburtshilfe Frauenheilkd. 2014;74(7):646-655. DOI: 10.1055/s-0034-1368462.
- Mannaerts D., Faes E., Cornette J., Gyselaers W., Spaanderman M., Goovaerts I. Low-flow mediated constriction as a marker of endothelial function in healthy pregnancy and preeclampsia: A pilot study. Pregnancy Hypertens. 2019;17:75-81. DOI: 10.1016/j.preghy.2019.02.001.
- Slack E., Best K.E., Rankin J., Heslehurst N. Maternal obesity classes, preterm and post-term birth: a retrospective analysis of 479,864 births in England. BMC Pregnancy Childbirth. 2019;19(1):434. DOI: 10.1186/s12884-019-2585-z.
- Timmermans Y.E.G., van de Kant K.D.G., Oosterman E.O., Spaanderman M.E.A., Villamor-Martinez E., Kleijnen J. The impact of interpregnancy weight change on perinatal outcomes in women and their children: A systematic review and meta-analysis. Obes. Rev. 2020;21(3):е12974. DOI: 10.1111/obr. 12974.
- Denison F.C., Norwood P., Bhattacharya S., Duffy A., Mahmood T., Morris C. et al. Association between maternal body mass index during pregnancy, short-term morbidity, and increased health service costs: a population-based study. BJOG. 2014;121(1):72-81. DOI: 10.1111/1471-0528.12443.
- Catalano P., de Mouzon S.H. Maternal obesity and metabolic risk to the offspring: why lifestyle interventions may have not achieved the desired outcomes. Int. J. Obes. (Lond.). 2015;39(4):642-649. DOI: 10.1038/ijo.2015.15.
- Kalliala I., Markozannes G., Gunter M.J., Paraskevaidis E., Gabra H., Mitra A. et al. Obesity and gynaecological and obstetric conditions: umbrella review of the literature. BMJ. 2017;359:j4511. DOI: 10.1136/bmj.j4511.
- Kalhan S.C. One carbon metabolism in pregnancy: Impact on maternal, fetal and neonatal health. Mol. Cell Endocrinol. 2016;435:48-60. DOI: 10.1016/j.mce.2016.06.006.
- Harville E.W., Juonala M., Viikari J.S., Kahonen M., Raitakari O.T. Vascular ultrasound measures before pregnancy and pregnancy complications: A prospective cohort study. Hypertens. Pregnancy. 2017;36(1):53-58. DOI: 10.1080/10641955.2016.1237643.
- Van Balen L.V.A., van Gansewinkel T.A.G., de Haas S., van Kuijk S.M.J., van Drongelen J., Ghossein-Doha C. Physiological adaptation of endothelial function to pregnancy: systematic review and meta-analysis. Ultrasound Obstet. Gynecol. 2017;50(6):697-708. DOI: 10.1002/uog.17431.
- Choi R., Choi S., Lim Y., Cho Y.Y., Kim H.J., Kim S.W. et al. A prospective study on serum methylmalonic acid and homocysteine in pregnant women. Nutrients. 2016;8(12):797. DOI: 10.3390/nu8120797.
- Maru L., Verma М., Jinsiwale N. Homocysteine as predictive marker for pregnancy-induced hypertension - a comparative study of homocysteine levels in normal versus patients of PIH and its complications. J. Obstet. Gynaecol. India. 2016;66(1):167-171. DOI: 10.1007/s13224-015-0832-4.
- Wang X.C., Sun W.T., Yu C.M., Pun S.H., Underwood M.J., He G.W. et al. ER stress mediates homocysteine-induced endothelial dysfunction: Modulation of IKCa and SKCa channels. Atherosclerosis. 2015;242(1):191-198. DOI: 10.1016/j.atherosclerosis.2015.07.021.


