Функциональная регуляция адренорецепторов артерий при симпатолизисе в работающих мышцах на норэпинефрин при холодовой адаптации
Автор: Ананьев В.Н., Ананьев Г.В., Ананьева О.В.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Физиология
Статья в выпуске: 2 т.24, 2024 года.
Бесплатный доступ
Цель: изучить изменения адренореактивности артериальных сосудов на норэпинефрин при функциональном симпатолизисе в артериальных сосудах работающих мышц после 30-дневной холодовой адаптации.
Кролики, холодовая адаптация, симпатолизис, электростимуляция мышц, норэпинефрин, а1-адренорецепторы артерий
Короткий адрес: https://sciup.org/147244059
IDR: 147244059 | УДК: 612.815: | DOI: 10.14529/hsm240204
Текст научной статьи Функциональная регуляция адренорецепторов артерий при симпатолизисе в работающих мышцах на норэпинефрин при холодовой адаптации
V.N. Ananev1, , G.V. Ananev2, , O.V. Ananeva3, ,
Введение. Люди, подвергаясь воздействию холодной окружающей среды, демонстрируют ряд адаптаций. Первичные адаптации включают: а) гиперметаболические, б) изоляционные и в) привычные реакции [2]. Изоляционная адаптация характеризуется большей степенью сужения кожных сосудов, что приводит к снижению температуры кожи и уменьшению потери тепла периферией [2, 4, 9].
Гиперметаболическая или изоляционная адаптация может произойти после длительного и сильного воздействия холода, что приводит к усилению механизмов защиты от холода, таких как усиление термогенеза и сужение периферических сосудов соответственно [20]. При адаптации к холоду определены функциональные зоны воздействия холода, которые иллюстрируют, подвержен ли человек риску снижения физической работоспособности или травм в холодную погоду [11]. Определение и оценка холодной среды для всего тела описаны в Международном стандарте ISO 11079 «Эргономика тепловой среды – определение и интерпретация холодового стресса при использовании требуемой изоляции одежды (IREQ) и локальных эффектов охлаждения» [8]. При холоде организму приходится защищаться с помощью центральных меха- низмов терморегуляции, таких как сужение сосудов кожи, которое уменьшает передачу тепла к коже, и индуцированный холодом термогенез, который увеличивает выработку тепла телом [6].
Есть связь между воздействием холода и зимней смертностью, вызванной сердечными заболеваниями, но хорошо известно, что адекватный режим холодной акклиматизации оказывает благотворное влияние [18]. Так, в опытах на крысах Wistar животные подвергались воздействию холода 4 недели при t = 8 °C в течение 24 ч/сут. Получено, что инфаркт миокарда, индуцированный коронарной окклюзией в течение 20 мин с последующей 3-часовой реперфузией, был снижен до 30 % после холодовой адаптации [17, 18].
Показано, что в адаптации к холоду важную роль играет норадреналин, выделяющийся из симпатических нервных окончаний. В ходе акклимации калоригенный эффект норадреналина усиливается. Катехоламины стимулируют несократительный термогенез в бурой жировой ткани, в белой жировой ткани и скелетных мышцах [14]. Сердечно сосудистая система распределяет кислород и питательные вещества по организму за счет симпато-лизиса (активной рабочей гиперемии), что имеет решающее значение для переносимости физической нагрузки [5, 9, 10].
Механизмы симпатолизиса, увеличивающие кровоток при физической нагрузке мышц, остаются не до конца понятыми. Было показано несколько медиаторов функционального симпатолиза, включая АТФ и оксид азота, хотя относительный вклад каждого из этих медиаторов остается неясным. Сужение сегментов бедренной артерии под действием агониста α1-адренорецепторов, метоксамина, было ослаблено у тренированных мышей по сравнению с не тренированными мышами [3, 7]. Исследование роли оксида азота (NO) как модулятора функционального симпатоли-за обсуждалось в литературе [19]. Изучение влияния мышечной гиперемии при ходьбе в течение 15 недель, по 153 минуты в неделю, на артериальное давление у 5763 участников в 22 странах в возрасте от 16 до 84 лет показало, что ходьба снижает систолическое артериальное давление и в меньшей степени – диастолическое [12]. Функциональный сим-патолизис был продемонстрирован у многих видов животных (мыши, крысы, хомяки, кошки, собаки и человек) в различных экспери- ментальных условиях [15]. При гипертонии ее лечение влияет на функциональный симпато-лизис у пациентов и легко улучшает его [16].
Анализ литературных источников показал, что механизмы усиления кровотока в работающих мышцах в виде симпатолизиса изучены еще не полностью. Встречаются работы, описывающие симпатолизис у человека и животных [1, 5, 7, 12, 19] при комфортных температурах внешней среды, но нет ни одной публикации о механизмах симпатолизиса после 30 дней холодовой адаптации, чему и посвящено наше исследование.
Методы и организация исследования. Эксперименты провели на кроликах (2,5–3,5 кг) под наркозом (гексенал в/в 30 мг/кг) при в/в гепарина (1000 ед./кг). В опытах было четыре серии (группы кроликов). Контрольная серия – 20 кроликов (N1), 15 кроликов при симпато-лизисе (N2). На фоне 30 дней адаптации к холоду при ежедневном охлаждении по 6 ч при температуре –10 °С было проведено 2 серии опытов. Одна серия (N3) – после холода у 15 животных, другая серия (N4) – на фоне холодовой адаптации при симпатолизисе. Основу метода составило искусственное кровообращение задней конечности кролика с помощью перфузионного насоса постоянной производительности через бедренную артерию, с перевязкой всех анастомозов [1, 13]. Введение 8 доз от 0,5 до 30 мкг на 1 кг массы животного норэпинефрина (NE) в русло перфузируемой насосом артерии вызывало повышение давления за счет активации а1-адренорецепторов (а1-AR). Увеличение давления в бедренной артерии регистрировалось датчиком давления MPX5100DP (фирмы «Моторола») и через аналогово-цифровой преобразователь (на базе ADS1286) вводилось и записывалось постоянно в компьютер. Одновременно проводилась аналоговая запись перфузионного давления на выходе насоса на самописец Line Recorder TZ4620. Для моделирования симпа-толизиса (рабочей мышечной гиперемии) через игольчатые электроды сокращали мышцы конечности при частоте 5 Гц, при напряжении 10 В (L = 5 мс).
Для выяснения механизмов фармакодинамики и фармакокинетики NE при действии его на а1-AR артерий проведен анализ в двойных обратных координатах Lineweaver–Burk, где по данным доза-эффект таблицы и рис. 1 экспериментальные точки соединяли прямой методом наименьших квадратов [1, 13] до пе-
Активность а1-адренорецепторов (М ± m, мм рт. ст.) артерий конечности кролика на 8 доз норэпинефрина в четырех сериях опытов: в контроле (N1) – 20 кроликов, при симпатолизисе (N2) – 15 кроликов, 30 дней холодовой адаптации (N3) – 15 кроликов, при симпатолизисе на фоне 30 дней холодовой адаптации (N4) – 15 кроликов Activity of α1-adrenergic receptors (M ± m, mmHg) in response to 8 doses of norepinephrine in a series of experiments: control (N1) 20 rabbits, sympatholysis (N2) 15 rabbits, 30-day cold adaptation (N3) 15 rabbits, sympatholysis and 30-day cold adaptation (N4) 15 rabbits
|
Серия Experiment |
Доза, мкг/кг (Y) Dose, mcg/kg |
0,5 (Y) |
1,0 (Y) |
2,0 (Y) |
5,0 (Y) |
10 (Y) |
15 (Y) |
20 (Y) |
30 (Y) |
|
N1 |
Контроль (N1) Control (N1) (М1 ± m1) mmHg |
65 ± 2,1 |
94 ± 1,7 |
122 ± 3,5 |
148 ± 4,2 |
159 ± 4,6 |
163 ± 5,1 |
165 ± 4,2 |
167 ± 4,5 |
|
N2 |
Симпатолиз Sympatholysis (М2 ± m2) mmHg |
3 ± 0,12* |
6 ± 0,14* |
11 ± 0,3* |
26 ± 0,8* |
45 ± 1,2* |
60 ± 1,8* |
71 ± 1,1* |
88 ± 1,7* |
|
N3 |
Холод 30 дней 30-day cold adaptation (М3 ± m3) mmHg |
51 ± 2,1* |
75 ± 1,7* |
97 ± 3,5* |
117 ± 4,2* |
126 ± 4,6* |
130 ± 5,1* |
132 ± 4,2* |
133 ± 4,5* |
|
N4 |
Холод 30 дней При симпатолизе 30-day col adaptation + Sympatholysis (Sym) (М4 ± m4) mmHg |
2 ± 0,12* ▲ |
3,8 ± 0,14* ▲ |
7,3 ± 0,3* ▲ ■ |
16,6 ± 0,8* ▲ ■ |
29 ± 1,2* ▲ ■ |
38,3 ± 1,8* ▲ ■ |
46 ± 1,1* ▲ ■ |
57 ± 1,7* ▲ ■ |
Примечание. * - p < 0,01 изменения достоверны к контролю (N1); ▲ - p < 0,01 изменения достоверны к Холод 30 дней (N3); ■ - p < 0,05 изменения достоверны к Симпатолизис (N2).
Note. * - p < 0.01 changes are significant compared to control animals (N1); ▲ - p < 0.01 changes are significant compared to a 30-day cold adaptation (N3); ■ - p < 0.05 changes are significant compared to sympatho-lysis (N2).
ресечения с осью ординат и абсцисс. Это позволило определить максимальное количество активных адренорецепторов (Pm), что соответствовало возбуждению 100 % a1-AR, так же по этому графику находили чувствительность (1/K) a1-AR к NE. Обратная величина (1/К) равна дозе (К) NE, вызывающей 50 % от максимального (Pm) сокращения артерий. Полученные данные статистически обработаны по Стьюденту.
Результаты исследования и их обсуждение. В контрольной группе кроликов (N1) на все дозы NE происходило дозозависимое увеличение перфузионного давления (см. таблицу и рис. 1). Так, на дозу NE 0,5 мкг/кг ПД в русле бедренной артерии на выходе насоса увеличилось до 65 ± 2,1 мм рт. ст., на дозу NE 5 мкг/кг ПД увеличилось до 148 ± 4,2 мм рт. ст., а доза 30 мкг/кг вызвала увеличение ПД до 167 ± 4,5 мм рт. ст. Анализ реакций доза-эффект в контрольной группе кроликов (N1) в двойных координатах Lineweaver–Burk показал, что максимальная возможная реакция (Pm) при возбуждении 100 % a1-AR артерий равна Pm = 172 мм рт. ст. Эта величина определяется экстраполяцией прямой данных опытов конт- роля (N1) на ось ординат (рис. 2), где при пересечении с ней получаем 1/Pm = 0,0058 – обратная величина Pm, откуда Pm = 172 мм рт. ст. При экстраполяции прямой точек опыта в контроле (N1) до пересечения с осью абсцисс (см. рис. 2, требуется увеличение масштаба графика) получаем величину чувствительности рецепторов к NE (1/К), обратная величина которой (К) является дозой NE, вызывающей 50 % от максимальной реакции (Pm). Мы получили, что К = 0,833 мкг/кг NE, соответственно, чувствительность взаимодействия NE c а1-адрено-рецепторами артерий конечности была равна 1/К = 1,2 1/мкг·кг.
Исследование результатов доза-эффект NE на артерии кроликов группы (N2) на фоне симпатолизиза (рабочей мышечной гиперемии) при электростимуляции мышц показало значительное увеличение кровотока в работающих мышцах за счет снижения реактивности а1-AR артерий к NE. Эти данные были опубликованы нами в журнале [1]. Но там не было анализа реактивности артерий к NE при симпатолизисе при кинетическом анализе результатов в двойных обратных координатах Lineweaver–Burk (см. рис. 2).
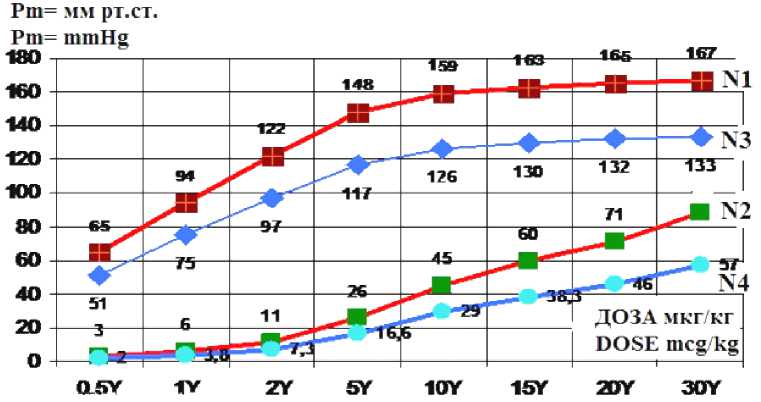
Рис. 1. Увеличение перфузионного давления в бедренной артерии в 4 группах кроликов на 8 доз норэпинефрина в контрольной группе животных (N1), кроликов при симпа-толизисе (N2), животных после 30 дней холодовой адаптации (N3), животных после 30 дней холодовой адаптации при симпатолизисе (N4). Ось абсцисс: доза норэпинефрина в мкг/кг (Y). Ось ординат: увеличение перфузионного давления (мм рт. ст.). Все различия величин опытов при симпатолизисе (N2) и контроле (N1) достоверны (P < 0,01). Все различия величин опытов при симпатолизисе на фоне 30 дней холода (N4) и после 30 дней холода (N3) достоверны (P < 0,01). Данные опытов при симпатолизисе на фоне 30 дней холода (N4) и симпатолизисе (N2) достоверны при дозах норэпине ф рина от 2 мкг/кг до 30 мкг/кг (P < 0,05) Fig. 1. Comparative Analysis of Norepinephrine-Induced Perfusion Pressure Changes in Rabbits Across Different Conditions: Control Group (N1); Sympatholysis Group (N2); Cold Adaptation Group (N3); Combined Condition Group (N4). X-Axis: Norepinephrine dose administered (mcg/kg); Y-Axis: Increase in perfusion pressure (mm Hg); Statistical Significance: differences are significant between the sympatholysis group (N2) an d the control group (N1) (P < 0.01); differences are significant between the combined condition group (N4) and the cold adaptation group (N3) (P < 0.01); differences are significant for experime n ts involving sympatholysis w ith or without cold adaptation (N2 and N4) at norepinephrine doses ranging from 2 μg/kg to 30 μg/kg (P < 0.05)
Анализ результатов опытов (N2) в координатах Lineweaver–Burk показал (см. рис. 2), что при симпатолизисе уменьшается достоверно (P < 0,05) прессорная реакция артерий в работающей мышце за счет уменьшения чувствительности (1/К) а1-AR в 34,29 раза с 1/К = 1,2 в контроле (N1) – до величины 1/К = 0,035 при симпатолизисе (N2). Количество же активных а1-адренорецепторов (Pm) в контрольной группе (N1) и при симпатолизисе (N2) не изменилось и составляло Pm = 172 мм рт. ст. в обеих этих группах (см. рис. 2).
Анализ результатов изменения адренореактивности артерий к NE у кроликов после 30 дней холодовой адаптации (N3) показал, что на все дозы NE от 0,5 мкг/кг до 30 мкг/кг прессорное действие достоверно (P < 0,05) было меньше, чем в контрольной группе (N1) без воздействия холода (см. таблицу и рис. 1). Анализ механизмов уменьшения реактивности a1-AR артерий к NE после 30 дневной холодовой адаптации в координатах Lineweaver– Burk (см. рис. 2) показал, что после холодовой адаптации (N3) уменьшилось количество активных (Pm) a1-AR в 1,255 раза (снизилось на 20,34 %) с Pm = 172 мм рт. ст. в контроле до Pm = 137 мм рт. ст. после холода (N3) (P < 0,05). Но чувствительность а1-адреноре-цепторов к NE в контрольной группе (N1) и после холодовой адаптации (N2) не изменилась и была одинакова, 1/К = 1,2 (К = 0,833 мкг/кг).
Нами доказано, что при симпатолизисе у кроликов (N4) после холода сокращение артерий было намного меньше, чем у к роликов (N3) с холодовой адаптацией без симпатоли-зис а (см. таблицу и рис. 1) (P < 0,05). Например, доза (NE) 0,5 мкг/кг увеличила давление в артерии после холода (N3) на 51 м м рт. ст., а при симпатолизисе и холоде (N4) только на 2 мм рт. ст., что было в 25,5 раза меньше, чем без симпатолизиса. При д озе (NE) 1 мкг/кг после холода (N3) давление артерий бедренной артерии увеличилось на 75 м м рт. ст., а при симпатолизисе после холода (N4) увеличилось только на 3,8 мм рт. ст., что было в 19,7 раз меньше. На все другие дозы норэпинефрина на фоне холода при симпатолизисе (N4) прессорная реакция была меньше, чем
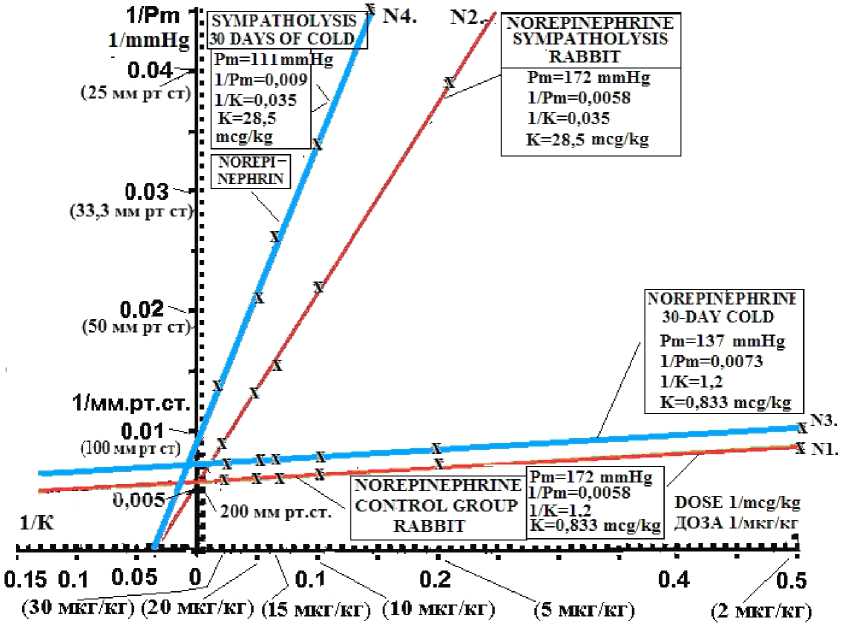
Рис. 2. Увеличение перфузионного давления в бедренной артерии в 4 группах кроликов на 8 доз норэпинефрина в контрольной группе животных (N1), кроликов при симпатолизисе (N2), животных после 30 дней холодовой адаптации (N3), животных после 30 дней холодовой адаптации при симпатолизисе (N4) в двойных обратных координатах Lineweaver–Burk. Ось абсцисс: доза норэпинефрина в обратной величине 1/(мкг/кг). Ось ординат: перфузионное давление в обратной величине 1/(мм рт. ст.)
Fig. 2. Comparative Analysis of Norepinephrine-Induced Perfusion Pressure Changes in Rabbits Across Different Conditions in Lineweaver–Burk plots (double reciprocal plots): Control Group (N1); Sympatholysis Group (N2); Cold Adaptation Group (N3); Combined Condition Group (N4). X-Axis:
Norepinephrine dose administered 1/(mcg/kg); Y-Axis: Increase in perfusion pressure 1/(mm Hg)
после холода (N3) (см. таблицу). При дозе (NE) 30 мкг/кг после холода (N3) (см. таблицу) давление выросло на 133 мм рт. ст., а при симпатолизисе на фоне холода (N4) увеличилось только на 57 мм рт. ст., то есть было в 2,33 раза меньше (см. рис. 1).
Наши результаты исследования о снижении а1-адренореактивности при симпатолизисе согласуются с данными исследований [1, 7]. Но в этих работах не исследовался симпатоли-зис после 30 дней адаптации к холоду. Мы не нашли ни одной работы, где авторы анализировали бы эффекты симпатолизиса в двойных обратных координатах Lineweaver–Burk.
Полученные нами данные об увеличении кровотока и снижении а1-адренореактивности артерий при симпатолизисе согласуются с результами работ авторов [7, 12, 16], которые показали, что занятие спортом способствует снижению системного давления за счет сим-патолизиса.
В данных литературы мы не нашли работ о проявлении симпатолизиса после холодовой адаптации, как и анализа взаимодействия лиганд рецептор в двойны х обратных координат а х Lineweaver–Burk. Поэтому на ш и данные представляют как практический методический интерес, так и раскрывают фундамент а льные механизмы изменений при х олодовой адаптации.
Заключение. Исследование показало, что симпатолизис как механизм увеличения кровотока в работающих мышцах осуществляется за счет уменьшения чувствительности (1/К) а1-адренорецепторов артериальных сосудов как при комфортной температуре, так и после 30 дней холодовой адаптации при –10 °С. При сравнении симпатолизиса без холода и симпатолизиса после 30 дней холодовой адаптации впервые получено, что на фоне холода симпатолизис достоверно гораздо более выражен за счет снижения количества активных а1-адренорецепторов, при одинаковой чувствительности a1-AR. При симпатолизисе на фоне 30 дней холодовой адаптации количество А1-AR было Pm = 111 мм рт. ст., а без холода при симпатолизе а1-AR – Pm = 172 мм рт. ст., т. е. было меньше в 1,55 раза. Чувствительность а1-AR при симпатолизисе (1/К) и при симпа- толизисе на фоне 30 дней холодовой адаптации была одинакова и составила 1/К = 0,035 (К = 28,5 мкг/кг). Полученные данные показывают, что кровоток в работающих мышцах после 30 дней холодовой адаптации при сим-патолизисе более выражен, чем в мышцах без холодовой адаптации.
Список литературы Функциональная регуляция адренорецепторов артерий при симпатолизисе в работающих мышцах на норэпинефрин при холодовой адаптации
- Ананьев В.Н., Ананьев Г.В., Ананьева О.В. Значение адренорецепторов артерий при симпатолизисе в регуляции кровотока в работающих мышцах // Человек. Спорт. Медицина. 2023. Т. 23, № 2. С. 61–68. [Ananev V.N., Ananev G.V., Ananeva O.V. The Importance of Arterial Adrenoceptors in Sympatholysis in the Regulation of Blood Flow in Working Muscles. Human. Sport. Medicine, 2023, vol. 23 (2), pp. 61–68. (in Russ.)] DOI: 10.14529/hsm230208
- Castellani J.W., Young A.J. Human Physiological Responses to Cold Exposure: Acute Responses and Acclimatization to Prolonged Exposure. Auton Neuroscience, 2016, vol. 196, pp. 63–74. DOI: 10.1016/j.autneu.2016.02.009
- Cooper I.R., Just T.P., DeLorey D.S. β‐Adrenoreceptors do not Oppose Sympathetic Vaso-constriction in Resting and Contracting Skeletal Muscle of Male Rats. Applied Physiology, Nutrition and Metabolism, 2019, vol. 44 (11), pp. 1230–1236. DOI: 10.1139/apnm-2019-0130
- Daanen H.A., Van Marken Lichtenbelt W.D. Human whole Body Cold Adaptation. Temperature, 2016, vol. 3 (1), pp. 104–118. DOI: 10.1080/23328940.2015.1135688
- Dulaney C.S., Heidorn C.E., Singer T.J., McDaniel J. Mechanisms that Underlie Blood Flow Regulation at Rest and During Exercise. Advances Physiology Education, 2023, vol. 47 (1), pp. 26–36. DOI: 10.1152/advan.00180.2022
- Haman F., Souza S., Castellani J.W. et al. Human Vulnerability and Variability in the Cold: Establishing Individual Risks for Cold Weather Injuries. Temperature, 2022. DOI: 10.1080/23328940. 2022.2044740
- Horst J., Møller S., Kjeldsen S.A.S. et al. Functional Sympatholysis in Mouse Skeletal Muscle Involves Sarcoplasmic Reticulum Swelling in Arterial Smooth Muscle Cells. Physiology Rep., 2021, vol. 9 (23), e15133. DOI: 10.14814/phy2.15133
- ISO 11079:2007. Ergonomics of the Thermal Environment – Determination and Interpretation of Cold Stress when Using Required Clothing Insulation (IREQ) and Local Cooling Effects. Available at: https://www.iso.org/obp/ui/#iso:std:iso:11079:ed-1:v1:en [Google Scholar].
- Joyner M.J., Casey D.P. Regulation of Increased Blood Flow (Hyperemia) to Muscles During Exercise: a Hierarchy of Competing Physiological Needs. Physiology Rev., 2015, vol. 95, pp. 549–601. DOI: 10.1152/physrev.00035
- Just T.P., Cooper I.R., DeLorey D.S. Sympathetic Vasoconstriction in Skeletal Muscle: Adaptations to Exercise Training. Exercise Sport Science Rev., 2016, vol. 44, pp. 137–143. DOI: 10.1249/ JES.0000000000000085
- Kingma B., Sullivan-Kwantes W., Castellani J. et al. We are all Exposed, but some are More Exposed Than Others. International Journal Circumpolar Healthcare, 2023, vol. 82 (1), 2199492. DOI: 10.1080/22423982.2023.2199492
- Lee L.L., Mulvaney C.A., Wong Y.K.Y. et al. Walking for Hypertension. Cochrane Data-base Syst Rev., 2021, vol. 24, vol. 2 (2), CD008823. DOI: 10.1002/14651858
- Manukhin B.N., Anan'ev V.N., Anan'eva O.V. Effect of Cold Adaptation of α- and β-adrenergic Responses of Blood Pressure in Hindlimb and Small Intestine in Situ and Systemic Blood Pressure in Rabbits. Biology Bulletin, 2007, vol. 34, no. 2, pp. 133–143. DOI: 10.1134/S1062359007020057
- Maslov L.N., Vychuzhanina E.A. Role of Sympatho-adrenomedullar System in Adaptation to Cold. Ross Fiziol Zh Im I M Sechenova, 2015, vol. 101 (2), pp. 145–162. PMID: 26012107
- Sarelius I., Pohl U. Control of Muscle Blood Flow During Exercise: Local Factors and Integrative Mechanisms. Acta Physiology, 2010, vol. 199, pp. 349–365. DOI: 10.1111/j.1748-1716.2010.02129.x
- Thomas G.D. Functional Sympatholysis in Hypertension. Auton Neuroscience, 2015, vol. 188, pp. 64–68. DOI: 10.1016/j.autneu.2014.10.019
- Tibenska V., Benesova A., Vebr P. Gradual Cold Acclimation Induces Cardioprotection without Affecting β-adrenergic Receptor-mediated Adenylyl Cyclase Signaling. Journal Appl. Physiology, 2020, vol. 128 (4), pp. 1023–1032. DOI: 10.1152/japplphysiol.00511.2019
- Tibenska V., Marvanova A., Elsnicova B. et al. The Cardioprotective Effect Persisting During Recovery from Cold Acclimation is Mediated by the β2-adrenoceptor Pathway and Akt Activation. Journal Appl Physiology, 2021, vol. 130 (3), pp. 746–755. DOI: 10.1152/japplphysiol.00756.2020
- Venturelli M., Rossman M.J., Ives S.J. et al. Passive Leg Movement-induced Vasodilation and Exercise-induced Sympathetic Vasoconstriction. Auton Neuroscience, 2022, vol. 239, 102969. DOI: 10.1016/j.autneu.2022.102969
- Yurkevicius B.R., Alba B.K., Seeley A.D., Castellani J.W. Human Cold Habituation: Physiology, Timeline, and Modifiers. Temperature (Austin), 2021, vol. 9 (2), pp. 122–157. DOI: 10.1080/ 23328940.2021.1903145


