Функциональное состояние фетоплацентарного комплекса у беременных с ожирением и метаболическим синдромом
Автор: Кан Нина Ивановна, Федорина Татьяна Александровна, Николаева-Балл Диана Раисовна, Ванина Людмила Николаевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Цель - изучить особенности функционального состояния фетоплацентарного комплекса в зависимости от формы ожирения и развития метаболического синдрома. Материалы и методы. Исследовали состояние фетоплацентарного комплекса у 229 женщин, из них 46 - с нейроэндокринным ожирением (НЭО), 41 - с алиментарно-конституциональным (АКО), 20 женщин без ожирения; а также 85 - с метаболическим синдромом (МС) и 37 женщин без метаболического синдрома. Ультразвуковую фето- и плацентометрию, доплерометрию сосудов матки и пуповины осуществляли на ультразвуковых аппаратах HDJ-3000 и Aloka SSD-650. Морфологическое исследование плацент проводили по методу А.П. Милованова и А.И. Брусиловского в модификации Е.П. Калашниковой. Для оценки роста и развития плода использовали пер-центильную оценку ультразвуковой биометрии. Результаты. У беременных с ожирением увеличиваются показатели систоло-диастолического отношения (СДО) в артерии пуповины с 28 нед. беременности на 17,3 %, после 36 нед. -на 33,8 %, что указывает на риск антенатального поражения плода. Плаценты женщин с НЭО имеют морфологические признаки активации плацентарных гормонов в 53,3 % случаев в форме патологической незрелости ворсин; у женщин с АКО в 67,9 % имеет место угнетение синтеза плацентарных гормонов, сочетающееся в 57,1 % случаев с маловодием. При МО показатели СДО в маточных артериях превышают показатели нормы в 75,3 % случаев, в артериях пуповины - в 57,7 %, в аорте плода - в 62,4 %. Заключение. У каждой второй женщины с НЭО снижена скорость кровотока в пуповине плода, нарушено формирование ворсинчатого дерева, что указывает на развитие вторичной плацентарной недостаточности. При АКО выявлены деструктивные изменения, ишемия плаценты, склерозирование и фиброз стромы, что является признаком первичной декомпенсированной плацентарной недостаточности. При МО на ранних этапах беременности отмечены выраженные реологические нарушения в меж-ворсинчатом пространстве и ангиоматозные изменения в ворсинах с выключением терминальных ворсин из плацентарного обмена.
Адаптивные реакции, метаболический синдром, беременность, преэклампсия, система "мать-плод"
Короткий адрес: https://sciup.org/14113301
IDR: 14113301 | УДК: 618.35:616-056.52 | DOI: 10.23648/UMBJ.2017.27.7078
Текст научной статьи Функциональное состояние фетоплацентарного комплекса у беременных с ожирением и метаболическим синдромом
Введение. ВОЗ рассматривает ожирение как эпидемию, охватившую миллионы людей. У женщин с ожирением значительно повышается частота осложненного течения беременности, родов и антенатальных повреждений плода, обусловленных формированием плацентарной недостаточности [1-3].
При ожирении, особенно абдоминального типа, наблюдаются гормональные и метаболические нарушения, объединенные в понятие «метаболический синдром» (МС). Распространенность МС, по данным ВОЗ, дости- гает 20 % среди взрослого населения. При метаболическом синдроме патогенетическим механизмом развития осложнений беременности, в частности преэклампсии и хронической плацентарной недостаточности со сниженным плодово-плацентарным кровотоком, является дисфункция эндотелия и протром-бический эффект, в т.ч. и в сосудах плаценты [4-б].
Современное представление о морфофункциональных признаках фетоплацентар-ной недостаточности (ФПН) основано на оценке состояния компенсаторно-приспособительных реакций плаценты [7]. При ожирении снижаются объем и масса плаценты [8], кровоток в зависимости от степени ожирения [9]. Однако сведения о функциональном состоянии фетоплацентарного комплекса при ожирении и метаболическом синдроме у матери достаточно противоречивы.
Цель исследования . Изучение особенностей функционального состояния фетопла-центарного комплекса в зависимости от формы ожирения и развития метаболического синдрома.
Материалы и методы. Абдоминальный тип ожирения определяли по отношению объемов талии и бедра (ОТ/ОБ>0,85). Для верификации МС использовали критерии Международной федерации диабета (International Diabets Federation, 2005).
Изучали особенности функционального состояния фетоплацентарного комплекса у 229 женщин, из них 46 чел. с нейроэндокринным ожирением (НЭО), 41 чел. с алиментарно-конституциональным ожирением (АКО), 20 женщин без ожирения, 85 чел. с МС и 37 женщин без МС.
Ультразвуковую фето- и плацентомет-рию, доплерометрию сосудов матки и пуповины в 50 исследованиях осуществляли на ультразвуковых аппаратах HDJ-3000 и А1ока SSD-650, снабженных доплерометрическим блоком пульсовой волны. Изучали кривые скорости кровотока в артерии пуповины и аорте плода, в маточных артериях с расчетом систоло-диастолического отношения (СДО) и индекса резистентности: ИР=А-В/А, где А – максимальная систолическая скорость кровотока, В – конечная диастолическая скорость кровотока.
Морфологическое исследование плаценты проводили по методу А.П. Милованова и А.И. Брусиловского (1987) в модификации Е.П. Калашниковой (1988).
Для исследования роста и развития плода использовали перцентильную (П) оценку его ультразвуковой (УЗ) биометрии.
Математическую обработку данных производили методами описательной статистики с помощью пакетов прикладных программ Microsoft Office Excel 7.0 и STATISTICA 8.0.
Результаты. Динамика отклонения биометрических значений у беременных с ожирением от значений, характерных для популяции, представлена на рис. 1.
Кривая pоста бипариетального размера головы (БПР) от 17 до 32 нед. расположена ниже 50П популяционного уровня и в эти же сроки от 24 до 48 % наблюдений – ниже 25П, что является признаком гипотрофии плода; в 33–36 нед. кривая роста соответствовала 54П (34,4–71,2), затем наблюдалось снижение до 37П (23,5–55,1).
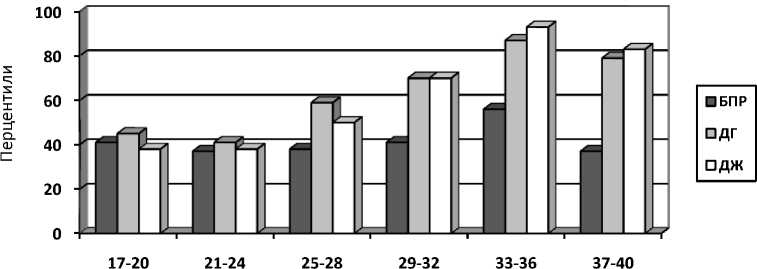
Рис. 1. Динамика УЗ-размеров плода у беременных с ожирением
Анализ динамики диаметра груди (ДГ) плода выявил отставание в сроки с 17 до 25 нед. беременности (медиана показателя от 25 до 50П), с 26 до 28 нед. показатели соответствовали 50П (38,1–48,4), у бepeменных с НЭО данный показатель превосходил популяционное значение (больше 75П).
При анализе кривых poстa диаметра живота (ДЖ) плода было отмечено, что до 24 нед. беременности показатели медианы находились ниже 50П (37,2–78,1). К 27 нед. ДЖ плодов у матерей с АКО достигали медианы 51П (27,1–75,1), в то время как у беременных с НЭО дальнейший рост параметра вплоть до родоразрешения продолжал увеличиваться.
Аналогично предыдущим параметрам с ранних сроков гестации до 29 нед. 20-36 % всех измерений ДЖ находились ниже уровня 25П, что является характерным признаком гипотрофии плода и плацентарной недостаточности у беременных с АКО.
Показатели кровотока в артерии пуповины (табл. 1) свидетельствовали о состоянии сосудистого сопротивления периферического русла плаценты
Таблица 1
|
Группа |
Срок гестации |
||
|
21–27 нед. |
28–36 нед. |
37–40 нед. |
|
|
НЭО, n=46 |
3,81 (3,44-4,81) |
3,78* (3,10-4,33) |
3,48** (3,09-4,05) |
|
АКО, n=41 |
3,41 (3,17-3,76) |
3,14* (2,87-3,65) |
3,05** (2,70-3,51) |
|
Контрольная группа, n=20 |
3,22 (2,3-3,92) |
2,95 (2,63-3,10) |
2,60 (2,30-2,95) |
Примечание. Достоверность различий с контрольной группой: * - р<0,05; ** - р<0,001. Далее обозначения те же.
Показатели СДО в артерии пуповины у беременных с ожирением
У беременных с ожирением с 28 нед. гестации выявлялось достоверное (р<0,05) увеличение показателей СДО, что отражало снижение плацентарной перфузии и наличие выраженной плацентарной недостаточности. У беременных с ожирением и без него разница значений данного показателя составляла 17,3 % (р=0,05) до 36 нед., 33,8 % (р<0,001) - после 36 нед., что свидетельствовало о нарастании тяжести нарушений в системе «мать-плацента-плод» и указывало на повышение риска антенатального поражения плода.
Доплерограмма кровотока в артерии пуповины у женщин с ожирением в 36 нед. представлена на рис. 2.
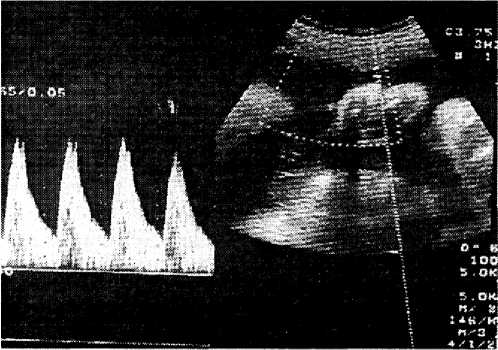
Рис. 2. Доплерограмма кровотока в артерии пуповины у женщины с ожирением (беременность 36 нед.)
Нулевой и отрицательный диастолический кровоток в артерии пуповины у беременных с ожирением (как признак критиче- ского кровотока) был выявлен в 38,9 % наблюдений при антенатальной гибели плода и постнатальной гибели новорожденного.
Изучение состояния кровотока в аорте плода показало достоверное (р<0,05) повышение показателя СДО с 28 нед. гестации (табл. 2).
У 80 % беременных с АКО с 28 нед. беременности показатели СДО в аорте плода превышали верхние границы контрольной группы (р<0,001) и были достоверно (р<0,01) выше аналогичных показателей беременных с НЭО. Такая выраженная декомпенсация плодово-плацентарного кровообращения возникала на фоне преэклампсии.
Таблица 2
|
Группа |
Срок гестации |
||
|
21–27 нед. |
28–36 нед. |
37–40 нед. |
|
|
НЭО, n=46 |
6,03 (5,01-6,65) |
6,05* (5,55-6,77) |
5,78** (5,32-6,71) |
|
АКО, n=41 |
5,96 (4,56-6,47) |
5,85* (5,12-6,53) |
5,64** (5,30-6,54) |
|
Контрольная группа, n=20 |
5,65 (5,12-6,53) |
4,85 (4,41-5,71) |
4,31 (4,19-5,28) |
Показатели СДО в аорте плода у беременных с ожирением
Параллельно с увеличением срока гестации возрастала и степень нарушения гемодинамики у плода. В 28-36 нед. разница в значениях данного показателя у беременных с ожирением и без него составляла 24,7 %, после 36 нед. гестации достигала 30,9 %, что свидетельствовало о нарастании признаков страдания плода (рис. 3).
В 27,8 % наблюдений было выявлено критическое состояние кровотока и имели место антенатальная гибель плода и постнатальная гибель новорожденного. Наличие нулевого или отрицательного диастолического компонента кровотока в аорте плода сви- детельствовало о критическом состоянии фе-топлацентарного комплекса.
Показатели СДО и ИР маточно-плацентарного и фетоплацентарного кровотока у беременных с МС представлены в табл. 3.
Отмечено повышение СДО в артерии пуповины у 57,7 % беременных с МС и у 67,6 % женщин без МС. Повышение СДО в аорте плода зафиксировано у 62,4 % женщин с МС и только у 43,2 % в группе без МС. У 36,5 % плодов женщин с МС показатели аортального кровотока сочетались с изменениями пуповинного кровотока.
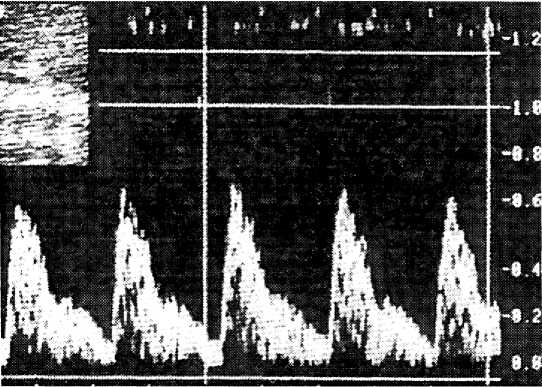
Рис. 3. Доплерограмма кровотока в грудной аорте плода у женщины с ожирением (беременность 34 нед.)
Таблица 3
Показатели СДО и ИР маточно-плацентарного и фетоплацентарного кровотока
|
Показатель |
МС, n=85 |
Без МС, n=37 |
||||||
|
Маточная артерия |
Артерия пуповины |
Аорта плода |
Маточная артерия |
Артерия пуповины |
Аорта плода |
|||
|
левая |
правая |
левая |
правая |
|||||
|
СДО |
2,04±0,22 |
2,17±0,32 |
2,57±0,09* |
6,50±0,57* |
1,93±0,15 |
1,98±0,23 |
2,49±0,12 |
5,94±0,02 |
|
ИР |
0,48±0,03 |
0,49±0,04 |
0,61±0,01* |
0,83±0,01* |
0,48±0,03 |
0,47±0,05 |
0,59±0,02 |
0,82±0,02 |
Примечание. *- достоверные различия с группой без МС (р<0,05).
Таким образом, у беременных с метаболическим синдромом выявлены нарушения маточно-плацентарного и фетоплацентарного кровотоков, формирующие плацентарную недостаточность и способствующие развитию постгипоксических осложнений у новорожденных.
Сравнение доплерометрических показателей нарушений кровотока с биофизическим профилем плода показало достоверное уменьшение окружности живота (р<0,05), что является признаком гипотрофии плода и проявлением плацентарной недостаточности у беременных с МС.
Проведенный микроскопический анализ плацент позволил разделить их на три подгруппы по типам эндокринной активности эпителиальных и вневорсинчатых структур: с морфофункциональными признаками активации синтеза плацентарных гормонов (37); с относительно нормальным уровнем гормональной функции синцитиотрофобласта ворсин и вневорсинчатых структур (33); с признаками угнетения эндокринной функции плаценты (28). В контрольной группе было 20 наблюдений.
У пациенток с НЭО плацента имела морфологические признаки активации синтеза плацентарных гормонов. Макроскопически плацентарная ткань была избыточно полнокровна, с небольшими по объему межворсинчатыми кровоизлияниями, подчеркнутым рисунком котиледонов. В большинстве наблюдений (53,3 %) преобладал вариант патологи- ческой незрелости. Доминировали ворсины c умеренной васкуляризацией стромы и уменьшением объема межворсинчатого пространства (рис. 4).
В 26,7 % наблюдений диагностировано преобладание промежуточных незрелых ветвей; в 13,3 % - вариант относительной незрелости ворсин. При электронно-микроскопическом исследовании незрелые ворсины имели утолщенный эпителиальный слой, выраженную плотную сеть микроворсинок на поверхности синцитиотрофобласта, гипертрофированную гранулярную сеть (рис. 5).
В плодных капиллярах видно выбухание ядерной зоны в просвет капилляра и множественные цитоплазматические отростки (рис. 6), микроскопические псевдокисты.
Имели место и реологические нарушения. В незрелой строме ворсинчатого дерева отмечены изменения сосудистой сети компенсаторного характера.
Морфологический тип угнетения синтеза плацентарных гормонов выявлен в 67,9 % плацент женщин с АКО и в 32,1 % случаев при НЭО. Ворсинчатое дерево плаценты незрелое. Отмечено диссоциированное развитие котиледонов (30,8 %) и доминирование промежуточных дифференцированных ворсин со слабой васкуляризацией. Вариантом патологической незрелости оказались случаи, когда превалировали промежуточные незрелые ворсины с четко обозначенными стромальными каналами и клетками Кащенко– Гофбауэра в их просветах (рис. 7).
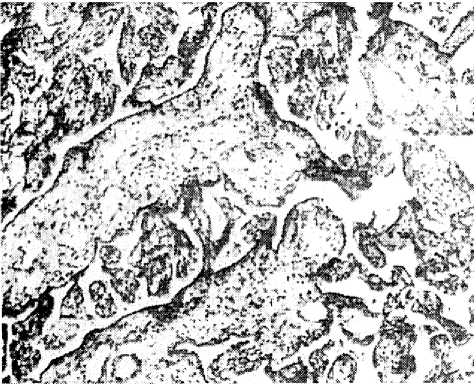
Рис. 4. Преобладание промежуточных ворсин с небольшим числом терминальных ветвей (окраска гематоксилином и эозином, ув. ×63)
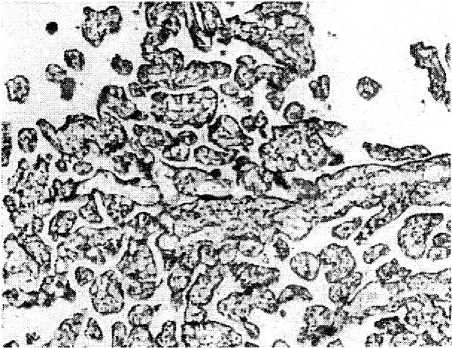
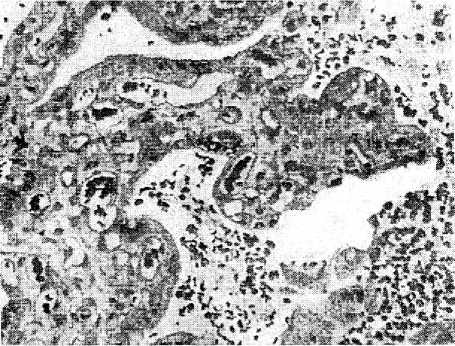
Рис. 5. Ветвление многочисленных терминальных ворсин в плацентах женщин с ожирением
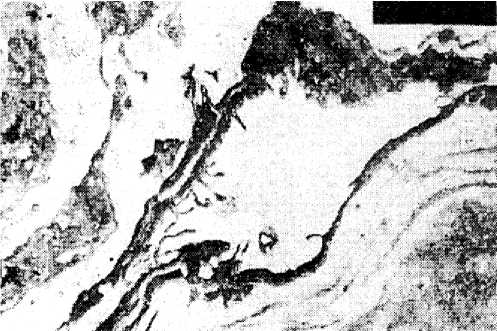
Рис. 6. Продольный срез узкого капилляра, неравномерная толщина эндотелиального слоя, многочисленные выpocты в просвет, перикапиллярный склероз (электроннограмма, ув. ×2500)
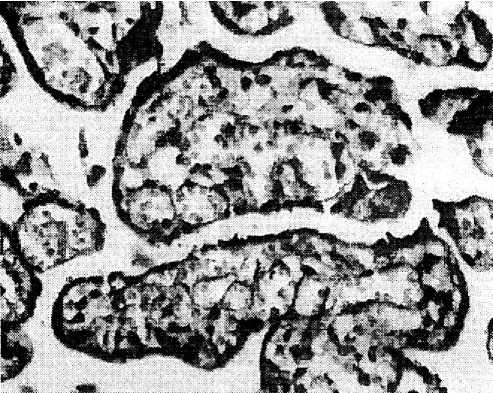
Рис. 7. Компенсаторный ангиоматоз в плацентах у женщин с ожирением: терминальные ворсины с широкими синусоидами, заполненными эритроцитами плода (окраска гематоксилином)
Наблюдались участки с обширными скоплениями межворсинчатого фибринолиза, псевдоинфарктов, выявлялись функциональные зоны при сближении промежуточных дифференцированных и терминальных ворсин, которые не участвовали в маточноплацентарной циркуляции. Отмечено значительное урежение поверхностного слоя микроворсинок и истончение цитоплазмы синци-тиотрофобласта с обеднением органелл. В ядрах синцитиотрофобласта обнаруживался некроз. Выявлены изменения в плодных ка- пиллярах и эритроцитах, изменение их формы, что косвенно характеризует нарушение эритропоэза гипоксической природы у плода.
Микроскопическое исследование плацент у беременных с МС показало наличие ангиоматоза ворсин (рис. 8) и реологических нарушений в межворсинчатом пространсте (рис. 9). При морфологическом исследовании плацент женщин с МС отмечалась более тяжелая фетоплацентарная недостаточность на более ранних этапах беременности относительно женщин с ожирением.
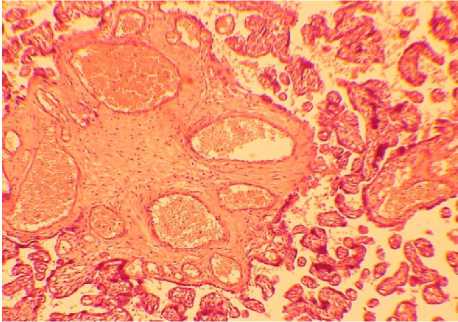
Рис. 8. Ангиоматоз опорной ворсины (ув. ×100)
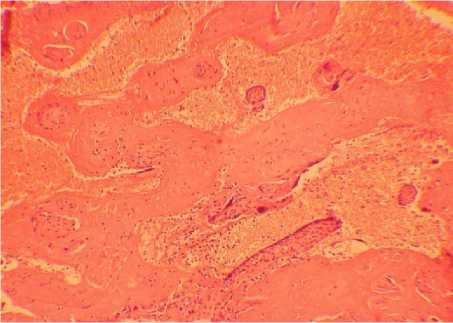
Рис. 9. Межворсинчатое кровоизлияние (ув. ×100)
Обсуждение. Наиболее частым осложнением у беременных с ожирением является развитие хронической плацентарной недостаточности и гипоксии внутриутробного плода. В плацентах преобладают циркуляторные нарушения, обусловленные снижением скорости кровотока и отеком тканей [2], явления склероза [4]. Морфологическим субстратом компенсаторно-приспособительных механизмов адаптации следует признать усиление васкуляризации ворсин, образование синцитиальных узлов, пролиферации ворсин для уменьшения риска формирования синдрома задержки развития плода из-за сниженного маточно-плацентарного кровотока.
Оценивая гемодинамические показатели при доплерометрическом исследовании характера внутриплацентарного и плодовоплацентарного кровотока, мы отметили, что нулевые значения диастолического кровотока в аорте плода ассоциируются с аналогичными изменениями кровотока в пуповине плода. Нулевой диастолический кровоток в аорте плода обнаружен в 30,9 % случаев (р=0,05), в артерии пуповины - в 38,9 % (р=0,05). Данный показатель отражает увеличение периферического сопротивления с 28 нед. гестации. Повышение СДО с 28 нед. гестации наблюдалось у 80 % женщин с АКО (р<0,01). Состояние кровотока в грудном отделе нисходящей ветви аорты плода отражает состояние компенсаторно-приспособительных механизмов центральной гемодинамики плода в ответ на снижение плацентарной перфузии. Патологические показатели аортального кровотока в сочетании с изменениями пуповинного кровотока не позволяют рассчитывать на рождение ребенка в удовлетворительном состоянии (в 30 % развивается гипотрофия плода при АКО, в 100 % - внутриутробная гипоксия независимо от формы ожирения). По данным других авторов, при ожирении нарушения состояния фетоплацентарного комплекса выявлены у 70,1 % женщин, нарушения маточноплацентарного кровотока - у 31,1 % [1, 8].
У беременных с метаболическим синдромом при преэклампсии выявлены более выраженные нарушения маточно-плацентарного и фетоплацентарного кровотоков. Об этом свидетельствуют данные доплерометрии: СДО в артерии пуповины выше на 3,2 % (р<0,05), чем в группе без МС; СДО в аорте плода в группе с МС выше на 9,4 % (р<0,05) относительно группы женщин без МС, беременность которых также осложнилась преэклампсией.
Результаты проведенных нами морфологических исследований плацент свидетельствуют о формировании в них инволютивнодистрофических и циркуляторных нарушений. Наиболее ранними признаками проявления плацентарной недостаточности следует признать изменения в сосудах децидуальной оболочки: спазм спиральных артерий и явления стаза, атероматоз с жировым повреждением и некрозом стенок. Подобные изменения существенно уменьшают приток крови в межворсинчатые пространства, способствуют развитию ишемии плаценты и образованию инфарктов. При морфометрическом исследовании обнаружено снижение в 2 раза объема сосудистого русла плодовой части плаценты, уменьшение объема хориального эпителия периферического трофобласта, отложение фибриноида и трансформация терминальных ворсин. Наличие полнокровных фибриноидных изменений отечных и склерозированных ворсин приводит к выключению их из трансплацентарного обмена [6, 7].
Гемодинамические расстройства сопровождаются образованием геморрагических инфарктов, псевдоинфарктов в базальной и хориальных пластинках, тромбов в базальной пластинке и межворсинчатом пространстве. Неполноценность васкуляризации развития хориального дерева плаценты приводит к снижению ее функциональной активности, нарушению синтеза и метаболизма гормонов, что проявляется в медленном увеличении диаметра капилляров и их количества в терминальных отделах ворсин.
Таким образом, в плацентах женщин с ожирением повышаются показатели сосудистого сопротивления, причем более выра-женно при AKO. Увеличение сопротивления терминальной сосудистой сети плаценты и спазм периферических сосудов - это механизм компенсаторной централизации кровообращения плода в условиях сниженной плацентарной перфузии, кислородного и метаболического дефицита.
Развитие хронической плацентарной недостаточности при ожирении проявляется замедленным созреванием ворсин, диссоциированным развитием ворсинчатого хориона, наличием инволютивно-дистрофических изменений. Полученные нами данные подтверждаются другими исследователями [10–12]. Нами выделены 3 типа плацент: с «активацией», с «угнетением» и «нормальным» синтезом плацентарных гормонов. У каждой второй женщины с НЭО обнаружен тип «активации» синтеза плацентарных гормонов (нарушения формирования ворсинчатого дepeва со II триместра беременности), что характеризуется выраженной патологической незрелостью ворсин в 53,3 % случаев. Компенсаторно-приспособительные реакции в плацентах выражались в гиперплазии концевых ворсин, возрастании числа синцитиокапилляр-ных мембран, синцитиальных узелков пролиферативного типа, увеличении числа микроворсин. Значительный объем реологических нарушений при относительно слабой выраженности компенсаторного ангиоматоза в терминальных ворсинах указывает на тяжелую степень вторичной плацентарной недостаточности, оцениваемой в 2,3 балла (при 5-балльной шкале).
Плаценты с признаками «угнетения» синтеза плацентарных гормонов наблюдали у 67,9 % женщин с АКО с ранних сроков гестации в сочетании с гипотрофией плода в 72 % случаев. В плацентах были признаки нарушения созревания ворсинчатого дерева со слабой васкуляризацией, нарушением развития котиледонов и другими дефектами плацентации. Обнаружены обширные участки микропатологии на уровне ультраструк-турных изменений плацентарного барьера: деструктивные изменения с развитием ишемии, гипоксии отдельных участков плаценты; утолщение базальной мембраны хориального синтиция, снижение числа микроворсинок, отложение фибриноида в децидуальной оболочке, склерозирование и фиброз стромы, что указывает на декомпенсированную первичную плацентарную недостаточность.
У женщин с МС по данным микроскопического исследования плацент выявили сформированную фетоплацентарную недостаточность. Об этом свидетельствует наличие в плацентах ангиоматоза ворсин и реологических нарушений в межворсинчатом про-странсте.
Заключение. Обобщая результаты проведенных исследований, следует указать на несомненную роль ожирения и метаболического синдрома в формировании хронической плацентарной недостаточности, что оказывает неблагоприятное влияние на течение гестационного процесса, внутриутробное развитие плода и перинатальные осложнения. Новорожденные представляют группу риска по формированию высокой частоты ближайших и отдаленных неонатальных осложнений и требуют адекватной терапии и медикогенетического консультирования.
При ожирении и метаболическом синдроме гемодинамические расстройства проявляются снижением скорости кровотока в пуповине плода, нарушением формирования ворсинчатого дерева у каждой второй женщины с НЭО, что свидетельствует о вторичной плацентарной недостаточности; при АКО – деструктивными изменениями с развитием ишемии плаценты, склерозированием и фиброзом стромы, что указывает на первичную декомпенсированную плацентарную недостаточность.
У женщин с метаболическим синдромом на ранних этапах беременности отмечены выраженные реологические нарушения в межворсинчатом пространстве и ангиоматоз-ные изменения в ворсинах с выключением терминальных ворсин из плацентарного обмена.
Список литературы Функциональное состояние фетоплацентарного комплекса у беременных с ожирением и метаболическим синдромом
- Бериханова Р.Р. Особенности течения беременности, родов, послеродового периода у пациенток с метаболическим синдромом: автореф. дис.. канд. мед. наук. Волгоград; 2009. 25.
- Кан Н.И. Репродуктивное здоровье женщин при ожирении: автореф. дис.. д-ра мед. наук. М.; 2004. 50.
- Mahizir D. Material obesity in females born small: Pregnancy complications and offspring disease risk in. Mol. Nutr. Food Res. 2015; 14.
- Кан Н.И., Потатуркина-Нестерова Н.И., Николаева-Балл Д.Р. Метаболический синдром: пути профилактики репродуктивных потерь. Ульяновск: УлГУ, 2013. 92.
- Репина М.А., Кузьмина-Крутецкая С.Р., Айламазян Э.К., ред. Метаболический синдром у женщин: методические рекомендации. СПб.: Изд-во Н-Л; 2011. 80.
- Ray J.G. Metabolic syndrome and the risk of placental dysfunction. Can. 2005; 27 (12): 1095-1101.
- Милованов А.П. Патология системы мать-плацента-плод: руководство для врачей. М.: Медицина; 1999. 448.
- Карелина О.Б. Фетоплацентарная недостаточность у женщин с гипоталамическим синдромом: диагностика, перинатальные исходы: автореф. дис.. канд. мед. наук. Иркутск; 2008. 24.
- Николаева-Балл Д.Р., Кан Н.И. Особенности маточно-плацентарного и фетоплацентарного кровотока у женщин с метаболическим синдромом. Гинекология. 2014; 15: 789-803.
- Лукьянова Е.В., Михайлова О.И., Тютюник В.Л. Состояние фетоплацентарного комплекса при различных вариантах нарушений формирования ворсинчатого дерева. Акушерство и гинекология. 2011; 1: 27-31.
- Серов В.Н., Кан Н.И., Богданова Е.А. Ожирение и здоровье женщины. М.: Научный центр акушерства, гинекологии и перинатологии РАМН; 2005. 184.
- Сидорова И.С. Акушерство: руководство для практикующих врачей. М.: ООО «Издательство «Медицинское информационное агентство»; 2013. 1048.


