Функциональное состояние микрофагоцитов периферической крови и спектр продуцируемых ими цитокинов при раке шейки матки
Автор: Абакумова Татьяна Владимировна, Антонеева Инна Ивановна, Генинг Татьяна Петровна, Долгова Динара Ришатовна, Генинг Снежанна Олеговна, Воронова Ольга Сергеевна, Волгина Ильмира Вагизовна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Акушерство и гинекология
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
В нейтрофилах периферической крови 109 первичных больных раком шейки матки на I–IV стадиях по FIGO с целью оценки возможности развития проопухолевого действия исследовали фагоцитарную и цитотоксическую активность, а также спектр продуцируемых цитокинов. В динамике опухолевой прогрессии выявлено увеличение абсолютного и относительного количества Нф, снижение фагоцитарной активности, снижение бактерицидности, выраженное на Ib–IIa стадиях. Спектр цитокинов, продуцируемых нейтрофилами, характеризовался выраженным повышением уровня IL-10 и снижением уровней IL-1β, IFN-γ, IL-6, TNF-α на Ib–IIa стадиях заболевания.
Цитокины, нейтрофилы, рак шейки матки
Короткий адрес: https://sciup.org/14112926
IDR: 14112926 | УДК: 571.27:616-006.6
Текст научной статьи Функциональное состояние микрофагоцитов периферической крови и спектр продуцируемых ими цитокинов при раке шейки матки
Введение. 1 При прогрессировании неоплазмы микрофагоциты могут оказывать прямое цитостатическое и цитотоксическое действие на опухолевые клетки [13]. Существуют данные о концентрации нейтрофилов (Нф) в зоне интенсивного роста опухоли и ингибировании ими поверхностной диффузии опухолевых клеток [11]. Нейтрофилы разрушают опухолевые клетки, в т.ч. и с помощью активных форм кислорода (АФК) [26]. В то же время показано, что продуцируемая гранулоцитами перекись водорода подавляет реакции адаптивного иммунитета [27], усиливает ангиогенез и метастазирование на поздних стадиях развития опухоли, в т.ч. и с помощью цитокинов [34].
Установлено, что раковые клетки секретируют широкий спектр цитокинов, в результате чего создается микроокружение развивающейся опухоли [18, 21, 24]. При этом выявлена связь уровня секретируемых опухолью цитокинов и хемотаксических факторов со степенью участия Нф в иммунном ответе [26, 31]. Предположение о том, что цитокины при этом запускают в Нф процессы, активирующие основные внутриклеточные регуляторные системы, находит экспериментальное подтверждение. Так, в частности, показана in vitro способность TNF-α и IL-8 модулировать активность NADPH-оксидазы Нф [16, 19, 25, 29]. Существует мнение, что хроническое воспаление, имеющее место при развитии опухоли, сопровождается увеличением уровня цитокинов (TNF-α, IFN-γ, IL-1, IL-2, IL-4) [31, 33], что подавляет вхождение Нф в апоптоз и удлиняет время их жизни [20]. В результате праймирования цитокинами на плазматической мембране Нф усиленно экспрессируются адгезивные молекулы во взаимодействии с межтканевым матриксом и эндотелием сосудов [14]. Миграция опухолевых клеток происходит при участии тех же интегринов, что и миграция Нф. Следствием возрастания количества клеток-предшественников в костном мозге считается увеличение абсолютного числа Нф при прогрессировании опухоли [17].
Таким образом, данные литературы и результаты наших исследований [5, 10] свидетельствуют о том, что злокачественная опухоль модифицирует морфофункциональное состояние периферических Нф. Информация об участии цитокинов в этом процессе представляется значимой при разработке схем иммунотерапии в зависимости от биологического портрета опухоли и стадии опухолевой прогрессии.
Цель исследования. Изучение функционального состояния периферических Нф и уровня продуцируемых ими провоспалитель-ных цитокинов при прогрессировании рака шейки матки in vivo.
Материалы и методы. Обследуемая группа состояла из 109 первичных больных раком шейки матки (РШМ) I–IV стадий по классификации FIGO, подвергавшихся обследованию в гинекологическом отделении Ульяновского областного клинического диспансера. Контрольную группу составили практически здоровые женщины (n=30). Подбор пациенток проводили строго по определенным критериям: возраст 30–45 лет, отсутствие острых воспалительных инфекционных и неинфекционных заболеваний, отсутствие в анамнезе хирургических вмешательств давностью менее года, включая стоматологические. Больные РШМ были разделены на три группы: Iа стадии (начальный рак) – первая группа; Ib–IIa стадий (местно-ограниченный рак) – вторая группа и IIb–IV стадий (распространенный рак) – третья группа.
Нф выделяли из венозной крови путем центрифугирования на двойном градиенте плотности фиколла-урографина (плотность 1,117 и 1,077 г/мл) и ресуспендировали в за-буференном физиологическом растворе.
Исследование фагоцитарной активности Нф проводили стандартным методом с использованием дрожжевых клеток. Рассчитывали фагоцитарный индекс по Гамбургеру – процент фагоцитирующих Нф через 5, 30 и 60 мин инкубации, фагоцитарное число (ФЧ) – по Райту и индекс завершенности фагоцитоза: ИЗФ = ФЧ 5' / ФЧ 60'. Кроме того, в Нф цитохимически определяли активность миелопероксидазы (МПО) с бензидином, уровень катионных белков (КБ) по Шубичу, щелочной фосфатазы (ЩФ) по Rutenburg, долю активных нейтрофилов в спонтанном вари-анте с восстановлением нитросинего тет-разолия (НСТ-тест). Результаты выражали в виде среднего цитохимического коэффициента.
Для оценки спонтанной продукции цитокинов в сыворотке крови и лизате Нф определяли концентрации цитокинов (IL-1β, IL-1Ra, IL-2, IL-6, IL-10, IL-18, TNF-α, IFN-γ) с использованием твердофазного иммуно-ферментного метода. В результате проведенных исследований установлено, что распределение показателей уровня цитокинов отличалось от распределения Гаусса, поэтому в качестве центральной характеристики применяли медиану, а при сравнении использовали непараметрический критерий Манна– Уитни.
Результаты и обсуждение. В ходе исследований установлено, что при РШМ абсолютное и относительное количество периферических Нф значимо повышается на Ib–IIa стадиях и продолжает возрастать при распространенном РШМ (рис. 1).
Число фагоцитирующих клеток (30 мин) у больных РШМ было значимо снижено по сравнению с контролем и составило на Ia стадии 40,4±5,4 %, на Ib–IIa стадиях – 30,6±4,4 % и на IIb–IV стадиях – 35,1±5,9 % против 70,8±0,4 % в контроле. Также было снижено ФЧ (30 мин): 1,54±0,08 у.е. на Ia стадии и 1,46±0,08 у.е. на IIb–IV стадиях против 1,97±0,18 у.е. в контроле. При этом фагоцитоз при РШМ идет, видимо, по незавершенному типу, так как ИЗФ на всех клинических стадиях заболевания меньше 1,0.
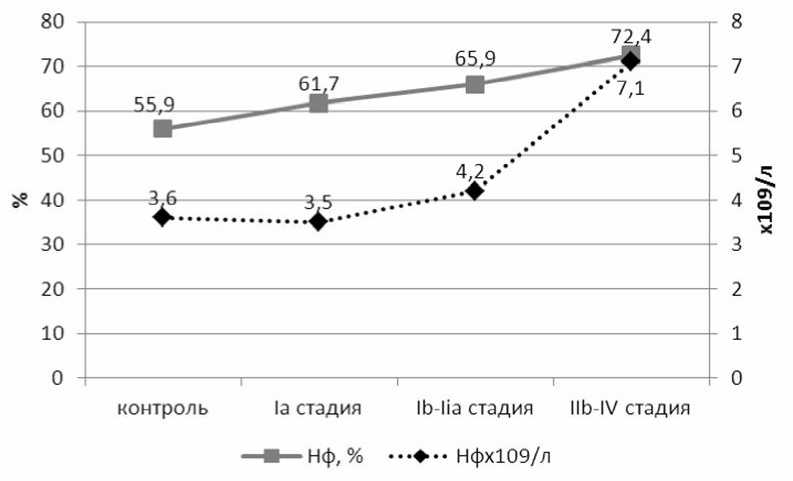
Рис. 1. Абсолютное и относительное количество Нф на различных клинических стадиях РШМ
Непосредственная цитотоксическая активность Нф проявляется при активации секреторной дегрануляции. У Нф имеется 4 типа гранул. Азурофильные гранулы содержат нейтральные протеазы, в т.ч. МПО. Именно эти гранулы мобилизуются при фагоцитозе и участвуют в образовании фаголизосом. Роль МПО в контроле опухолевой трансформации была показана как в работах in vitro с очищенной МПО и МПО-содержащими клетками, так и клиническими данными о повышенной чувствительности пациентов с дефицитом МПО к развитию злокачественных опухолей. С другой стороны, МПО участвует в повреждении тканей при хроническом воспалении в результате использования для окисления АФК, продуцируемых фагоцитами [1, 12]. По данным литературы, активность МПО снижается в периферических Нф по сравнению с контролем при различной локализации опухоли в эксперименте [2, 4]. Мы показали увеличение активности МПО при РШМ по сравнению с контролем на всех клинических стадиях заболевания (рис. 2).
Нами выявлено, что характеризующий способность Нф к внутриклеточному и экстрацеллюлярному киллингу уровень КБ значимо снижался в Нф больных РШМ на
Ib–IIa стадиях (рис. 2). КБ формируют водные каналы в мембранах, что приводит к лизису клетки. Снижение уровня КБ в периферических Нф показано при различной локализации злокачественной опухоли [3]. В наших исследованиях установлено, что количество Нф, активированных в спонтанном НСТ-тесте и продуцирующих АФК, возрастает на Ia стадии (рис. 2), что может инициировать «всплеск» свободно-радикальных процессов, приводящий к дестабилизации клеточных мембран самих Нф, а значит, нарушить распределение мембранных рецепторов, которые обеспечивают их взаимодействие с эндо-телием сосудов. Это не позволяет создать полноценно функционирующий пул Нф в тканях.
Кислая и щелочная фосфатазы – гидролитические ферменты специфических гранул Нф, принимающие активное участие в анаэробном метаболизме, в частности в переваривании остатков, поглощенных Нф [6]. Нами установлено повышение активности кислой фосфатазы (КФ) в периферических Нф, значимое по сравнению с контролем, на Ib–IIa стадиях (рис. 2). Активность ЩФ на всех клинических стадиях заболевания изменялась в пределах коридора нормы.
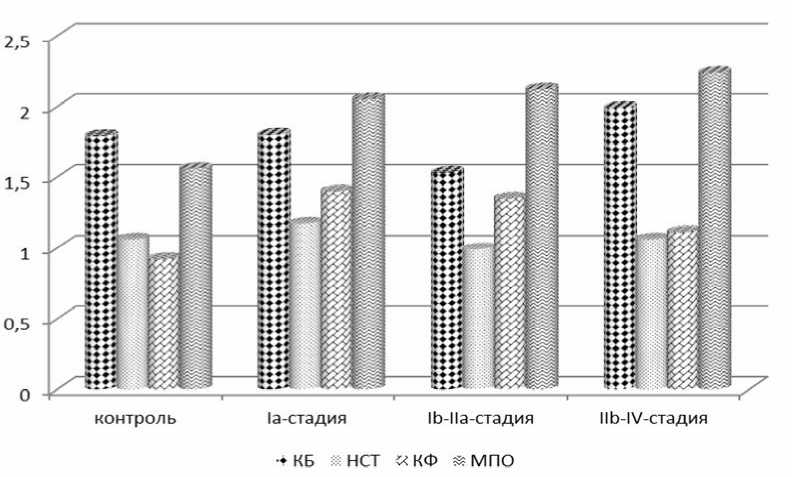
Рис. 2. Показатели секреторной активности периферических Нф при прогрессировании РШМ
В эксперименте В.Н. Мальцевой с соавт. показано, что развитие опухоли в организме животного сопровождается последовательными изменениями морфофункционального состояния периферических Нф [4]. Полученные нами данные также позволяют предполагать зависимость этого состояния от стадии опухолевого процесса при РШМ. Так, на начальной стадии (Ia) при незначительном снижении общего количества Нф резко и значимо снижается их фагоцитарная активность при нарушении завершенности фагоцитоза, но возрастает доля активных Нф в НСТ-тесте, активность МПО и КФ. При местно ограниченном процессе (Ib–IIa стадии) абсолютное количество Нф значимо увеличивается, но продолжает снижаться фагоцитарная активность, резко снижено и количество Нф, активированных в спонтанном НСТ-тесте, не изменяется активность МПО, определяющая аэробную бактерицидность. Остается повышенной активность КФ, и значимо снижается уровень КБ – показатель анаэробной бакте-рицидности. На стадии распространенного процесса (IIb–IV) продолжает увеличиваться абсолютное количество Нф и повышается уровень КБ. Остальные показатели сохраняются на уровне предыдущей стадии.
На сегодня считается доказанной роль Нф в формировании «цитокиновой сети». При этом, с одной стороны, они могут сек- ретировать ряд провоспалительных (IL-1α, IL-1β, IFN-γ, TNF-α) и противоспалительных (IL-4, IL-10 и т.д.) цитокинов [3]. С другой стороны, они могут отвечать на воздействие провоспалительных цитокинов повышением экспрессии генов, участвующих в реализации фагоцитоза, и экспрессией рецепторов, присущих антиген-презентирующим клеткам [15, 32]. В то же время раковые клетки секретируют широкий спектр цитокинов, обладающих ангиогенными и иммуносупрессивными свойствами [23]. В экспериментах in vitro показано, что активация провоспали-тельной активности Нф может быть следствием влияния опухолевых клеток на сигнальные пути [22]. Существует мнение, что смена противоопухолевого действия Нф на проопу-холевое может быть результатом влияния биологически активных веществ, в т.ч. цитокинов, продуцируемых опухолью [20, 33]. В своих работах с экспериментальными опухолями и на клиническом материале мы показали, что развитие злокачественной опухоли в организме сопровождается изменением морфофункционального состояния Нф [7–9].
В результате проведенных исследований нами было установлено значимое повышение уровня IL-6 и IFN-γ, тенденция к увеличению IL-1β и IL-10 и снижение уровня TNF-α в сыворотке крови на Ia стадии заболевания (рис. 3).
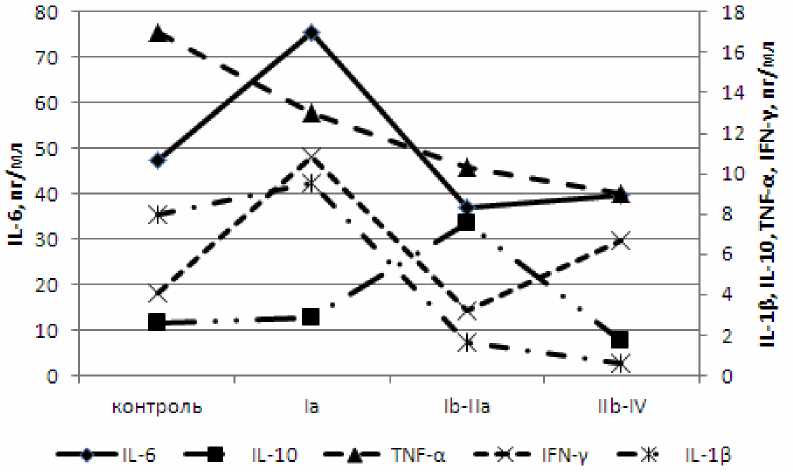
Рис. 3. Динамика спонтанной продукции цитокинов в сыворотке крови при прогрессировании РШМ
В лизате Нф уровни IL-6 и IL-10 также возрастали, IFN-γ был на уровне контроля, но значимо возрастал уровень TNF-α, и снижался по сравнению с контролем уровень IL-18, IL-1β и IL-1Ra (табл. 1). Показана способность цитокинов стимулировать отдельные механизмы антимикробного действия Нф. Так, TNF-α усиливает фагоцитоз бактерий. Уровень TNF-α в сыворотке крови снижен уже на Ia стадии РШМ и продолжает снижаться на последующих стадиях при прогрессировании опухоли (табл. 1). Это снижение коррелирует с падением фагоцитарной активности Нф на стадиях Ib–IIa (r=0,3550; p<0,02) и IIb–IV (r=0,5600; p<0,02). В то же время ряд экспериментов показывает, что Нф повреждают опухолевые клетки с помощью растворимых медиаторов (TNF-α, IL-1β, IFN-γ). Определяемые нами уровни TNF-α в лизате Нф были значимо повышены на всех стадиях заболевания (табл. 1), в то время как уровни IL-1β были снижены, а IFN-γ – сни- жены до 0 на стадиях Ib–IIa либо оставались на уровне нормы на остальных стадиях.
IL-1β занимает важное место среди цитокинов, продуцируемых Нф. Он способен активировать и праймировать зрелые клетки, усиливать в них продукцию супероксид-аниона, хемотаксис и дегрануляцию, повышать жизнеспособность и замедлять апоптоз. Однако для оптимальной активации IL-1β необходимы его высокие концентрации. Все свои эффекты IL-1β может осуществлять через взаимодействие с рецепторами IL-1Ra. Нами установлено пониженное количество IL-1Ra в лизате Нф больных уже на Ia стадии и значимо снижающееся при прогрессировании заболевания (табл. 1). При оценке корреляции уровня IL-1β в сыворотке крови с активностью Нф в спонтанном НСТ-тесте нами установлены слабые коррелятивные связи на Ib–IIa (r=0,3551; p<0,02) и IIb–IV стадиях (r=0,3590; p<0,02).
Таблица 1
Динамика уровня цитокинов (пг/мл) в лизате Нф при прогрессировании РШМ
|
IL-1β |
IL-1Ra |
IL-2 |
IL-6 |
IL-10 |
IL-18 |
TNF-α |
IFN-γ |
|
|
Доноры, n=30 |
ей ° 7 eq |
О СП о |
03 9 rsf |
04 04 СП 41 1 О 40 По |
04 ОО*' В 40 |
4 § 41 2 g °° О? СП ГП ^ |
04 IT) О Jo ОО О |
40 Tf IT) О СП 41 О 40 |
|
РШМ Ia стадии, n=24 |
co ? 7 о S/ со" |
40 О о ОО f#-) 2 1 41 04 СЧ 40 1гГ СП £ S |
о -Н m 04 ^ 04 ОО | 40 О |
? 7 СП |
04 04 40 А. 04 |
(М 04 ОО ОО 04 ОО ^ 41 СП 04 ОО | (М |
оо 04^ 41 9 |
(М 04^ ^ |
|
РШМ Ib–IIa стадий, n=24 |
O\ <4 о 7 5 |
04 О 4 о ОО гп СП 1 -н см У гп см <4 ОО ся |
ОО 04 41 А СП 1 40 40 оС осГ |
04 о 3 |
О о ОО Й4 |
О 40 4о" СП СП 04 Я 7 40 |
7 оо |
о |
|
РШМ IIb–IV стадий, n=24 |
40 о 4 7 ^ о |
-4- g 40 +1 тг СП 4 СП ОО см ОО |
g 7 7 см 4 оо ^ 1/^ |
IT) 7 |
СП 04 СП 04 |
ng ur> g ГП 5 т£ 04 |
40 00 СП 54 V7 О |
^ 04^ |
Заключение. В результате проведенных исследований установлено на фоне возрастания общего количества Нф снижение их фагоцитарной активности, бактерицидности и возрастание ригидности мембраны, наиболее выраженное на Ib–IIa стадиях РШМ. Одновременное снижение уровня продуцируемого нейтрофилами IL-1β и IL-1Rα, уровня IFN-γ позволяет предполагать возникновение на этой стадии РШМ проопухолевого эффекта Нф.
-
3. Лаврова В. С. Нейтрофилы и злокачественный рост / В. С. Лаврова, Н. В. Васильев. – Томск : Изд-во ТГУ, 1992. – 124 с.
-
4. Наблюдение в динамике модификации функциональной активности периферических нейтрофилов и ее регуляции при росте опухоли in vivo / В. Н. Мальцева [и др.] // Цитология. – 2006. – Вып. 12. – С. 1000–1009.
-
5. Нейтрофильный статус при раке шейки матки Ia стадии / Т. В. Абакумова [и др.] // Вестник РОНЦ им. Н.Н. Блохина РАМН. – 2011. – Т. 22, № 2. – С. 65–68.
-
6. Нестерова И. В. Нейтрофильные гранулоциты – ключевые клетки иммунной системы / И. В. Нестерова, И. Н. Швыдченко, В. А. Ромен-ская // Аллергология и иммунология. – 2008. – № 4. – С. 432–436.
-
7. Роль цитокинов в развитии полимодаль-ных локальных и дистантных эффектов при прогрессировании рака шейки матки / Т. П. Генинг [и др.] / Сб. статей Международной конференции «Рецепторы и внутриклеточная сигнализация». – Пущино, 2013. – С. 519–523.
-
8. Синдром опухоль-ассоциированного вторичного иммунодефицита на различных клинических стадиях рака шейки матки / И. И. Антонеева [и др.] // Российский аллергологический журн. – 2013. – № 2. – С. 14–15.
-
9. Функциональная неравнозначность нейтрофилов периферической крови при экспериментальном раке шейки матки / Т. В. Абакумова [и др.] // Медицинский академический журн. – 2012. – Прил. – С. 12–13.
-
10. Цитоархитектоника и фагоцитарная активность нейтрофилов больных раком шейки матки при фемтосекундном лазерном излучении in vitro / Т. В. Абакумова [и др.] // Вестник новых медицинских технологий. – 2012. – Т. XIX, № 3. – С. 34–37.
-
11. Bru A. Pinning of tumoral growth by enhancement of the immune response / A. Bru, S. Albertos, J. A. Lopez Garcia-Asenjo // Phys. Rev. Lett. – 2004. – Vol. 92. – P. 8101–8104.
-
12. Cancer despite immunosurveillance: immunoselection and immunosubversion / L. Zitvogel [et al.] // Nat Rev Immunol. – 2006. – Vol. 6. – P. 715–727.
-
13. CD95L mediates tumor counterattack in vitro but induces neutrophil-independent tumor rejection in vivo / F. H. Igney [et al.] // Int. J. Cancer. – 2004. – Vol. 113. – P. 78–87.
-
14. Chuluyan H. E. Differential mechanisms of neutrophil and monocyte adhesion on neuroblastoma cells: CD18 and VLA-4 integrins mediate adhesion to SK-N-SH, but not to SK-N-MC cell line / H. E. Chu-luyan, B. J. Lang, A. C. Issekutz // J. Neurosci Res. – 2000. – Vol. 60. – P. 649–655.
-
15. Cossatella M. A. The neutrophil. An emerging regulator of inflammatory and immune response / M. A. Cossatella // Chemical Immunology and Allergology. – 2003. – Vol. 83. – P. 232.
-
16. Distinct ligand-dependent roles for p38 MAPK in priming and activation of the neutrophil NADPH oxidase / G. E. Brown [et al.] // J. Biol Chem. – 2004. – Vol. 279. – P. 27059–27068.
-
17. Hyperfunction of neutrophils in a patient with BCR/ABL negative chronic myeloid leukemia: a case report with in vitro studies / K. Watari [et al.] // Cancer. Aug. – 2000. – Vol. 89. – P. 551–560.
-
18. IL-6 secretion by a rat T9 glioma clone induces a neutrophil-dependent antitumor response with resultant cellular, antiglioma immunity / M. R. Graf [et al.] // J. Immunol. – 2001. – Vol. 166. – P. 121–129.
-
19. Interleukin-8-induced priming of neutrophil oxidative burst requires sequential recruitment of NADPH oxidase components into lipid rafts / C. Guichard [et al.] // J. Biol. Chem. – 2005. – Vol. 280. – P. 37021–37032.
-
20. Ishikawa F. New biodefense strategies by neutrophils / F. Ishikawa, S. Miyazaki // Arch. Im-
munol. Ther. Exp. (Warsz). – 2005. – Vol. 53. – P. 226–233.
-
21. Kato T. Regulation of neutrophil functions by proinflammatory cytokines / T. Kato, S. Kitagawa // Int. J. Hematol. – 2006. – Vol. 84. – P. 205–209.
-
22. Klink M. Ovarian cancer cells modulate human blood neutrophils response to activation in vitro / M. Klink, K. Jastrzembska, M. Nowak // Scand. J. Immunol . – 2008. – Vol. 68. – P. 328–336.
-
23. Mesothelioma environment comprises cytokines and T-regulatory cells that suppress immune responses / J. P. Hegmans [et al.] // Eur. Respir. J. – 2006. – Vol. 27. – P. 1086–1095.
-
24. Mueller M. M. Friends or foes – bipolar effects of the tumor stroma in cancer / M. M. Mueller, N. F. Fusenig // Nature Rev. Cancer. – 2004. – Vol. 4. – P. 839–849.
-
25. Ohira T. Protein phosphorylation in neutrophils monitored with phosphospecific antibodies / T. Ohira, Q. Zhan, Q. Ge // J. Immunol. Methods. – 2003. – Vol. 281. – P. 79–94.
-
26. Oxidative burst and anticancer activities of rat neutrophils / M. Zivkovic [et al.] // Biofactors. – 2005. – Vol. 24. – P. 305–312.
-
27. Schmielau J. Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of T-cell function in advanced cancer patients / J. Schmielau, O. J. Finn // Cancer Res. – 2001. – Vol. 61. – P. 4756–4760.
-
28. Segal A. W. How neutrophils kill microbes / A. W. Segal // Ann. Rev Immunol. – 2005. – Vol. 23. – P. 197–223.
-
29. Sequential activation of class IB and class IA PI3K is important for the primed respiratory burst of human but not murine neutrophils / A. M. Condliffe [et al.] // Blood. – 2005. – Vol. 106. – P. 1432–1440.
-
30. Shojaei F. Role of Bv8 in neutrophildependent angiogenesis in a transgenic model of cancer progression / F. Shojaei, M. Singh, J. D. Thompson // Proc. Natl. Acad. Sci. USA. – 2008. – Vol. 105. – P. 2640–2645.
-
31. The intriguing role of polymorphonuclear neutrophils in antitumor reactions / E. Di Carlo [et al.] // Blood. – 2001. – Vol. 97. – P. 339–345.
-
32. Transdifferentiation of polymorphonuclear neutrophils: acquisition of CD83 and other functional characteristics of dendritic cells / C. Iking-Konert [et al.] // J. Mol. Med. (Berl.). – 2001. – Vol. 79. – P. 464–474.
-
33. Visser K. E. Paradoxical role of the immune system during cancer development / K. E. Visser, A. de Eichten, L. M. Coussens // Nature. Rev. Cancer. – 2006. – Vol. 6. – P. 24–37.
-
34. Wu Q. D. Human neutrophils facilitate tumor cell transendothelial migration / Q. D. Wu, J. H. Wang, A. Condron // Amer. J. Physiol. Cell. Physiol. – 2001. – Vol. 280. – P. 814–822.
FUNCTIONAL STATUS OF MICROPHAGOCYTESOF THE PERIPHERAL BLOOD AND A RANGEOF CYTOKINES PRODUCED BY THEM IN CERVICAL CANCER
T.V. Abakumova, I.I. Antoneeva, T.P. Gening, D.R. Dolgova, S.O. Gening, O.S. Voronova, I.V. Volgina
Ulyanovsk State University
Список литературы Функциональное состояние микрофагоцитов периферической крови и спектр продуцируемых ими цитокинов при раке шейки матки
- Антонеева И. И. Нейтрофильные гранулоциты в динамике прогрессии рака яичников/И. И. Антонеева//Клин. лаб. диагностика. -2007. -№ 8. -С. 43-46.
- Взаимодействие церулоплазмина, лактоферрина и миелопероксидазы/А. В. Соколов [и др.]//Биохимия. -2007. -№ 4. -С. 506-514.
- Лаврова В. С. Нейтрофилы и злокачественный рост/В. С. Лаврова, Н. В. Васильев. -Томск: Изд-во ТГУ, 1992. -124 с.
- Наблюдение в динамике модификации функциональной активности периферических нейтрофилов и ее регуляции при росте опухоли in vivo/В. Н. Мальцева [и др.]//Цитология. -2006. -Вып. 12. -С. 1000-1009.
- Нейтрофильный статус при раке шейки матки Ia стадии/Т. В. Абакумова [и др.]//Вестник РОНЦ им. Н.Н. Блохина РАМН. -2011. -Т. 22, № 2. -С. 65-68.
- Нестерова И. В. Нейтрофильные гранулоциты -ключевые клетки иммунной системы/И. В. Нестерова, И. Н. Швыдченко, В. А. Роменская//Аллергология и иммунология. -2008. -№ 4. -С. 432-436.
- Роль цитокинов в развитии полимодальных локальных и дистантных эффектов при прогрессировании рака шейки матки/Т. П. Генинг [и др.]/Сб. статей Международной конференции «Рецепторы и внутриклеточная сигнализация». -Пущино, 2013. -С. 519-523.
- Синдром опухоль-ассоциированного вторичного иммунодефицита на различных клинических стадиях рака шейки матки/И. И. Антонеева [и др.]//Российский аллергологический журн. -2013. -№ 2. -С. 14-15.
- Функциональная неравнозначность нейтрофилов периферической крови при экспериментальном раке шейки матки/Т. В. Абакумова [и др.]//Медицинский академический журн. -2012. -Прил. -С. 12-13.
- Цитоархитектоника и фагоцитарная активность нейтрофилов больных раком шейки матки при фемтосекундном лазерном излучении in vitro/Т. В. Абакумова [и др.]//Вестник новых медицинских технологий. -2012. -Т. XIX, № 3. -С. 34-37.
- Bru A. Pinning of tumoral growth by enhancement of the immune response/A. Bru, S. Albertos, J. A. Lopez Garcia-Asenjo//Phys. Rev. Lett. -2004. -Vol. 92. -P. 8101-8104.
- Cancer despite immunosurveillance: immunoselection and immunosubversion/L. Zitvogel [et al.]//Nat Rev Immunol. -2006. -Vol. 6. -P. 715-727.
- CD95L mediates tumor counterattack in vitro but induces neutrophil-independent tumor rejection in vivo/F. H. Igney [et al.]//Int. J. Cancer. -2004. -Vol. 113. -P. 78-87.
- Chuluyan H. E. Differential mechanisms of neutrophil and monocyte adhesion on neuroblastoma cells: CD18 and VLA-4 integrins mediate adhesion to SK-N-SH, but not to SK-N-MC cell line/H. E. Chuluyan, B. J. Lang, A. C. Issekutz//J. Neurosci Res. -2000. -Vol. 60. -P. 649-655.
- Cossatella M. A. The neutrophil. An emerging regulator of inflammatory and immune response/M. A. Cossatella//Chemical Immunology and Allergology. -2003. -Vol. 83. -P. 232.
- Distinct ligand-dependent roles for p38 MAPK in priming and activation of the neutrophil NADPH oxidase/G. E. Brown [et al.]//J. Biol Chem. -2004. -Vol. 279. -P. 27059-27068.
- Hyperfunction of neutrophils in a patient with BCR/ABL negative chronic myeloid leukemia: a case report with in vitro studies/K. Watari [et al.]//Cancer. Aug. -2000. -Vol. 89. -P. 551-560.
- IL-6 secretion by a rat T9 glioma clone induces a neutrophil-dependent antitumor response with resultant cellular, antiglioma immunity/M. R. Graf [et al.]//J. Immunol. -2001. -Vol. 166. -P. 121-129.
- Interleukin-8-induced priming of neutrophil oxidative burst requires sequential recruitment of NADPH oxidase components into lipid rafts/C. Guichard [et al.]//J. Biol. Chem. -2005. -Vol. 280. -P. 37021-37032.
- Ishikawa F. New biodefense strategies by neutrophils/F. Ishikawa, S. Miyazaki//Arch. Im-munol. Ther. Exp. (Warsz). -2005. -Vol. 53. -P. 226-233.
- Kato T. Regulation of neutrophil functions by proinflammatory cytokines/T. Kato, S. Kitagawa//Int. J. Hematol. -2006. -Vol. 84. -P. 205-209.
- Klink M. Ovarian cancer cells modulate human blood neutrophils response to activation in vitro/M. Klink, K. Jastrzembska, M. Nowak//Scand. J. Immunol. -2008. -Vol. 68. -P. 328-336.
- Mesothelioma environment comprises cytokines and T-regulatory cells that suppress immune responses/J. P. Hegmans [et al.]//Eur. Respir. J. -2006. -Vol. 27. -P. 1086-1095.
- Mueller M. M. Friends or foes -bipolar effects of the tumor stroma in cancer/M. M. Mueller, N. F. Fusenig//Nature Rev. Cancer. -2004. -Vol. 4. -P. 839-849.
- Ohira T. Protein phosphorylation in neutrophils monitored with phosphospecific antibodies/T. Ohira, Q. Zhan, Q. Ge//J. Immunol. Methods. -2003. -Vol. 281. -P. 79-94.
- Oxidative burst and anticancer activities of rat neutrophils/M. Zivkovic [et al.]//Biofactors. -2005. -Vol. 24. -P. 305-312.
- Schmielau J. Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of T-cell function in advanced cancer patients/J. Schmielau, O. J. Finn//Cancer Res. -2001. -Vol. 61. -P. 4756-4760.
- Segal A. W. How neutrophils kill microbes/A. W. Segal//Ann. Rev Immunol. -2005. -Vol. 23. -P. 197-223.
- Sequential activation of class IB and class IA PI3K is important for the primed respiratory burst of human but not murine neutrophils/A. M. Condliffe [et al.]//Blood. -2005. -Vol. 106. -P. 1432-1440.
- Shojaei F. Role of Bv8 in neutrophil-dependent angiogenesis in a transgenic model of cancer progression/F. Shojaei, M. Singh, J. D. Thompson//Proc. Natl. Acad. Sci. USA. -2008. -Vol. 105. -P. 2640-2645.
- The intriguing role of polymorphonuclear neutrophils in antitumor reactions/E. Di Carlo [et al.]//Blood. -2001. -Vol. 97. -P. 339-345.
- Transdifferentiation of polymorphonuclear neutrophils: acquisition of CD83 and other functional characteristics of dendritic cells/C. Iking-Konert [et al.]//J. Mol. Med. (Berl.). -2001. -Vol. 79. -P. 464-474.
- Visser K. E. Paradoxical role of the immune system during cancer development/K. E. Visser, A. de Eichten, L. M. Coussens//Nature. Rev. Cancer. -2006. -Vol. 6. -P. 24-37.
- Wu Q. D. Human neutrophils facilitate tumor cell transendothelial migration/Q. D. Wu, J. H. Wang, A. Condron//Amer. J. Physiol. Cell. Physiol. -2001. -Vol. 280. -P. 814-822.


