Функциональный резерв фагоцитов крови быков-голштинов в норме и при патологии
Автор: Лесовская М.И.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и животноводство
Статья в выпуске: 6, 2013 года.
Бесплатный доступ
У быков, выбракованных по причине инфекционных заболеваний, обнаружена крайняя степень несостоятельности фагоцит-опосредованной защиты. Это проявлялось в совпадении уровней стимулированного и базального хемилюминесцентного ответа фагоцитов крови. Резерв свободнорадикальной активности фагоцитов крови, оцениваемый по диапазону ответа в базальном и стимулированном состоянии, может служить маркером снижения резистентности организма в целом.
Фагоциты, свободные радикалы, резистентность, хемилюминесцентный анализ крови
Короткий адрес: https://sciup.org/14083078
IDR: 14083078 | УДК: 576.08
Текст научной статьи Функциональный резерв фагоцитов крови быков-голштинов в норме и при патологии
Введение. В настоящее время клеточные технологии занимают ведущие позиции как экспрессные и информативные методы функциональной диагностики иммунорезистентности, основанной на количественном анализе свободнорадикального баланса внутренней среды организма. Клеточным объектом при этом являются нейтрофильные гранулоциты – фагоциты крови, реализующие уникальный механизм НАДФ-зависимого «дыхательного взрыва». Процесс представляет собой лавинообразную продукцию биогенных свободных радикалов – активных форм кислорода (АФК) – в процессе выполнения защитных, в частности микробицидных, функций. Применение автоматизированного хемилюминесцентного (ХЛ) анализа дополняет преимущества клеточной диагностики экономичностью и возможностью создания цифровых банков данных.
В системе in vitro хемилюминесцентный зонд (люминол) окисляется свободнорадикальными метаболитами фагоцитарного «дыхательного взрыва» с выделением квантов света в видимом диапазоне ( ʎ =425 нм).
Использование современной биолюминесцентной аппаратуры [5] позволяет многократно усиливать эти сигналы и передавать на дисплей в виде графических изображений, интегрально регистрирующих важнейший признак гомеостаза. Фагоциты представляют собой наиболее мобильный клеточный механизм неспецифической защиты организма. Поэтому при адаптационном напряжении под влиянием стресс-факторов параметры функционального ответа фагоцитов являются высокоинформативными и прогностически значимыми.
Для раннего выявления нарушений гомеостаза, для эффективной коррекции биологических процессов внутренней среды организма необходима информация о резерве функциональной активности фагоцитов крови сельскохозяйственных животных в норме и при патологии. Поскольку в литературе подобная информация практически отсутствует, целью настоящей работы был сравнительный анализ показателей фагоцитарной реактивности быков голштинской породы в норме и при патологии, с использованием хемилюминесцентного анализа крови.
Объектом исследования являлись быки голштинской породы (n=39) племзавода «Красный Маяк» Красноярского края. Образцы периферической крови были получены из ярёмной вены с соблюдением правил антисептики и использованием гепарина (20 МЕ/мл). В контрольную группу входили здоровые животные (n=19, возраст 1,5–2,5 года). В экспериментальную группу были включены животные той же породы и аналогичного возраста (n=20), выбракованные при обнаружении инфекционных заболеваний различной этиологии (бактерии, кокки, микроскопические грибы, вирусы, микоплазмы).
Лейкоциты подсчитывали под микроскопом в камере Горяева [2]. Функциональную активность фагоцитов цельной крови оценивали микрометодом люминол-зависимой латекс-стимулированной хемилюминесценции по Tono-Oka e.a. в модификации [3]. В работе использовали 36-канальный серийный программноаппаратурный комплекс «Биохемилюминометр-3604» (СКТБ «Наука» КНЦ СО РАН, г. Красноярск) и пакет программ lgraf.exe [5].
Полученные результаты представлены на рисунках 1 и 2. Кинетика ХЛ-активности гранулоцитов у здоровых племенных быков голштинской породы характеризовалась полимодальностью с тремя чёткими пиками, для обнаружения которых время наблюдения было увеличено вдвое против обычного, до 180 мин (рис. 1).
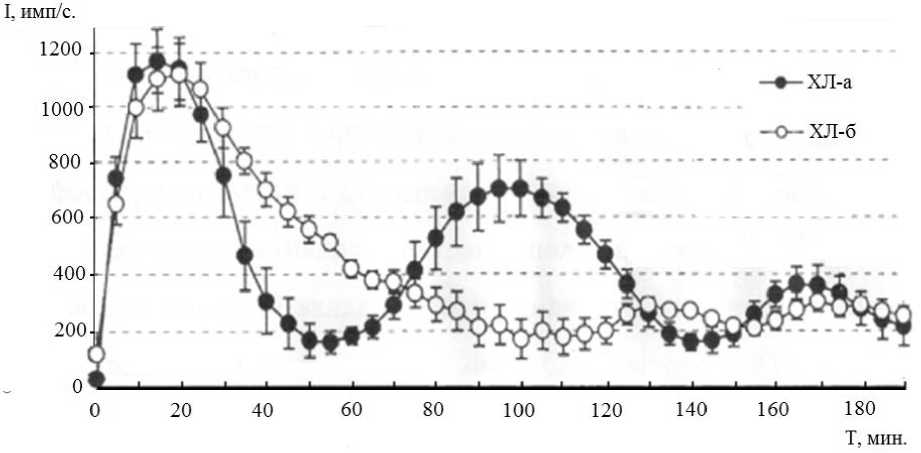
Рис. 1. Кинетика активированной (ХЛ-а) и базальной (ХЛ-б) продукции АФК фагоцитами крови у быков в норме
Характерно, что базальная реакция клеток является мономодальной (бифазной) в отличие от поли-модальной активированной кинетограммы.
На рисунке 2 представлены результаты определения уровня функциональной активности гранулоцитов у группы животных с нарушениями неспецифического иммунитета, в результате которых снижается их резистентность к инфекциям.
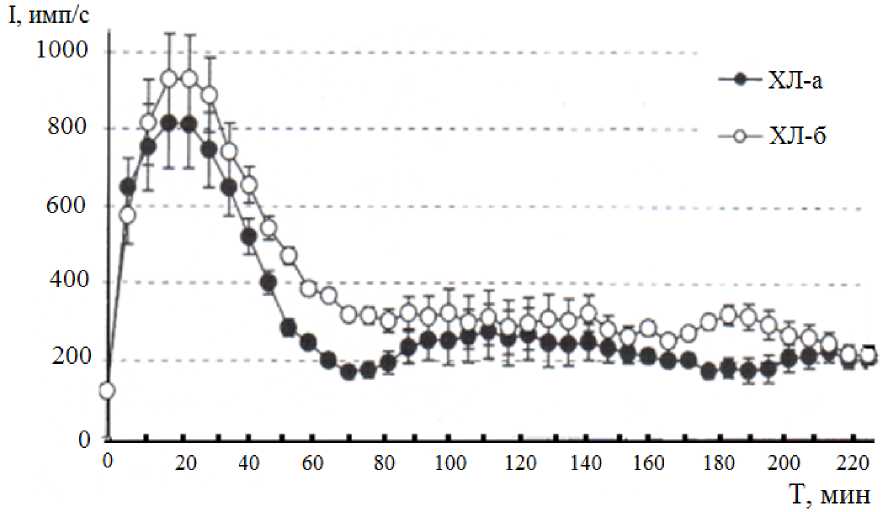
Рис. 2. Кинетика активированной (ХЛ-а) и базальной (ХЛ-б) продукции АФК фагоцитами крови у быков при различных инфекционных патологиях
Очевидны значимые изменения характера и уровня продукции АФК. Функциональный ответ клеток крови быков при данной патологии характеризовался достоверным снижением первого пика на 33% (p<0,05) и исчезновением последующих экстремумов кинетограммы. Различие между активированным и базальным ответами нивелировано, что, по-видимому, свидетельствует об истощении функционального резерва клеток и резком снижении неспецифической резистентности.
Аналогичная картина наблюдается в начальный период жизни телят, когда наблюдается выраженное разобщение процессов окисления и фосфорилирования в клетках крови и низкая активность интрацеллю-лярного фермента, обеспечивающего основной вклад в бактерицидность фагоцитов - миелопероксидазы (МПО) [1]. С возрастом у крупного рогатого скота устанавливается сопряжённость процессов окисления и фосфорилирования в электронтранспортной цепи митохондрий, вследствие чего в клетках возрастает образование АТФ, в тканях резервируются запасы клеточного «топлива» и нормализуется активность МПО [6]. По-видимому, развитие патологического процесса блокирует данный ферментативный механизм адаптации, возвращая клеточное звено неспецифической резистентности к функциональной несостоятельности.
Известно, что микробицидность гранулоцитов и интенсивность процессов окисления имеют у крупного рогатого скота чётко выраженные сезонные ритмы. Так, активность окислительно-восстановительных ферментов в клетках зависит от температуры воздуха и состава рациона, а функциональная активность фагоцитов значительно выше весной и ниже осенью [4]. Это свидетельствует о высокой индуцибельности ферментов редокс-системы. Можно ожидать, что лабильность этих ферментных систем в наибольшей степени будет влиять на клеточный ответ фагоцитов, реализация которого прямо связана с редокс-гомеостазом, а следовательно, обеспечивать высокую индикаторную значимость данных показателей.
Диапазон содержания лейкоцитов у крупного рогатого скота в норме шире, чем у человека, его верхняя граница достигает 12±0,7 млрд кл/л [4]. Количество лейкоцитов у экспериментальных групп быков составило в среднем 7,8±0,6 млрд кл/л. В то же время кровь крупного рогатого скота отличается от крови других животных и человека преобладанием лимфоцитов (70-85%) над гранулоцитами. Следовательно, наблю- даемая хемилюминесценция, амплитуда и светосумма которой была вдвое ниже, чем у человека, обеспечивалась в 5–7 раз меньшим количеством клеток.
Это означает, что в целом клетки крови у быков характеризуются более высокой интенсивностью генерации АФК. Судя по полученным результатам, фагоциты крупного рогатого скота обладают высокой чувствительностью к любому неспецифическому стресс-воздействию, и внесение клеток в искусственную среду даже в отсутствии дополнительных раздражителей (латекс) уже само по себе является достаточным раздражителем.
Выводы
-
1. При использовании люминесцентной диагностики интегральный статус неспецифической клеточной резистентности у обследованных животных хорошо распознается и поддаётся количественной оценке как в норме, так и при патологии.
-
2. Крайней степени несостоятельности фагоцит-опосредованной защиты у быков, выбракованных по причине инфекции, соответствует совпадение уровней стимулированного и базального ХЛ-ответа фагоцитов крови.
-
3. Маркером снижения резистентности организма в целом может быть снижение резерва свободнорадикальной активности фагоцитов в базальном и стимулированном состоянии.
Автор выражает благодарность ст. науч. сотр. группы иммунологии Международного научнотехнического центра при Президиуме КНЦ СО РАН, канд. биол. наук Макарской Галине Владимировне за предоставленную возможность провести исследования.


