Гальваностатическое исследование электропереноса на контакте RbCuCl I 4 3 2
Автор: Остапенко Г.И.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика твёрдого тела и твердотельная электроника
Статья в выпуске: 1 т.2, 2000 года.
Бесплатный доступ
Исследована кинетика процесса электропереноса, происходящего на стеклоуглеродном электроде в контакте с твердым электролитом RbCu Cl I. В интервале потенциалов от нуля до потенциала 4 3 2 разложения электролита на электроде происходит обратим ая электрохимическая реакцияCu+ e ? Cu2+. Скорость электродной реакции контролируется диффузией Cu2+ ионов в электролите. Коэффициент диффузии Cu2+ ионов равен 1,5?10-8 см2/с. Плотность тока обмена электродной реакции составляет около 20?10-6 А/cм2.
Короткий адрес: https://sciup.org/148197560
IDR: 148197560
Текст научной статьи Гальваностатическое исследование электропереноса на контакте RbCuCl I 4 3 2
Электролит RbCu 4 Cl 3 I2 обладает наиболее высокой проводимостью ( по ионам Cu+ ) среди низкотемпературных твердых электролитов. Поэтому актуальными являются мощные химические источники электрической энергии , работающие при комнатной температуре, а также электролитические суперконденсаторы с емкостью до 50 Ф/см3 с этим электролитом. При функционировании этих устройств на контактах происходят электрохимические реакции, от скорости протекания которых зависят рабочие характеристики устройств.
Некоторые электрохимические реакции с участием Cu+ ионов в медьпроводящих твердых электролитах, например:
Cu0 - e ^ Cu+, (1) исследованы достаточно подробно [1-3]. Однако такие твердые электролиты всегда содержат примесь Cu2+ ионов вследствие химической нестабильности соединений одновалентной меди. Поэтому в этих электролитах, в том числе в RbCu4Cl 3 I2 , имеет место электрохимическая реакция с участием Cu2+ ионов [4-8] :
Cu+ - e ^ Cu2+. (2)
Исследование этой реакции представляет значительный интерес, т.к. при некоторых допущениях [7] Cu2+ ионы можно связать с дырочной проводимостью медьпроводящих твердых электролитов, определяющей саморазряд электрохимических устройств с этими электролитами.
Реакцию (2) удобно исследовать при поляризации индифферентного (не медного) электрода. При потенциостатических исследованиях платинового [5] и стеклоуглеродного [7,8] электродов было выяснено, что вблизи равновесного потенциала скорость реакции (2) контролируется замедленной диффузией Cu2+ ионов в электролите.
В представляемой работе проведено подробное гальваностатическое исследование стеклоуглеродного электрода в контакте с твердым электролитом RbCu4Cl 3 I2 при потенциалах от нуля до потенциала электрохимического разложения электролита ф й ( для RbCu4Cl 3 I2 : ф й = 0,57 В [9]).
Эксперимент
Твердый электролит RbCu4Cl 3 I2 готовили по способу, описанному в [10] . Структуры: Cu /RbCu4Cl 3 I2 / С (стеклоуглерод) приготавливали в атмосфере сухого воздуха (осушитель Рр ) ) путем прессования при давлении 2,2x10 8 Па порошков RbCu 4 Cl3I 2 и меди к плоскому стеклоуглеродному диску диаметром 12 мм. Толщина слоя электролита равна около 1 мм. В электролит помещали электрод сравнения из медной проволоки диаметром 0,2 мм. Поджим ячеек составлял около 3x10 6 Па. Перед измерениями ячейки прокаливали при температуре 130 оС в течение нескольких часов.
Поляризацию ячеек осуществляли с помощью потенциостата П-5848 (Россия) при комнатной температуре.
Результаты и дискуссия
Стеклоуглеродный электрод в контакте с исследованным RbCu 4 Cl 3 I2 имеет равновесный потенциал ф0 около 0,5 В.
На рис.1 показаны типичные анодные и катодные гальваностатические (при протекании через контакт постоянного по величине тока) переходные характеристики потенциал ф - время t .
Сразу необходимо заметить, что влиянием заряжения емкости двойного электрического слоя контакта углерод/твердый электролит (10...20 мкФ/см2) на переходные характеристики при исследованных временах можно пренебречь.
В случае диффузионной кинетики гальваностатические переходные характеристики описываются известным уравнением [11] :
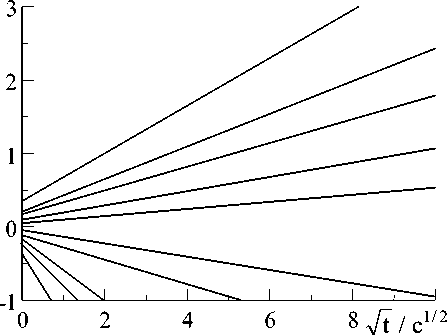
Рис. 2. Гальваностатические переходные характеристики из рис.1 в координатах ур.(5)
kT ф - ф 0 = — In e
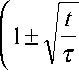
'
/
где k - постоянная Больцмана, Т - температура, e - элементарный заряд и переходное время (через которое концентрация Cu2+ ионов на контакте станет равной нулю):
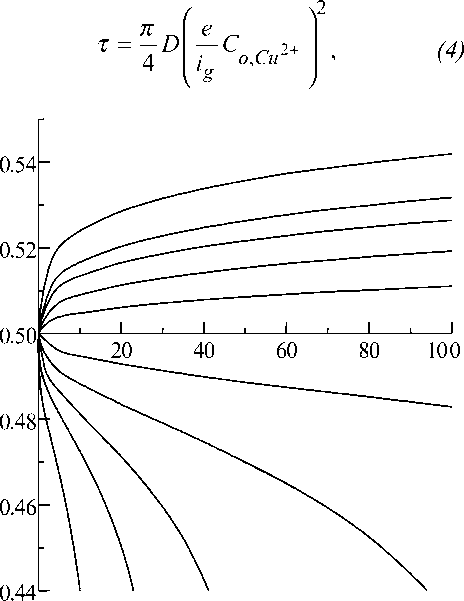
Рис.1. Гальваностатические переходные характеристики при плотностях тока, мкА/см2: 1 -6; 2 - 4; 3 - 3; 4 - 42; 5 - (-1); 6 - (-2);
7 - (-3); 8 - (-4)
где Co cu 2 + - равновесная концентрация Cu2+ ионов в электролите, D - коэффициент диффузии этих ионов, i g - плотность тока.
Уравнение (3) можно представить в виде:
e exp — kT
(ф - ф0 ) -1 = ^ .
На рис.2 показаны гальваностатические переходные характеристики из рис.1 в координатах (5). В этих координатах переходные характеристики близки к прямым. Следовательно, можно утверждать, что в интервале потенциалов 0 ..ф (при потенциалах 0...ф 0 реакция (1) блокирована и при ф 0 ..ф реакция (2) обратима) скоростьопределяющей стадией электродной реакции (2) является замедленная диффузия Cu2+ ионов в электролите.
Однако прямые на рис.2 не экстраполируются в нуль координат. Следовательно, при t^ 0, перенапряжение (ф - ф0) = n ^ 0. Это перенапряжение может быть только перенапряжением переноса заряда ntr. На рис.2 ntr не превышает 8 мВ. Поэтому можно оценить величину сопротивления переноса заряда 0 через контакт из отрезков ординат при t = 0: 0 = n tr / ig. В нашем случае 0 = (1,3 ± 0,1) х 103 Ом/см2. Отсюда величина тока обмена на кон- kT 1
такте i o = — — с оставляет (20 ± 2) х 10-6 А/см 2 .
На рис.3 показаны гальваностатические переходные характеристики из рис.2 для “чистой” диффузии, т.е. за вычетом перенапряжения переноса заряда n tr . Вычислены величины т из наклона прямых:
1 3 ГГ e z .1 .
еХР кТ (ф - ф 0 -^ tr )- 1
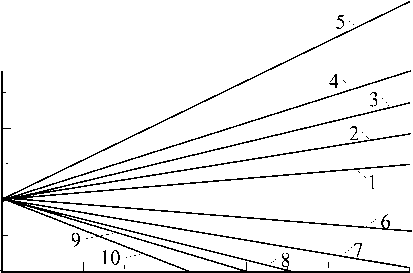
Рис. 3. Гальваностатические переходные характеристики из рис. 2 за вычетом перенапряжения переноса заряда h r .
- 1
С использованием этой величины по уравнению (6) вычислено:
D = (1,5 ± 0,5) х 1^ 8 c м 2/c .
Здесь необходимо заметить, что уравнение (3) выведено для случая избытка фонового электролита. В нашем случае таким “электролитом” являются Cu+ ионы. Эти ионы элиминируют градиент электрического поля в глубине RbCu 4 Cl 3 I2 и таким образом мы исследуем “чистую” диффузию Cu2+ ионов.
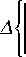
exP e ( Ф — O tr - Ф о ) - 1
А^
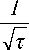
На рис.4 показана зависимость т от плотности тока в координатах уравнения (4). Наклон прямой на этом рисунке зависит от коэффициента диффузии и равновесной концентрации Cu2+ ионов:
А
V
ig
л /
a V t
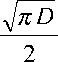
C „ 2 + o,Cu
Величина равновесной концентрации Cu2+ ионов взаимосвязана с равновесным потенциалом стеклоуглеродного электрода уравнением Нернста:
Ф 0 = Ф 0 2+Jr + Cu / Cu
C 2 +
+ kT In -(C e Co,Cu + ’
Выводы
Скоростьопределяющей стадией электрохимического процесса на контакте С/ RbCu 4 Cl 3 I 2 в интервале потенциалов от нуля до потенциала электрохимического разложения электролита является диффузия Cu2+ ионов в электролите. Коэффициент диффузии Cu2+ ионов равен 1,5 х 10-8 см 2/ с.
Плотность тока обмена электродной реакции Cu+ - e ^ Cu2+ составляет около 2 0 х10- 6 А/ c м2.
Представленные в этой работе результаты гальваностатических экспериментов хорошо согласуются с результатами потенциоста-тических исследований [8].
Показано, что в случае контакта C/RbCu 4 C1 3 I 2 можно использовать классические уравнения электрохимической кинетики и не требуется специальных теорий для твердых электролитов [14,15].
Твердые электролиты являются превосходным объектом для исследования диффузионных процессов, т.к. в них отсутствует конвекция. Поэтому гальваностатические пе-
где Ф cu 2 + /cu + - стандартный электрохими
ческий потенциал пары Cu2+/Cu+ и C o cu + -равновесная концентрация Cu+ ионов в электролите.
Из этого уравнения при ф0 = 0,5 В, 0
ФCu 2 +/ Cu + = 0,624 В [!2] и
C o , Cu + = 1,59х102 см3 [13] имеем:
Co,Cu 2 + = 1,25 х1018 см-1.
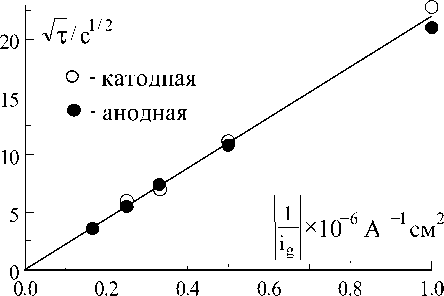
Рис. 4. Зависимость переходного времени от плотности тока
реходные характеристики хорошо соответствуют уравнениям диффузионной кинетики даже при сравнительно длительных временах.
Работа выполнена в рамках Федеральной целевой программы “Государственная поддержка интеграции высшего образования и фундаментальной науки”, проект № А-0066.


