Гаплотипы фертильности голштинского скота
Автор: Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 4 т.51, 2016 года.
Бесплатный доступ
Голштинскую породу крупного рогатого скота разводят по крайней мере в 161 стране, на долю животных голштинской и голштинизированной черно-пестрой пород в общем поголовье молочного скота в России приходится более 65 %. Однако на фоне постоянного увеличения молочной продуктивности у коров голштинской породы наблюдается снижение репродуктивной способности (A. Barbat с соавт., 2010). В настоящее время такое снижение связывают с генетическими факторами. Поступательный рост гомозиготности в культурных породах крупного рогатого скота (КРС) обусловливает возрастание негативного влияния LoF-мутаций (loss-of-function) на фертильность коров. Диагностика LoF-мутаций, ассоциированных с летальными наследственными заболеваниями, становится одним из ключевых элементов в системе генетического мониторинга популяций сельскохозяйственных животных (Ю.А. Столповский, 2010; Н.С. Марзанов с соавт., 2012). Существенный прогресс в идентификации LoF-мутаций, ассоциированных с фертильностью, был достигнут с разработкой нового подхода, названного картированием гомозиготности (C. Charlier с соавт., 2008). Он основан на генотипировании десятков тысяч SNP (single nucleotide polymorphism) с помощью чипов средней и высокой плотности и последующей идентификации регионов с потерей гомозиготности, то есть характеризующихся отсутствием одного из гомозиготных генотипов. Этот подход позволяет выявлять области хромосом, которые служат регионами-кандидатами для локализации гаплотипов фертильности, ассоциированных с эмбриональной и ранней постэмбриональной смертностью. В течение последних нескольких лет гаплотипы фертильности были идентифицированы практически во всех основных породах молочного скота: голштинской (P.M. VanRaden с соавт., 2011; S. Fritz с соавт., 2013; T.A. Cooper с соавт., 2013), джерсейской (P.M. VanRaden с соавт., 2011; T.S. Sonstegard с соавт., 2013), бурой швицкой (P.M. VanRaden с соавт., 2011; T.A. Cooper с соавт., 2013; M. McClure с соавт., 2013), монбельярдской (S. Fritz с соавт., 2013), айрширской (T.A. Cooper с соавт., 2013), симментальской (H. Pausch с соавт., 2015), у красного нордического скота (N.K. Kadri с соавт., 2014). В представленном обзоре обобщены результаты идентификации LoF-мутаций, приводящих к нарушениям воспроизводства, в геноме голштинского скота. В настоящее время в голштинской породе регистрируется 10 гаплотипов фертильности (HCD, HH0, HH1, HH2, HH3, HH4, HH5, HHB, HHC, HHD), оказывающих влияние на степень стельности и(или) ассоциированных с эмбриональной и ранней постэмбриональной смертностью на различных стадиях (J.B. Cole с соавт., 2016). Рассматриваются возможные причины распространения гаплотипов фертильности в популяциях крупного рогатого скота: интенсивное использование в искусственном осеменении быков - скрытых носителей, значительный период времени от возникновения до идентификации мутаций (18-59 лет), возможная связь гаплотипов фертильности с показателями молочной продуктивности. Дана характеристика хромосомной локализации гаплотипов фертильности, показано их влияние на степень стельности, приводятся частоты встречаемости в североамериканской популяции голштинов, описаны стадии стельности и возраст телят, на которые приходится гибель плодов и телят - носителей гаплотипов фертильности. Представлена информация о быках-производи-телях, ставших родоначальниками гаплотипов фертильности. Дана характеристика генов и соответствующих LoF-мутаций, ассоциированных с гаплотипами фертильности. Показано, что отцы более 5 % быков-производителей, используемых в Российской Федерации, - скрытые носители гаплотипов фертильности. Это обусловливает актуальность скрининга российской популяции голштинского и голштинизированного скота с целью выявления скрытых носителей. Отмечается важная роль ДНК-диагностики в контроле и элиминации гаплотипов фертильности и ассоциированных с ними генетических дефектов в российской популяции племенного скота. Так, в первые 1-2 года генетического мониторинга среди быков-производителей диагностировалось боле
Голштинская порода, эмбриональная смертность, генетические дефекты, гаплотипы фертильности
Короткий адрес: https://sciup.org/142213696
IDR: 142213696 | УДК: 636.234.1:636.082:57.017.53:577.21 | DOI: 10.15389/agrobiology.2016.4.423rus
Текст обзорной статьи Гаплотипы фертильности голштинского скота
Голштинская порода крупного рогатого скота используется для
Исследования выполнены при поддержке государства в лице Минобрнауки России, проект ¹ 14.604.21.0062, уникальный идентификационный номер RFMEFI60414X0062.
производства молока во всем мире. По данным FAO (Food and Agriculture Organization), ее разводят по крайней мере в 161 стране (1). На долю животных голштинской и голштинизированной черно-пестрой пород в общем поголовье молочного скота в России приходится более 65 % (2).
Однако на фоне постоянного поступательного роста молочной продуктивности у коров голштинской породы наблюдается снижение репродуктивной способности (3). Так, в американской популяции голштинских коров с 1976 по 1999 год сервис-период (период от рождения потомства до первого результативного осеменения) увеличился со 126 до 169 сут (4); с 1970 по 2000 год число осеменений, необходимых для достижения стельности, увеличилось с 1,8 до 3,0, а интервал между отелами — с 13,5 до 14,9 мес (5); с 1972 по 1996 год доля стельностей после первого осеменения снизилась с 62 до 34 % (6).
В России частота наступления стельности коров после первого осеменения составляет 40-50 % (7). До недавнего времени снижение воспроизводительной способности связывали главным образом с послеродовыми проблемами клинического характера, а также с развитием метаболического стресса, обусловленного лактацией. В настоящее время считается, что по крайней мере половина такого снижения обусловлена генетическими факторами (5, 8, 9).
Исследование нескольких сотен человеческих геномов, полученных с использованием NGS-технологий (new generation sequencing), показало, что усредненный геном несет 250-300 вариантов последовательностей с нарушением функций (LoF, loss-of-function), 50-100 из которых локализованы в генах заболеваний (10, 11) и около 20 представляют собой полностью инактивированные гены (12). Сходная вариабельность геномов человека и крупного рогатого скота позволяет предположить наличие приблизительно равного числа LoF-мутаций в геноме последнего (13).
В настоящем обзоре обобщены результаты исследований по идентификации LoF-мутаций у голштинского крупного рогатого скота, ассоциированных с эмбриональной и ранней постэмбриональной смертностью и обозначенных как гаплотипы фертильности. Открытие целого ряда LoF-мутаций стало возможным благодаря разработке и применению нового подхода — так называемого картирования гомозиготности.
Возрастание негативного влияния LoF-мутаций на фертильность коров связывают с поступательным ростом гомозиготности в культурных породах, поскольку в гомозиготном состоянии такие мутации могут быть летальными, приводя к эмбриональной гибели. Так, средний коэффициент инбридинга у голштинского скота в США вырос с 0,22 % в 1965 году до 6,53 % в 2015 году (14). Причинами возрастания степени инбридинга стали относительно низкое исходное генетическое разнообразие в большинстве молочных пород как следствие их происхождения от ограниченного числа родоначальников; интенсивное использование для искусственного осеменения относительно небольшого числа выдающихся быков-производителей, практикуемое в течение более 50 лет; жесткая селекция по ограниченному числу признаков (15). Некоторые голштинские быки стали отцами нескольких тысяч сыновей, оцененных по качеству потомства, и нескольких сотен тысяч и даже более миллиона лактирующих дочерей. Кроме того, из приблизительно 5000 быков, оцениваемых ежегодно по качеству потомства, почти 50 % — потомки 10 наиболее популярных быков (16). В этой связи диагностика LoF-мутаций, ассоциированных с летальными наследственными заболеваниями, становится одним из клю-424
чевых элементов в системе генетического мониторинга популяций сельскохозяйственных животных (17, 18).
Число LoF-мутаций, обусловливающих наследственные аномалии и вызывающих эмбриональную и раннюю постэмбриональную смертность, в молочных породах крупного рогатого скота до недавнего времени ограничивалось единицами. Так, в голштинской породе были идентифицированы LoF-мутации, вызывающие следующие наследственные заболевания: дефицит уридинмонофосфатсинтазы (deficiency of uridine monophosphate synthase, DUMPS) (19), дефицит лейкоцитарной адгезии (bovine leukocyte adhesion deficiency, BLAD) (20), комплексный порок позвоночника (complex vertebral malformation, CVM) (21), брахиспинальный синдром (brachyspina syndrome, BY) (22); в бурой швицкой породе с проявлением LoF-мутаций связывали синдром Вивера (23).
Существенный прогресс в идентификации LoF-мутаций, ассоциированных с фертильностью, был достигнут с разработкой нового подхода, названного картированием гомозиготности. Он основан на генотипировании десятков тысяч SNP (single nucleotide polymorphism) с помощью чипов средней и высокой плотности и последующей идентификации регионов с потерей гомозиготности, то есть характеризующихся отсутствием одного из гомозиготных генотипов. Примером может служить чип Bovine SNP50 v2 BeadChip («Illumina», США), позволяющий проводить анализ 54609 SNP.
Подобные участки генома рассматриваются в качестве кандидатов для локализации генов, несущих LoF-мутации. Предложенный метод позволяет осуществлять идентификацию летальных генетических дефектов в течение очень короткого периода времени и при наличии ограниченного числа случаев их проявления (24). Применение нового подхода позволило в течение последних нескольких лет идентифицировать такие дефекты практически во всех основных породах молочного скота: голштинской (25-27), джерсейской (25, 28), бурой швицкой (25, 27, 29), монбельярдской (26), айрширской (27), симментальской (30), у красного нордического скота (31). Выявленные посредством картирования гомозиготности дефекты получили название гаплотипов фертильности. Известные ранее генетические дефекты DUMPS, BLAD, CVM и Брахиспина были также подтверждены с использованием этого подхода. Если для диагностики генетических дефектов используется ДНК-чип, то результаты интерпретируются как идентификация соответствующих гаплотипов (HHD, HHB, HHC, HH0), в то время как при прямом анализе причинной мутации речь идет об идентификации собственно генетических дефектов.
В голштинской породе в настоящее время регистрируется 10 гаплотипов фертильности (HCD, HH0, HH1, HH2, HH3, HH4, HH5, HHB, HHC, HHD), оказывающих влияние на процент успешных осеменений (с наступлением стельности) и(или) ассоциированных с эмбриональной и ранней постэмбриональной смертностью на различных стадиях и встречающихся с частотой от 0,01 до 2,95 % (32) (рис. 1). Негативное влияние этих гаплотипов, оцененное в популяции североамериканских голшти-нов, проявляется в снижении частоты осеменений, завершившихся стельностью (при спаривании коров, отцы которых были скрытыми носителями гаплотипа, с быками, содержащими в геноме аналогичный гаплотип), на 1,0-9,9 % (25-27).
Распространению гаплотипов фертильности способствует то, что их носители — выдающиеся быки-производители, которых предпочитают использовать в системе искусственного осеменения. Например, знаменитый бык Carlin-M Ivanhoe BELL оказался скрытым носителем гаплотипов HHB и HHC. Однако только в США от него получили более 79000 лактирую-щих дочерей и более 1200 оцененных сыновей (33).
Носителями гаплотипа HH1 были два интенсивно вовлекавшихся в воспроизводство быка-производителя — Pawnee Farm Arlinda CHIEF (1962 год рождения) и его сын Walkway Chief MARK (1978 год рождения). От последнего получено более 60 тыс. дочерей и сыновья, ставшие активно используемыми быками-производителями (34). Установлено, что с каждым из двух этих быков связано около 7 % аллелофонда современной североамериканской популяции голштинов (35).
А
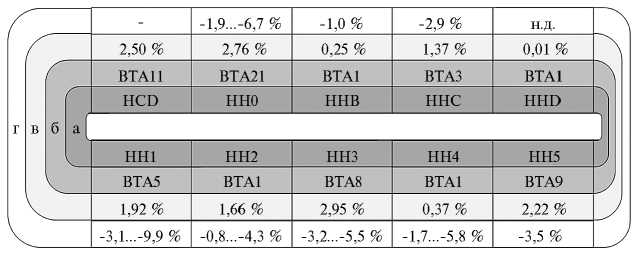
Б
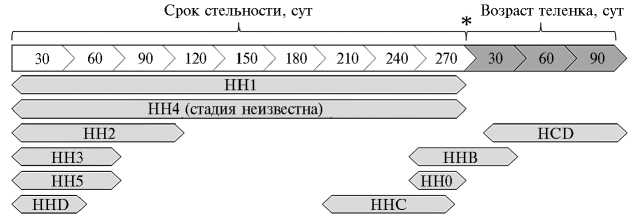
Рис. 1. Краткая характеристика гаплотипов фертильности у голштинского скота.
А — хромосомная локализация, распространение и фенотипическое проявление гаплотипов фертильности голшинского скота: а — гаплотипы фертильности голштинского скота; б — аутосомы крупного рогатого скота (BTA), на которых локализованы гены, ассоциированные с гаплотипами фертильности; в — частота встречаемости гаплотипа (составляет 1/ 2 от частоты скрытых носителей) в североамериканской популяции голштинов; г — снижение частоты стельности у коров, отцы которых были скрытыми носителями дефекта, при спаривании с быками — скрытыми носителями аналогичного дефекта, рассчитанное для североамериканской и французской популяций голштинов. Прочерк означает, что стельность протекает нормально, а гибель теленка происходит в течение 1-2 мес жизни; н.д. — не диагностировалось.
Б — схематическое отображение сроков гибели плодов (телят) — гомозиготных носителей гаплотипов фертильности. Срок стельности коров-матерей указан на шкале с белой заливкой, начиная с осеменения (принимается за 0-е сут); дата отела маркирована звездочкой. Шкала, отражающая возраст теленка, начинается с даты отела (принимается за 0-е сут) и показана серой заливкой. Гаплотипы фертильности (HCD, HH0, HH1, HH2, HH3, HH4, HH5, HHB, HHC, HHD) указаны внутри стрелок, расположение которых относительно шкалы срока стельности и шкалы возраста теленка показывает вероятный период, когда происходит гибель плода или теленка, гомозиготного по соответствующему гаплотипу.
Широкое распространение гаплотипа HH4 произошло через французского быка JOCKO BESNE, от которого было получено более 1,7 млн доз семени. В базах данных голштинского скота в 21 стране имеются учетные записи о продуктивности более 160 тыс. его дочерей. Число ферм во Франции, на которых используются дочери JOCKO BESNE, — свыше 23000 (36).
Другая причина накопления гаплотипов фертильности в популяци- ях скота — длительный интервал (18-59 лет) от возникновения мутаций до их идентификации и разработки тест-систем для скрининга и выявления скрытых носителей (рис. 2).
I 1950 > > > > > > > 2020 ^
< 1954 | НИЗ (Gray View SKYLINER) \
< 1968 | HH3 (GLENDELL Arlinda Chief) p'/
< 1957 | HHDi | 198~ >
< 1957 | HH5 (THORNLEA TEXAL SUPREME) | 2013 >
< 1962 | HH1 (Pawnee Farm Arlinda CHIEF) | 2012 >
< 1963 | HHC (Pennstate IVANHOE Star) | 20<~ >
< 1974 | HHB2 | 1992~>
< 1974 |HH0 (Sweet Haven TRADITION)! 2012 >
< 1975 | HH2 (MARK ANTHONY) | 2014 >
< 1986 |HH4 (BESNE BUCK), 2013 >
< 1991 |HDC (M. STORM*)| 2016 >
Рис. 2. Период от рождения голштинских быков — родоначальников гаплотипов фертильности до идентификации соответствующих мутаций. По каждому гаплотипу стрелка ориентирована по шкале времени (вверху) от года рождения быка-родоначальника (слева) до года идентификации соответствующей мутации (справа). Название гаплотипа приведено в скобках в центральной части стрелки с указанием клички соответствующего быка-родоначальника (HHD1 — Skokie Sensation NED; HHB2 — Carlin-M Ivanhoe BELL). Звездочкой отмечен наиболее ранний описанный носитель мутации (точный родоначальник неизвестен).
В качестве еще одной причины распространения гаплотипов фертильности можно рассматривать их возможную ассоциацию с продуктивными качествами. Так, анализ ∼ 3 млн записей параметров продуктивности у 1,7 млн дочерей быков с известными генотипами по HHC показал, что дочери быков — скрытых носителей HHC имели более высокий удой (в среднем на 160 кг) и больший выход молочного жира (на 4 кг) и белка (на 5 кг) (37). В настоящее время установлены гены и точная локализация соответствующих LoF-мутаций для 9 гаплотипов фертильности голштинского скота (табл.).
Гены и соответствующие LoF-мутации, ассоциированные с гаплотипами фертильности у голштинского скота
|
Гаплотип |
OMIA ID |
Ген |
Полиморфизм |
Ссылка |
||
|
символ |
] наименование (дефект) |
позиции |
тип |
|||
|
HCD |
001965 |
APOB |
Аполипопротеин B (дефицит холестерина; cholesterol deficiency haplotype, CDH) |
77.958.994 |
1,3 kb Ins (G135Vfs10X) (38-40) |
|
|
HH0 |
000151 |
FANCI |
Анемия Фанкони, комплементарная группа I (брахиспина; brachyspina syndrome, BY) |
21.184.869 21.188.198 |
Del (V877Lfs27X) (22, 41) |
|
|
HH1 |
000001 |
APAF1 |
Фактор 1, активирующий апоптические протеазы; apoptic protease-activating factor 1 |
63.150.400 |
С → T (Q579X) |
(42) |
|
HH2 |
001823 |
94.860.836 96.553.339 |
(25, 43) |
|||
|
HH3 |
001824 |
SMC2 |
Белок структурной поддержки хромосом 2 |
95.410.507 |
T → C (F1135S) |
(43, 44) |
|
HH4 |
001826 |
GART |
Фосфорибозилглицинамид-синтетаза |
1.277.227 |
A → C (N290T) |
(26) |
|
HH5 |
001941 |
TFB1M |
Митохондриальный транскрипционный фактор B1 |
93.232.651 93.370.998 |
138 kb Del |
(27, 45) |
|
HHB |
000595 |
ITGB2 |
β-Интегрин (дефицит лейкоцитарной адгезии; 145.119.004 A → G bovine leukocyte adhesion deficiency, BLAD) |
(20) |
||
|
HHC |
001340 |
SLC35A3 |
Член А3 семейства транспортеров растворенных веществ 35 (комплексный порок позвоночника; complex vertebral malformation, CVM) |
43.411.473 |
G → T (V180F) |
(21) |
|
HHD |
000262 |
UMPS |
Уридинмонофосфатсинтаза (дефицит ури-динмонофосфатсинтазы; deficiency of uridine monophosphate synthase, DUMPS) |
69.757.801 |
T → C (R1247X) |
(19) |
П р и м е ч а н и е. OMIA ID — идентификационный номер в базе данных Online Mendelian Inheritance in Animals. Прочерки означают, что ген и мутация пока не идентифицированы.
Гаплотип HCD, приводящий к гибели телят в первые недели или месяцы жизни от последствий, вызванных идиопатической диареей, картирован на 11-й хромосоме (38). Причина HCD — инсерция мобильного LTR-элемента (ERV2-1) размером 1299 bp после позиции 77.958.994 BTA11 (UMD3.1), расположенная между 24-м и 25-м нуклеотидами экзона 5 в гене аполипопротеина B ( APOB , apolipoprotein B) (39). В независимом исследовании (40) локализацию мутации подтвердили, однако полный размер инсерции эндогенного ретровирусного элемента (BoERV) оценили равным примерно 7 kb. Инсерция обусловливает сдвиг рамки считывания, начиная от аминокислоты APOB в позиции 135 (Gly135ValfsX10), и приводит к отсечению 97 % соответствующего белка длиной 4567 аминокислот. APOB занимает центральное место в системе аполипопротеинов и служит обязательным компонентом липопротеинов низкой плотности и хиломикронов. Выявленный дефект аналогичен наследственной гипобеталипопротеинэмии 1 (familial hypobetalipoproteinemia 1, FHBL1) у человека (OMIM ¹ 615558), которая характеризуется гипохолестерин-эмией и отсутствием абсорбции жирорастворимых витаминов, что приводит к деградации сетчатки.
Гаплотип HH0, ассоциированный с мертворождением, картирован в области 20-25 Mb на 21-й хромосоме (25). Была установлена связь с гаплотипом HH0 делеции размером 3,3 kb в гене FANCI (Fanconi anemia complementation group I), которая включала экзоны 25-27-й из 37 экзонов, интроны 25-й, 26-й и частично интроны 24-й и 27-й (41). FANCI необходим для поддержания хромосомной стабильности. Специфически связываясь как с одноцепочечной, так и с двухцепочечной ДНК, этот белок принимает участие в активации на фазах S и G 2 клеточного цикла. FANCI играет важную роль в репарации разрывов двухцепочечной ДНК посредством гомологической рекомбинации и в репарации межцепочечных кросслинков (interstrand crosslink, ICL). Мутация в гене FANCI у крупного рогатого скота обусловливает нарушения эмбрионального развития, проявляющиеся в снижении массы плода, нарушении роста, позвоночных уродствах в форме укорочения позвоночного столба и удлинении конечностей. Кроме того, отмечаются аномалии развития внутренних органов, в частности сердца, почек и гонад.
Гаплотип HH1, связанный с эмбриональной смертностью на разных сроках стельности, картирован на 5-й хромосоме в области 58-66 Mb (25, 26). Установлено, что причиной снижения фертильности, ассоциированной с HH1, служит нонсенс-мутация C → T в гене фактора 1, активирующего апоптотические протеазы (apoptotic peptidase-activating factor 1, APAF1 ), приводящая к замене Gln Stop в позиции 579 аминокислотной последовательности (42). Функциональный пептид APAF1 инициирует апоптоз и необходим для нормального эмбрионального развития (46).
Гаплотип HH2, который становится причиной гибели плодов до 100-х сут стельности, картирован в области 92-97 Mb на 1-й хромосоме (25). Позднее для HH2 было указано расположение между позициями 94.860.836 и 96.553.339 (43), однако точная локализация мутации до настоящего времени не установлена.
Гаплотип HH3, с которым связана эмбриональная смертность до 60-х сут стельности, картирован на 8-й хромосоме на участке 90-95 Mb (25). По уточненным данным, область локализации HH3 — 94-96 Mb (26), установлена его ассоциация с мутацией в гене структурной поддержки хромосом 2 ( SMC2 , structural maintenance of chromosomes 2), также известном как chromosome-associated polypeptide E (ассоциированный c хромо-428
сомами полипептид E) (30). Причина HH3 — несинонимичная замена Т → С в позиции 95.410.507 24-го экзона в гене SMC2 , приводящая к аминокислотной замене Phe → Ser в положении 1135 в НТФазном домене кодируемого белка (43, 44, 47). Являясь субъединицей конденсинов I и II — больших белковых комплексов, SMC2 участвует в репарации ДНК, конденсации хромосом и их сегрегации в процессе клеточного деления (48).
Гаплотип HH4, приводящий к эмбриональной смертности (стадия неизвестна) локализован на 1-й хромосоме в области 1,9-3,3 Mb (26). Установлено, что гаплотипу HH4 соответствует миссенс-мутация A → C в положении 1.277.227 в гене фосфорибозилглицинамид-синтетазы ( GART , glycinamide ribonucleotide formyltransferase), приводящая к аминокислотной замене Asn → Thr в позиции 290 (26). GART — трифункциональный пептид, который участвует в биосинтезе пуринов de novo (49) и необходим для нормального эмбрионального развития.
Гаплотип HH5, обусловливающий эмбриональные потери до 2 мес стельности, картирован на 9-й хромосоме (25) в области 92.350.05293.910.957 (27). Установлено, что причина эмбриональной смертности, ассоциированной с HH5, — делеция размером 138 kb (точки разрыва и слияния соответственно в позициях 93.232.651 и 93.370.998 UMD_3.1). На участках, прилегающих к разрывам с обеих сторон, найдены повторяющиеся элементы — член семейства Bov-B (upstream) и L1ME3 из семейства L1 LINE (downstream). Исходя из этого, был сделан вывод, что мутационное событие произошло вследствие гомологичной рекомбинации/делеции. Делеция затрагивает полную последовательность гена диметиладенозин-трансферазы 1, известного также как ген митохондриального транскрипционного фактора B1 (mitochondrial transcription factor B1, TFB1M ) (45) . TFBM1 необходим для инициации трансляции белков в митохондриях, поэтому его отсутствие у животных, гомозиготных по мутации, вызывает летальный эффект.
Методом картирования гомозиготности были подтверждены ассоциации гаплотипов HHB (локализован в области 141-146 Mb на 1-й хромосоме), HHC (40-46 Mb на 3-й хромосоме) и HHD (55-73 Mb на 1-й хромосоме) с ранее открытыми наследственными дефектами — соответственно дефицитом лейкоцитарной адгезии у крупного рогатого скота (BLAD), комплексным пороком позвоночника (CVM) и дефицитом ури-динмонофосфатсинтазы (DUMPS) (25).
Известно, что причина BLAD — замена A → G в позиции 383 гена β -интегрина (integrin beta 2, ITGB2 ), приводящая к аминокислотной замене Asp → Gly (20). ITGB — мембранный белок, компонент гетеродимерного поверхностного гликопротеина, состоящего из субъединиц α и β , который необходим для обеспечения агрегации тромбоцитов. Интегрины влияют на онтогенез, гемостаз, тромбоз, заживление ран, метастазирование опухолей, а также на иммунную защиту. Мутация в ITGB приводит к нарушению взаимодействия β -субъединицы с α -субъединицами, что делает лейкоциты неспособными проникать из кровяного русла к месту инфекции (50), нарушая тем самым иммунную защиту организма.
Причина CVM — миссенс-мутация G → T в позиции 599 в гене члена A3 семейства транспортеров растворенных веществ 35 (solute carrier family 35, member A3, SLC35A3 ), приводящая к аминокислотной замене Val → Phe в позиции 180 (51). SLC35A3 (UDP-N-ацетилглюкозамин, UDP-GlcNAc, транспортер), известный также как DKFZp781P1297, отвечает за транспорт UDP-N ацетилглюкозамина в полости комплекса Гольджи. Мутация в гене SLC35A3 приводит к нарушению его функции. Дан-429
ные, полученные при анализе 62062 осеменений с использованием быков — скрытых носителей мутации и их дочерей, показали, что большинство (до 77 %) плодов-носителей резорбируются или погибают до 260-х сут стельности, при этом аборты могут происходить на любых сроках (52). Остальные стельности заканчиваются мертворождением обычно на 1-2 нед раньше ожидаемой даты отела. Лишь небольшая доля гомозиготных по CVM телят рождаются живыми, однако и они вскоре погибают. Характерные признаки телят-носителей — общая недоразвитость, укороченная шея, слившиеся и деформированные позвонки и сколиоз. Также может наблюдаться деформация суставов передних и задних конечностей. Кроме того, у родившихся в срок мертвыми телят выявляются пороки сердца. Так, из 62 пораженных CVM плодов и мертворожденных телят в 61 случае (98,4 %) с использованием радиографии были установлены повреждения позвоночника, из которых в 58 случаях (93,5 %) выявлены пороки ребер. Пороки сердца, главным образом в форме дисплазии, присутствовали в 15 случаях (24,2 %). Билатеральная симметричная изогнутость запястных и пястных суставов была обнаружена во всех случаях, в то время как поздний артрит выявлен в 54 (87,1 %). Дефект перегородки желудочков сердца наблюдался в 33 случаях (53,2 %) зачастую в сочетании с другими кардиальными пороками (53).
DUMPS возникает вследствие нуклеотидной замены T → C в позиции 1247 гена уридинмонофосфатсинтазы (uridine monophosphate synthase, UMS ), приводящей к аминокислотной замене Arg → Stop (54). У животных-носителей вместо белка нормальной длины синтезируется укороченный протеин с нарушенными биологическими функциями. UMS — фермент, ответственный за превращение оротовой кислоты в уридинмонофосфат, служащий составной частью пиримидиновых нуклеотидов. Гомозиготность по мутантному аллелю обусловливает внутриматочную гибель эмбрионов до 40-х сут стельности, оказывая тем самым отрицательное влияние на плодовитость (55, 56).
Проведенный анализ родословных 560 быков-производителей, используемых в системе искусственного осеменения в России, и оценка их статуса по результатам поиска в базе данных голштинского скота (57) показали, что доля быков, имеющих отцов — скрытых носителей гаплотипов фертильности, достигает 5,4 %. Для снижения генетически обусловленных эмбриональных и ранних постэмбриональных потерь необходимо установить контроль за распространением гаплотипов фертильности в российской популяции голштинского и голштинизированного скота.
С этой целью в Центре биотехнологии и молекулярной диагностики Всероссийского НИИ животноводства им. академика Л.К. Эрнста (Московская обл., пос. Дубровицы) проводится генетический мониторинг LoF-мутаций в генах APOB , FANCI , APAF1 , SMC2 , GART , TFBM1 , ITGB2 , SLC35A3 , UMPS , которые ассоциированы соответственно с HCD, BY, HH1, HH3, HH4, HH5, BLAD, CVM и DUMPS (58-61).
Скрининг на наличие скрытых носителей вышеназванных генетических дефектов среди отечественного голштинского и черно-пестрого голштинизированного крупного рогатого скота показал, что они встречаются с относительно высокой частотой, которая достигает примерно 10 % у коров и около 4 % у быков-производителей.
Внедрение ДНК-диагностики позволяет контролировать распространение мутаций, обусловливающих наследственные дефекты, в популяции племенного скота и постепенно их элиминировать. Так, в первые 1-2 года генетического мониторинга среди быков-производителей диа-430
гностировалось более 5 % скрытых носителей CVM и около 3 % скрытых носителей BLAD, в то время как в настоящее время соответствующие мутантные аллели в исследованном поголовье быков-производителей отсутствуют (62, 63).
Таким образом, благодаря новому подходу — картированию гомозиготности в породах крупного рогатого скота были идентифицированы участки генома, ассоциированные с эмбриональной и ранней постэмбриональной смертностью, получившие название гаплотипов фертильности. В голштинской породе молочного скота в настоящее время регистрируются 10 летальных гаплотипов. Вследствие широкого распространения в популяциях племенного скота гаплотипы фертильности и лежащие в их основе LoF-мутации — одна из существенных причин снижения фертильности у коров. Принимая во внимание экспоненциальный рост числа исследований в области структурной и функциональной геномики животных, в частности крупного рогатого скота, в ближайшее время следует ожидать открытия новых генетических дефектов. В этой связи ДНК-диагностика станет действенным инструментом в контроле и управлении рисками, обусловленными распространением генетических дефектов в популяциях племенных животных.
Список литературы Гаплотипы фертильности голштинского скота
- Domestic animal diversity database (DAD-IS). Режим доступа: http://dad.fao.org/. Дата обращения: 27.02.2016.
- Лабинов В.В. Результаты и основные направления совершенствования селекционно-племенной работы в молочном скотоводстве Российской Федерации. Министерство сельского хозяйства РФ. Режим доступа: www.mcx.ru/documents/file_document/v7_show/33370.133.htm. Дата обращения: 28.05.2016.
- Barbat A., LeMezec P., Ducrocq V., Mattalia S., Fritz S., Boichard D., Ponsart C., Humblot P. Female fertility in French dairy breeds: current situation and strategies for improvement. J. Reprod. Dev., 2010, 56: S15-S21( ) DOI: 10.1262/jrd.1056S15
- Washburn S.P., Silvia W.J., Brown C.H., McDaniel B.T., McAllister A.J. Trends in reproductive performance in Southeastern Holstein and Jersey DHI herds. J. Dairy Sci., 2002, 85: 244-251 ( ) DOI: 10.3168/jds.S0022-0302(02)74073-3
- Lucy M.C. Reproductive loss in high-producing dairy cattle: where will it end? J. Dairy Sci., 2001, 84: 1277-1293( ) DOI: 10.3168/jds.S0022-0302(01)70158-0
- Silvia W. Changes in reproductive performance of Holstein dairy cows in Kentucky from 1972 to 1996. J. Dairy Sci., 1998, 81(Suppl. 1): 244.
- Субботин А.Д. Оптимальные режимы искусственного осеменения. Животноводство России, 2011, 10: 45-46.
- Dobson H., Smith R.F., Royal M.D., Knight C.H., Sheldon I.M. The high producing dairy cow and its reproductive performance. Reprod. Domest. Anim., 2007, 42(Suppl 2): 17-23 () DOI: 10.1111/j.1439-0531.2007.00906.x
- Oltenacu P.A., Broom D.M.The impact of genetic selection for increased milk yield on the welfare of dairy cows. Animal Welfare, 2010, 19(S): 39-49.
- Durbin R.M., the 1000 Genomes Project Consortium. A map of human genome variation from population-scale sequencing. Nature, 2010, 467: 1061-1073 ( ) DOI: 10.1038/nature09534
- Pelak K., Shianna K.V., Ge D., Maia J.M., Zhu M., Smith J.P., Cirulli E.T., Fellay J., Dickson S.P., Gumbs C.E., Heinzen E.L., Need A.C., Ruzzo E.K., Singh A., Campbell C.R., Hong L.K., Lornsen K.A., McKenzie A.M., Sobreira N.L., Hoover-Fong J.E., Milner J.D., Ottman R., Haynes B.F., Goedert J.J., Goldstein D.B. The characterization of twenty sequenced human genomes. PLoS Genet., 2010, 6(9): e1001111 ( ) DOI: 10.1371/journal.pgen.1001111
- MacArthur D.G., Balasubramanian S., Frankish A. et al. A systematic survey of loss-of-function variants in human protein-coding genes. Science, 2012, 335: 823-828 ( ) DOI: 10.1126/science.1215040
- Bickhart D.M., Hou Y., Schroeder S.G., Alkan C., Cardone M.F., Matukumalli L.K., Song J., Schnabel R.D., Ventura M., Taylor J.F., Garcia J.F., Van Tassell C.P., Sonstegard T.S., Eichler E.E., Liu G.E. Copy number variation of individual cattle genomes using next-generation sequencing. Genome Res., 2012, 22(4): 778-790 ( ) DOI: 10.1101/gr.133967.111
- Council on dairy cattle breeding. Inbreeding trend for Holstein or Red &White cows. Режим доступа: https://www.cdcb.us/eval/summary/inbrd.cfm? Дата обращения: 27.02.2016.
- Кузнецов В.М., Вахонина Н.В. Об ограничении инбридинга в малочисленных популяциях молочного скота. Сельскохозяйственная биология, 2010, 4: 55-58.
- Weigel K.A. Controlling inbreeding in modern breeding programs. J. Dairy Sci., 2001, 84(Suppl. E): E177-E184.
- Столповский Ю.А. Концепция и принципы генетического мониторинга для сохранения insitu пород доместицированных животных. Сельскохозяйственная биология, 2010, 6: 3-8.
- Марзанов Н.С., Девришов Д.А., Марзанова С.Н., Комкова Е.А., Озеров М.Ю., Кантанен Ю. Генетическое маркирование, сохранение биоразнообразия и проблемы разведения животных. Сельскохозяйственная биология, 2011, 2: 3-14.
- Shanks R.D., Dombrowski D.B., Harpestad G.W., Robinson J.L. Inheritance of UMP synthase in dairy cattle. J. Hered., 1984, 75: 337-340.
- Shuster D.E., Kehrli Jr. M.E., Ackermann M.R., Gilbert R.O. Identification and prevalence of a genetic defect that causes leukocyte adhesion deficiency in Holstein cattle. PNAS USA, 1992, 89: 9225-9229 ( ) DOI: 10.1073/pnas.89.19.9225
- Agerholm J.S., Bendixen C., Andersen O., Arnbjerg J. Complex vertebral malformation in Holstein calves. J. Vet. Diagn. Invest., 2001, 13: 283-289 ( ) DOI: 10.1177/104063870101300401
- Agerholm J.S., McEvoy F., Arnbjerg J. Brachyspina syndrome in a Holstein calf. J. Vet. Diagn. Invest., 2006, 18: 418-422 ( ) DOI: 10.1177/104063870601800421
- Georges M., Dietz A.B., Mishra A., Nielsen D., Sargeant L.S., Sorensen A., Steele M.R., Zhao X., Leipold H., Womack J.E. Microsatellite mapping of the gene causing weaver disease in cattle will allow the study of an associated quantitative trait locus. PNAS USA, 1993, 90: 1058-1062 ( ) DOI: 10.1073/pnas.90.3.1058
- Charlier C., Coppieters W., Rollin F., Desmecht D., Agerholm J.S., Cambisano N., Carta E., Dardano S., Dive M., Fasquelle C., Frennet J.-C., Hanset R., Hubin X., Jorgensen C., Karim L., Kent M., Harvey K., Pearce B.R., Simon P., Tama N., Nie H., Vandeputte S., Lien S., Longeri M., Fredholm M., Harvey R.J., Georges M. Highly effective SNP-based association mapping and management of recessive defects in livestock. Nat. Genet., 2008, 40: 449-454 ( ) DOI: 10.1038/ng.96
- Van Raden P.M., Olson K.M., Null D.J., Hutchison J.L. Harmful recessive effects on fertility detected by absence of homozygous haplotypes. J. Dairy Sci., 2011, 94: 6153-6161 ( ) DOI: 10.3168/jds.2011-4624
- Fritz S., Capitan A., Djari A., Rodriguez S.C., Barbat A., Baur A., Grohs C., Weiss B., Boussaha M., Esquerré D., Klopp C., Rocha D., Boichard D. Detection of haplotypes associated with prenatal death in dairy cattle and identification of deleterious mutations in GART, SHBG and SLC37A2. PLoS ONE, 2013, 8(6): e65550 ( ) DOI: 10.1371/journal.pone.0065550
- Cooper T.A., Wiggans G.R., Van Raden P.M., Hutchison J.L., Cole J.B., Null D.J. Genomic evaluation of Ayrshire dairy cattle and new haplotypes affecting fertility and stillbirth in Holstein, Brown Swiss and Ayrshire breeds. JAM, 2013, T206.
- Sonstegard T.S., Cole J.B., Van Raden P.M., Van Tassell C.P., Null D.J., Schroeder S.G., Bickhart D., McClure M.C. Identification of a nonsense mutation in CWC15 associated with decreased reproductive efficiency in Jersey cattle. PLoS ONE, 2013, 8: e54872 ( ) DOI: 10.1371/journal.pone.0054872
- McClure M., Kim E., Bickhart D., Null D., Cooper T., Cole J., Wiggans G., Ajmone-Marsan P., Colli L., Santus L., Liu G.E., Schroeder S., Matukumalli L., Van Tassell C., Sonstegard T. Fine mapping for Weaver syndrome in Brown Swiss cattle and the identification of 41 concordant mutations across NRCAM, PNPLA8 and CTTNBP2. PLoS ONE, 2013, 8(3): e59251 ( ) DOI: 10.1371/journal.pone.0059251
- Pausch H., Schwarzenbacher H., Burgstaller J., Flisikowski K., Wurmser C., Jansen S., Jung S., Schnieke A., Wittek T., Fries R. Homozygous haplotype deficiency reveals deleterious mutations compromising reproductive and rearing success in cattle. BMC Genomics, 2015, 16: 312 ( ) DOI: 10.1186/s12864-015-1483-7
- Kadri N.K., Sahana G., Charlier C., Iso-Touru T., Guldbrandtsen B., Karim L., Nielsen U.S., Panitz F., Aamand G.P., Schulman N., Georges M., Vilkki J., Lund M.S., Druet T.A 660-Kb deletion with antagonistic effects on fertility and milk production segregates at high frequency in Nordic Red cattle: additional evidence for the common occurrence of balancing selection in livestock. PLoS Genet., 2014, 10(1): e1004049 ( ) DOI: 10.1371/journal.pgen.1004049
- Cole J.B., Van Raden P.M., Null D.J., Hutchison J.L., Cooper T.A., Hubbard S.M. Haplotype tests for recessive disorders that affect fertility and other traits. AIP Research Report Genomic3, 02. Feb. 2016. Режим доступа: http://aipl.arsusda.gov/reference/recessive_haplotypes_ARR-G3.html. Дата обращения: 09.02.2016.
- Olson T. New genes: good and bad. Режим доступа: http://dairy.ifas.ufl.edu/dpc/2002/Olson.pdf. Дата обращения: 02.03.2016.
- Vierhout C.N., Cassell B.G., Pearson R.E. Comparisons of cows and herds in two progeny testing programs and two corresponding states. J. Dairy Sci., 1999, 82: 822-828 ( ) DOI: 10.3168/jds.S0022-0302(99)75302-6
- Larkin D.M., Daetwyler H.D., Hernandez A.G., Wright C.L., Hetrick L.A., Boucek L., Bachman S.L., Band M.R., Akraiko T.V., Cohen-Zinder M., Thimmapuram J., Macleod I.M., Harkins T.T., McCague J.E., Goddard M.E., Hayes B.J., Lewin H.A. Whole-genome resequencing of two elite sires for the detection of haplotypes under selection in dairy cattle. PNAS USA, 2012, 109(20): 7693-7698 () DOI: 10.1073/pnas.1114546109
- Holstein sire Jocko Besne Passes. Holstein World, 2012. Режим доступа: http://www.holsteinworld.com/story.php?id=6044#sthash.5tNGTcW4.dpbs. Дата обращения: 02.03.2016.
- Kuhn M., Hutchison J., Van Tassell C. Effects of complex vertebral malformation gene on production and reproduction. J. Anim. Sci., 2005, 83(Suppl. 1): 140.
- Kipp S., Segelke D., Schierenbeck S., Reinhardt F., Reents R., Wurmser C., Pausch H., Fries R., Thaller G., Tetens J., Pott J., Piechotta M., Grünberg W. A new Holstein haplotypeaffectingcalfsurvival. Interbull Bull., 2015, 49: 49-53.
- Menzi F., Besuchet-Schmutz N., Fragnière M., Hofstetter S., Jagannathan V., Mock T., Raemy A., Studer E., Mehinagic K., Regenscheit N., Meylan M., Schmitz-Hsu F., Drögemüller C. A transposable element insertion in APOB causes cholesterol deficiency in Holstein cattle. Anim. Genet., 2016, 47(2): 253-257 ( ) DOI: 10.1111/age.12410
- Charlier C. The role of mobile genetic elements in the bovine genome. Proc. Plantand Animal Genome XXIV Conf. San Diego, 2016: W636.
- Charlier C., Agerholm J.S., Coppieters W., Karlskov-Mortensen P., Li W., de Jong G., Fasquelle C., Karim L., Cirera S., Cambisano N., Ahariz N., Mullaart E., Georges M., Fredholm M. A deletion in the bovine FANCI gene compromises fertility by causing fetal death and brachyspina. PLoS ONE, 2012, 7(8): e43085 ( ) DOI: 10.1371/journal.pone.0043085
- Adams H.A., Sonstegard T., Van Raden P.M., Null D.J., Van Tassell C., Lewin H. Identification of a nonsense mutation in APAF1 that is causal for a decrease in reproductive efficiency in dairy cattle. Proc. PlantandAnimal Genome XX Conf. San Diego, 2012: P0555.
- McClure M.C., Bickhart D., Null D., Van Raden P., Xu L., Wiggans G., Liu G., Schroeder S., Glasscock J., Armstrong J., Cole J.B., Van Tassell C.P., Sonstegard T.S. Bovine exome sequence analysis and targeted SNP genotyping of recessive fertility defects BH1, HH2 and HH3 reveal causative mutation in SMC2 for HH3. PLoS ONE, 2014, 9: e92769 ( ) DOI: 10.1371/journal.pone.0092769
- Daetwyler H.D., Capitan A., Pausch H., Stothard P. et al. Whole-genome sequencing of 234 bulls facilitates mapping of monogenic and complex traits in cattle. Nature Genet., 2014, 46: 858-865 ( ) DOI: 10.1038/ng.3034
- Schütz E., Wehrhahn C., Wanjek M., Bortfeld R., Wemheuer W.E., Beck J., Brenig B. The Holstein Friesian lethal haplotype 5 (HH5) results from a complete deletion of TBF1M and cholesterol deficiency (CDH) from an ERV-(LTR) insertion into the coding region of APOB. PLoS ONE, 2016, 11(4): e0154602 ( ) DOI: 10.1371/journal.pone.0154602
- De Zio D., Maiani E., Cecconi F. Apaf1 in embryonic development -shaping life by death, and more. Int. J. Dev. Biol., 2015, 59(1-3): 33-39 ( ) DOI: 10.1387/ijdb.150047dd
- Hayes B., Daetwyler H.D., Fries R., Guldbrandtsen B., Lund M.S., Boichard D.A., Stothard P., Veerkamp R.F., Hulsegge I., Rocha D., Van Tassell C., Mullaart E., Gredler B., Druet T., Bagnato A., Goddard M., Chamberlain A., 1000 Bull Genomes Consortium. The 1000 Bull Genomes project -toward genomic selection from whole genome sequence data in dairy and beef cattle. Proc. Plantand Animal Genome XXI Conf. San Diego, 2013: W150.
- Schmiesing J.A., Ball A.R. Jr., Gregson H.C., Alderton J.M., Zhou S., Yokomori K. Identification of two distinct human SMC protein complexes involved in mitotic chromosome dynamics. PNAS USA, 1998, 95(22): 12906-12911 ( ) DOI: 10.1073/pnas.95.22.12906
- Ng A., Uribe R.A., Yieh L., Nuckels R., Gross J.M. Zebrafish mutations in gart and paics identify crucial roles for de novo purine synthesis in vertebrate pigmentation and ocular Development. Development, 2009, 136(15): 2601-2611 ( ) DOI: 10.1242/dev.038315
- Nagahata H. Bovine leukocyte adhesion deficiency (BLAD): a review. J. Vet. Med. Sci., 2004, 66: 1475-1482 ( ) DOI: 10.1292/jvms.66.1475
- Thomsen B., Horn P., Panitz F., Bendixen E., Petersen A.H., Holm L.E., Nielsen V.H., Agerholm J.S., Arnbjerg J., Bendixen C. A missense mutation in the bovine SLC35A3 gene, encoding a UDP-N-acetylglucosamine transporter, causes complex vertebral malformation. Genome Res., 2006, 16: 97-105 ( ) DOI: 10.1101/gr.3690506
- Nielsen U.S., Aamand G.P., Andersen O., Bendixen C., Nielsen V.H., Agerholm J.S. Effects of complex vertebral malformation on fertility traits in Holstein cattle. Livestock Production Science, 2003, 79: 233-238 ( ) DOI: 10.1016/S0301-6226(02)00170-7
- Agerholm J.S., Andersen O., Almskou M.B., Bendixen C., Arnbjerg J., Aamand G.P., Nielsen U.S., Panitz F., Petersen A.H. Evaluation of the inheritance of the complex vertebral malformation syndrome by breeding studies. Acta Vet. Scand., 2004, 45: 133-137.
- Schwenger B., Schöber S., Simon D. DUMPS cattle carry a point mutation in the uridine monophosphate synthase gene. Genomics, 1993, 16(1): 241-244 ( ) DOI: 10.1006/geno.1993.1165
- Shanks R.D., Robinson J.L. Embryonic mortality attributed to inherited deficiency of uridine monophosphate synthase. J. Dairy Sci., 1989, 72(11): 3035-3039 ( ) DOI: 10.3168/jds.S0022-0302(89)79456-X
- Shanks R.D., Popp R.G., McCoy G.C., Nelson D.R., Robinson J.L. Identification of the homozygous recessive genotype for the deficiency of uridine monophosphate synthase in 35-day bovine embryos. J. Reprod. Fertil., 1992,94(1): 5-10 ( ) DOI: 10.1530/jrf.0.0940005
- Bulls' status for haplotypes impacting fertility on the records of Holstein Association USA. Holstein Association USA, 14.12.2015. Режим доступа: www.holsteinusa.com/pdf/haplotype/hapbulcarriers.pdf. Дата обращения: 05.03.2016.
- Зиновьева Н.А., Гладырь Е.А., Эрнст Л.К., Брем Г. Введение в молекулярную генную диагностику сельскохозяйственных животных. Дубровицы, 2002.
- Романенкова О.В., Гладырь Е.А., Костюнина О.В., Зиновьева Н.А. Разработка тест-системы для диагностики гаплотипа фертильности крупного рогатого скота HH3, ассоциированного с ранней эмбриональной смертностью. Достижения науки и техники АПК, 2015, 11: 91-94.
- Романенкова О.В., Гладырь Е.А., Костюнина О.В., Зиновьева Н.А. Cкрининг российской популяции крупного рогатого скота на наличие мутации в APAF1, ассоциированной с гаплотипом фертильности HH1. Достижения науки и техники АПК, 2016, 30(2): 94-97.
- Зиновьева Н.А., Костюнина О.В., Волкова В.В., Янчуков И.Н., Ермилов А.Н. Дефицит холестерина -новый рецессивный генетический дефект голштинского скота. Молочное и мясное скотоводство, 2016, 2: 5-7.
- Зиновьева Н.А., Гладырь Е.А., Харзинова В.Р., Костюнина О.В., Покровская М.В., Друшляк Н.Г., Кабицкая Я.А. Роль ДНК-диагностики в контроле и элиминации рецессивных наследственных аномалий сельскохозяйственных животных. Достижения науки и техники АПК, 2012, 11: 37-40.
- Зиновьева Н.А., Стрекозов Н.И., Ескин Г.В., Турбина И.С., Янчуков И.Н., Ермилов А.Н. Моногенные наследственные дефекты и их роль в воспроизводстве. Животноводство России, 2015, 6: 30-31.


