Гастроинтестинальная стромальная опухоль желудка, осложненная желудочным кровотечением
Автор: Кочуков В.П., Репин И.Г., Ложкевич А.А., Медведев А.А., Розанов А.Н., Исаев В.В., Мимоход А.А.
Журнал: Хирургическая практика @spractice
Рубрика: Современное состояние проблемы: обзоры, лекции
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
В статье приводится обзор литературы по гастроинтестинальным стромальным опухолям, их распространенности и степени поражения того или иного отдела желудочно-кишечного тракта. В обзоре подробно описаны методы диагностики, способы лечения и прогноз. Приводимые авторами клиническое наблюдение ГИСО желудка, осложненное кровотечением, представляет определенный клинический интерес. Авторами успешно использован лапароскопический способ резекции желудка, по данным гистологического заключения - операция была выполнена радикально.
Гисо желудка, эзофагогастродуоденоскопия, эндоузи желудка, лапароскопическая хирургия, иммуногистохимия, ский индекс, объем резекции желудка
Короткий адрес: https://sciup.org/142211612
IDR: 142211612 | УДК: 616.43;
Текст научной статьи Гастроинтестинальная стромальная опухоль желудка, осложненная желудочным кровотечением
Гастроинтестинальная стромальная опухоль (ГИСО, англ. GIST) — наиболее распространенная мезенхимальная опухоль желудочно-кишечного тракта, составляющая 1 - 3% от всех гастроинтестинальных опухолей.
ГИСО представляют собой опухоли соединительной ткани, то есть саркомы, в отличие от большинства гастроинтестинальных опухолей имеющих эпителиальное происхождение. В 70% случаев поражается желудок, в 20% — тонкая кишка, пищевод поражается менее чем в 10% случаев. Опухоли небольших размеров, обычно имеют доброкачественное течение, особенно при низком митотическом индексе; крупные же опухоли могут диссеминировать в печень, сальник и брюшину. Другие органы брюшной полости поражаются редко. Считается, что ГИСО возникают из интерстициальных клеток Кахаля.
Гастроинтестинальные опухоли (ГИСО) составляют 1% всех новообразований желудочно-кишечного тракта, однако среди сарком количество их достигает 80%.
Классификация
Классификация TNM (7-е изд., 2009):
T - первичная опухоль:
T1 - опухоль ≤ 2 см в наибольшем измерении;
T2 - опухоль > 2 см, но ≤ 5 см в наибольшем измерении;
T3 - опухоль > 5 см, но ≤ 10 см в наибольшем измерении;
T4 - опухоль > 10 см в наибольшем измерении.
N - регионарные лимфатические узлы:
NХ - недостаточно данных для оценки состояния регионарных лимфатических узлов;
N0 - отсутствуют метастазы в регионарных лимфоузлах;
N1 - метастазы в регионарных лимфатических узлах.
M - отдаленные метастазы:
M0 - нет отдаленных метастазов;
M1 - имеются отдаленные метастазы.
Примечание: регионарные лимфоузлы редко поражаются при ГИСО, поэтому в случаях, когда состояние лимфоузлов не было оценено (клинически или морфологически), должна выставляться категория N0 вместо NX или pNX.
Группировка по стадиям
Критерии стадирования для опухолей тонкого кишечника могут применяться при GIST пищевода, ободочной, прямой кишки и брыжейки.
Гистологический спектр ГИСО выглядит следующим обра зом:
-
• веретеноклеточный тип (70%) - с палисадообразными структурами, мономорфными ядрами округлой или сигарообразной формы;
-
• эпителиоидный тип (20%) - наличие клеток округлой или полигональной формы со светлой цитоплазмой и светлыми ядрами;
-
• илеоморфный тип (10%) - с выраженным полиморфизмом, высокой митотической активностью.
Редко:
-
• перстневидно-клеточный тип - крупные округлые клетки с развитой цитоплазмой (слизь, цитокератин);
-
• мезотелиомоподобный тип;
-
• онкоцитарный тип.
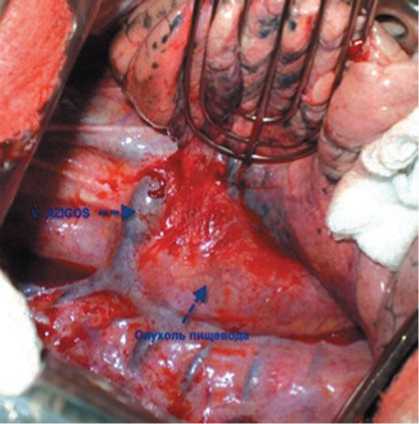
Рис. 1. ГИСО пищевода
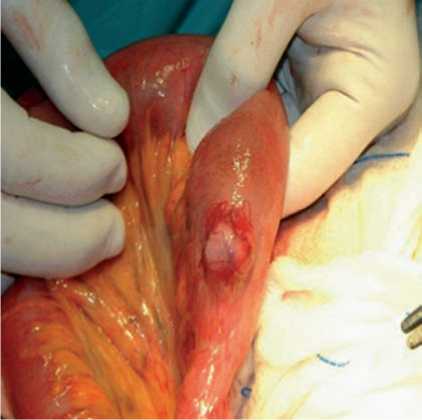
Рис. 2. ГИСО тонкого кишечника
Первичная локализация GIST, %
|
Локализация |
Данные ГВКГ им. Н.Н. Бурденко (n=18) |
Данные зарубежных авторов |
|
Желудок |
50,0 |
70,0 |
|
Тонкая кишка |
33,3 |
20,0 |
|
Толстая и прямая кишка |
1,1 (прямая кишка) |
5,0 |
|
Пищевод |
0 |
<5,0 |
|
Внеорганная опухоль |
5,6 (забрюшинное пространство) |
Редко |
Клиническая картина
В клинической картине GIST не существует специфических симптомов, в то время как более 90% из них являются злокачественными.
Манифестные ГИСО могут проявляться затруднением глотания, желудочно-кишечным кровотечением, метастазированием (преимущественно в печень).
Бессимптомное течение ГИСО отмечается в 20% случаев. В 20–50% наблюдаются боли в животе без четкой локализации. Развитие острых кровотечений из различных отделов ЖКТ диагностируют в 50%, а непроходимость - в 10–30% случаев. В спектре симптомов также - увеличение в объеме живота, анемия, слабость, потеря массы тела, тошнота, рвота, пальпируемые опухолевые массы. Но перечисленные признаки не являются строго патогномоничными и могут быть присущи опухолям ЖКТ любого гистогенеза.
К моменту постановки диагноза опухоль может достигать довольно больших размеров.
Рациональный диагностический алгоритм при подозрении на ГИСО включает:
-
1. Ультразвуковое исследование, в том числе эндосоногра-фию.
-
2. Компьютерную томографию (КТ) с контрастированием:
-
- для определения стадии опухолевого процесса и планирования объема хирургического лечения;
-
- при метастазировании ГИСО в печень и брюшную полость;
-
- при ГИСО небольших размеров, выявленных эндоскопически.
-
3. Магнитно-резонансную томографию (МРТ):
-
- при подозрении на GIST, особенно локализованных в прямой кишке.
-
4. Эндоскопическую диагностику (ФГДС, ФКС).
-
5. Рентгенологическое исследование ЖКТ.
-
6. Позитронно-эмиссионную томографию - ПЭТ (лучше ПЭТ/КТ):
-
- для оценки эффекта терапии (с целью выполнения органосохраняющих операций при локализации GIST в прямой кишке, пищеводе);
-
- для выявления метастазов в кости, плевру, легкие, мягкие ткани, лимфатические узлы;
-
- при подозрении на рецидив.
Диагностика
В 2005 г. ведущими морфологами, молекулярными биологами, рентгенологами, хирургами, онкологами и врачами общей практики ряда европейских стран, а также Японии и Австралии были утверждены рекомендации по диагностике и лечению GIST. Согласно этому документу перед началом терапии диагноз GIST должен быть подтвержден морфологически, что позволяет дифференцировать большинство из этих новообразований.
Диагноз устанавливается на основании:
-
— клинической картины,
-
— эндоскопических данных,
-
— компьютерной томографии с внутривенным контрастированием,
-
— результатов морфологического исследования биоптата либо морфологического исследования удаленной опухоли.
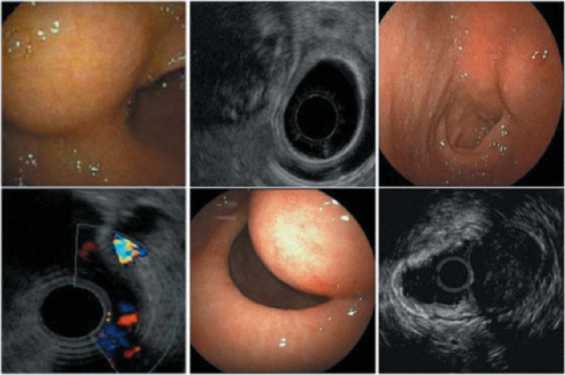
Радиологические исследования
Радиологические исследования используются для уточнения локализации новообразования, выявления признаков инвазии и метастазирования. Проявления ГИСО варьируют в зависимости от размера опухоли и пораженного органа. Диаметр опухоли может составлять от нескольких миллиметров, до 30 см и больше. Крупные опухоли обычно вызывают клинические проявления, бессимптомные опухоли обычно небольших размеров и имеют лучший прогноз. Большие опухоли чаще ведут себя более злокачественно, однако и небольшие ГИСО могут иметь агрессивное течение.
Небольшие ГИСО
Так как ГИСО происходят из мышечного слоя (который располагается глубже слизистого и подслизистого слоев), небольшие ГИСО чаще визуализируются как подслизистое или внутристеночное объемное образование. При исследовании желудочно-кишечного тракта с барием обычно выявляются ровные контуры образования, формирующие прямой или тупой угол со стенкой, что наблюдается и при любых других интрамуральных процессах. Поверхность слизистой интактна, за исключением случаев изъязвления, которые присутствуют при 50% ГИСО. При КТ с контрастным усилением небольшие ГИСО обычно визуализируются как интрамуральные образования с ровными, четкими контурами и гомогенным контрастированием.
Крупные ГИСО
По мере роста опухоли, она может проецироваться снаружи от органа (экзофитный рост) и/или в просвете органа (интра-люминальный рост); чаще всего ГИСО растут экзофитно, таким образом, большая часть опухоли располагается в проекции брюшной полости. Если увеличение объема опухоли опережает рост ее кровоснабжения, опухоль может некротизироваться в толще с формированием центральной зоны жидкостной плотности и кавитацией, что может приводить к изъязвлению и формированию соустья с полостью органа. В этом случае исследование с бариевой взвесью может демонстрировать газ, уровни газ/жидкость или депонирование контрастного препарата в этих областях. При КТ с контрастным усилением крупные ГИСО выглядят негомогенно, в связи с неоднородностью структуры опухоли, обусловленной участками некроза, кровоизлияниями и полостями, что радиологически проявляется контрастированием опухоли преимущественно по периферии.
Выраженность некроза и кровоизлияний влияет на интенсивность сигнала при МРТ. Зоны кровоизлияний в толще опу- холи будут иметь разный сигнал в зависимости от давности кровоизлияния. Солидный компонент опухоли обычно имеет низкую интенсивность на T1-взвешенных изображениях и высокую интенсивность на T2-взвешенных изображениях, усиливаясь после введения гадолиния. В случае присутствия газа в толще опухоли отмечаются участки отсутствия сигнала.
Признаки злокачественности
Рентгенографические исследования с барием и компьютерная томография обычно применяются для обследования пациентов с абдоминальными жалобами. Исследования с барием выявляют патологические изменения в 80% случаев ГИСО. Однако некоторые ГИСО могут располагаться полностью вне просвета органа, что делает невозможным их выявление при исследовании с барием. Даже в случае выявления патологических изменений при рентгенографии с барием, необходимо последующее дообследование методами МРТ или КТ. КТ-исследование проводится с пероральным и внутривенным контрастным усилением и позволяет визуализировать ГИСО в 87% случаев. Мягкие ткани наиболее контрастны при МРТ, что помогает в выявлении интрамуральных образований. Для оценки васкуляризации опухоли необходимо внутривенное введение контрастного препарата.
Методами выбора в диагностике ГИСО являются КТ и МРТ, и в некоторых случаях эндоскопическое УЗИ. Томографические методы позволяют уточнить органную принадлежность опухоли (что может быть затруднительно при ее больших размерах), визуализировать инвазию в соседние органы, асцит и метастазы.
Лечение
При небольших размерах опухоли, менее 1–2 см, на основании клинической картины допустимо динамическое наблюдение, однако необходимо принимать во внимание потенциальный риск прогрессирования с учетом результатов морфологического исследования (факторов риска) при отказе от активной хирургической тактики.
При локальных резектабельных ГИСО у взрослых и отсутствии противопоказаний хирургическое лечение является методом выбора.
Основным хирургическим принципом является полная резекция опухоли. Частичная резекция - метод выбора только при локализации GIST в пищеводе, поджелудочной железе и прямой кишке. Хирург должен быть готов к возможной резекции части органов, в том числе печени.
Допустимо выполнение экономных резекций при отступлении от края опухоли на 1 - 2 см.
Стандарт операции — радикальное удаление опухолевых очагов единым блоком с морфологически негативными краями резекции (R0). При опухолевых клетках по линии разреза (R1) показана ререзекция. При оставлении каких-либо участков ткани показатель резектабельности снижается с 55 до 40%.
При локализации опухоли в пищеводе, области кардии, двенадцатиперстной кишке и прямой кишке показана предоперационная терапия с целью уменьшения размеров и попытки выполнения органосохранной операции.
Установлен ряд особенностей хирургической техники при GIST различных локализаций:
-
• Пищевод - возможна энуклеация (крайне редкая локализация для истинной GIST).
-
• Желудок - при небольшой опухоли ее клиновидная резекция, более 5 см - гастрэктомия или резекция.
-
• Двенадцатиперстная кишка - панкреатодуоденальная резекция.
-
• Тонкая кишка - резекция участка кишки с участком брыжейки.
-
• Ободочная кишка - гемиколэктомия.
-
• Обязательный этап любой операции в брюшной полости - удаление большого сальника.
Случай разрыва опухоли, возникший спонтанно или в процессе хирургической резекции, должен быть зафиксирован, потому что он имеет крайне неблагоприятное прогностическое значение вследствие контаминации брюшной полости. В случаях разрыва опухоли должны быть взяты смывы из брюшной полости.
Метастазы в лимфатические узлы при ГИСО встречаются редко, в связи с чем резекция лимфатических узлов обычно не требуется. Однако при локализации опухоли в области прямой кишки случаи метастазирования в регионарные лимфоузлы наблюдают достаточно часто (25-30%), что обусловли- вает необходимость выполнения лимфаденэктомии. Наличие местного обсеменения брюшины опухолью, характерного для ГИСО, требует проведения локальной перитонеумэктомии. Была продемонстрирована эффективность лапароскопической хирургии для удаления ГИСО, что позволяет уменьшить объем операции. Клинические данные по тактике выбора варианта хирургического вмешательства в зависимости от размера опухоли противоречивы; таким образом, решение по выбору лапароскопической методики должно приниматься индивидуально, с учетом размера опухоли, локализации и типа ее роста.
При изолированном поражении печени возможно выполнение радиочастотной термоаблации либо резекция печени.
После радикальной операции с низким риском прогрессирования показано динамическое наблюдение.
Лучевая терапия не продемонстрировала эффективность в лечении ГИСО, также не было отмечено значимого ответа ГИСО на большинство химиотерапевтических препаратов (ответ был достигнут менее чем в 5% случаев). Однако была доказана клиническая эффективность трех препаратов в терапии ГИСО: иматиниба, сунитиниба и регорафениба.
Иматиниб (гливек), пероральный препарат, изначально использовавшийся при лечении хронического миелолейкоза в связи с его способностью ингибировать bcr-abl, также ингибирует мутантные c-kit и PDGFRA, что позволяет в некоторых случаях использовать его в терапии ГИСО. В ряде случаев считается достаточным хирургическое удаление ГИСО, однако значительная часть ГИСО имеет высокий риск рецидива, и в этих случаях рассматривается возможность проведения адъювантной терапии. В качестве критериев для оценки риска рецидива и принятия решения об использовании иматиниба учитываются размер опухоли, митотический индекс и локализация. Опухоли размером <2 см с митотическим индексом менее <5/50 HPF продемонстрировали меньший риск рецидива, чем более крупные или агрессивные опухоли. При повышенном риске рецидива рекомендуется прием иматиниба в течение 3 лет.
Также иматиниб продемонстрировал эффективность в терапии метастатических и неоперабельных ГИСО. Двухлетняя выживаемость пациентов с поздними стадиями заболевания на фоне лечения иматинибом возросла до 75 - 80%.
Пациентам высокой группы риска (III–IV стадии заболевания) показано проведение адъювантной химиотерапии: имати-ниб 400 мг внутрь ежедневно в течение 1 года.
Лечение первично-нерезектабельных форм ГИСО. При нере-зектабельной опухоли и наличии метастазов лечение начинается с химиотерапии: иматиниб 400 мг/сут. Лечебный эффект по данным КТ/МРТ оценивается каждые 3 месяца. Если опухоль становится резектабельной, рассматривается вопрос о выполнении радикального хирургического вмешательства.
Лечение нерезектабельных форм ГИСО. Стандартом первой линии химиотерапии является иматиниб в дозе 400 мг/сут. При прогрессировании процесса, при выявлении мутации в 9 экзоне гена KIT - дозу препарата повышают поэтапно до 800 мг/ сут. У пациентов с мутацией в 9 экзоне KIT-гена должна сразу использоваться высокая доза иматиниба (800 мг/сут, по 400 мг два раза в день).
При прогрессировании заболевания или у пациентов, нечувствительных к иматинибу, стандартом терапии второй линии является сунитиниб (по 50 мг внутрь ежедневно в течение 4 недель, интервал между курсами - 2 недели).
Эффективность иматиниба и сунитиниба зависит от генотипа: cKIT- и PDGFRA-негативные ГИСО, а также ассоциированные с нейрофибромазомом-1 ГИСО «дикого типа» обычно резистентны к терапии иматинибом. Специфический подтип мутации PDGFRA, D842V также нечувствителен к иматинибу.
Регорафениб (Стиварга) был одобрен FDA в 2013 году для терапии поздних стадий неоперабельных ГИСО, переставших отвечать на иматиниб и сунитиниб.
Непосредственно за прекращением лечения практически во всех случаях ГИСО следует относительно быстрая опухолевая прогрессия.
При исходно нерезектабельных опухолях у больных с эффектом в результате терапии целесообразна оценка радикального хирургического лечения через 6 - 12 месяцев после начала терапии.
Эффективность лечения у большинства пациентов проявляется в уменьшении размера опухоли, но в некоторых случаях могут происходить только изменения в плотности опухоли по данным КТ, или эти изменения могут предшествовать более позднему сокращению размеров опухоли. Некоторое увеличение размера опухоли может указывать на эффективность терапии, если одновременно с этим плотность опухоли по данным КТ уменьшилась. Внезапное выявление новых образований на КТ может быть связано с тем, что они становятся более визуализируемыми, когда теряют плотность. Следовательно, размер и плотность опухоли должны рассматриваться как критерии эффективности проводимой терапии.
С другой стороны, опухолевая прогрессия может не сопровождаться изменениями размера опухоли. Некоторое увеличение плотности в пределах опухолевого образования может указывать на прогрессирование заболевания. Типичная картина прогрессирования - «узел в узле», при котором часть образования, ранее «ответившего» на лечение, приобретает повышенную плотность.
Десятилетний опыт применения таргетной терапии гастроинтестинальных стромальных опухолей продемонстрировал небывалый успех в онкологии. Впервые в диагностике и лечении солидных опухолей удалось не только выявить ключевой механизм патогенеза, но и подобрать высокоточное «оружие» к «мишени» (англ. target - мишень). Применение Гливека улучшило выживаемость больных с метастатической формой болезни в три раза. Предоперационная терапия позволила улучшить результаты лечения при местно-распространенных формах. Адъювантная терапия снизила риск рецидива и увеличила общую выживаемость пациентов. Стромальные опухоли обладают выраженной гетерогенностью по мутационному статусу, который является фактором прогноза и, по возможности, должен выполняться всем больным. Развитие вторичных мутаций и прогрессирование на фоне лечения препаратом первой линии диктуют необходимость изменения тактики лечения и поиска новых путей блокады опухолевой прогрессии.
Отдаленные результаты
Показатели 5-летней выживаемости пациентов после проведения радикального хирургического лечения значительно варьируют в пределах 35 - 65%; согласно исследованию MDACC, этот показатель составляет 48%.
Результаты хирургического лечения GIST:
-
— при полной резекции 5-летняя выживаемость 50%;
-
— выживаемость менее 20% если опухоль >10 cм;
-
— в течение 2 лет рецидив в 80% наблюдений (локальный — 75%, локальный + печень - 50%).
Опыт лечения ГИСО в ГВКГ им. Н.Н. Бурденко соответствует уровню ведущих клиник. Анализ общей выживаемости пациентов с ГИСО проведен за 8-летний период (2002–2010 гг.). Из 52200 госпитальных случаев онкологических заболеваний, выявленных в исследуемые годы, на долю ГИСО пришлось 0,034 (n=18). Мужчин было 11 (61%), женщин - 7 (39%). У 3 пациентов (17%) диагностирована II стадия, у 14 (83%) - IV стадия заболевания. Медиана возраста пациентов - 64,5 года (от 54 до 73 лет).
Клинический пример
Пациентка Ф., 1952 года рождения, история болезни № 105631. Поступила 08.10.2014. Из анамнеза: больная в мае 2014 года была госпитализирована в городскую больницу с желудочно-кишечным кровотечением.

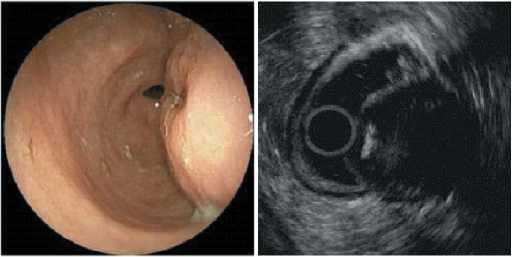
лой и представленная преимущественно веретеновидными клетками, среди которых определяется и эпителиоидный тип клеток, расположенных в отечной, местами миксоматозной, васкуляризированной строме, формирующими солидные и вихреобразные структуры, пучки и гирлянды. Отмечается мелкоочаговая лимфоидная
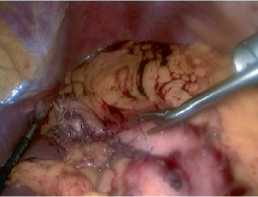
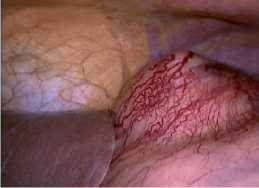
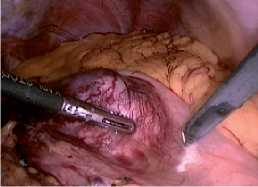
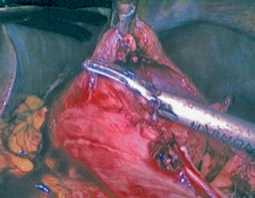
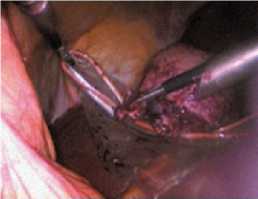
Рис. 8 Погружение резицированной опухоли в контейнер
Заключение
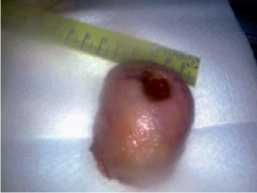
Рис. 9. Опухоль с кратером язвы в центре
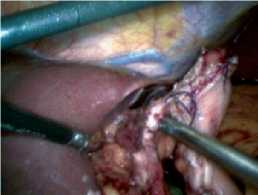
Гистологическое исследование
Список литературы Гастроинтестинальная стромальная опухоль желудка, осложненная желудочным кровотечением
- Степанова Е.В., Кешта Р.А., Бохян Б.Ю. и др. Экспрессия с-Kit в саркомах мягких тканей: перспективы использования Гливек//Рос. биотерапевт. ж. 2002. № 4 (1). С. 21-23.
- Стромальные опухоли желудочно-кишечного тракта: Клиническая монография. Тверь: ООО «Издательство «Триада», 2006. 40 с.
- Щеголев А.И., Дубова Е.А., Щеголева Н.Н., Мишнев О.Д. Эндокринные опухоли поджелудочной железы. М.: Типография Россельхозакадемия, 2007. 68 с.
- Гастроинтестинальные стромальные опухоли (диагностика, лечение). Практические рекомендации. М., 2008. 53 с.
- Demetri G., Benjamin R., Blanke C.D. et al. NCCN доклад: оптимальная терапия пациентов с гастроинтестинальными стромальными опухолями (GIST) -расширение и усовершенствование NCCN клинических рекомендаций//JNCCN. 2004. Vol. 2 (Suppl. 1). P. 1-26.
- Miettinen M., Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis»//Arch. Pathol. Lab. Med. 2006. Vol. 130 (10). P. 1466-1478.
- Cassier P.A., Dufresne A., Blay J.Y. Controversies in the Adjuvant Treatment of Gastrointestinal Stromal Tumors (GIST) with Imatinib. ASCO Educational Book, 2008.
- Raut Chandrajit and Dematteo Ronald Evidence-Guided Surgical Management of GIST: Beyond a Simple Case of Benign and Malignant//Ann. Surg. Onc. 2008. Vol. 15 (5). P. 1542.
- Dirnhofer S., Leyvraz S. Current standarts and progress in understanding and treatment of GIST//Swissmedkly. 2009. Vol. 139 (7-8). P. 90-102.
- Casali P.G., Blay J-Y. on behalf of the ESMO/CONTICANET/EUROBONET. Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up//Annals of Oncology. 2010. Vol. 21 (Suppl. 5). P. 98-102.
- Kelly L., Bryan K., Kim S.Y., Janeway K.A., Killian J.K., Schildhaus H. U., Miettinen M., Helman L., Meltzer P.S., van de Rijn M., Debiec-Rychter M., O'Sullivan M. Post-Transcriptional Dysregulation by miRNAs Is Implicated in the Pathogenesis of Gastrointestinal Stromal Tumor . 2010.
- http://omr.by/sites/default/files/struktura/16_GIST.pdf.
- https://ru.wikipedia.org/wiki/Гастроинтестинальная_стромальная_опухоль.
- http://www.rosoncoweb.ru/standarts/RUSSCO/24.pdf.
- http://health-ua.com/pics/pdf/O_2010_2/29.pdf.
- http://www.gastro-j.ru/files/s8_1285710558.pdf.
- http://dspace.nbuv.gov.ua/bitstream/handle/123456789/19757/289. pdf?sequence=1.
- http://umedp.ru/articles/onko_3_2012/stromalnaya_opukhol_ zheludochnokishechnogo_trakta.html.


