Гемадсорбция при африканской чуме свиней
Автор: Середа А.Д., Иматдинов А.Р., Макаров В.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Свойство вызывать гемадсорбцию при репродукции вируса африканской чумы свиней (АЧС) в культурах клеток костного мозга свиньи (КМС), лейкоцитов свиньи (ЛС) или перевиваемых клеток в присутствии эритроцитов свиньи характерно для большинства его изолятов (W.A. Malmquist, D. Hay, 1960). Это используется в диагностике болезни по аутогемадсорбции в крови свиней, при титровании вируса в культурах клеток, селекции аттенуированных вариантов в лабораторных условиях (А.Д. Середа с соавт., 2014). Реакция задержки гемадсорбции (РЗГАд) вместе с биопробой на иммунных свиньях применяется для классификации изолятов вируса АЧС по сероиммунотипам (Н.И. Митин с соавт., 1985). Оценка гетерогенности популяции вируса АЧС по количественной гемадсорбции («плотная», «промежуточная», «рыхлая») используется в качестве фенотипического признака изолятов, штаммов и вариантов вируса АЧС (V. Makarov с соавт., 2016). Еще один измеряемый количественно признак при гемадсорбции - доля окружности эритроцитов при их контактах с зараженными макрофагами. Установлены количественные различия сывороток крови свиней по активности в РЗГАд при постановке реакции с референтными вирулентными и полученными из них аттенуированными вариантами. Эти результаты ждут своего объяснения. Потеря способности индуцировать гемадсорбцию не критична для репродукции вируса АЧС, но часто сопровождается снижением вирулентности возбудителя. Поэтому аттенуированные варианты вируса АЧС получают, как правило, посредством селекции предельными разведениями из популяций вирулентных изолятов, выделенных из клонов с пониженной способностью к гемадсорбции (Д.В. Колбасов с соавт., 2014). При репродукции вируса развитие гемадсорбции предшествует его экзоцитозу. Вирионы не играют существенной роли в механизме гемадсорбции, однако их взаимодействие с мембраной эритроцитов помогает диссеминации вируса по организму свиней и более эффективному проникновению в клетки кишечника клещей (L.K. Dixon и соавт., 2004). Гемадсорбирующие свойства вируса АЧС определяются его трансмембранным высокогликозилированным белком CD2v (J.M. Rodríguez с соавт., 1993). Возникновение негемадсорбирующих авирулентных изолятов, вероятно, происходит в результате сдвига открытой рамки считывания (ORF) в генах EP402R и EP153R, кодирующих соответственно CD2v и лектиноподобный белок (D.A. Chapman с соавт., 2008). Высказано предположение, что гемадсорбция обусловлена взаимодействием углеводных остатков олигосахаридов гликопротеинов вируса АЧС с лектиноподобным рецептором эритроцитов свиньи.
Африканская чума свиней, гемадсорбция, негемадсорбирующие изоляты
Короткий адрес: https://sciup.org/142213731
IDR: 142213731 | УДК: 636.4:619:578.842.1:616-097:57.083.3 | DOI: 10.15389/agrobiology.2016.6.763rus
Текст обзорной статьи Гемадсорбция при африканской чуме свиней
Возбудитель африканской чумы свиней — крупный ДНК-содержа-щий вирус семейства Asfarviridae (1). Его вирулентные изоляты могут вызвать болезнь со 100 % смертностью домашних свиней ( Sus scrofa domesticus ) и диких кабанов ( Sus scrofa ). В Африке АЧС поддерживается в цикле передачи между природными хозяевами — бородавочниками ( Phacochoerus spp.), кустарниковыми свиньями ( Potomochorus porcus ) и переносчиками, в роли которых выступают мягкие клещи рода Оrnithodoros (2). Болезнь контагиозна, а вирус хорошо адаптирован к хозяевам и вызывает у них субклиническую хроническую или инаппарантную форму инфекции.
Интерес к гемадсорбции при репродукции вируса АЧС обусловлен несколькими обстоятельствами. Пока что окончательно не выяснено, каковы молекулярные механизмы гетерогенности вируса АЧС по признаку гемадсорбции, почему некоторые изоляты не обладают этим свойством и как способность к гемадсорбции связана с другими фенотипическими характеристиками изолятов и лабораторных вариантов. В ветеринарной практике гемадсорбцию используют для титрования вируса АЧС (поскольку в
Работа выполнена в рамках проекта Российского научного фонда «Создание кандидатной вакцины против африканской чумы свиней на основе химерных вирусов» (проект ¹ 16-16-00090).
большинстве случаев получаемые результаты совпадают с данными титрования по цитопатическому действию), при селекции аттенуированных вариантов, прижизненной диагностике болезни по аутогемадсорбции лейкоцитов крови у зараженных свиней. Реакцию задержки гемадсорбции (РЗГАд) вместе с биопробой на иммунных свиньях применяют для классификации изолятов вируса АЧС по сероиммунотипам (3-5).
Феномен гемадсорбции . Известно, что культуры клеток, зараженные ортомиксо-, парамиксо-, тога-, рабдо-, поксвирусами, частицы которых могут отпочковываться от клеточной плазматической мембраны, приобретают способность адсорбировать эритроциты (6, 7). Гемадсорбция обусловлена включением в плазматическую мембрану клетки синтезируемых вирусных белков, имеющих сродство к эритроцитам. В ряде случаев она имеет общие механизмы с гемагглютинацией и проявляется на ранних сроках цикла репродукции вирусов до развития цитопатического эффекта или же при его отсутствии либо слабой выраженности.
Гемадсобцию при репродукции вируса АЧС впервые обнаружили и описали W.A. Malmquist и D. Hay (3). Показав, что сыворотки свиней, переболевших АЧС, задерживают гемадсорбцию, но не нейтрализуют цито-патический эффект и не влияют на репродукцию вируса, они предположили, что ответственный за гемадсорбцию антиген не связан с вирионами. S.S Brees и W.R. Hess (8) установили, что целостность плазмалеммы зараженных клеток — необходимое условие гемадсорбции при репродукции вируса АЧС. Электронная микроскопия позволила выявить два основных способа связывания эритроцитов с мембраной клетки при гемадсорбции — за счет прикрепления к клеточным филаментам, выступающим из плазма-леммы, и непосредственно к мембране зараженной клетки (8). Мембрана зараженной клетки приобретает способность адсорбировать эритроциты до начала миграции вирионов из цитоплазматических матриксов, где происходит их созревание. Иными словами, вирусоспецифическая модуляция клеточной мембраны не просто предшествует экзоцитозу вируса, а хронологически опережает его, эти стадии по времени разобщены (9, 10).
По мнению большинства исследователей, присутствие вирусной частицы в месте контакта эритроцитов с клеткой не обязательно (11, 12). Визуально при увеличении ½400 эритроциты располагаются на макрофаге либо в один слой, либо многослойно. Их число на одну гемадсорбирую-щую клетку варьирует от единиц до 80 и более. Показано (13), что видимость многослойности при так называемой плотной гемадсорбции создается в результате изменения формы эритроцитов и находящихся на значительном расстоянии от основной части клетки выростов цитоплазмы зараженного макрофага, контактирующего с эритроцитом. Отсутствие гемагглютинации при АЧС также свидетельствует в пользу того, что вирионы не играют роли в явлении гемадсорбции. При исследовании взаимодействия вирионов и свиных эритроцитов (заражение 30 свиней 17 изоля-тами вируса АЧС) с использованием флуоресцирующих антител и моноклональных антител к вирусоспецифическим полипептидам с молекулярной массой 13 кДа и 73 кДа установлена локализация вирусных антигенов на поверхности свиных эритроцитов in vitro и in vivo (14). Методом трансмиссионной микроскопии вирионы были обнаружены в инвагинациях (углублениях) мембран на поверхности эритроцитов (14). Вирус связывается с эритроцитами в момент их взаимодействия с инфицированными клетками. Вирионы прикрепляются к поверхности клеточной мембраны эритроцитов, но остаются в инвагинациях мембраны и не проникают в цитоплазму. Этот механизм может обеспечивать сохранность вируса в кро-764
ви. Есть основания полагать, что присоединение вирионов к эритроцитам существенно способствует проникновению вируса АЧС через стенки кишечника клещей за счет фагоцитоза эритроцитов клетками гемоцеля (15). Отмечено, что не все клетки, где имеются центры репликации вируса или вирусные частицы, демонстрируют гемадсорбцию (16).
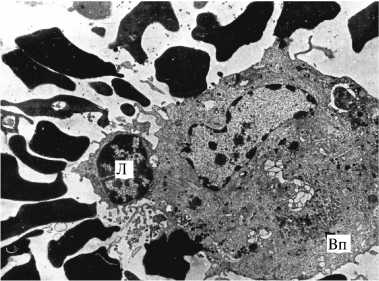
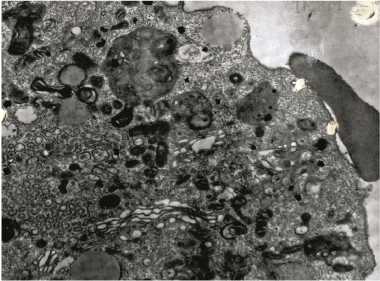
Количественные характеристики гемадсорбции. Определение числа прикрепившихся эритроцитов. Гемадсорбцию рассматривают как способность зараженных клеток связывать содержавшиеся в культуре клеток эритроциты, удерживая их при ее отмывании. Сравнительное исследование феномена гемадсорбции с использованием различных изолятов, штаммов и вариантов вируса АЧС выявило их существенные различия по признакам количественной гемадсорбции и структуре популяций в корреляционной связи с вирулентностью. В культуре клеток костного мозга свиньи (КМС) число эритроцитов на одной клетке у аттенуированного штамма ФК-32/135 и вирулентных Ф-32 и Киравира-67 значительно варьировало, причем распределение по этому признаку оказалось близким к нормальному. Среднее арифметическое число эритроцитов на гемадсорбирующую клетку в вариационном ряду у изученных штаммов было неодинаковым: у ФК-32/135 — низкое (18,52±0,36), у штаммов Франция-32 и Киравира-67 — выше (соответственно 29,32±0,71 и 34,49±0,89) (17). По количественной гемадсорбции для популяции каждого штамма характерна гетерогенность и специфичность: одновременно в поле зрения встречается плотная (41-80 эритроцитов на клетку), промежуточная (21-40 эритроцитов) и рыхлая (120 эритроцитов) гемадсорбция, но в разных пропорциях (рис.).
А
Б
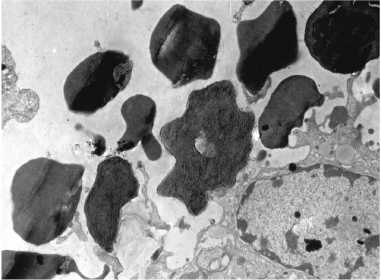
Типы гемадсорбции при репродукции разных штаммов вируса африканской чумы свиней в культуре клеток костного мозга свиньи: А — плотная (штамм Киравира-67), Б — промежуточная (штамм Лиссабон-111), В — рыхлая (штамм ФК-32/135); Л — цитотоксический Т-лимфоцит, Вп — виропласт.
Таким образом, количественная характеристика гемадсорбирую-щей активности в культуре клеток КМС — это фенотипический признак изолятов, штаммов, вариантов вируса АЧС. На основании исследования восьми штаммов вируса АЧС с различными биологическими характеристиками был сформирован своего рода градиент по степени вирулентности и гемадсорбирующей актив- ности, что свидетельствует о генетическом контроле экспрессии гемадсор- бирующего антигена (17, 18). Аттенуированные (авирулентные) варианты вируса АЧС характеризовались присутствием только субпопуляций с рыхлым и промежуточным типами гемадсорбции, вирулентные штаммы, напротив, были представлены только субпопуляциями с промежуточным и плотным типами. На этом основании высказано предположение о том, что антигенная модуляция зараженных мононуклеарных макрофагов в наибольшей степени свойственна авирулентным вариантам вируса (19).
Различия между штаммами по доле окружности эритроцитов при их контакте с макрофагом. Для авирулентного аттенуированного штамма ФК-32/135 с характерной рыхлой однослойной гемадсорбцией доля окружности эритроцитов, контактирующей с плазмалеммой зараженных макрофагов, составила 34,2±7,3 %, тогда как для вирулентных штаммов с плотной гемадсорбцией типичны менее протяженные межмембранные контакты (Франция-32 — 7,8±3,1 %, Киравира-67 — 11,2±6,4 %) (9). Эти результаты можно интерпретировать и как свидетельство антигенной модуляции мембраны зараженных моноцитов (макрофагов), наиболее свойственной авирулентным вариантам, и как указание на высокую аффинностью ге-мадсорбирующего белка у вирулентных вариантов.
Различия в активности сывороток в РЗГАд с референтным вирулентным и аттенуированными штаммами вируса АЧС . Интересные результаты получены в исследованиях антител, участвующих в РЗГАд, при тестировании сыворотки крови свиней, которые выжили после острой формы АЧС. С этой целью испытывали три специфические антисыворотки I серотипа с вирулентным штаммом Лиссабон-57 и его производными Л-50, ЛК-111, ЛК-200 (аттенуированные варианты), пять антисывороток II серотипа с вирулентными штаммами Ямба-20, Конго-49 и его аттенуированным штаммом КК-202 (получен из штамма Конго-49), пять антисывороток III серотипа с вирулентным штаммом Мозамбик-78 и его аттенуированными производными МК-200 и МК-250, а также шесть антисывороток IV cеротипа со штаммом Франция-32 и его аттенуированным производным ФК-32/135, штаммом Португалия-60 и его аттенуированным вариантом Р60/81 и штаммом Бразилия-80. Титры антисывороток в РЗГАд с вирулентными штаммами были в 1,7-2,8 log2 ниже, чем с гомологичными аттенуированными штаммами. Еще большие различия отмечали для аттенуированного штамма ФК-32/135, индуцирующего рыхлую гемад-сорбцию: по сравнению с ним у штамма Франция-32 титры антисывороток в РЗГАд были в 29,5 раза ниже (20). То есть при рыхлой гемадсорбции для задержки требуется значительно меньше антител, чем при плотной.
Гипотезу, согласно которой в инфицированных культурах клеток КМС или лейкоцитов свиньи (ЛС) лизис клеток-мишеней в результате антителозависимой клеточной цитотоксичности (АЗКЦ) частично или полностью может конкурировать с развитием гемадсорбции и имитировать ее задержку, проверили экспериментально (21). Однако у пяти сывороток титры антител в РЗГАд с адаптированным к перевиваемой культуре клеток вариантом штамма ФК-135 совпадали как в зараженной им первичной культуре клеток КМС, где реализовывался механизм АЗКЦ, так и в перевиваемой культуре клеток почки эмбриона свиньи (ППК-66б), в которой эффекторы АЗКЦ отсутствовали. Это свидетельствовало, что АЗКЦ и РЗГАд протекают одновременно и независимо друг от друга (21).
Влияние ингибиторов гликозилирования на репродукцию вируса АЧС . Ингибиторный анализ — весьма информативный инструмент в изучении биосинтеза и морфогенеза вирусов, в том числе процессинга их структурных и неструктурных белков в зараженной клетке. Нецитоцидные 766
концентрации ингибиторов определяют, в частности, на основании данных оптической и электронной микроскопии (22). Для исследования роли гликозилирования в репродукции вируса АЧС были отобраны и сгруппированы по сероиммунотиповой специфичности, общности происхождения и контрастности основных биологических свойств штаммы, изоляты и варианты вируса АЧС (23). Каждая группа включала референтный штамм одного из I-IV сероиммунотипов и, как правило, полученные из них аттенуированные лабораторные варианты. Референтные штаммы характеризовались высокой вирулентностью и способностью индуцировать плотную гемад-сорбцию при репродукции в культуре клеток КМС. Их аттенуированные варианты были либо слабовирулентными, либо авирулентными, а гемад-сорбция при репродукции в культуре клеток КМС — менее плотной (вплоть до рыхлой). Кроме того, исследовали негемадсорбирующие изоляты.
Известно, что туникамицин блокирует образование долихол-РР-аце-тил-D-глюкозамина (первый этап в долихолзависимом пути гликозилирования белков) (24). Эффект от внесения туникамицина в зараженную культуру клеток КМС различался в зависимости от фенотипических свойств исследуемых штаммов, изолятов и вариантов вируса АЧС. Снижение титров у референтных штаммов Лиссабон-57 (I сероиммунотип), Конго-49 (II се-роиммунотип), Франция-32 (IV сероиммунотип) было больше, чем у лабораторных аттенуированных штаммов и вариантов ЛК-111 и ЛЦ (I), ФК-32/135, ФНГ (IV), и негемадсорбирующего изолята Петит-Энге (II). В диапазоне нецитоцидных концентраций туникамицина (0,5-1,0 мкг/см3) разница в накоплении инфекционного потомства между вирулентными и аттенуированными штаммами вируса АЧС в группах I, II, IV сероиммунотипов была примерно 10-кратной (около 1,0 lg ЦПД50). И только между штаммом Мозамбик-78 и его аттенуированным вариантом МК-200 (III сероиммуно-тип) подобных различий не выявили. Ионофор моненсин одинаково подавлял репродукцию всех исследованных вирусных штаммов и вариантов (23).
Электронная микроскопия показала, что ингибитор гликозилирования туникамицин не влиял на структуру вирусных матриксов и сроки отпочкования вирионов, однако в его присутствии отмечалась выраженная ассоциация почкующихся вирионов с мембранами вакуолей аппарата Гольджи. При концентрации туникамицина 0,5 мкг/см3 снижение урожая вируса АЧС штамма Франция-32 в культуре клеток КМС по сравнению с контролем (без ингибитора) составило 1,2±0,2 lg ГАЕ50/см3. В присутствии туникамицина число вирионов, связанных с мембранами аппарата Гольджи, и их доля (%) равнялись 184 (50 %), без ингибитора — 43 (13 %), число вирионов, ассоциированных с плазмалеммой, — 181 (50 %), без ингибитора — 281 (87 %) (23).
Из этого следует, что при ингибировании гликозилирования не нарушается сборка капсидов и не уменьшается их число, но из-за нарушения транспорта гликопротеинов к плазматической мембране усиливается почкование вирионов в вакуоли аппарата Гольджи, что приводит к снижению урожая внеклеточного вируса. Таким образом, формирование инфекционного потомства гемадсорбирующих штаммов и вариантов вируса АЧС зависит от полноценного гликозилирования.
Влияние моносахаров, экзо- и эндогликозидаз на гемад-сорбцию при АЧС . На обработанных ингибиторами туникамицином и моненсином и затем зараженных гемадсорбирущими штаммами вируса АЧС А-клетках (адгезированные клетки) КМС гемадсорбция не проявляется (23). Это обстоятельство послужило основанием для предположения, что гемадсорбция — результат взаимодействия углеводных компонентов глико-767
протеинов вируса АЧС с лектиноподобными рецепторами эритроцитов. Для его проверки изучили влияние обработки инфицированных вирусом АЧС А-клеток КМС экзо- и эндогликозидазами, а также различных моносахаров, присутствующих в среде культивирования, на гемадсорбцию (табл.) (23).
Развитие гемадсорбции при инфицировании А-клеток КМС вирусом африканской чумы свиней (штамм Франция-32) в присутствии агентов, влияющих на углеводный компонент вирусных гликопротеинов (23)
|
Агент |
1 1 ч |
1 2 ч 1 |
3 ч |
|
Обра |
ботка экзо- |
и эндогликозидазами |
|
|
Ферменты, ед/см3: |
|||
|
нейраминидаза, 10 |
+ |
+ |
+ |
|
β -галактозидаза, 150 |
- |
+ |
+ |
|
β -гликозидаза, 50-100 |
+ |
+ |
+ |
|
α -маннозидаза, 8,5 |
- |
- |
- |
|
эндогликозидаза D, 0,1 |
+ |
+ |
+ |
|
эндогликозидаза F, 0,1 |
- |
- |
- |
|
Присутств |
ие моносахаров |
||
|
Моносахара, %: |
|||
|
D-глюкоза |
|||
|
1,25 |
+ |
+ |
+ |
|
2,50 |
+ |
+ |
+ |
|
5,00 |
+ |
+ |
+ |
|
L-фруктоза |
|||
|
1,25 |
+ |
+ |
+ |
|
2,50 |
+ |
+ |
+ |
|
5,00 |
+ |
+ |
+ |
|
D-галактоза |
|||
|
1,25 |
+ |
+ |
+ |
|
2,50 |
- |
+ |
+ |
|
5,00 |
- |
+ |
+ |
|
метил- α -D-маннопиранозид |
|||
|
1,25 |
- |
+ |
+ |
|
2,50 |
- |
+ |
+ |
|
5,00 |
- |
- |
+ |
|
N-ацетилглюкозамин |
|||
|
1,25 |
+ |
+ |
+ |
|
2,50 |
+ |
+ |
+ |
|
5,00 |
+ |
+ |
+ |
П р и м еч а ни е. А-клетки КМС — адгезированные клетки костного мозга свиньи; «+» и « - » — наличие или отсутствие гемадсорбции.
Поскольку экзогликозидазы отщепляют лишь моносахаридные остатки, то очевидно, что на невосстановленных концах олигосахаридов гемад-сорбирующего белка вируса АЧС находится α -манноза. В пользу этого свидетельствует ингибирование гемадсорбции метил- α -D-маннопиранози-дом, а также ее чувствительность к эндогликозидазе F, специфичной в отношении высокоманнозных гликанов (25). Полученные результаты свидетельствуют об участии высокоманнозных олигосахаридов из гликопротеинов вируса АЧС в гемадсорбции.
Негемадсорбирующие изоляты, штаммы, варианты вируса АЧС. В Африке негемадсорбирующие изоляты вируса АЧС выделяли от хронически инфицированных диких (бородавочники, кустарниковые свиньи) и домашних, в том числе аборигенных, свиней, а также от клещей Ornitodoros moubata (26-32). Одни изоляты при пассировании на домашних свиньях или в первичной культуре клеток КМС восстанавливали гемад-сорбирующую активность, другие не восстанавливали (33). С 1972 по 1985 год в Народной Республике Конго в результате обследования более 7 тыс. свиней европейских и местных пород выделено 79 изолятов вируса АЧС. Было показано, что при естественном течении эпизоотий и экспериментальной селекции культуральные и патогенные свойства возбудителя АЧС подвергались значительной модификации: он мог утрачивать гемадсорби-рующую способность, снижать вирулентность вплоть до полной ее утраты.
Среди местных животных вирус АЧС часто циркулировал в негемадсорби-рующей форме, не вызывая клинических признаков и создавая положительный иммунный фон (34, 35).
В Европе негемадсорбирующие изоляты вируса АЧС, как правило, получены от хронически больных домашних свиней и клещей Ornitodoros erraticus . Например, в Испании с 1965 по 1974 годы выделили 206 негемад-сорбирующих изолятов (26). В Португалии из клещей Ornitodoros erraticus , которых собрали с 1988 по 1993 годы, выделили 10 изолятов вируса АЧС, из которых шесть были гемадсорбирующими и патогенными, а четыре — негемадсорбирующими и непатогенными (27). При пассажах на интактных домашних свиньях геном вируса АЧС мало подвержен модификации: было показано его сходство после 20 пассажей на свиньях, а также после 17100 пассажей на культуре свиных альвеолярных макрофагов (36, 37). Вместе с тем сообщалось об утрате вирулентных и (или) гемадсорбирующих свойств при длительном пассировании гемадсорбирующих изолятов в первичных или перевиваемых культурах клеток (38, 39).
Считается, что утрата гемадсорбирующего фенотипа не влияет на патогенность изолятов вируса АЧС. Негемадсорбирующие изоляты, выделенные от свиней в очагах болезни в Южной Африке и на Мадагаскаре, вызывали гибель 80-90 % животных (40). Тем не менее, многие исследователи обращали внимание на низкую вирулентность и протективные свойства у негемадсорбирующих природных изолятов и полученных лабораторных вариантов (11, 28, 41, 42). С помощью прямых и селекционных пассажей в культуре клеток КМС из высокореактогенного штамма Катанга-105 (I сероиммунотип), вызывавшего гибель 87 % домашних свиней, после 44 прямых пассажей в клетках КМС получили негемадсорбирующий вариант КЦ-149, который стал авирулентным для свиней. Он сохранял свойства до 190-го пассажа, не реверсировал при трех пассажах на свиньях, а также защищал от гибели при последующем внутримышечном заражении животных вирулентным референтным штаммом I сероиммунотипа Лиссабон-57 в дозе 104 ГАЕ50 (43, 44).
При изучении влияния γ -облучения на вирус АЧС получены неожиданные результаты. Культуральные препараты гемадсорбирующих и негемадсорбирующих изолятов, штаммов и вариантов вируса АЧС (неконцентрированные и концентрированные), которые утратили инфекцион-ность после облучения дозой 25 кГр ( γ -облученные препараты, γ -ОП), индуцировали гемадсорбцию при внесении в культуру клеток КМС. В субпассажах (от 3 до 8) этот эффект не воспроизводился и инфекционный вирус АЧС в исследуемых образцах не выделялся. По характеру расположения эритроцитов гемадсорбция, вызванная γ -ОП, практически не отличалась от рыхлой, наблюдаемой в культуре клеток КМС, зараженной, к примеру, аттенуированным штаммом ФК-32/135. На основании данных о развитии гемадсорбции, выявлении вирусоспецифических антигенов в обработанных γ -ОП А-клетках КМС с помощью иммунофлуоресценции и иммуноблоттинга, влиянии ингибиторов синтеза РНК и гликозилирования доказано, что в этом случае гемадсорбция обусловлена синтезом de novo вирусоспецифических белков в результате функционирования неповрежденных участков генома вируса АЧС. Продемонстрирована серологическая типоспецифичность гемадсорбции, индуцируемой γ -ОП негемад-сорбирующих изолятов вируса АЧС, что позволило проводить их сероти-пирование in vitro (45).
Белки, участвующие в гемадсорбции при АЧС. I.D. Vigario с соавт. (46) предположили, что существование негемадсорбирующих изоля-769
тов и штаммов вируса АЧС связано с дефектностью белка, обеспечивающего гемадсорбцию, при их репродукции. Позднее было установлено, что гемадсорбирующие свойства вируса АЧС определяются его трансмембранным белком, который схож с белком клеток хозяина CD2 (47, 48). Вирусоспецифический CD2-подобный белок был обозначен как CD2v, его мРНК транскрибируется благодаря открытой рамке считывания (ORF) в гене EP402R (49). Экстраклеточный домен CD2v сходен с таковым у белка связывания CD2 хозяина и содержит два Ig-подобных домена и 15 потенциальных сайтов для N-гликозилирования в отличие от 3-4 у CD2 (48, 50, 51). Молекулярная масса полноразмерного гликозилированного CD2v у изолята Malawi LIL20/1 — 105-110 кДа (52). Удаление гена, кодирующего CD2v белок, из генома вирулентных изолятов АЧС приводило к задержке виремии и диссеминации вируса в организме свиней, но не снижало процента смертности от вируса. В крови инфицированной свиньи экспрессия белка CD2v у внеклеточных вирусных частиц коррелировала с активностью их связывания с эритроцитами. Поэтому, по мнению авторов, потеря гемадсорбирующего фенотипа может быть фактором низкой или спорадической виремии, наблюдаемой при инфекциях, вызванных негемадсорби-рующими изолятами. Однако и другие свойства CD2v могут быть причиной снижения репродукции вируса в организме хозяина. К примеру, экспрессия CD2v приводит к подавлению пролиферации лимфоцитов в ответ на митогены in vitro, и это свидетельствует, что CD2v играет важную роль в уклонении вируса АЧС от иммунной системы хозяина (53, 54). Считают, что взаимодействие между CD2v и его лигандом на эритроцитах стабилизируется вследствие экспрессии вирусоспецифического лектиноподобного белка С-типа, кодируемого ORF EP153R , поскольку делеция гена EP153R приводит к снижению гемадсорбции вокруг зараженных вирусом АЧС клеток (55-57). Было показано, что белок EP153R ингибирует апоптоз и снижает экспрессию антигена главного комплекса гистосовместимости класса I свиней SLA I (58, 59). Установлено, что в геноме негемадсорби-рующих авирулентных изолятов OURT88/3 и NHV сдвинуты рамки считывания EP153R и EP402R , что в конечном счете и обусловливает этот фенотип (60-62). Интересно, что восстановление гемадсорбирующего фенотипа у штамма NHV приводило к усилению репродукции вируса в клещах, но не у свиней (63).
В зараженных гемадсорбирующими штаммами вируса АЧС и маркированных 3Н-глюкозамином А-клетках КМС методом радиоиммунопреципитации с активными в РЗГАд гомологичными антисыворотками был обнаружен серотипоспецифический гликопротеин с молекулярной массой 110-140 кДа (64). Авторы сочли его причастным к гемадсорбции на том основании, что этот гликопротеин не удавалось обнаружить в случае заражения А-клеток КМС негемадсорбирующими изолятами и штаммами, а также при использовании в иммунопреципитации неактивных в РЗГАд антисывороток свиней (в частности, полученных после введения животным аттенуированных штаммов вируса АЧС) (64).
Итак, проявление гемадсорбции при африканской чуме свиней (АЧС) имеет количественные характеристики. Потеря способности индуцировать гемадсорбцию сопровождается снижением вирулентности возбудителя. Свойство вирионов связываться с мембраной адсорбированных на макрофагах эритроцитов помогает диссеминации вируса по организму свиней и способствует более эффективному проникновению в клетки кишечника клещей. Гемадсорбирующие характеристики вируса АЧС определяются его трансмембранным высокогликозилированным белком CD2v. Исходя из данных 770
ингибиторного анализа, можно предположить, что гемадсорбция обусловлена взаимодействием олигосахаридов, входящих в состав гликопротеинов вируса АЧС, с лектиноподобным рецептором эритроцитов свиней.
Список литературы Гемадсорбция при африканской чуме свиней
- Dixon L.K., Costa J.V., Escribano J.M., Rock D.L., Vinuela E., Wilkinson P.J. Family Asfarviridae. In: Virus taxonomy/M.H.V. van Regenmortel, C.M. Fauquet, D.H.L. Bishop, E.B. Carstens, M.K. Estes, S.M. Lemon, J. Maniloff, M.A. Mayo, D.J. McGeoch, C.R. Pringle, R.B. Wickner (eds.). Academic Press, London, San Diego, CA, 2000: 159-165.
- Sanchez-Vizcaıno J.M., Mur L., Martınez-Lopez B. African swine fever: An epidemiological update. Transbound. Emerg. Dis., 2012, 59(1): 27-35 ( ) DOI: 10.1111/j.1865-1682.2011.01293
- Malmquist W.A., Hay D. Hemadsorbtion and cytophatic effect produced by African swine fever virus in swine bone marrow and buffy coat culture. Am. J. Vet. Res., 1960, 21: 104-108.
- Malogolovkin А., Burmakina G., Titov I., Sereda A., Gogin A., Baryshnikova E., Kolbasov D. Comparative analysis of African swine fever virus genotypes and serogroups. Emerg. Infect. Dis., 2015, 21(2): 312-315 ( ) DOI: 10.3201/eid2102.140649
- Колбасов Д.В., Балышев В.М., Середа А.Д. Итоги разработки живых вакцин против африканской чумы свиней. Ветеринария, 2014, 8: 3-8.
- Uhlendorff J., Matrosovich T., Klenk H.D., Matrosovich M. Functional significance of the hemadsorption activity of influenza virus neuraminidase and its alteration in pandemic viruses. Arch. Virol., 2009, 154: 945-957 ( ) DOI: 10.1007/s00705-009-0393-x
- Saburi Y., Okuda K., Takhashi T. Electron microscopic study of gemadsorbtion on vaccinia virus infected cells. Microbiol. Immunol., 1977, 21(10): 593-600.
- Breese S.S., Hess W.R. Electron microscopy of African swine fever virus hemadsorbtion. J. Bacteriol., 1966, 92(1): 272-274.
- Makarov V., Nedosekov V., Sereda A., Matvienko N. Immunological conception of African swine fever. Zoology and Ecology, 2016, 26(3): 236-243 ( ) DOI: 10.1080/21658005.2016.1182822
- Макаров В.В. Африканская чума свиней. М., 2011.
- Coggins L. Segregation of a non-hemadsorbing African swine fever virus in tissue culture. The Cornеll Veterinarian, 1968, 58(1): 12-20.
- Coggins L. African swine fever virus. Pathogenesis. Prog. Med. Virol., 1974, 18: 48-65.
- Малахова М.С. Взаимодействие вируса АЧС с иммунокомпетентными клетками свиньи. Канд. дис. Покров, 1987.
- Quintero J.C., Wesley R.D., Whyard T.C., Gregg D., Mebus C.A. In vitro and in vivo association of African swine fever virus with swine erythrocytes. Am. J. Vet. Res., 1986, 47(5): 1125-1131.
- Rowlands R.J., Duarte M.M., Boinas F., Hutchings G., Dixon L.K. The CD2v protein enhances African swine fever virus replication in the tick vector, Ornithodoros erraticus. Virology, 2009, 393: 319-328 ( ) DOI: 10.1016/j.virol.2009.07.040
- Sierraj M.A., Gomez-Villamanld C., Rasco O., Fernandeez A., Jover A. In vivo study of hemadsorption in African swine fever virus infected cells. Vet. Pathol., 1991, 28: 178-181.
- Макаров В.В., Вишняков И.Ф., Власов Н.А., Серова А.М. Популяционная структура вируса африканской чумы свиней по признаку количественной гемадсорбции. Вопросы вирусологии, 1991, 4: 321-324.
- Макаров В.В., Сухарев О.И., Цветнова И.В. Эпизоотологическая характеристика вируса африканской чумы свиней. Ветеринарная практика, 2013, 60(1): 6-16.
- Макаров В.В. Иммунологическая концепция африканской чумы свиней (некоторые итоги исследований). Ветеринарная практика, 2013, 62(3): 7-22.
- Митин Н.И., Шевченко А.А., Балышев В.М., Елисова С.Н. Дифференциация вирулентных и аттенуированных штаммов вируса АЧС в РЗГА. Тез. науч. конф. ВНИИВВиМ, посвященной 40-летию Великой Победы «Вопросы ветеринарной вирусологии, микробиологии и эпизоотологии». Покров, 1985: 39-41.
- Шубина Н.Г., Колонцов А.А., Малахова М.С., Макаров В.В. Межклеточные взаимодействия в культурах клеток костного мозга свиньи и ППК-66б, зараженных вирусом африканской чумы свиней. Бюллетень экспериментальной биологии и медицины, 1996, 122(10): 418-424.
- Šereš M., Cholujová D., Bubenčíkova T., Breier A., Sulová Z. Tunicamycin depresses P-glycoprotein glycosylation without an effect on its membrane localization and drug efflux activity in L1210 cells. Int. J. Mol. Sci., 2011, 12(11): 7772-7784 ( ) DOI: 10.3390/ijms12117772
- Макаров В.В., Середа А.Д., Пиря А.А., Малахова М.С. Функциональная роль гликозилирования вирусных компонентов. Вопросы вирусологии, 1992, 5-6: 267-270.
- Reszka N., Krol E., Patel A.H., Szewczyk B. Effect of tunicamycin on the biogenesis of hepatitis C virus glycoproteins. Acta biochimika Polonica, 2010, 57(4): 541-546.
- Shi X., Brauburger K., Elliott R.M. Role of N-linked glycans on bunyamwera virus glycoproteins in intracellular trafficking, protein folding, and virus infectivity. J. Virol., 2005, 79(21): 13725-13734 ( ) DOI: 10.1128/jvi.79.21.13725-13734.2005
- Gonzague M., Roger F., Bastos A., Burger C., Randriamparany T., Smondack S., Cruciere C. Isolation of a non-haemadsorbing, non-cytopathic strain of African swine fever virus in Madagascar. Epidemiol. Infect., 2001, 126(3): 453-459 ( ) DOI: 10.1017/s0950268801005465
- Boinas F.S., Hutchings G.H., Dixon L.K., Wilkinson P.J. Characterization of pathogenic and non-pathogenic African swine fever virus isolates from Ornithodoros erraticus inhabiting pig premises in Portugal. J. Gen. Virol., 2004, 85: 2177-2187 ( ) DOI: 10.1099/vir.0.80058-0
- Oura C.A.L., Denyer M.S., Takamatsu H., Parkhouse R.M.E. In vivo depletion of CD8+ T lymphocytes abrogates protective immunity to African swine fever virus. J. Gen. Virol., 2005, 86(9): 2445-2450 ( ) DOI: 10.1099/vir.0.81038-0
- Souto R., Mutowembwa P., van Heerden J., Fosgate G.T., Heath L., Vosloo W. Vaccine potential of two previously uncharacterized African swine fever virus isolates from Southern Africa and heterologous cross protection of an avirulent European isolate. Transbound. Emerg. Dis., 2016, 63: 224-231 ( ) DOI: 10.1111/tbed.12250
- Колбасов Д.В., Середа А.Д. Вопросы биологии вируса африканской чумы свиней в клещах. Ветеринария, 2013, 1: 19-23.
- Jori F., Bastos A.D.S. Role of wild suids in the epidemiology of African swine fever. EcoHealth, 2009, 6(2): 296-310 ( ) DOI: 10.1007/s10393-009-0248-7
- Roger F., Crucière C., Randriamahefa N., Zeller H., Uilenberg G., Randriamparany T., Gonzague M., Rousset D., Benkirane A., Diallo A. African swine fever in Madagascar: epidemiological assessment of the recent epizootic. Proc. 9th Int. Symp. on Veterinary Epidemiology and Economics. Breckenridge, Colorado, USA, 2000.
- Середа А.Д., Балышев В.М., Моргунов Ю.П., Колбасов Д.В. Антигенные свойства вируса африканской чумы свиней в искусственных и естественных смешанных популяциях. Сельскохозяйственная биология, 2014, 1: 64-69 ( ) DOI: 10.15389/agrobiology.2014.4.64rus
- Бадаев Ф.А., Рудобельский Э.В., Чевелев С.Ф., Киселев А.В., Никишин И.В., Бадаева Н.В., Бурлаков В.А., Балабанов В.А., Захаров В.М., Байбиков Т.З., Бурдов А.Н. Биологические свойства вируса африканской чумы свиней. Мат. науч. конф. ВНИИВВиМ «Вопросы ветеринарной вирусологии, микробиологии и эпизоотологии». Покров, 1992, 1: 24-27.
- Бадаев Ф.А., Черятников Л.Л., Рудобельский Э.В., Чевелев С.Ф., Киселев А.В., Бадаева Н.В., Захаров В.М., Байбиков Т.З. Экология вируса африканской чумы свиней. Мат. науч. конф. ВНИИВВиМ «Вопросы ветеринарной вирусологии, микробиологии и эпизоотологии». Покров, 1992, 1: 44.
- Rodríguez J.M., Moreno L.T., Alejo A., Lacasta A., Rodríguez F., Salas M.L. Genome sequence of African swine fever virus BA71, the virulent parental strain of the nonpathogenic and tissue-culture adapted BA71V. PLoS ONE, 2015, 10(11): e0142889 ( ) DOI: 10.1371/journal.pone.0142889
- Portugal R., Coelho J., Hoper D., Little N.S., Smithson C., Upton C., Martins C., Leitão A., Keil G.M. Related strains of African swine fever virus with different virulence: genome comparison and analysis. J. Gen. Virol., 2015, 96: 408-419 ( ) DOI: 10.1099/vir.0.070508-0
- Моргунов Ю.П., Малоголовкин А.С., Моргунов С.Ю., Бурмакина Г.С., Кушнир С.Д., Юрков С.Г., Цыбанов С.Ж., Колбасов Д.В. Биологические характеристики штаммов вируса африканской чумы свиней 8-го сероиммунотипа, адаптированных к перевиваемой линии клеток СОS-1. Ветеринария, 2015, 10: 53-57.
- Krug P.W., Holinka L.G., O’Donnell V., Reese B., Sanford B., Fernandez-Sainz I., Gladue D.P., Arzt J., Rodriguez L., Risatti G.R., Borca M.V. The progressive adaptation of a Georgian isolate of African swine fever virus to Vero cells leads to a gradual attenuation of virulence in swine corresponding to major modifications of the viral genome. J. Virol., 2015, 89(4): 2324-2332 ( ) DOI: 10.1128/JVI.03250-14
- Neser J.A., Pidllips T., Thomson G.R., Gainaru M.D., Coetzee T. African swine fever. I. Morphological changes and virus replication in blood platelets of pigs infected with virulent haemadsorbing and non-haemadsorbing isolates. Onderstepoort J. Vet., 1986, 53: 133-141.
- Reis A.L., Parkhouse R.M., Penedos A.R., Martins C., Leitão A. Systematic analysis of longitudinal serological responses of pigs infected experimentally with African swine fever virus. J. Gen. Virol., 2007, 88(9): 2426-2434 ( ) DOI: 10.1099/vir.0.82857-0
- Takamatsu H.H., Denyer M.S., Lacasta A., Stirling C.M.A., Argilaguet J.M., Netherton C.L., Oura C.A.L., Martins C., Rodríguez F. Cellular immunity in ASFV responses. Virus Res., 2013, 173(1): 110-121 ( ) DOI: 10.1016/j.virusres.2012.11.009
- Бредихина Т.Т., Колосов В.М., Архипова С.Н. Селекция аттенуированного варианта вируса АЧС 1 серотипа из штамма Катанга-105. Тез. науч.-теор. конф. ВНИИВВиМ, посвященной 60-летию образования СССР. Покров, 1983: 120-123.
- Бредихина Т.Г., Колосов В.М. Некоторые биологические свойства аттенуированного штамма КЦ-160 вируса АЧС 1 серотипа. Сообщение 1. Реактогенность и реверсибельность. Тез. науч.-теор. конф. ВНИИВВиМ, посвященной 60-летию образования СССР. Покров, 1983: 123-124.
- Середа А.Д. Определение серотиповой специфичности негемадсорбирующих штаммов вируса африканской чумы свиней. Научный журнал КубГАУ, 2010, 62(8). Режим доступа: http://ej.kubagro.ru/2010/08/pdf/23.pdf. Без даты.
- Vigario I.D., Terrinha A.M., Moura Nunes J.F. Antigenic relationships among strains of African swine fever virus. Archiv fur die gesamte Virusforschung, 1974, 45(3): 272-277.
- Borca M.V., Kutish G.F., Afonso C.L., Irusta P., Carrillo C., Brun A., Sussman M., Rock D.L. An African swine fever virus gene with similarity to the T-lymphocyte surface-antigen Cd2 mediates hemadsorption. Virology, 1994, 199(2): 463-468 ( ) DOI: 10.1006/viro.1994.1146
- Rodríguez J.M., Yáñez R.J., Almazán F., Viñuela E., Rodriguez J.F. African swine fever virus encodes a Cd2 homolog responsible for the adhesion of erythrocytes to infected-cells. J. Virol., 1993, 67(9): 5312-5320.
- Kay-Jackson P.C., Goatley L.C., Cox L., Miskin J.E., Parkhouse R.M., Wienands J., Dixon L.K. The CD2v protein of African swine fever virus interacts with the actin-binding adaptor protein SH3P7. J. Gen. Virol., 2004, 85(1): 119-130 ( ) DOI: 10.1099/vir.0.19435-0
- Мима К.А., Бурмакина Г.С., Титов И.А., Малоголовкин А.С. Иммунологически значимые гликопротеины p54 и CD2v вируса африканской чумы свиней: биоинформатический анализ генетических вариаций и гетерогенности. Сельскохозяйственная биология, 2015, 50(6): 785-793 ( , 10.15389/agrobiology.2015.6.785eng) DOI: 10.15389/agrobiology.2015.6.785rus
- Ruiz-Gonzalvo F., Rodríguez F., Escribano J.M. Functional and immunological properties of the baculovirus-expressed hemagglutinin of African swine fever virus. Virology, 1996, 218(1): 285-289 ( ) DOI: 10.1006/viro.1996.0193
- Goatley L.C., Dixon L.K. Processing and localization of the African swine fever virus CD2v transmembrane Protein. J. Virol., 2011, 85(7): 3294-3305 ( ) DOI: 10.1128/JVI.01994-10
- Tulman E.R., Delhon G.A., Ku B.K., Rock D.L. African swine fever virus. Curr. Top. Microbiol. Immunol., 2009, 328: 43-87.
- Dixon L.K., Abrams C.C., Bowick G., Goatley L.C., Kay-Jackson P.C., Chapman D., Liverani E., Nix R., Silk R., Zhang F. African swine fever virus proteins involved in evading host defense systems. Vet. Immunol. Immunopathol., 2004, 100(3-4): 117-134 ( ) DOI: 10.1016/j.vetimm.2004.04.002
- Galindo I., Almazán F., Bustos M.J., Viñuela E., Carrascosa A.L. African swine fever virus EP153R open reading frame encodes a glycoprotein involved in the hemadsorption of infected cells. Virology, 2000, 266(2): 340-351 ( ) DOI: 10.1006/viro.1999.0080
- Burmakina G., Malogolovkin A., Tulman E.R., Zsak L., Delhon G., Diel D.G., Shobogorov N.M., Morgunov Y.P., Morgunov S.Y., Kutish G.F., Kolbasov D., Rock D.L. African swine fever virus serotype-specific proteins are significant protective antigens for African swine fever. J. Gen. Virol., 2016, 97(7): 1670-1675 ( ) DOI: 10.1099/jgv.0.000490
- Neilan J.G., Borca M.V., Lu Z., Kutish G.F., Kleiboeker S.B., Carrillo C., Zsak L., Rock D.L. An African swine fever virus ORF with similarity to C-type lectins is non-essential for growth in swine macrophages in vitro and for virus virulence in domestic swine. J. Gen. Virol., 1999, 80(10): 2693-2697 ( ) DOI: 10.1099/0022-1317-80-10-2693
- Hurtado C., Granja A.G., Bustos M.J., Nogal M.L., Buitrago G.G., Yébenes V.G., Salas M.L., Revilla Y., Carrascosa A.L. The C-type lectin homologue gene (EP153R) of African swine fever virus inhibits apoptosis both in virus infection and in heterologous expression. Virology, 2004, 326(1): 160-170 ( ) DOI: 10.1016/j.virol.2004.05.019
- Hurtado C., Bustos M.J., Granja A.G., León P., Sabina P., López-Viñas E., Gómez-Puertas P., Revilla Y., Carrascosa A.L. The African swine fever virus lectin EP153R modulates the surface membrane expression of MHC class I antigens. Arch. Virol., 2011, 156: 219-234 ( ) DOI: 10.1007/s00705-010-0846-2
- Chapman D.A., Tcherepanov V., Upton C., Dixon L.K. Comparison of the genome sequences of nonpathogenic and pathogenic African swine fever virus isolates. J. Gen. Virol., 2008, 89: 397-408 ( ) DOI: 10.1099/vir.0.83343-0
- Leitão A., Cartaxeiro C., Coelho R., Cruz B., Parkhouse R.M., Portugal F., Vigario J.D., Martins C.L. The non-haemadsorbing African swine fever virus isolate ASFV/NH/P68 provides a model for defining the protective anti-virus immune response. J. Gen. Virol., 2001, 82(3): 513-523 ( ) DOI: 10.1099/0022-1317-82-3-513
- Malogolovkin A., Burmakina G., Tulman E.R., Delhon G., Diel D.G, Salnikov N., Kutish G.F., Kolbasov D., Rock D.L. African swine fever virus CD2v and C-type lectin gene loci mediate serological specificity. J. Gen. Virol., 2015, 96: 866-873 ( ) DOI: 10.1099/jgv.0.000024
- Rowlands R.J., Duarte M.M., Boinas F., Hutchings G., Dixon L.K. The CD2v protein enhances African swine fever virus replication in the tick vector, Ornithodoros erraticus. Virology, 2009, 393(2): 319-328 ( ) DOI: 10.1016/j.virol.2009.07.040
- Середа А.Д., Анохина Е.Г., Фугина Л.Г., Макаров В.В. Серологические и физико-химические свойства ГП 110-140 вируса африканской чумы свиней. Ветеринария, 1993, 1: 26-28.


