Гендерные особенности регресса гипертрофии левого желудочка после ренальной денервации у пациентов с резистентной артериальной гипертонией
Автор: Ситкова Е.С., Мордовии В.Ф., Рипп Т.М., Пекарский С.Е., Рябова Т.Р., Фальковская А.Ю., Личикаки В.А., Зюбанова И.В., Баев А.Е., Мочула О.В., Усов В.Ю.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.34, 2019 года.
Бесплатный доступ
Цель: изучить гендерные особенности регресса гипертрофии левого желудочка (ГЛЖ) после ренальной денервации (РДН).Материал и методы. Восьмидесяти четырем пациентам (50% мужчин) с резистентной артериальной гипертонией (РАГ) после подписания информированного согласия выполнена РДН. Исходно, через 6 и 12 мес. произведено измерение «офисного» артериального давления (АД) и эхокардиография (ЭхоКГ) с изучением толщины стенок ЛЖ, массы миокарда ЛЖ (ММ ЛЖ), а также магнитно-резонансная томография (МРТ) сердца с включением в анализ ММ ЛЖ.Результаты. Мужчины и женщины были сопоставимы по возрасту, уровню АД, количеству принимаемых антигипертензивных препаратов и произведенных радиочастотных воздействий при РДН. ММ ЛЖ была выше у мужчин ввиду анатомических особенностей. ГЛЖ по ЭхоКГ встречалась у женщин чаще (90%), чем у мужчин (76%), χ2 = = 0,079. При сопоставимой и значимой динамике АД регресс толщины межжелудочковой перегородки (на 4,4%, р = = 0,039) и ММ ЛЖ (на 9,5%, р = 0,044) выявлен через 1 год у мужчин по данным ЭхоКГ и МРТ с сокращением ММ ЛЖ через 6 мес. на 11,9% (р = 0,039) и на 22,9% через 12 мес. (р = 0,026). У женщин значимых изменений отмечено не было. Выраженность регресса ГЛЖ не была связана с антигипертензивным эффектом РДН ни у мужчин, ни у женщин.Заключение. Встречаемость ГЛЖ у женщин с РАГ составила 90% против 76% у мужчин. Через год после РДН у мужчин отмечен значимый регресс ГЛЖ при отсутствии изменений у женщин, не связанный с выраженностью снижения АД.
Гипертензия, гипертрофия левого желудочка, кардиопротективная эффективность, гендерные особенности, ренальная денервация
Короткий адрес: https://sciup.org/149126216
IDR: 149126216 | УДК: 616.12-008.331.1-085.015.46:616.136.7-089-072.1-06:616 | DOI: 10.29001/2073-8552-2019-34-4-128-135
Текст научной статьи Гендерные особенности регресса гипертрофии левого желудочка после ренальной денервации у пациентов с резистентной артериальной гипертонией
–135
Крайне высокая встречаемость гипертрофии левого желудочка (ГЛЖ) при артериальной гипертонии (АГ) сопряжена с повышением риска развития кардиоваскулярных осложнений. И хотя значение гендерной детерминанты имеет существенную вариабельность в определении прогноза в зависимости от возраста, наличие ГЛЖ является фактором, обусловливающим худший кар- диоваскулярный прогноз у женщин, чем у мужчин [1]. Большая частота встречаемости ГЛЖ у женщин, в частности в постменопаузальном периоде, сопровождается развитием сердечной недостаточности с сохраненной фракцией выброса, имеющей не меньшее влияние на прогноз, чем сердечная недостаточность со сниженной сократительной функцией [2, 3].
Возможности фармакотерапевтической коррекции ГЛЖ имеют обширную доказательную базу (LIFE, SAVE, AIRE, TRACE, SOLVD). Однако даже использование высокоэффективных современных препаратов для лечения АГ не позволяет достичь регресса ремоделирования миокарда в 100% случаев [4].
Отдельного внимания наряду с возможностями фармакотерапии заслуживает метод ренальной денервации (РДН), позволяющий, по отдельным данным, реализовать стойкий кардиопротективный эффект лечения [5, 6]. Изучение предикторов эффективности РДН проводилось в основном в аспекте повышения основного, антигипертензивного эффекта лечения. Однако возможность кардиопротекции, доказано сопряженной со снижением риска сердечно-сосудистых осложнений и летальности, является не менее значимым эффектом терапии. Ввиду доказанно большего влияния ГЛЖ на прогноз у женщин, большой интерес представляет сравнительный анализ возможностей РДН в коррекции выраженности ГЛЖ в зависимости от гендерной принадлежности. Стимулирует научный интерес в изучении этого вопроса и тот факт, что, несмотря на изученные особенности структурно-функциональных изменений миокарда в зависимости от пола [7], возраста, расовой принадлежности и модифицируемых факторов риска (LIFE, HYVET), подходы к диагностике и лечению сердечно-сосудистой патологии, в частности АГ (в том числе структурно-функциональных изменений сердца) [8], идентичны у мужчин и женщин, а данные о возможности коррекции кардиальных изменений с учетом пола при использовании РДН отсутствуют вовсе.
Цель: изучить гендерные особенности регресса ГЛЖ после РДН у пациентов с резистентной АГ (РАГ).
Материал и методы
Исследование выполнено в соответствии с национальными и международными стандартами проведения клинических исследований (Хельсинкская Декларация Всемирной медицинской ассоциации) при одобрении Комитета по биомедицинской этике НИИ кардиологии Томского НИМЦ. Консультативный отбор производился из популяции пациентов, направленных для обследования в НИИ кардиологии (Томск) с учетом резистентности АГ к амбулаторно подобранной многокомпонентной терапии в максимально переносимых терапевтических дозировках. Включение пациентов в исследование осуществлялось после анализа результатов расширенного клинико-инструментального обследования в соответствии c рекомендациями по исключению вторичных форм АГ и псевдорезистентности, а также подписания информированного согласия на участие.
Критерии включения:
– мужчины и женщины 18–80 лет;
– артериальное давление (АД) ≥ 160/100 мм рт. ст. при терапии в течение не менее 3 мес. тремя и более антигипертензивными препаратами с включением диуретика;
– письменное информированное согласие на участие в исследовании.
Критерии исключения:
– симптоматическая АГ;
– суточное систолическое АД < 135 мм рт. ст.
-
– патология почечных артерий, технически несовместимая с выполнением РДН;
-
– тяжелая сопутствующая патология, сопряженная с высоким риском осложнений вмешательства;
-
– расчетная скорость клубочковой фильтрации (MDRD) < 30 мл/мин/м2;
В исследование включены 84 пациента с РАГ с равным соотношением представителей обоих полов. После подписания информированного согласия РДН была выполнена всем больным . Сравнительная характеристика мужчин и женщин представлена в таблице 1.
Через 6 мес. обследование прошли 77 пациентов. Из семи необследованных пять человек не вышли на контакт/отказались от дальнейшего наблюдения, один пациент погиб по причине, не связанной с основным заболеванием, один не прибыл на госпитализацию по причине отдаленности проживания. Итого годовой этап обследования завершили 69 пациентов (2 умерли, из них один от инсульта; 13 не вышли на контакт/отказались от дальнейшего наблюдения).
Таблица 1. Сравнительная клиническая характеристика мужчин и женщин, включенных в исследование
Table 1. Baseline characteristics of men and women
|
Показатели Parameters |
Мужчины Men (n = 42) М ± SD , n (%) |
Женщины Women (n = 42) М ± SD , n (%) |
р |
|
Возраст, годы Age, years |
54,5 ± 10,2 |
55,5 ± 7,9 |
0,63 |
|
Офисное САД, мм рт. ст. Office SBP, mmHg |
177,7 ± 21,1 |
178,8 ± 22,6 |
0,15 |
|
Офисное ДАД, мм рт. ст. Office DBP, mmHg |
101,8 ± 17,4 |
99,0 ± 14,8 |
0,43 |
|
Офисная ЧСС, уд./мин Office HR, bpm |
70,9 ± 10,5 |
71,3 ± 9,4 |
0,86 |
|
Количество антигипертензивных препаратов, n Number of antihypertensive drugs, n |
4,0 ± 1,1 |
3,9 ± 0,9 |
0,51 |
|
Общее количество радиочастотных аппликаций, n A number of radiofrequency applications, n |
12,9 ± 2,5 |
12,6 ± 2,7 |
0,67 |
Окончание табл. 1
End of table 1
|
Показатели Parameters |
Мужчины Men (n = 42) М ± SD , n (%) |
Женщины Women (n = 42) М ± SD , n (%) |
р |
|
|
ИМТ, кг/м2 BMI, kg/m2 |
31,4 ± 5,0 |
35,3 ± 6,2 |
0,002 |
|
|
рСКФ (CKD-EPI), мл/мин/1,73 м2 eGFR (CKD-EPI), mL/min/1.73 m2 |
82,7 ± 21,8 |
82,7 ± 18,9 |
0,99 |
|
|
СД, n (%) DM, n (%) |
16 (29,6%) |
16 (29,6%) |
ns |
|
|
ИБС n (%) CAD, n (%) |
17 (34%) |
16 (29,6%) |
0,88 |
|
|
ХСН n (%) HF, n (%) |
20 (40%) |
20 (40%) |
ns |
Примечание: ИМТ – индекс массы тела; САД – систолическое АД; ДАД – диастолическое АД; ЧСС – частота сердечных сокращений; СКФ – скорость клубочковой фильтрации; СД – сахарный диабет; ИБС – ишемическая болезнь сердца; ХСН – хроническая сердечная недостаточность.
Note: BMI – body mass index; SBP – systolic blood pressure; DBP – diastolic blood pressure; HR – heart rate; eGFR – glomerular filtration rate; DM – diabetes mellitus; CAD – coronary artery disease; HF – heart failure.
Пациентам, включенным в исследование и явившимся в центр через 6 и 12 мес. после РДН, выполнено:
-
1. Регистрация «офисного» АД и частоты сердечных сокращений (ЧСС).
-
2. Эхокардиография (ЭхоКГ) на аппарате экспертного класса EnVisor C HD (фирма Philips) в М- и В-режи-мах трансторакальным доступом с изучением толщины межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ), массы миокарда левого желудочка (ММ ЛЖ) по формуле Devereux. ГЛЖ документировалась при ЭхоКГ значениях индекса ММ ЛЖ (ИММ ЛЖ) у женщин >95 г/м2, а у мужчин >115 г/м2 [9].
-
3. Магнитно-резонансная томография (МРТ) сердца дополнительно выполнена 35 больным по стандартному протоколу на высокопольном томографе Toshiba Vantage Titan 1,5T MRI System (Япония). Исследование проводилось с синхронизацией по дыханию и ЭКГ на конец диастолы в SSFP режиме в 2-камерной проекции по короткой оси ЛЖ и 4-камерной проекции по длинной оси ЛЖ (cine MRI). Изучению подвергалась ММ ЛЖ, рассчитанная по формуле R.B. Devereux и N. Reichek.
Группы, сформированные в соответствии с гендерной принадлежностью, были сопоставимы по основным клиническим характеристикам, в том числе по структуре антигипертензивной терапии. Исключение составил индекс массы тела (ИМТ), который значительно преобладал у женщин. Важно, что 48 из 50 женщин находились в постменопаузальном периоде без заме- стительной гормональной терапии. С учетом гендерной принадлежности толщина стенок ЛЖ и ММ ЛЖ была значительно больше у мужчин, что обусловлено анатомически.
Нормальность распределения выборки определялась при помощи теста Колмогорова Смирнова с поправкой Лильефорса. При нормальном законе распределения показателей анализ основывался на t-критерии Стьюдента, при ненормальном – на критерии Манна Уитни. В случае сравнительного анализа двух зависимых групп по аналогичному принципу прибегали к использованию параметрического (t-критерия Стьюдента) и непараметрического метода (критерий знаков). Корреляционный анализ выполнен на основании непараметрического метода Спирмена. При сравнении переменных, принимающих дискретные значения, использовался χ2. Значимость различий верифицировалась при значении p < 0,05. Данные представлены в виде М ± SD , где М – среднее арифметическое значение, SD – стандартное отклонение и Me [ LQ ; UQ ], где Me – медиана, а LQ и UQ – 25% и 75% квартили соответственно.
Результаты
Регресс АД был статистически значимый в обеих группах, несколько лучший через 6 мес. у женщин, но сопоставимый к окончанию наблюдения с мужчинами при отсутствии изменений в структуре антигипертензивной терапии (табл. 2).
Таблица 2. Регресс «офисного» АД и ЧСС у мужчин и женщин после РДН
Table 2. Dynamics of office BP and HR after the renal denervation
|
Показатели Parameters |
Мужчины Men М ± SD , р |
Женщины Women М ± SD , р |
р * |
||
|
∆Офисное САД 6 мес., мм рт. ст. ∆Office SBP at 6 months, mmHg |
20,4 ± 18,9, р < 0,0001 |
35,1 ± 27,7, р < 0,0001 |
0,02 |
Окончание табл. 2
End of table 2
|
Показатели Parameters |
Мужчины Men М ± SD , р |
Женщины Women М ± SD , р |
р * |
|
∆Офисное ДАД 6 мес., мм рт. ст. ∆Office DBP at 6 months, mmHg |
9,6 ± 15,1, р < 0,0001 |
18,6 ± 14,2, р < 0,0001 |
0,02 |
|
∆Офисное ЧСС 6 мес., уд./мин ∆Office HR at 6 months, bpm |
2,7 ± 11,6, р = 0,025 |
3,9 ± 10,7, р = 0,094 |
0,86 |
|
∆Офисное САД 12 мес., мм рт. ст. ∆Office SBP at 12 months, mmHg |
28,8 ± 27,4, р < 0,0001 |
33,2 ± 26,0, р < 0,0001 |
0,54 |
|
∆Офисное ДАД 12 мес., мм рт. ст. ∆Office DBP at 12 months, mmHg |
15,4 ± 19,7, р < 0,0001 |
13,7 ± 15,9, р < 0,0001 |
0,73 |
|
∆Офисное ЧСС 12 мес., уд./мин ∆Office HR at 12 months, bpm |
0,13 ± 10,6, р = 0,32 |
2,4 ± 12,0, р = 0,37 |
0,47 |
Примечание: САД – систолическое АД; ДАД – диастолическое АД; ЧСС – частота сердечных сокращений; р – уровень значимости различий при сравнении с исходными данными; р * – уровень значимости различий при межгрупповом сравнительном анализе.
Note: SBP – systolic blood pressure; DBP – diastolic blood pressure; HR – heart rate; p – the level of significance of differences when compared with baseline; р * – the level of significance of differences in the intergroup comparative analysis.
Встречаемость ГЛЖ в целой группе до РДН составила 83,3%, у 76% мужчин и 90% женщин (χ2= 0,079). У мужчин отмечен статистически значимый регресс толщины МЖП (15,8 ± 2,6 и 15,1 ± 2,3 мм, р = 0,039) и ММ ЛЖ (331,4 ± ± 89,5 и 299,8 ± 70,5 г, р = 0,044) через 12 мес. после РДН при отсутствии регресса показателей у женщин (рис. 1, 2).
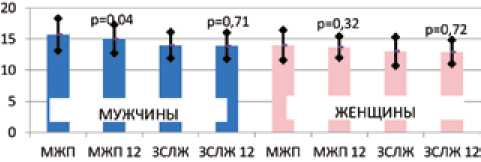
Рис. 1. Динамика толщины стенок ЛЖ у мужчин и женщин через 12 мес. после РДН
Fig. 1. Changes in wall thickness in men and women 12 months after renal denervation
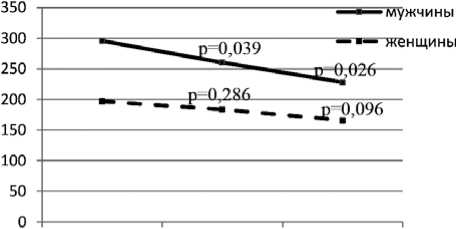
исход 6 мес . 12 мес .
Рис . 3 . Динамика ММ ЛЖ по данным МРТ сердца с контрастированием у мужчин и женщин
Fig. 3. Changes in left ventricular mass in men and women 12 months after renal denervation according to data of cardiac magnetic resonance imaging
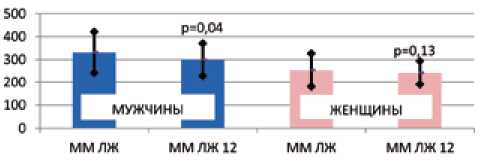
Рис. 2. Динамика ММ ЛЖ у мужчин и женщин через 12 мес. после РДН
Fig. 2. Changes in left ventricular mass in men and women 12 months after renal denervation
По результатам МРТ, выполненной у 35 пациентов, у мужчин уже через 6 мес. в сравнении с исходными данными регистрируется отчетливый регресс ММ ЛЖ (295,7 г [235; 350]; 260,4 г [201,9; 325,1]; р = 0,039) с сохранением значимости различий и к 12 мес. после РДН (295,7 г [235; 350]; 228,0 г [174,8; 275,9]; р = 0,026), в то время как у женщин значимой динамики показателей ни к 6, ни к 12 мес. после РДН отмечено не было ( р = 0,096) (рис. 3).
Ни в одной из групп не отмечено связи регресса ГЛЖ с выраженностью снижения АД после РДН.
Учитывая значительные различия ИМТ в сравниваемых группах, выполнен корреляционный анализ для оценки влияния обсуждаемого фактора на полученные результаты у женщин. Таким образом, установлено, что в рамках изучаемой выборки величина ИМТ не коррелирует с выраженностью регресса ММ ЛЖ и МЖП ни в одной из групп.
Обсуждение
Встречаемость ГЛЖ растет с возрастом, что имеет большое значение для женщин менопаузального периода, особенно при отсутствии заместительной терапии эстрогенами. Доказано, что в постменопаузальном периоде частота ГЛЖ у женщин выше, что является фактором, имеющим большее влияние на смертность при отсутствии коронарной патологии, чем у мужчин (43,4 vs. 32,1%, p < 0,01) [10, 11]. И если риск больших кардиовас- кулярных событий при отсутствии ГЛЖ у женщин статистически значимо ниже, чем у мужчин, то факт наличия ГЛЖ выравнивает шансы на развитие кардиоваскулярных осложнений [10].
Попытки изучения гендерассоциированных различий в патофизиологии исходов, эффектов при лечении показаны для многих кардиоваскулярных заболеваний [12]. В этом аспекте изучен ряд факторов, имеющих влияние у женщин на механизмы формирования кардиальной патологии, среди которых большая распространенность ожирения, снижение уровня эстрогенов, изменения сосудистой реактивности и нарушения липидного профиля как следствие постменопаузальных гормональных изменений, отличный от мужчин метаболизм получаемой фармакотерапии. Доказано, что миокард женщин более чувствителен к повышению АД и отвечает развитием ремоделирования реактивнее, чем у мужчин. Авторы этих исследовательских работ связывают данный факт с большей жесткостью аорты, что имеет значение в постменопаузальном периоде у женщин [13, 14].
Немаловажное значение в постменопаузальном периоде отводится эстрогенодефициту. Однако, несмотря на роль эстрогенов в реализации гендерассоциирован-ных различий в развитии сердечно-сосудистых заболеваний, эстрогензаместительная терапия в постменопаузе у женщин пока не является рекомендованной для снижения сердечно-сосудистого риска ввиду противоречивых данных исследований [15]. Отдельные авторы реализацию кардиопротекторных эффектов женских половых гормонов связывают с изменением фенотипа тучных клеток или, вероятно, предотвращением их активации [16]. Изучена роль и андрогенов в реализации ремоделирования миокарда, что, по мнению авторов, играет большую роль в реализации гендерассоцииро-ванных различий, чем защитные свойства эстрогенов [17].
Список литературы Гендерные особенности регресса гипертрофии левого желудочка после ренальной денервации у пациентов с резистентной артериальной гипертонией
- Liao Y., Cooper R.S., Mensah G.A., McGee D.L. Left ventricular hypertrophy has a greater impact on survival in women than in men. Circulation. 1995;92(4):805-810. DOI: 10.1161/01.cir.92.4.805.
- Lee D.S., Gona P., Vasan R.S., Larson M.G., Benjamin E.J., Wang T.J. et al. Relation of disease pathogenesis and risk factors to heart failure with preserved or reduced ejection fraction: insights from the Fram-ingham heart study of the national heart, lung, and blood institute. Circulation. 2009;119:3070-3077. DOI: 10.1161/CIRCULATI0NA-HA.108.815944.
- Melenovsky V., Borlaug B.A., Rosen B., Hay I., Ferruci L., Morell C.H. et al. Cardiovascular features of heart failure with preserved ejection fraction versus nonfailing hypertensive left ventricular hypertrophy in the urban Baltimore community: the role of atrial remodeling/dysfunction. J. Am. Coll. Cardiol. 2007;49(2):198-207. DOI: 10.1016/j. jacc.2006.08.050.
- Вайдья Р. Структурно-функциональные изменения левого желудочка у больных артериальной гипертонией при эффективной антигипертензивной терапии: автореф. дис. ... канд. мед. наук. Великий Новгород, 2004:20.
- Ситкова Е.С., Мордовин В. Ф., Рипп Т.М., Пекарский С.Е., Рябова Т.Р., Личикаки В.А. и др. Положительное влияние ренальной де-нервации на гипертрофию и субэндокардиальное повреждение миокарда. Артериальная гипертензия. 2019;25(1):46-59. DOI: 10.18705/1607-419X-2019-25-1-46-59.
- Sitkova E.S., Mordovin V.F., Ripp T.M., Pekarskiy S.E., Ryabova T.P., Lichikaki V.A. et al. Positive effects of renal denervation on left ventricular hypertrophy and subendocardial damage. Arterial Hypertension. 2019;25(1):46-59 (In Russ.). DOI: 10.18705/1607-419X-2019-25-1-46-59.
- De Sousa Almeida M., de Araújo Gongalves P., Branco P., Mesquita J., Carvalho M.S., Dores H. et al. Impact of renal sympathetic denervation on left ventricular structure and function at 1-year follow-up. PLoS One. 2016;11(3):e0149855. DOI: 10.1371/journal.pone.0149855.
- Nio A.Q.X., Stöhr E.J., Shave R.E. Age-related differences in left ventricular structure and function between healthy men and women. Climacteric. 2017;20(5):476-483. DOI: 10.1080/13697137.2017.1356814.
- Conroy R.M., Pyorala K., Fitzgerald A.P., Sans S., Menotti A., de Backer G. et al. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur. Heart J. 2003;24:987-1003. DOI: 10.1016/s0195-668x(03)00114-3.
- Mancia G., Fagard R., Narkiewicz K., Redón J., Zanchetti A., Böhm M. et al. Guidelines 2013 ESH/ESC for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European
- Society of Cardiology (ESC). J. Hypertens. 2013;31(7):1281-1357. DOI: 10.1097/01.hjh.0000431740.32696.cc.
- Gerdts E., Izzo R., Mancusi C., Losi M.A., Manzi M.V., Canciello G. et al. Left ventricular hypertrophy offsets the sex difference in cardiovascular risk (the Campania Salute Network). Int. J. Cardiol. 2018;258:257-261. DOI: 10.1016/j.ijcard.2017.12.086.
- Muiesan M.L., Paini A., Aggiusti C., Bertacchini F., Rosei C.A., Salvetti M. Hypertension and organ damage in women. High Blood Press. Car-diovasc. Prev. 2018;25(3):245-252. DOI: 10.1007/s40292-018-0265-0.
- Regitz-Zagrosek V., Oertelt-Prigione S., Prescott E., Franconi F., Gerdts E., Foryst-Ludwig A. et al. Gender in cardiovascular diseases: impact on clinical manifestations, management, and outcomes. Eur. Heart J. 2016;37(1):24—34. DOI: 10.1093/eurheartj/ehv598.
- Kostkiewicz M., Tracz W., Olszowska M., Podolec P., Drop D. Left ventricular geometry and function in patients with aortic stenosis: gender differences. Int. J. Cardiol. 1999;71:57-61. https://www.ncbi.nlm.nih. gov/pubmed/10522565.
- Krumholz H.M., Larson M., Levy D. Sex differences in cardiac adaptation to isolated systolic hypertension. Am. J. Cardiol. 1993;72(3):310-313. DOI: 10.1016/0002-9149(93)90678-6.
- Williams B., Mancia G., Spiering W. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the
- management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J. Hypertens. 2018;36(10):1953—2041. DOI: 10.1097/HJH.0000000000001940.
- Lu H., Meléndez G.C., Levick S.P., Janicki J.S. Prevention of adverse cardiac remodeling to volume overload in female rats is the result of an estrogen-altered mast cell phenotype. Am. J. Physiol. Heart Circ. Physiol. 2012;302(3):H811—817. DOI: 10.1152/ajpheart.00980. 2011.
- Montalvo C., Villar A.V., Merino D., Garcia R., Ares M., Llano M. et al. Androgens contribute to sex differences in myocardial remodeling under pressure overload by a mechanism involving TGF-ß. PLoS One. 2012;7(4):e35635. DOI: 10.1371/journal.pone.0035635.
- Gerdts E., Okin P.M., de Simone G., Cramariuc D., Wachtell K., Boman K. et al. Gender differences in left ventricular structure and function during antihypertensive treatment: the Losartan Intervention for Endpoint Reduction in Hypertension Study. Hypertension. 2008;51(4):1109—1114. DOI: 10.1161/HYPERTENSIONA-HA.107.107474.
- Murdolo G., Angeli F., Reboldi G., Di Giacomo L., Aita A., Bartolini C. et al. Left ventricular hypertrophy and obesity: only a matter of fat? High Blood Press. Cardiovasc. Prev. 2015;22(1):29-41. DOI: 10.1007/ s40292-014-0068-x.


