Генерализованное лимфогенное метастазирование с поражением паренхиматозных органов при раке желудка (случай из практики)
Автор: Завьялова М.В., Завьялов А.В., Пудова Е.С., Куценко И.Г., Егунова М.А., Кляус К.А., Орл Д.А., Вторушин С.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.24, 2025 года.
Бесплатный доступ
Генерализованное метастатическое поражение паренхиматозных органов при раке желудка чаще всего объясняют гематогенным распространением опухолевых клеток. Обширное лимфогенное метастазирование поражает отдаленные регионы лимфоузлов и серозные оболочки. Практически отсутствуют сведения о массивном метастатическом поражении паренхиматозных органов в результате опухолевой эмболии их лимфатических сосудов. Данный случай демонстрирует именно такое распространение опухолевого процесса. Цель исследования - демонстрация случая летального исхода при раке желудка с генерализованным лимфогенным метастатическим поражением паренхиматозных органов. Описание случая летального исхода. Представлен случай летального исхода с обширным лимфогенным метастазированием рака желудка с поражением паренхиматозных органов. Пациентка, 56 лет, получала симптоматическое лечение в течение 11 койко-дней в стационаре общехирургического профиля с Диагнозом: Рак желудка, IV стадия. Состоявшееся желудочное кровотечение . Во время патологоанатомического исследования обнаружена обширная лимфоваскулярная инвазия с массивной эмболией лимфатических сосудов брюшины, плевры, перикарда, забрюшинной клетчатки и практически всех органов за исключением головного мозга. Опухолевые эмболы в лимфатических сосудах интенсивно экспрессировали субъединицы интегринов a6 и b4, а также субъединицу ламинина γ 2.
Генерализованное лимфогенное метастазирование, рак желудка, опухолевая мболия лимфатических сосудов, субъединицы интегринов α6 и β4, субъединица ламинина γ2
Короткий адрес: https://sciup.org/140309641
IDR: 140309641 | УДК: 616.33-006.6-033.2:611-018.98 | DOI: 10.21294/1814-4861-2025-24-1-189-198
Текст научной статьи Генерализованное лимфогенное метастазирование с поражением паренхиматозных органов при раке желудка (случай из практики)
Оба яичника увеличены, замещены плотной светло-серой тканью (рис. 1В). В параметрии и в серозной оболочке маточных труб и матки – множественные нечетко отграниченные узлы светло серого цвета, плотной консистенции. Один из узлов (диаметром 5 см) врастал в стенку матки более чем на 2/3 толщины миометрия (рис. 1 Г).
Многочисленные диффузно расположенные плотные светло-серые узелки, диаметром от 2 до 10 мм, определялись в париетальной и висцеральной плевре (рис. 2 В, Г), легких, перикарде (рис. 2 Д, Е), миокарде, капсуле и поверхности печени, парарек-тальной клетчатке и серозной оболочке прямой кишки. Восьмой сегмент левого легкого и надпочечники диффузно уплотнены, замещены светло-серой
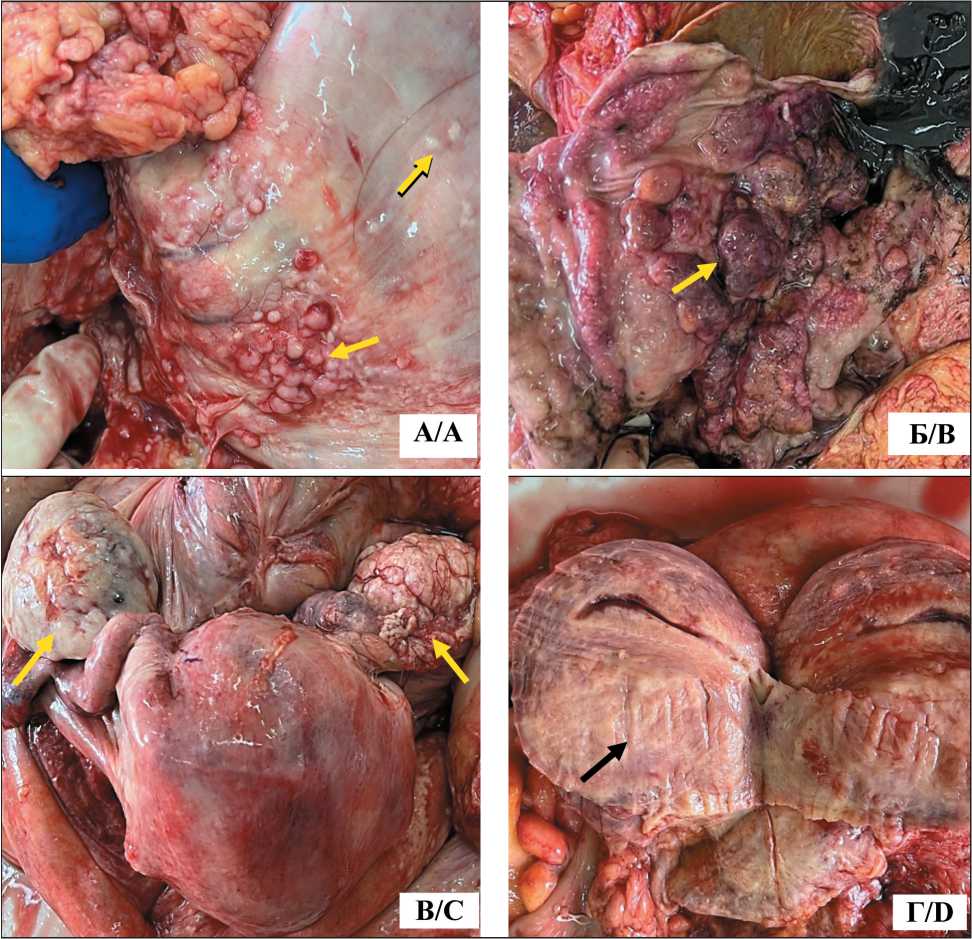
В – яичники значительно увеличены, замещены плотной светло-серой тканью (желтые стрелки); Г – со стороны серозной оболочки в стенку матки врастает нечетко отграниченный плотный светло-серый узел (черная стрелка).
Примечание: рисунок выполнен авторами
Fig. 1. Macroscopic image: A – serous membrane of the stomach with numerous light gray dense foci (yellow arrows); B – in the stomach there is a proliferation of tuberous tissue with areas of decay imbibed with blood (yellow arrow); C – ovaries are significantly enlarged, replaced by dense light gray tissue (yellow arrows); D – from the side of the serous membrane, a vaguely demarcated dense light gray node grows into the wall of the uterus (black arrow). Note: created by the authors
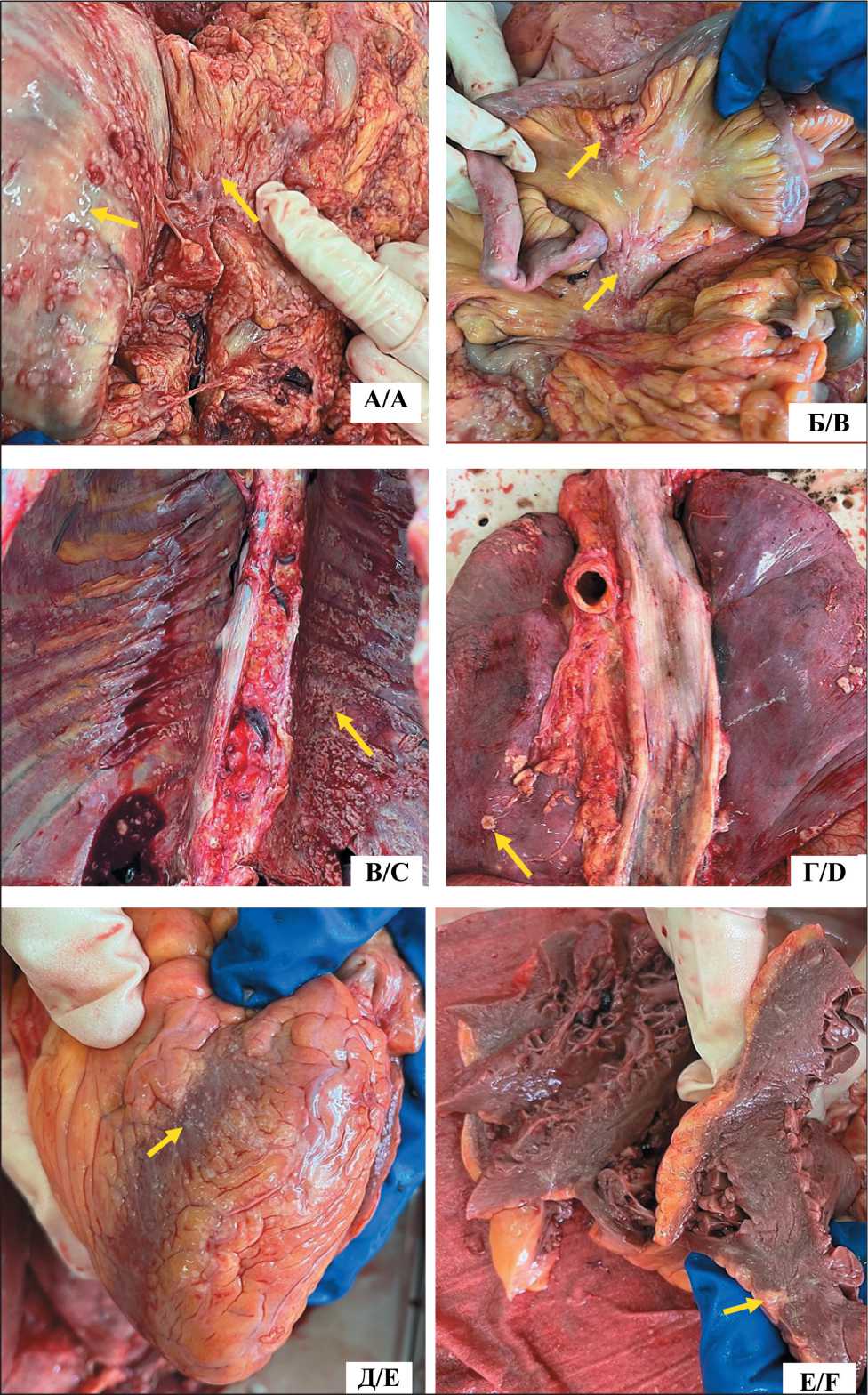
Рис. 2. Макроскопическая картина: А – висцеральная брюшина с многочисленными светло-серыми плотными узлами (желтая стрелка); Б – висцеральная брюшина с многочисленными светло-серыми плотными узлами (желтая стрелка); В – париетальная плевра с многочисленными светло-серыми плотными узлами (желтая стрелка); Г – висцеральная плевра с многочисленными светло-серыми плотными узлами (желтая стрелка); Д – висцеральный перикард с многочисленными светло-серыми плотными узлами (желтая стрелка); Е – со стороны висцерального перикарда в миокард врастает плотная светло-серая ткань (желтая стрелка). Примечание: рисунок выполнен авторами
Fig. 2. Macroscopic image: A – visceral peritoneum with numerous light gray dense nodes (yellow arrow); B – visceral peritoneum with numerous light gray dense nodes (yellow arrow); C – parietal pleura with numerous light gray dense nodes (yellow arrow); D – visceral pleura with numerous light gray dense nodes (yellow arrow); E – visceral pericardium with numerous light gray dense nodes (yellow arrow); F – from the side of the visceral pericardium, dense light gray tissue grows into the myocardium (yellow arrow).
Note: created by the authors тканью. Перибронхиальные, бифуркационные, пара-трахеальные, левый надключичный, правые и левые аксиллярные лимфоузлы, пупочное кольцо были увеличенными, плотными, замещенными светло-серой тканью. В области ворот печени, гепатодуоденаль-ной связки – конгломерат увеличенных лимфоузлов, замещенных плотной светло-серой тканью.
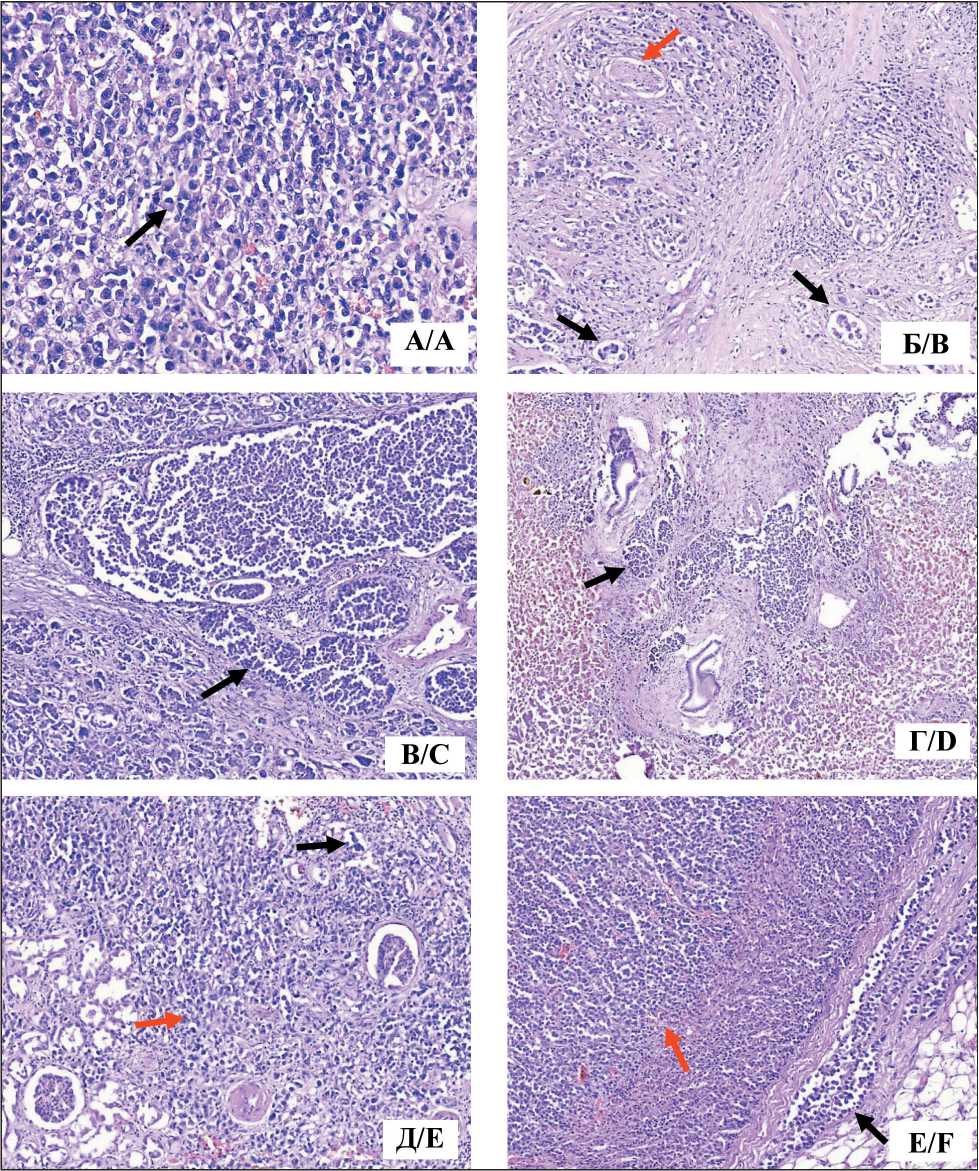
сосудах и многочисленные очаги разрастания опухолевой ткани, замещающие паренхиму перечисленных органов. Опухолевые эмболы обнаруживались и в лимфатических сосудах трабекул селезенки (рис. 3 Б–Е).
В легких определялось разрастание опухоле-вой ткани в плевре, опухолевые эмболы в лимфатических сосудах плевры, а также опухолевые эмболы в лимфатических сосудах по ходу ветвей легочной артерии, легочных вен с формированием «муфтообразных опухолевых инфильтратов», в стенках бронхов, в межальвеолярных перегородках, а также многочисленные поля разрастания опухолевой ткани с десмопластической реакцией стромы. Перибронхиальные, бифуркационные и паратрахеальные лимфоузлы были тотально замещены опухолевой тканью. Опухолевые эмболы обнаруживались в афферентных и эфферентных лимфатических сосудах.
В перикарде выявлены многочисленные опухолевые эмболы в лимфатических сосудах и очаги разрастания опухолевой ткани. Опухолевая ткань врастала со стороны эпикарда в миокард, в котором также обнаруживались многочисленные опухолевые эмболы в лимфатических сосудах.
В лимфатических сосудах широкой связки матки, серозной оболочки маточной трубы, сероз-ной оболочки матки выявлялись многочисленные опухолевые эмболы (рис. 4 А). Опухолевая ткань со стороны серозной оболочки врастала в ткань стенки матки, инвазируя более 2/3 толщины миометрия. В лимфатических сосудах брюшины, покрывающей яичники, а также в ткани яичников обнаруживались многочисленные опухолевые эмболы и обширные поля разрастания опухолевой ткани, замещающие ткань яичников за исключением структуры белых тел (рис. 4 Б–Г).
Разрастание опухолевой ткани с замещением паренхимы органов и многочисленные опухолевые эмболы определялись во всех макроскопически измененных органах, лимфатических узлах, в афферентных и эфферентных лимфатических сосудах, что является уникальной чертой описанного клинического случая. Кроме того, обнаруживалось тотальное метастатическое поражение левого надключичного лимфоузла, правых и левых аксиллярных лимфоузлов, пупочного кольца, пара-ректальной клетчатки.
При уточнении типа сосудов, содержащих опухолевые эмболы, методом иммуногистохими-
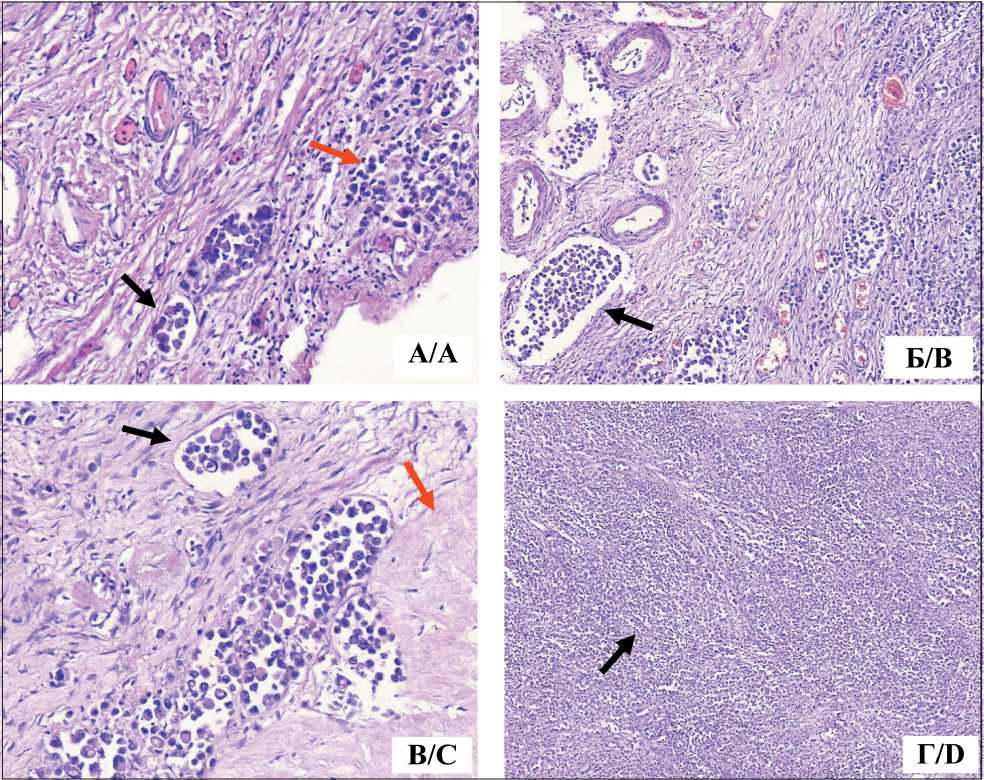
Рис. 4. Микрофото. Окраска гематоксилином и эозином: А – опухолевые эмболы в лимфатических сосудах серозной оболочки матки (черная стрелка), разрастание опухолевой ткани (красная стрелка), ×400; Б – опухолевые эмболы в лимфатических сосудах брюшины, покрывающей яичник (черная стрелка), ×200; В – опухолевые эмболы в лимфатических сосудах яичника (черная стрелка), белое тело (красная стрелка), ×400; Г – разрастание опухолевой ткани в яичнике (черная стрелка), ×100.
Примечание: рисунок выполнен авторами
Fig. 4. Microphoto. Hematoxylin and eosin staining: A – tumor emboli in the lymphatic vessels of the serous membrane of the uterus (black arrow), proliferation of tumor tissue (red arrow), ×400; B – tumor emboli in the lymphatic vessels of the peritoneum covering the ovary (black arrow), ×200; C – tumor emboli in the lymphatic vessels of the ovary (black arrow), white body (red arrow), ×400; D – proliferation of tumor tissue in the ovary (black arrow), ×100. Note: created by the authors
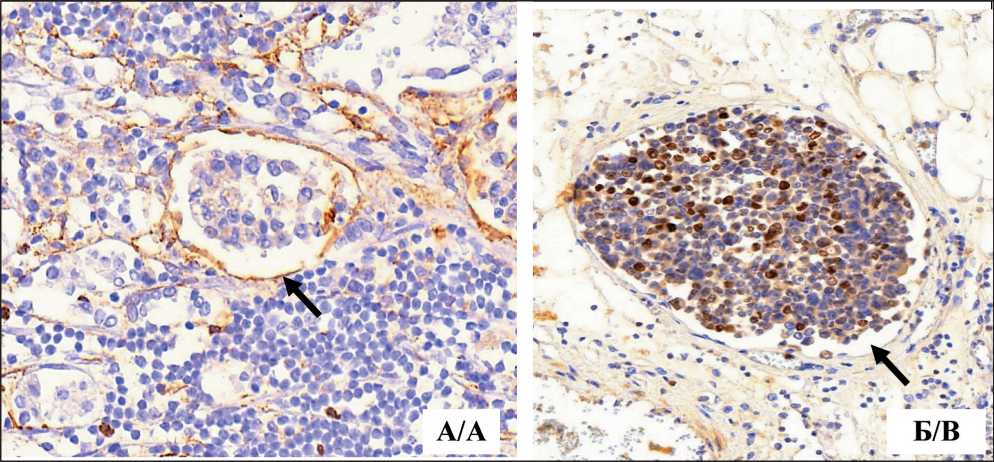
Рис. 5. Микрофото. Иммуногистохимическое исследование: А – позитивная экспрессия Podoplanin (Clone D2-40) в эндотелии лимфатических сосудов, содержащих опухолевые эмболы (черная стрелка), ×400; Б – позитивная экспрессия Ki67 в клетках опухолевого эмбола (черная стрелка), ×200. Примечание: рисунок выполнен авторами
Fig. 5. Microphoto. Immunohistochemical study: A – positive expression of Podoplanin (Clone D2-40) in the endothelium of lymphatic vessels containing tumor emboli (black arrow), ×200; B – positive expression of Ki67 in tumor embolus cells (black arrow), ×200.
Note: created by the authors
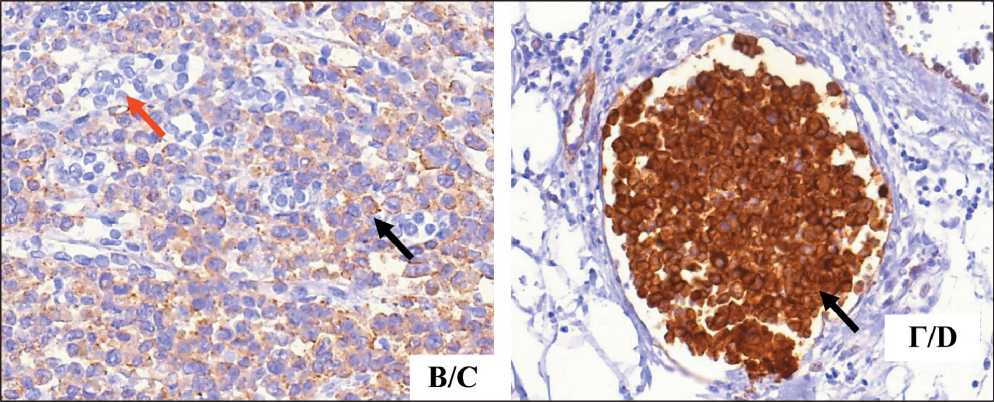
Рис. 6. Микрофото. Иммуногистохимическое исследование: А – гетерогенная экспрессия интегрина α6 в клетках первичной опухоли: позитивная (черная стрелка) и негативная (красная стрелка), ×600; Б – гомогенная позитивная экспрессия интегрина α6 в клетках опухолевого эмбола (черная стрелка), ×400; В – гетерогенная экспрессия интегрина β4 в клетках первичной опухоли: позитивная (черная стрелка) и негативная (красная стрелка), ×600; Г – гомогенная позитивная экспрессия интегрина β4 в клетках опухолевого эмбола (черная стрелка), ×400. Примечание: рисунок выполнен авторами
Fig. 6. Microphoto. Immunohistochemical study: A – heterogeneous expression of α6 integrin in primary tumor cells: positive (black arrow) and negative (red arrow), ×600; B – homogeneous positive expression of α6 integrin in tumor embolus cells (black arrow), ×400; C – heterogeneous expression of β4 integrin in primary tumor cells: positive (black arrow) and negative (red arrow), ×600n; D – homogeneous positive expression of β4 integrin in tumor embolus cells (black arrow), ×400. Note: created by the authors
ческого исследования с применением Anti-Human Podoplanin (Clone D2-40) оказалось, что эмболизи-рованы были лимфатические сосуды. В опухолевых эмболах определялась высокая пролиферативная активность (рис. 5).
Было выполнено исследование экспрессии субъединиц интегринов α6 и β4 в случаях генерализованного канцероматозного лимфангита с массивным метастатическим поражением лимфоузлов разных регионов. Оказалось, что в первичной опухоли действительно наблюдалась гетерогенная экспрессия субъединиц α6 и β4, в то время как в опухолевых эмболах в лимфатических сосудах присутствовала гомогенная позитивная экспрессия – все опухолевые клетки экспрессирова- ли этот маркер (рис. 6). Кроме того, как в клетках первичной опухоли, так и в клетках опухолевых эмболов определялась позитивная гетерогенная экспрессия ламинина ɣ2 (рис. 7).
Заключение
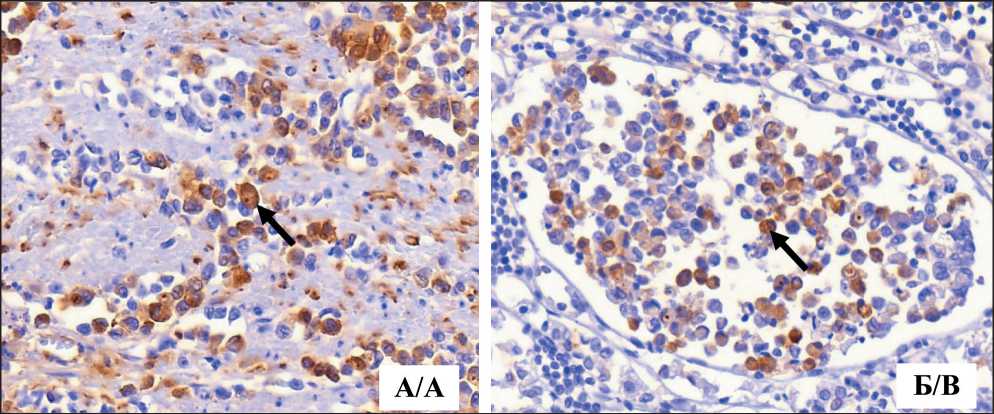
Рис. 7. Микрофото. Иммуногистохимическое исследование: А – позитивная гетерогенная экспрессия ламинина ɣ2 в клетках первичной опухоли (черная стрелка), ×600; Б – позитивная гетерогенная экспрессия ламинина ɣ2 в клетках опухолевого эмбола (черная стрелка), ×400. Примечание: рисунок выполнен авторами
Fig. 7. Microphoto. Immunohistochemical study: A – positive heterogeneous expression of laminin ɣ2 in the cells of the primary tumor (black arrow), ×600; B – positive heterogeneous expression of laminin ɣ2 in tumor embolus cells (black arrow), ×400.
Note: created by the authors
к возникновению желудочного кровотечения. Выраженный периневральный рост обусловливал развитие нарастающего болевого синдрома.
В нашем исследовании дискогезивные клетки опухолевых эмболов в лимфатических сосудах ин- тенсивно экспрессировали субъединицы интегринов a6 и b4, а также ламинин – лиганд гетеродимера α6β4. Эти факты позволяют нам предположить, что существенным звеном развития канцероматозного лимфангита может быть приобретение опухолевыми клетками способности к «якорь-независимому» существованию и сниженной способности клеток опухоли к адгезии, которые обусловлены экспрессией интегрина α6β4. Способность интегрина α6β4 предотвращать развитие апоптоза (аноикиса) опухолевых клеток, открепившихся от базальной мембраны, описана в литературе [12]. С фундаментальной точки зрения этот случай открывает перспективы для изучения механизма, запускающего каскад процессов, реализующихся генерализованным лимфогенным метастазированием. Знание этого механизма поможет контролировать течение опухолевого процесса, оптимизировать терапевтические стратегии у данной категории онкологических больных.


