Генетическая модификация половых клеток петухов с использованием различных методических подходов
Автор: Ветох А.Н., Волкова Л.А., Иолчиев Б.С., Томгорова Е.К., Волкова Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Современные достижения и проблемы генетики и биотехнологии в животноводстве
Статья в выпуске: 2 т.55, 2020 года.
Бесплатный доступ
Половые клетки гонад самцов сельскохозяйственной птицы рассматриваются в качестве перспективных клеток-мишеней для введения рекомбинантной ДНК с целью направленного внесения модификаций их генома. Наибольший интерес представляет модификация предшественников половых клеток и ранних половых клеток - примордиальных зародышевый клеток (ПЗК) и сперматогониев. В случае их трансплантации и успешной колонизации в гонадах реципиентов возможно получение значительной популяции трансформированных зрелых половых клеток (спермиев), которые могут быть использованы для осеменения самок и получения потомства с внесенными генетическими модификациями. Новизна настоящего исследования заключалась в разработке и оптимизации отдельных этапов локальной трансформации сперматогенных клеток петухов посредством трансфекции ПЗК эмбрионов и сперматогогенных клеток семенников на ранних стадиях дифференцировки. Нашей целью была оценка эффективности генетической трансформации половых клеток петухов с использованием различных методических подходов. Исследования выполняли на курах ( Gallus gallus domesticus ) породы русская белая. Примордиальные зародышевые клетки выделяли из 6-суточных эмбрионов. Трансформацию полученной культуры ПЗК осуществляли посредством электропорации с применением системы Neon («Thermo Fisher Scientific», США). Для трансфекции использовали плазмиду ZsGreen1-N1 («Addgene», США) с геном ZsGreen под CMV промотором. Трансформированные клетки в количестве 400, 700 и 1000 вводили в дорсальную аорту 2,5-суточных эмбрионов. Эмбрионам контрольной группы в дорсальную аорту вводили ростовую среду DMEM. Трансформацию сперматогенных клеток петухов in vivo осуществляли посредством введения лентивирусного вектора непосредственно в семенники однократно в возрасте 3 или 4 мес и двукратно - в 3 и 4 мес. Вирусный препарат в концентрации 1´107 КОЕ/мл вводили из расчета 0,5 мл на семенник. Лентивирусный вектор содержал репортерный ген ZsGreen под CMV промотором. Для оценки эффективности колонизации и развития донорских примордиальных зародышевых клеток в гонадах реципиентов, а также результативности трансформации сперматогенных клеток in vivo были получены и проанализированы гистологические срезы семенников опытных самцов. В качестве контроля использовали нетрансгенных петухов, подобранных по принципу аналогов (возраст, порода). Для оценки возможности получения трансгенного потомства отбирали петухов с донорскими (введение в эмбрионы донорских ПЗК) и собственными (введение в семенники вирусного препарата) трансформированными половыми клетками, которых далее использовали для осеменения самок. Оценивали оплодотворяющую способность семени опытных петухов и долю эмбрионов с экспрессией гена ZsGreen . Эффективность трансформации клеток-мишеней определяли по экспрессии репортерного гена ZsGreen с использованием микроскопа Nikon Ni-U («Nikon», Япония). Культура эмбриональных клеток кур, полученная на первом этапе эксперимента, состояла из нескольких типов клеток. Доля ПЗК не превышала 3 %. Посредством разделения разных типов эмбриональных клеток по адгезии удалось повысить количество ПЗК в клеточной суспензии до 81 %. Эффективность трансформации клеточной культуры ПЗК составила 12 %. Наличие флуоресцирующих сперматогенных клеток в канальцах семенников было установлено при введении как трансформированных донорских ПЗК, так и лентивирусного вектора. При введении донорских ПЗК в концентрации 400, 700 и 1000 клеток на эмбрион доля цыплят с трансформированными половыми клетками составила соответственно 16, 23 и 26 %. Наибольшая результативность трансформации сперматогенных клеток семенников in vivo была установлена при двукратном введении вирусного препарата в возрасте 3 и 4 мес - 10 %. При однократном введении вирусного препарата этот показатель был 2 раза ниже. Результативность получения трансгенного потомства от особей с трансформированными половыми клетками составила 6
Петухи, эмбрионы, примордиальные зародышевые клетки, сперматогенные клетки, лентивирусный вектор, трансгенез
Короткий адрес: https://sciup.org/142226297
IDR: 142226297 | УДК: 636.52/.58:575.2.084:577.21:57.086.86 | DOI: 10.15389/agrobiology.2020.2.306rus
Текст научной статьи Генетическая модификация половых клеток петухов с использованием различных методических подходов
Использование клеток гонад самцов в качестве клеток-мишеней для адресной доставки рекомбинантной ДНК — один из приемов получения генетически модифицированных особей (1, 2). Перспективность этого направления связана прежде всего с развитием метода искусственного осеменения, что значительно расширяет возможности получения необходимой популяции особей с желательными признаками с использованием генетически модифицированного семени. Кроме того, генетическая трансформация половых клеток самцов позволяет целенаправленно воздействовать на конкретные клетки-мишени, снижая риски, связанные с появлением трансгенных особей-мозаиков, от которых в дальнейшем невозможно получить трансгенное потомство. Для генетической трансформации половых клеток самцов сельскохозяйственной птицы в качестве клеток-мишеней могут быть использованы примордиальные зародышевые клетки (ПЗК) — предшественники половых клеток (3, 4), ранние малодифференцированные половые клетки — сперматогонии (5, 6) и зрелые половые клетки — спермии (7).
Наиболее результативно с точки зрения получения трансгенных и химерных особей использование первичных и ранних половых клеток — ПЗК и сперматогониев, поскольку при дальнейшем развитии в процессе дифференцировки они могут сформировать значительную популяцию трансформированных зрелых половых клеток (8, 9). Возможность культивирования зародышевых и сперматогенных клеток птицы в культуре in vitro расширяет число методических приемов по введению рекомбинантной ДНК в клетки-мишени с использованием различных систем доставки генов, таких как липосомальная трансфекция (10), электропорация (11, 12), использование транспозонов (13), катионных полимеров (14), лентивирус-ных (15) и ретровирусных векторов (16, 17).
Использование ПЗК и сперматогониев в качестве донорских клеток предполагает их выделение, трансформацию и трансплантацию в гонады реципиентов с последующим получением потомства с внесенными признаками. Результативность колонизации донорских половых клеток при их трансплантации в гонады самцов-реципиентов первоначально показали на лабораторных животных (18, 19). В последующем был опубликован ряд работ по эффективности трансплантации донорских половых клеток у различных видов сельскохозяйственных животных, в частности свиней (20, 21), овец (22), коз (23), быков (24). Для сельскохозяйственной птицы работы были выполнены на петухах (25, 26) и перепелах (27).
Новизна настоящего исследования заключалась в разработке и оптимизации отдельных этапов локальной трансформации сперматогенных клеток петухов посредством трансфекции ПЗК эмбрионов и сперматого-генных клеток семенников на ранних стадиях дифференцировки.
Нашей целью была оценка эффективности генетической трансформации половых клеток петухов с использованием различных методических подходов.
Методика . Объектом исследований служили куры ( Gallus gallus do-mesticus ) породы русская белая. Примордиальные зародышевые клетки выделяли из 6-суточных эмбрионов. Диссоциацию эмбрионов проводили посредством последовательной механической и ферментативной обработки 0,05 % раствором трипсина. Полученную суспензию эмбриональных клеток переносили в чашки Петри и культивировали в ростовой среде DMEM (минимальная среда Игла в модификации Дюльбеко) («Thermo Fisher Scientific», США) с высоким содержанием глюкозы (4,5 г/л) с добавлением сыворотки плода коровы (10 %), глутамина (2 мМ), 2-меркаптоэтанола (10 - 6 мМ) и антибиотика гентамицина (50 мкг/мл).
Трансформацию полученной культуры ПЗК осуществляли посредством электропорации с применением системы Neon («Thermo Fisher Scientific», США). Для трансфекции использовали плазмиду ZsGreen1-N1 («Addgene», США) с геном ZsGreen под CMV промотором. Трансформированные клетки в количестве 400, 700 и 1000 (соответственно I, II и III опытные группы) вводили в дорсальную аорту 2,5-суточных эмбрионов, которые инкубировали до вылупления (RCOM Maru 190 Deluxe MAX, «Rcom», Южная Корея). В возрасте 1,5-2 мес от полученной птицы при убое отбирали образцы тканей репродуктивных органов для оценки эффективности трансформации половых клеток. Эмбрионам контрольной группы в дорсальную аорту вводили ростовую среду DMEM.
Трансформацию сперматогенных клеток петухов in vivo осуществляли посредством введения лентивирусного вектора (вирусного препарата) непосредственно в семенники однократно в возрасте 3 (I группа) или 4 мес (II группа) и 2-кратно в 3 и 4 мес (III группа). Вирусный препарат в концентрации 1½107 КОЕ/мл вводили из расчета 0,5 мл на семенник. Лен-тивирусный вектор содержал репортерный ген ZsGreen под CMV промотором. По достижении половозрелости от самцов отбирали образцы тканей семенника. Контролем служили нетрансгенные петухи, подобранные по принципу аналогов (возраст, порода). Гистологические срезы готовили на криостате Shandon Cryotome E («Thermo Fisher Scientific», США).
Для оценки возможности получения трансгенного потомства были отобраны петухи с донорскими (I группа, введение в эмбрионы донорских ПЗК) и собственными (II группа, введение в семенники вирусного препарата) трансформированными половыми клетками, которых использовали для осеменения самок. Оценивали оплодотворяющую способность семени опытных петухов и долю эмбрионов с экспрессией гена ZsGreen .
Эффективность трансформации клеток-мишеней определяли по экспрессии репортерного гена ZsGreen . Анализ и обработку цитологических и гистологических препаратов проводили с использованием микроскопа Nikon Ni-U в комплекте с программой обработки изображений NIS-Elements («Nikon», Япония).
Статистическую обработку данных осуществляли с помощью пакета для анализа данных Microsoft Excel 2016 ( t -test). В таблицах представлены средние арифметические значения ( M ) и ошибки средних (±SEM). Различия считали статистически значимыми при р < 0,01.
Результаты. На первом этапе получали культуру эмбриональных клеток кур, которая состояла из нескольких типов клеток. Основную часть составляли фибробласты. Доля ПЗК не превышала 3 %. Посредством разделения разных типов эмбриональных клеток по адгезии удалось повысить процент ПЗК в клеточной суспензии до 81 % (рис. 1, А, Б). Эту клеточную культуру использовали в дальнейшем для введения рекомбинантной ДНК. Эффективность трансформации клеточной культуры ПЗК составила 12 %. Она была использована в качестве донорских клеток для введения в эмбрионы (см. рис. 1, В, Г).
Культуру трансформированных донорских ПЗК в различной концентрации вводили в дорсальную аорту 2,5-суточных эмбрионов-реципиентов (всего 152 эмбриона). При этом количество введенных донорских клеток не оказывало существенного влияния на дальнейшее развитие эмбрионов. Доля развившихся эмбрионов варьировала в опытных группах от 78 до 85 %. В контрольной группе показатель составил 83 %. В опытных группах остановка в развитии эмбрионов отмечалась преимущественно на 308
6-10-е сут и в конце инкубации, в контрольной группе — в конце инкубации. Повышенная эмбриональная смертность в опытных группах в ранний период эмбриогенеза может быть связана с проводимыми генно-инженерными манипуляциями.
А Б
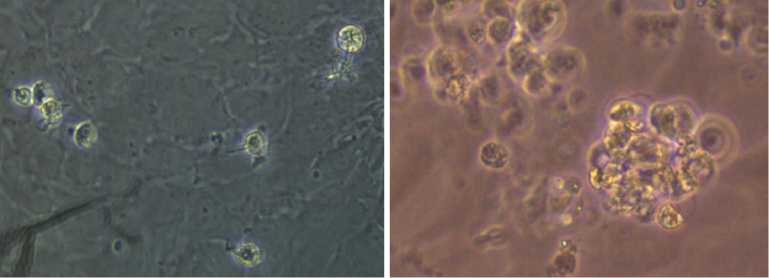
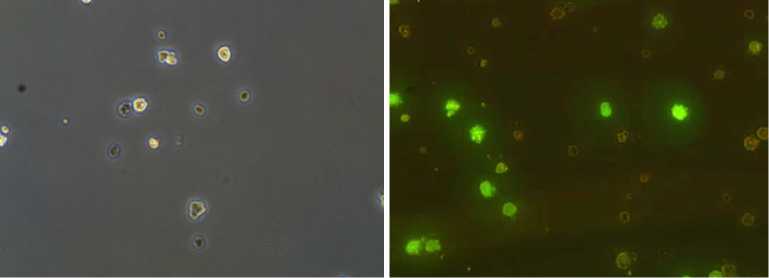
Рис. 1. Культура примордиальных зародышевых клеток кур (порода русская белая): А — 2-е сут культивирования, Б — 7-е сут культивирования (формируются колонии примордиальных зародышевых клеток, ПЗК), В — нативная суспензия ПЗК до трансформации, Г — суспензия ПЗК после трансформации (трансформированные клетки флуоресцируют). Световая микроскопия, фазовый контраст (А-В); флуоресцентная микроскопия (Г) (увеличение ½400, микроскоп Nikon Ni-U, «Nikon», Япония).
А Б
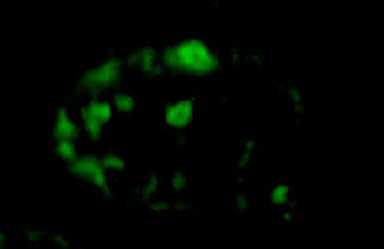
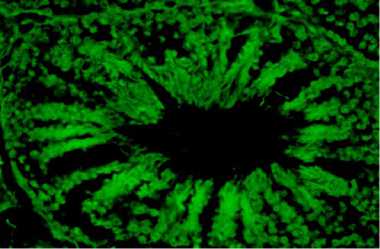
Рис. 2. Экспрессия гена ZsGreen в клетках гонад петухов (порода русская белая) в зависимости от возраста: А — 1,5 мес (введение трансформированных примордиальных зародышевых клеток эмбрионам-реципиентам, 400 клеток), Б — 9 мес (введение вирусного препарата в семенники in vivo, 700 клеток). Внутри семенных канальцев семенников видны флуоресцирующие сперматогенные клетки на разных стадиях дифференцировки (А, Б), в том числе сперматозоиды в просвете трансформированнного канальца (Б). Флуоресцентная микроскопия (А — увеличение ½400, Б — увеличение ½160, микроскоп Nikon Ni-U, «Nikon», Япония).
Эффективность колонизации и развития донорских ПЗК в гонадах реципиентов изучали у птицы в возрасте 1,5-2 мес. У исследованных осо- бей было установлено наличие флуоресцирующих сперматогенных клеток в семенных канальцах семенников (рис. 2, А). Доля цыплят с трансформированными половыми клетками в опытных группах варьировала в зависимости от концентрации вводимых донорских клеток. При введении ПЗК эмбрионам-реципиентам в количестве 400 клеток (I группа) этот показатель составил 16 %. При увеличении дозы до 700 (II группа) и 1000 клеток (III группа) эффективность трансгенеза достигала соответственно 23 и 26 % (табл. 1).
1. Эффективность введения донорских примордиальных зародышевых клеток (ПЗК) в дорсальную аорту эмбрионов-реципиентов (куры породы русская белая) в зависимости от количества ПЗК
|
Показатель |
1 Контроль |
I группа |
II группа |
III группа |
|
Проколото эмбрионов, n |
30 |
50 |
52 |
50 |
|
Введено донорских клеток, n |
400 |
700 |
1000 |
|
|
Развилось эмбрионов, n (%) Получено цыплят: |
25 (83) |
40 (80) |
44 (85) |
39 (78) |
|
всего, n (%) в том числе с трансформирован- |
18 (60) |
31 (62) |
33 (63) |
29 (58) |
|
ными половыми клетками, n |
8 |
12 |
13 |
|
|
Эффективность трансгенеза, % |
16 |
23 |
26 |
П р и м еч а ни е. Описание групп см. в разделе «Методика». Эффективность трансгенеза — отношение числа полученных особей с трансформированными половыми клетками к общему числу проинъеци-рованных эмбрионов.
Наряду с оптимизацией отдельных этапов получения трансгенной птицы посредством трансплантации донорских ПЗК была разработана технология трансформации сперматогенных клеток семенника петухов in vivo с целью генетической модификации половых клеток (спермиев). Эффективность трансформации сперматогенных клеток семенников зависела от схемы введения вирусного препарата (см. рис. 2, Б, табл. 2). При его введении в семенники опытных петухов в возрасте 3 мес (I группа) процент семенных канальцев с трансформированными сперматогенными клетками варьировал от 3 до 8 % и составил в среднем по группе 5,8±0,4 %. Введение лентивирусного вектора в возрасте 4 мес (II группа) оказалось менее эффективным. В этом случае эффективность трансформации клеток-мишеней была ниже по сравнению с аналогичным показателем для I группы и не превышала 4,0±0,6 %. Вместе с тем 2-кратное введение в семенники петухов вирусного препарата (III группа) способствовало повышению эффективности трансформации сперматогенных клеток по сравнению с показателем, установленным для I и II опытных групп, соответственно в 1,7 и 2,4 раза (p < 0,01).
2. Эффективность генетической трансформации сперматогенных клеток семенников петухов (порода русская белая) in vivo в зависимости от времени введения лентивирусного вектора ( M ±SEM)
|
Показатель |
I группа |
II группа |
III группа |
|
Число самцов, n |
5 |
5 |
5 |
|
Срок введения вирусного препарата в семенники, мес Общее число исследованных семенных канальцев от |
3 |
4 |
3 и 4 |
|
одного самца, n Число семенных канальцев с трансформированными |
201±1 |
252±13 |
257±24 |
|
сперматогенными клетками, n |
12±1 |
10±1 |
24±2 a, c; b, c |
|
Эффективность трансгенеза, % |
5,8±0,4 |
4,0±0,6 |
9,6±0,8 a, c; b, c |
П р и м еч а ни е. Описание групп см. в разделе «Методика». Эффективность трансгенеза — отношение числа семенных канальцев с трансформированными сперматогенными клетками к общему числу исследованных семенных канальцев.
a, с Различия между I и III группами статистически значимы при p < 0,01.
b, с Различия между II и III группами статистически значимы при p < 0,01.
При оценке возможности получения трансгенного потомства у трансгенных петухов наблюдалось незначительное снижение процента живых спермиев по сравнению с нетрансгенными аналогами (табл. 3). Различия по этому показателю между опытными и контрольной группами не превышали 2 %. У петухов опытных групп отмечалось увеличение доли сперматозоидов с анормальной морфологией по сравнению с контролем на 3 %. Наибольшая доля нарушений в морфологии сперматозоидов как в контрольной, так и опытных группах наблюдалась в области жгутика.
Оплодотворяющая способность семени у петухов из опытных групп была на 5-6 % ниже по сравнению с контролем. При этом экспрессия ре-портерного гена ZsGreen была установлена у 10 % эмбрионов в I группе и 6 % эмбрионов — во II группе.
3. Качественные показатели и оплодотворяющая способность семени нетрансгенных и трансгенных петухов (порода русская белая), полученных посредством трансплантации донорских примордиальных зародышевых клеток и трансформации сперматогенных клеток in vivo ( M ±SEM)
|
Показатель |
Контроль |
I группа |
1 II группа |
|
Подвижность сперматозоидов, % |
84±1 |
82±1 |
82±2 |
|
Доля живых сперматозоидов, % |
88±1 |
87±2 |
86±2 |
|
Доля сперматозоидов с анормальной морфологией, % |
7±1 |
9±1 |
10±1 |
|
Оплодотворяющая способность семени: |
|||
|
заложено яиц на инкубацию, шт. |
50 |
50 |
50 |
|
развилось эмбрионов до 6 сут инкубации, n (%) |
43 (86) |
41 (80) |
42 (81) |
|
Число эмбрионов с экспрессией ZsGreen , n (%) |
5 (10) |
3 (6) |
|
|
П р и м е ч а н и е. Описание групп см. в разделе «Методика» |
. |
Результативность трансформации ПЗК и сперматогенных клеток показана с помощью различных методических подходов. В работе J. Macdonald с соавт. (13) сообщается о трансфекции ПЗК кур с использованием транспозонов piggyBac и Tol2 с эффективностью соответственно 5,4 и 25,5 %. D. Sawicka с соавт. (29) и S.G. Tyack с соавт. (10) предложили эффективный метод трансфекции ПЗК кур с помощью транспозонных векторов в сочетании с липофекцией. M. Naito с соавт. (28) получили и трансформировали посредством нуклеофекции культуру ПЗК кур с эффективностью 10 %. Трансформированную культуру ПЗК ввели эмбрионам-реципиентам. От выведенной после этих манипуляций птицы было получено потомство. Наличие репортерного белка GFP (green fluorescent protein) установили у 1 из 270 полученных особей. Эти данные согласуются с нашими результатами: эффективность трансформации ПЗК кур методом электропорации в наших опытах достигала 12 %.
В работах S. Min с соавт. (30) и B. Li с соавт. (14) показана возможность использования катионного полимера SofastTM для трансформации сперматогенных клеток петухов in vivo посредством инъекции этого препарата в комплексе с генетической конструкцией непосредственно в паренхиму семенника. S. Min с соавт. (30) проводили исследования по получению кур, устойчивых к вирусу птичьего гриппа. Эффективность трансформации сперматогенных клеток при этом составила 72,2 %. Наличие трансгена было установлено в 10 % сперматозоидов и в крови у 7,8 % полученного потомства F1. В экспериментах B. Li с соавт. (14) результативность трансформации сперматогенных клеток не превышала 12-19 %.
В наших исследованиях для трансформации сперматогенных клеток семенников петухов in vivo мы использовали лентивирусный вектор, содержащий репортерный ген ZsGreen. Экспрессию репортерного гена отмечали в 10 % сперматогенных клеток петухов после инъекции вирусного препарата и у 6 % эмбрионов, резвившихся после осеменения самок семе- нем этих самцов.
Таким образом, подтверждена перспективность использования предшественников половых клеток самцов (примордиальных зародышевых клеток и сперматогониев) в качестве мишеней для введения рекомбинантной ДНК и получения генетически модифицированных половых клеток в гонадах самцов-реципиентов с целью последующего использования их семени для получения трансгенного потомства с определенными признаками. Наиболее высокая результативность трансгенеза установлена при введении трансформированных донорских примордиальных зародышевых клеток (ПЗК) эмбрионам-реципиентам в концентрации 1000 клеток на эмбрион: доля цыплят с трансформированными половыми клетками достигала 26 %. При использовании ПЗК в концентрации 400 и 700 клеток на эмбрион этот показатель оказался ниже соответственно на 3 и 10 %. Высокую эффективность трансформации сперматогенных клеток семенников in vivo отмечали при 2-кратном введении вирусного препарата петушкам в возрасте 3 и 4 мес — 10 %, что было в 2 раза выше по сравнению с однократным введением лентивирусного вектора. Результативность получения трансгенного потомства от особей с трансформированными половыми клетками составила 6-10 %.
Список литературы Генетическая модификация половых клеток петухов с использованием различных методических подходов
- Olive V., Cuzin F. The spermatogonial stem cell: from basic knowledge to transgenic technology. The International Journal of Biochemistry & Cell Biology, 2005, 37(2): 246-250 ( ). DOI: 10.1016/j.biocel.2004.07.017
- Han J.Y. Germ cells and transgenesis in chickens. Comparative Immunology, Microbiology and Infectious Diseases, 2009, 32(2): 61-80 ( ). DOI: 10.1016/j.cimid.2007.11.010
- Chojnacka-Puchta L., Kasperczyk K., Płucienniczak G., Sawicka D., Bednarczyk M. Primordial germ cells (PGCs) as a tool for creating transgenic chickens. Polish Journal of Veterinary Sciences, 2012, 15(1): 181-188 ( ). DOI: 10.2478/v10181-011-0132-6
- Macdonald J., Glover J.D., Taylor L., Sang H.M., McGrew M.J. Characterisation and germline transmission of cultured avian primordial germ cells. PLoS ONE, 2010, 5(11): e15518 ( ). DOI: 10.1371/journal.pone.0015518
- Zheng Y., Zhang Y., Qu R., He Y., Tian X., Zeng W. Spermatogonial stem cells from domestic animals: progress and prospects. Reproduction, 2014, 147(3): 65-74 ( ). DOI: 10.1530/REP-13-0466
- Li B., Sun G., Sun H., Xu Q., Gao B., Zhou G., Zhao W., Wu X., Bao W., Yu F., Wang K., Chen G. Efficient generation of transgenic chickens using the SSCs in vivo and ex vivo transfection. Science China Series C: Life Sciences, 2008, 51: 734-742 ( ).
- DOI: 10.1007/s11427-008-0100-2
- Cooper C.A., Challagulla A., Jenkins K.A., Wise T.G., O'Neil T.E., Morris K.R., Tizard M.L., Doran T.J. Generation of gene edited birds in one generation using sperm transfection assisted gene editing (STAGE). Transgenic Res., 2017, 26: 331-347 ( ).
- DOI: 10.1007/s11248-016-0003-0
- Takashima S. Biology and manipulation technologies of male germline stem cells in mammals. Reproductive Medicine and Biology, 2018, 17(4): 398-406 ( ).
- DOI: 10.1002/rmb2.12220
- Nakamura Y., Usui F., Miyahara D., Mori T., Ono T., Takeda K., Nirasawa K., Kagami H., Tagami T. Efficient system for preservation and regeneration of genetic resources in chicken: concurrent storage of primordial germ cells and live animals from early embryos of a rare indigenous fowl (Gifujidori). Reproduction, Fertility and Development, 2010, 22(8): 1237-1246 ( ).
- DOI: 10.1071/RD10056
- Tyack S.G., Jenkins K.A., O'Neil T.E., Wise T.G., Morris K.R., Bruce M.P., McLeod S., Wade A.J., McKay J., Moore R.J., Schat K.A., Lowenthal J.W., Doran T.J. A new method for producing transgenic birds via direct in vivo transfection of primordial germ cells. Transgenic Research, 2013, 22(6): 1257-1264 ( ).
- DOI: 10.1007/s11248-013-9727-2
- Yu F., Ding L.-J., Sun G.-B., Sun P.-X., He X.-H., Ni L.-G., Li B.-C. Transgenic sperm produced by electrotransfection and allogeneic transplantation of chicken fetal spermatogonial stem cells. Molecular Reproduction and Development, 2010, 77(4): 340-347 ( ).
- DOI: 10.1002/mrd.21147
- Hong Y.H., Moon Y.K., Jeong D.K., Han J.Y. Improved transfection efficiency of chicken gonadal primordial germ cells for the production of transgenic poultry. Transgenic Research, 1998, 7(4): 247-252 (doi: 10.1023/A:1008861826681).
- Macdonald J., Taylor L., Sherman A., Kawakami K., Takahashi Y., Sang H. M., McGrew M.J. Efficient genetic modification and germ-line transmission of primordial germ cells using piggyBac and Tol2 transposons. Proceedings of the National Academy of Sciences, 2012, 109(23): E1466-E1472 ( ).
- DOI: 10.1073/pnas.1118715109
- Li B., Sun G., Sun H., Xu Q., Gao B., Zhou G., Zhao W., Wu X., Bao W., Yu F., Wang K., Chen G. Efficient generation of transgenic chickens using the spermatogonial stem cells in vivo and ex vivo transfection. Science China Series C: Life Sciences, 2008, 51(8): 734-742 ( ).
- DOI: 10.1007/s11427-008-0100-2
- Scott B.B., Velho T.A., Sim S., Lois C. Applications of avian transgenesis. ILAR Journal, 2010, 51(4): 353-361 ( ).
- DOI: 10.1093/ilar.51.4.353
- Kalina J., Šenigl F., Mičáková A., Mucksová J., Blažková J., Yan H., Poplštein M., Hejnar J., Trefil P. Retrovirus-mediated in vitro gene transfer into chicken male germ line cells. Reproduction, 2007, 134(3): 445-453 ( ).
- DOI: 10.1530/rep-06-0233
- Allioli N., Thomas J.-L., Chebloune Y., Nigon V.-M., Verdier G., Legras C. Use of retroviral vectors to introduce and express the β-galactosidase marker gene in cultured chicken primordial germ cell. Developmental Biology, 1994, 165(1): 30-37 ( ).
- DOI: 10.1006/dbio.1994.1231
- Dobrinski I., Avarbock M.R., Brinster R.L. Germ cell transplantation from large domestic animals into mouse testes. Molecular Reproduction and Development, 2000, 57(3): 270-279 ( :33.0.CO;2-Z).
- DOI: 10.1002/1098-2795(200011)57
- Brinster R.L. Germline stem cell transplantation and transgenesis. Science, 2002, 296(5576): 2174-2176 ( ).
- DOI: 10.1126/science.1071607
- Honaramooz A.1., Megee S.O., Dobrinski I. Germ cell transplantation in pigs. Biology of Reproduction, 2002, 66(1): 21-28 ( ).
- DOI: 10.1095/biolreprod66.1.21
- Kim B.-G., Kim Y.-H., Lee Y.-A., Kim B.-J., Kim K.-J., Jung S.-E., Chung H.-J., Hwang S., Choi S.-H., Kim M.J., Kim D.-H., Kim I.C., Kim M.K., Kim N.-H., Kim C.G., Ryu B.-Y. Production of transgenic spermatozoa by lentiviral transduction and transplantation of porcine spermatogonial stem cells. Tissue Engineering and Regenerative Medicine, 2014, 11(6): 458-466 ( ).
- DOI: 10.1007/s13770-014-0078-8
- Rodriguez-Sosa J.R., Dobson H., Hahnel A. Isolation and transplantation of spermatogonia in sheep. Theriogenology, 2006, 66(9): 2091-2103 ( ).
- DOI: 10.1016/j.theriogenology.2006.03.039
- Honaramooz A., Behboodi E., Megee S.O., Overton S.A., Galantino-Homer H., Echelard Y., Dobrinski I. Fertility and germline transmission of donor haplotype following germ cell transplantation in immunocompetent goats. Biology of Reproduction, 2003, 69(4): 1260-1264 ( ).
- DOI: 10.1095/biolreprod.103.018788
- Oatley J.M. Spermatogonial stem cell biology in the bull: development of isolation, culture, and transplantation methodologies and their potential impacts on cattle production. Bioscientifica Proceedings, 2019, 7 RDRRDR10 ( ).
- DOI: 10.1530/biosciprocs.7.010
- Trefil P., Bakst M.R., Yan H., Hejnar J., Kalina J., Mucksová J. Restoration of spermatogenesis after transplantation of c-Kit positive testicular cells in the fowl. Theriogenology, 2010, 74(9): 1670-1676 ( ).
- DOI: 10.1016/j.theriogenology.2010.07.002
- Benesova B., Mucksova J., Kalina J., Trefil P. Restoration of spermatogenesis in infertile male chickens after transplantation of cryopreserved testicular cells. British Poultry Science, 2014, 55(6): 837-845 ( ).
- DOI: 10.1080/00071668.2014.974506
- Kim Y.M., Park J.S., Yoon J.W., Choi H.J., Park K.J., Ono T., Han J.Y. Production of germline chimeric quails following spermatogonial cell transplantation in busulfan-treated testis. Asian Journal of Andrology, 2018, 20(4): 414-416 ( ).
- DOI: 10.4103/aja.aja_79_17
- Naito M., Harumi T., Kuwana T. Long term in vitro culture of chicken primordial germ cells isolated from embryonic blood and incorporation into germline of recipient embryo. The Journal of Poultry Science, 2010, 47(1): 57-64 ( ).
- DOI: 10.2141/jpsa.009058
- Sawicka D., Chojnacka-Puchta L. Effective transfection of chicken primordial germ cells (PGCs) using transposon vectors and lipofection. Folia Biologica, 2019, 67(1): 45-52 ( ).
- DOI: 10.3409/fb_67-1.04
- Min S., Qing S.Q., Hui Y.Y., Zhi F.D., Rong Q.Y., Feng X., Chun L.B. Generation of antiviral transgenic chicken using spermatogonial stem cell transfected in vivo. African Journal of Biotechnology, 2011, 10(70): 15678-15683 ( ).
- DOI: 10.5897/AJB11.040


