Генетические биологические маркеры глиальных опухолей головного мозга: мутации в генах изоцитратдегидрогеназ 1 и 2
Автор: Прокудин Михаил Юрьевич, Мартынов Борис Владимирович, Свистов Дмитрий Владимирович, Литвиненко Игорь Вячеславович, Имянитов Евгений Наумович, Чирский Вадим Семенович, Бушуров Станислав Евгеньевич, Яковенко Андрей Игоревич, Чемодакова Ксения Андреевна, Клиценко Ольга Анатольевна, Горустович Ольга Андреевна, Медведева Галина Федоровна, Булатов Альберт Ренатович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Актуальность. Мутации в генах изоцитратдегидрогеназ 1 и 2 (IDH1 и IDH2) относятся к «драйверным» генетическим событиям при глиомах. Их частота достигает 70-80 % в глиомах низкой степени злокачественности и во вторичных глиобластомах, а онкогенный эффект реализуется путем избыточного накопления метаболита 2-гидроксиглутарата, нарушающего нормальные процессы метилирования ДНК и белков в клетках. Цель исследования - проанализировать ассоциации между наличием мутаций IDH1/2 и важнейшими клинико-морфологическими параметрами глиальных опухолей. Материал и методы. В исследование вошло 147 пациентов с глиальными опухолями головного мозга. Была изучена связь мутаций IDH1/2 с гистологическим типом, возрастом начала заболевания, локализацией опухоли, клиническими проявлениями глиом. Результаты. Установлено, что для содержащих мутации IDH1/2 глиом характерен более молодой возраст установки диагноза (39,5 лет) по сравнению с IDH-негативными случаями (47,2 года) (p
Эпилепсия, приступ, мутации idh1/2, глиомы, глиобластома, анапластическая астроцитома, диффузная астроцитома, опухоли головного мозга
Короткий адрес: https://sciup.org/140254367
IDR: 140254367 | УДК: 616.831-006.494:575.224.22 | DOI: 10.21294/1814-4861-2020-19-4-59-66
Текст научной статьи Генетические биологические маркеры глиальных опухолей головного мозга: мутации в генах изоцитратдегидрогеназ 1 и 2
В настоящее время во всем мире отмечается рост заболеваемости опухолями ЦНС, которая, по данным CBTRUS за 2010–14 гг., в возрасте от 15 до 39 лет составляет 10,94 на 100 тыс. населения в год, в возрасте старше 40 лет – 40,82 на 100 тыс. населения. Смертность в возрастной группе 15–39 лет составляет 0,94 на 100 тыс., старше 40 лет – 8,94 на 100 тыс. населения [1]. Глиомы представляют собой наиболее распространенную первичную опухоль головного мозга, а различные гистологические подтипы отличаются по спектру агрессивности и ответу на терапевтическое воздействие. При этом влияние прогностических факторов на исход более значимо, чем какие-либо минимальные изменения в лечебном воздействии. К клиническим факторам, оказывающим наиболь- шее влияние на исход лечения, относятся возраст пациента, гистологический тип опухоли и общее состояние больного перед операцией [2–5]. Также было показано, что наличие судорожного синдрома в предоперационном периоде у пациентов с глиомами различной степени злокачественности связано с лучшими показателями выживаемости [6–8].
Помимо клинических факторов, существенное влияние на исход заболевания оказывают молекулярно-генетические характеристики опухолей. К наиболее значимым для глиом генетическим нарушениям относятся мутации в генах изоцитратдегидрогеназ 1 и 2 (IDH1 и IDH2), определение которых необходимо для уточнения диагноза в соответствии с обновленной классификацией опухолей мозга ВОЗ [9]. Установлено, что мутации
IDH1/2 встречаются с высокой частотой (70–80 %) при глиомах низкой степени злокачественности [10] и вторичных глиобластомах и ассоциированы с хорошим прогнозом.
Целью исследования явилась оценка связи между клиническими прогностическими факторами и мутациями IDH1/2 при глиомах.
Материал и методы
В исследование были включены 147 пациентов с глиальными опухолями головного мозга, находившихся на лечении в клинике нейрохирургии и нервных болезней Военно-медицинской академии в период с 2014 по 2017 г. Критериями включения являлись: возраст от 18 лет, опухоли головного мозга, гистологическая характеристика которых соответствует диффузным астроцитарным и олигодендроглиальным опухолям, другим астроцитарным опухолям. Средний возраст начала заболевания составил 43,77 ± 14,91 года. В исследование вошли 76 мужчин (51,70 %) и 71 (48,3 %) женщина. Всем больным было выполнено иссле- дование частых мутаций в генах IDH1 (экзон 4) и IDH2 (экзон 4) в опухолевой ткани посредством высокоразрешающего анализа кривых плавления ПЦР-продуктов и секвенирования.
Статистический анализ выполнялся c использованием программы STATISTICA for Windows (версия 10). Сравнение количественных параметров (возраст) осуществлялось с помощью критериев Манна – Уитни, медианного χ 2 и модуля ANOVA. Сопоставление частотных характеристик качественных показателей (локализация, гистология, степень злокачественность, факт наличия эпилептических приступов) проводили с помощью непараметрических методов χ 2, χ 2 с поправкой Йетса (для малых групп), критерия Фишера. Принципиально важное для оценки наличия мутации IDH1/2 пороговое значение возраста получено с помощью метода построения классификационных деревьев. Анализ выживаемости и длительности безрецидивного периода на основе цензурированных наблюдений проводили с использованием метода Каплана – Мейера.
таблица 1/table 1
клинико-морфологические параметры опухолей головного мозга в зависимости от наличия мутаций в генах idh1/2
association of clinical/morphological parameters of brain tumors with idh1/2 mutations
|
Характеристика/Characteristics |
Опухоли без мутации/ Tumors having no mutations in IDH1/2 (n=82) |
Опухоли с мутацией/ Tumors with mutations IDH1/2 (n=65) |
Результат сравнения групп/ Statistical difference |
|
Средний возраст/Mean age |
47,2 ± 15,0 |
39,5 ± 13,8 |
p<0,01 |
|
Гистологический тип/Histological type |
|||
|
Субэпендимарная астроцитома (n=1)/ Subependymal astrocytoma (n=1) |
1 (100 %) |
0 (0 %) |
|
|
Диффузная астроцитома (n=40)/ Diffuse astrocytoma (n=40) |
28 (70,0 %) |
12 (30,0 %) |
|
|
Олигодендроглиома(n=22)/ Oligodendroglioma (n=22) |
0 (0 %) |
22 (100 %) |
p<0,001* |
|
Анапластическая астроцитома (n=36)/ Anaplastic astrocytoma (n=36) |
18 (50,0 %) |
18 (50,0 %) |
|
|
Глиобластома (n=48)/ Glioblastoma (n=48) |
35 (72,9 %) |
13 (27,1 %) |
|
|
Степень злокачественности/Differentiation grade |
|||
|
Grade I (n=1) |
1 (100 %) |
0 (0 %) |
|
|
Grade II (n=51) |
28 (54,9 %) |
23 (45,1 %) |
|
|
Grade III (n=47) |
18 (38,3 %) |
29 (61,7 %) |
p<0,01** |
|
Grade IV (n=48) |
35 (72,9 %) |
13 (27,1 %) |
|
|
Пол/Sex |
|||
|
Мужской/Male (n=76) |
43 (56,6 %) |
33 (43,4 %) |
|
|
Женский /Female (n=71) |
39 (54,9 %) |
32 (45,1 %) |
p>0,05 |
|
Наличие эпилептических приступов/Presence of epileptic seizures |
|||
|
Да/Yes (n=84) |
39 (46,4 %) |
45 (53,6 %) |
|
|
Нет/No (n=62) |
42 (67,7 %) |
20 (32,3 %) |
p<0,05 |
|
Продолжительность жизни, grade III/ Life span, grade III (n=46) |
n=18 |
n=28 |
|
|
Медиана, сут/Medium, days |
476 |
678,6 |
p>0,05 |
|
Длительность безрецидивного периода, grade III/Disesae-free time, grade III (n=46) |
|||
|
Медиана, сут/Medium, days |
243,2 |
678,2 |
p>0,05 |
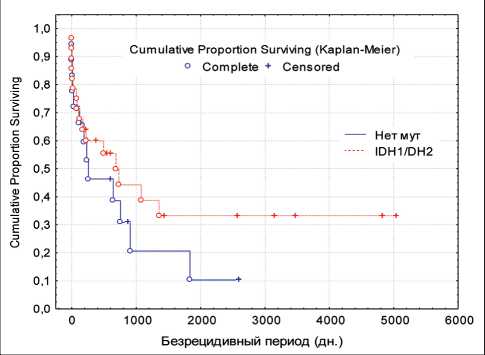
Рис. 1. Длительность безрецидивного периода у больных с глиальными опухолями головного мозга (grade III) с наличием и отсутствием мутации IDH1/2
Fig. 1. Disease-free time in patients with grade III brain tumors with or without IDH1/2 mutations
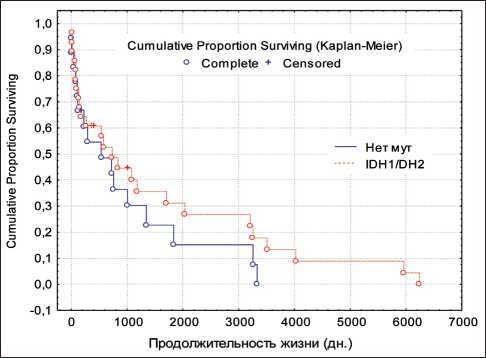
Рис. 2. Продолжительность жизни у больных с глиальными опухолями головного мозга (grade III) с наличием и отсутствием мутации IDH1/2
Fig. 2. Survival of patients with brain tumors (grade III) with or without IDH1/2 mutations
Результаты
Основные характеристики включённых в исследование пациентов и выявленные ассоциации представлены в табл. 1. В анализируемую группу вошли 1 (0,7 %) случай субэпендимарной астроцитомы, 40 (27,2 %) – диффузной астроцитомы, 22 (15 %) – олигодендроглиомы, 36 (24,5 %) – анапластических астроцитом, 48 (32,7 %) – глиобластом. Частота мутаций IDH1/2 во всей выборке составила 65/147 (44,2 %), при этом их встречаемость существенно отличалась при разных гистологических типах опухолей. Чаще всего мутации наблюдались при олигодендроглиомах (100 %) и анапластических астроцитомах (50 %), значительно реже при диффузных астроцитомах (30 %) и глиобластомах (27,1 %) (p<0,001). Низкая частота мутаций IDH1/2 в группе больных с глиобластомами свидетельствует о преобладании в нашей выборке первичных глиобластом.
По степени злокачественности глиом изучаемые случаи распределялись следующим образом: grade I – 1 (0,7 %) пациент, grade II – 51 (34,7 %), grade III – 47 (32 0 %), grade IV – 48 (32,7 %). Мутации IDH1/2 наиболее часто встречались при grade III (61,7 %) и grade II (45,1 %), и реже при grade IV (27,1 %) (p<0,01).
Присутствие мутаций IDH1/2 ассоциировалось с более молодым возрастом установки диагноза: у пациентов с мутациями средний возраст составил 39,5 ± 13,8 года, тогда как в остальных случаях – 47,2 ± 15,0 лет (p<0,01). Для определения порогового значения возраста, с наибольшей достоверностью разграничивающего случаи с наличием и отсутствием мутаций IDH1/2, был применен логико-структурный анализ методом построения классификационных деревьев. При его использовании было получено пороговое значение, соот- ветствующее 39 годам. В группе больных моложе 39 лет мутации IDH1/2 выявлялись достоверно чаще (63,2 %, n=36) в сравнении с группой больных 39 лет и старше (32,2 %, n=29) (p<0,001, отношение шансов (Odds Ratio, OR) составило 3,6 (95 % ДИ 1.87.2).
Генетические повреждения IDH1/2 ассоциировались с локализацией опухоли в лобной и теменной долях головного мозга (табл. 2). Их частота в глиомах лобной и теменной доли составила 39/73 (53,4 %) и 19/31 (61,3 %) соответственно, что оказалось значительно выше, чем в глиомах без вовлечения этих областей, – 26/74 (35,1%) и 46/116 (39,7%) соответственно, p<0,05 для обоих сравнений. Схожие результаты были представлены в работе F. Stockhammer et al. [10], в которой выявлена связь между мутацией в генах, кодирующих изоцитратдегидрогеназы 1/2, и локализацией опухоли в островковой и лобной долях головного мозга.
Анализ клинических проявлений глиом выявил, что встречаемость эпилептических приступов значительно выше у больных с IDH1/2-позитивными опухолями (45/65, 69,2 %), чем при отсутствии мутации (39/81, 48,2 %) (p<0,05). Эти данные согласуются с результатами предыдущих исследований [11–14]. При сочетании указанных факторов (локализация опухоли в лобной или теменной доле, наличие эпилепсии, возраст моложе 39 лет) частота мутаций IDH1/2 достигла 21/27 (77,8 %) и оказалась намного выше, чем у остальных пациентов (44/119 (37,0 %), OR=5,97, 95 % ДИ: 2,24–15,91, p=0,0003).
Таким образом, исходя из полученных нами данных, при локализации опухоли в лобной или теменной долях головного мозга, возрасте начала заболевания до 39 лет и при наличии в клинической картине эпилептических приступов можно предполагать наличие мутации в генах IDH1/2.
таблица 2/table 2
Частота встречаемости мутаций idh1/2 в зависимости от локализации опухоли в центральной нервной системе frequency of idh1/2 mutations in different lobes of brain tumors
|
Доля головного мозга/ Lobe of the brain |
Наличие мутации IDH1/2/ IDH1/2 mutation |
Достоверность различий/ Statistical significance |
|
|
Вовлечена/ Presence of mutation |
Не вовлечена/ Absence of mutation |
||
|
Лобная доля/Frontal lobe |
53,42 % (39/73) |
35,14 % (26/74) |
p<0,05 |
|
Височная доля/Temporal lobe |
36,21 % (21/58) |
49,44 % (44/89) |
p>0,05 |
|
Теменная доля/Parietal lobe |
61,29 % (19/31) |
39,66 % (46/116) |
p<0,05 |
|
Затылочная доля/Occipital lobe |
14,29 % (1/7) |
45,71 % (64/140) |
p>0,05 |
|
Парацентральная долька/Paracentral lobule |
55,00 % (11/20) |
42,52 % (54/127) |
p>0,05 |
|
Проводящие пути/Pathways |
16,67 % (1/6) |
45,39 % (64/141) |
p>0,05 |
В группе из 46 пациентов с глиомами grade III была выполнена также оценка длительности без-рецидивного периода и общей продолжительности жизни в зависимости от статуса генов IDH1/2. Оба показателя оказались выше у больных с мутациями IDH1/2, хотя различия не были статистически значимыми (рис. 1, 2). Медиана длительности безрецидивного периода в группе пациентов с наличием мутаций составила 678,2 сут, в группе с отсутствием – 243,2 сут. Медиана общей продолжительности жизни у больных с наличием мутаций составила 678,6 сут, с отсутствием таковых – 476,0 сут. Таким образом, качественный анализ показал более благоприятное течение заболевания у больных с глиальными опухолями головного мозга (grade III) с наличием мутации IDH1/2.
Обсуждение
При изучении любого заболевания необходим поиск доступных для анализа клинических и молекулярных маркеров. В случае первичных опухолей головного мозга важным является поиск биологических маркеров, которые отражают не только прогноз, но и характер течения заболевания, в частности эпилептогенез [10, 15, 16].
В ряде исследований показано, что мутации в генах, кодирующих изоцитратдегидрогеназы 1 и 2 типов, играют существенную роль в патогенезе глиом головного мозга. Связанные с ними метаболические нарушения ассоциируются со скоростью прогрессирования опухолей, вторичной трансформацией глиом низкой степени в глиомы высокой степени злокачественности [16], а также с развитием эпилепсии [10]. Изоцитрадегидрогеназа 1 типа является цитоплазматическим ферментом, а также содержится в пероксисомах, в то время как изоцитратдегидрогеназа 2 типа представлена в митохондриях. Функция изоцитратдегидрогеназ заключается в окислительном декарбоксилировании изоцитрата, который превращается в α-кетоглутарат. Наиболее распространённые (>90 % случаев) мутации вызывают замену аргинина (R132) на гистидин в IDH1 и аргинина (R172) на лизин в IDH2 [17]. Эти мутации приводят к снижению уровня нормального метаболита α-кетоглутарата и избыточному накоплению 2-гидроксиглутарата, который рассматривается как онкометаболит [11]. Более того, 2-гидрокси-глутарат схож по своей структуре с глутаматом, что приводит к активации NMDA рецепторов и развитию эпилепсии [10]. По результатам нашего исследования, эпилепсия наблюдалась в 69,2 % (45/65) в группе больных с мутациями IDH1/2. Эти данные хорошо согласуются с рядом работ, в которых также показана связь между мутациями изоцитратдегидрогеназ 1 и 2 и развитием эпилепсии [13, 14].
Результаты клинических исследований показали, что глиомы с IDH-мутацией составляют отдельную группу, характеризующуюся относительно благоприятным течением заболевания по сравнению с опухолями без мутации [18, 19]. В нашем исследовании было продемонстрировано увеличение как длительности безрецидивного периода, так и общей продолжительности жизни в группе пациентов с глиальными опухолями головного мозга (grade III) при наличии мутаций IDH1/2.
Заключение
Присутствие мутаций в генах IDH1/2 ассоциировано с локализацией глиальных опухолей в лобной и теменной долях головного мозга и с клиническими прогностическими факторами: с более молодым возрастом начала заболевания, присутствием в клинической картине эпилептических приступов. Для пациентов с наличием мутаций IDH1/2 характерно более благоприятное течение заболевания.
Список литературы Генетические биологические маркеры глиальных опухолей головного мозга: мутации в генах изоцитратдегидрогеназ 1 и 2
- Ostrom Q.T., GittlemanH., LiaoP., Vecchione-Koval T., Wolinsky Y., Kruchko C., Barnholtz-Sloan J.S. CBTRUS Statistical Report: Primary brain and other central nervous system tumors diagnosed in the United States in 20102014. Neuro Oncol. 2017 Nov 6; 19(suppl_5): v1v88. doi: 10.1093/neuonc/nox158.
- Carson K.A., Grossman S.A., Fisher J.D., Shaw E.G. Prognostic factors for survival in adult patients with recurrent glioma enrolled onto the new approaches to brain tumor therapy CNS consortium phase I and II clinical trials. J Clin Oncol. 2007 Jun 20; 25(18): 2601-6. doi: 10.1200/ JC0.2006.08.1661.
- Curran W.J.Jr., Scott C.B., Horton J., Nelson J.S., Weinstein A.S., FischbachA.J., Chang C.H., RotmanM., Asbell S.O., Krisch R.E. Recursive partitioning analysis of prognostic factors in three Radiation Therapy Oncology Group malignant glioma trials. J Natl Cancer Inst. 1993 May 5; 85(9): 704-10. doi: 10.1093/jnci/85.9.704.
- Iwabuchi S., Bishara S., Herbison P., Erasmus A., Samejima H. Prognostic factors for supratentorial low grade astrocytomas in adults. Neurol Med Chir (Tokyo). 1999 Apr; 39(4): 273-9. doi: 10.2176/ nmc.39.273.
- LambornK.R., ChangS.M., PradosM.D. Prognostic factors for survival of patients with glioblastoma: recursive partitioning analysis. Neuro Oncol. 2004 Jul; 6(3): 227-35. doi: 10.1215/S1152851703000620.
- МартыновБ.В., ПарфеновВ.Е., ТруфановГ.Е., ФокинВ.А., Алексеева Н.П., Цибиров А.А., Холявин А.И., Грачева П.В., Смирнов И.Б., Свистов Д.В. Прогностические факторы у больных с глиомами: симптомно-синдромальный анализ. Вестник Российской Военно-медицинской академии. 2010; 1(29): 7-14. [MartynovB. V, Parfenov V.E., Trufanov G.E., Fokin V.A., Alexeyeva N.P., Tsibirov A.A., Holyavin A.I., Gracheva P. V., Smirnov I.B., Svistov D.V. Prognostic factors of patients with gliomas: symptomatic-syndrome analysis. Bulletin of the Russian Military Medical Academy. 2010; 1(29): 7-14. (in Russian)].
- Lynam L.M., Lyons M.K., Drazkowski J.F., Sirven J.I., Noe K.H., ZimmermanR.S., Wilkens J.A. Frequency of seizures in patients with newly diagnosed brain tumors: a retrospective review. Clin Neurol Neurosurg. 2007; 109(7): 634-8. doi: 10.1016/j.clineuro.2007.05.017.
- OzbekN., Cakir S., Gursel B., Meydan D. Prognostic significance of seizure in patients with glioblastoma multiforme. Neurol India. 2004 Mar; 52(1): 76-8.
- Мацко Д.Е., Мацко М.В., Имянитов Е.Н. Нейроонкология. Практическая онкология. 2017; 18(1): 103-14. [Matsko D.E., MatskoM.V., ImyanitovE.N. Neurooncology. Practical Oncology. 2017; 18(1): 103-14. (in Russian)].
- Stockhammer F., Misch M., Helms H.J., Lengler U., Prall F., von Deimling A., Hartmann C. IDH1/2 mutations in WHO grade II astro-cytomas associated with localization and seizure as the initial symptom. Seizure. 2012; 21(3): 194-7. doi: 10.1016/j.seizure.2011.12.007.
- Duan W.C., WangL., LiK. IDH mutations but not TERTp mutations are associated with seizures in lower-grade gliomas. Medicine (Baltimore). 2018; 97(50): e13675. doi: 10.1097/MD.0000000000013675.
- ChenH., Judkins J., Thomas C., WuM., KhouryL., Benjamin C.G., Pacione D., Golfinos J.G., Kumthekar P., Ghamsari F., Chen L., Lein P., Chetkovich D.M., Snuderl M., Horbinski C. Mutant IDH1 and seizures in patients with glioma. Neurology. 2017; 88(19): 1805-13. doi: 10.1212/ WNL.0000000000003911.
- PhanK., Ng W., Lu V.M., McDonaldK.L., Fairhall J., Reddy R., Wilson P. Association Between IDH1 and IDH2 Mutations and Preoperative Seizures in Patients with Low-Grade Versus High-Grade Glioma: A Systematic Review and Meta-Analysis. World Neurosurg. 2018 Mar; 111: e539-e545. doi: 10.1016/j.wneu.2017.12.112.
- Yang Y., Mao Q., WangX., Liu Y., Mao Y., Zhou Q., Luo J. An analysis of 170 glioma patients and systematic review to investigate the association between IDH-1 mutations and preoperative glioma-related epilepsy. J Clin Neurosci. 2016 Sep; 31: 56-62. doi: 10.1016/j.jocn.2015.11.030.
- 15.ПрокудинМ.Ю., ОдинакМ.М., Литвиненко И.В, МартыновБ.В., ЖелезнякИ.С., ЛыткинМ.В., Воронцова Д.А. Магнитно-резонансная спектроскопия при глиомах головного мозга: биологические маркеры. Неврология. Психиатрия. 2018; 1(145): 10-15. [Prokudin M.Yu., Odinak МЫ., Litvinenko I. V., Martynov B.V., Zheleznyak I.S., Lytkin М.К, Okolzin A.V., Vorontsova D.А. Magnetic Resonance Spectroscopy in Cerebral Gliomas: Biologic Markers. Neurology. Psychiatry. 2018; 1(145): 10-15. (in Russian)].
- Chen R., Ravindra V.M., Cohen A.L., Jensen R.L., Salzman K.L., Prescot A.P., ColmanH. Molecular features assisting in diagnosis, surgery, and treatment decision making in low-grade gliomas. Neurosurg Focus. 2015 Mar; 38(3): E2. doi: 10.3171/2015.1.FOCUS14745.
- Табаков Д.В., Катаргин А.Н., Строганова АМ., Сендерович А.И., Насхлеташвили Д.Р., КиселеваН.П. Мутации изоцитратдегидрогеназ 1 и 2 и метилирование гена MGMT в глиомах. Успехи молекулярной онкологии. 2017; 4: 53-59. [Tabakov D.V., Katargin A.N., Stroganova A.M., Senderovich A.I., Naskhletashvili D.R., Kiseljova N.P. Isocitrate dehydrogenase 1 and 2 genes mutations and MGMT methylation in gliomas. Advances in Molecular Oncology. 2017; 4: 53-59. (in Russian)]. doi: 10.17650/2313-805X-2017-4-1-53-59.
- Лобанова Н.В., Шишкина Л.В., Рыжова М.В., Кобяков Г.Л., Сычева Р.В., Буров С.А., Лукьянов А.В., Омарова Ж.Р. Клинические, иммуногистохимические и молекулярно-генетические факторы прогноза у больных с глиобластомой. Архив патологии. 2016; 78(4): 10-19. [Lobanova N.V., Shishkina L.V., Ryzhova M.V., Kobyakov G.L., Sycheva R.V., Burov S.A., Lukyanov A.V., Omarova Zh.R. Clinical, im-munohistochemical, and molecular genetic prognostic factors in adult patients with glioblastoma. Archive of Pathology. 2016; 78(4): 10-19. (in Russian)]. doi: 10.17116/patol201678410-19.
- Schittenhelm J., Mittelbronn M., Meyermann R., Melms A., Tatagiba M., Capper D. Confirmation of R132H mutation of isocitrate dehydrogenase 1 as an independent prognostic factor in anaplastic as-trocytoma. Acta Neuropathol. 2011 Nov; 122(5): 651-2. doi: 10.1007/ s00401-011-0885-0.


