Генетические варианты, клиническая характеристика и исходы некомпактной кардиомиопатии
Автор: Комиссарова С. М., Ринейская Н. М., Чакова Н. Н., Ефимова А. А., Долматович Т. В., Ниязова С. С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Цель исследования: оценить клинические и структурно-функциональные характеристики, включая неблагоприятные события и исходы, у пациентов с некомпактной кардиомиопатией (НКМП) с различными генетическими вариантами.Материал и методы. Обследован 51 неродственный пациент с НКМП (медиана возраста - 37 [28; 47] лет; из них 54,9% мужчин, 45,1% женщин), наблюдаемых в течение от 7 до 211 мес. (медиана - 38 мес.). Клинико-инструментальное обследование включало осмотр, сбор индивидуального и семейного анамнеза, регистрацию ЭКГ-12, суточное мониторирование ЭКГ, эхокардиографию, магнитнорезонансную томографию (МРТ) сердца с отсроченным контрастированием. Поиск мутаций в кодирующих последовательностях 174 генов, ассоциируемых с сердечно-сосудистой патологией, проводили методом высокопроизводительного секвенирования (NGS).Результаты. У 24 из 51 (47,1%) пациента выявлены 27 мутаций IV и V классов патогенности, при этом у 21 (41,2%) пациента мутации находились в генах саркомерных белков, из них в гене MYBPC3 - 37,5%, в гене MYH7 - 25,0%, мутации в гене TTN, приводящие к укороченному белку (TTNtv), - 33,3%, в гене АСТС1 - 1 мутация (4,2%). У 5,9% пациентов мутации выявлены в генах, кодирующих структурные белки и субъединицы ионных каналов. У 10 из 24 (41,7%) пациентов было обнаружено по два и более генетических варианта. У 14 (27,4%) пациентов не было выявлено значимых генетических вариантов. Пациенты с мутациями в гене TTNtv были ассоциированы с выраженной систолической дисфункцией, дилатацией левого желудочка (ЛЖ). У носителей мутаций в гене MYBPC3 и нескольких генетических вариантов чаще регистрировали неблагоприятные события и исходы: прогрессирование хронической сердечной недостаточности (ХСН), желудочковые тахиаритмии, внезапную сердечную смерть (ВСС) с успешной реанимацией, летальные исходы. Пациенты с мутациями в гене MYH7 не имели неблагоприятных исходов.Заключение. Сравнительный анализ показал, что у пациентов с НКМП наиболее тяжелая форма заболевания с выраженными клиническими проявлениями, эпизодами клинической смерти с последующими реанимационным мероприятиями и имплантацией кардиовертера-дефибриллятора (КД) наблюдалась у пробандов с мутациями в TTNtv, мутациями в гене MYBPC3 или несколькими генетическими вариантами.
Некомпактная кардиомиопатия, генотип-фенотип корреляции, магнитно-резонансная томография, высокопроизводительное секвенирование (ngs)
Короткий адрес: https://sciup.org/149142830
IDR: 149142830 | УДК: 616.127-008-056.7-07-036.8 | DOI: 10.29001/2073-8552-2023-38-2-156-165
Текст научной статьи Генетические варианты, клиническая характеристика и исходы некомпактной кардиомиопатии
Некомпактная кардиомиопатия (НКМП) представляет собой генетически и клинически гетерогенную кардиомиопатию, которая может возникать изолированно или в сочетании с другими кардиомиопатиями и врожденными пороками сердца [1]. НКМП характеризуется интенсивно развитыми желудочковыми трабекулами в сочетании с глубокими выстланными эндокардом межтрабекулярными лакунами, сообщающимися с полостью левого желудочка (ЛЖ), и тонким эпикардиальным уплотненным миокардом, напоминающим структуру миокарда во время эмбриогенеза [2, 3]. Ввиду сложных морфологических нарушений миокарда при НКМП магнитно-резонансная томография (МРТ) сердца имеет некоторые потенциальные преимущества, поскольку позволяет выполнять более точную оценку миокарда с учетом полей зрения, пространственного разрешения и воспроизводимости [4]. Одной из основных причин НКМП являются мутации в генах, кодирующих саркомерные, структурные и регуляторные белки, а также белки, ответственные за функционирование ионных каналов [5]. Мутации наследуются по аутосомно-доминантному типу, реже являются рецессивными или X-сцепленными [6].
Цель работы: оценить клинические и структурно-функциональные характеристики, включая неблагоприятные события и исходы, у пациентов с НКМП в зависимости от генотипа.
Материал и методы
В исследование был включен 51 неродственный пациент с НКМП (медиана возраста 37 [28; 47] лет), из них 54,9% мужчин и 45,1% женщин, проспективно наблюдаемых в РНПЦ «Кардиология» в течение 38 мес. [медиана – 7; 211 мес.]. Все участники дали добровольное письменное информированное согласие на участие в исследовании и использование соответствующих биоматериалов. Клинико-инструментальное обследование помимо стандартных методов обследования (осмотр, сбор индивидуального и семейного анамнеза, электрокардиография, суточное мониторирование ЭКГ по Холтеру, эхокардиография (ЭхоКГ)) включало МРТ с отсроченным контрастированием, при необходимости коронароангио-графическое исследование. Диагноз НКМП устанавливали на основании: 1. ЭхоКГ критериев R. Jenni и соавт. [7], включающих наличие соотношения некомпактного (NC) и компактного (C) слоев NC/C > 2,0 в конце систолы; многочисленных чрезмерно выдающихся трабекул и глубоких межтрабекулярных углублений; наличие более 2 трабекулярных углублений, снабжаемых внутрижелудочковой кровью по данным цветного допплеровского анализа; 2. МРТ-критериев (Petersen) при конечно-диастолическом соотношении NC/C ≥ 2,3 в одном из сегментов ЛЖ по длинным осям МРТ-изображения [8] и доли некомпактного миокарда > 20%, согласно критериям А. Jaquier [9].
Критериями исключения были следующие факторы: 1) возраст < 18 лет; 2) исследование МРТ с ограниченным качеством изображения; 3) сопутствующая ишемическая болезнь сердца (ИБС); 4) синдромные заболевания.
Генетическое исследование. Поиск мутаций в кодирующих последовательностях 174 генов, ассоциируемых с сердечно-сосудистой патологией, проведен 51 неродственным пациентам с НКМП методом высокопроизводительного секвенирования (NGS) на генетическом анализаторе MiSeq (Illumina) с использованием набора «TruSight™ Cardio Sequencing Panel». Обработка и аннотирование результатов секвенирования проводились с помощью программного обеспечения ANNOVAR rev. 527 [10], позволяющего оценить патогенность выявленного генетического варианта.
Статистическая обработка материала осуществлялась с использованием пакета прикладных программ STATISTICA for Windows 12. Количественные показатели исследования представлены медианой и квартилями в виде Me [ Q 25; Q 75]. Качественные показатели представлены частотами и процентами в группе. При исследовании таблиц сопряженности использовался критерий χ 2, в случае нарушения предположений, лежащих в основе критерия χ 2-квадрат, использовался точный критерий Фишера. Сравнение двух несвязанных между собой групп по количественным признакам осуществлялось с помощью непараметрического метода с использованием U-критерия Манна – Уитни. Сравнение количественных показателей в трех группах проводилось с помощью критерия Краске-ла – Уоллиса. Статистически значимыми считались различия при p < 0,05.
Результаты
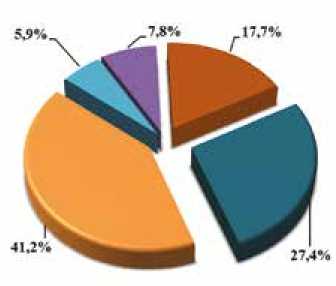
В исследуемой когорте из 51 пациента с НКМП в результате проведения высокопроизводительного секвенирования у 24 (47,1%) обнаружены 27 мутаций IV и V классов патогенности, согласно классификации ACMG (2015) [11], при этом у 21 (41,2%) пробанда мутации находились в генах саркомерных белков; у 5,9% пациентов мутации выявлены в генах, кодирующих структурные белки и субъединицы ионных каналов. У 13 (25,5%) из 51 пациента обнаружены один или более вариантов неопределенной клинической значимости (VUS, III класс) в генах, ассоциированных со структурными и/или электрофизиологическими нарушениями миокарда. Только у 4 (7,8%) пациентов VUS локализовались в саркомерных генах. У 14 (27,4%) пациентов не было выявлено значимых генетических вариантов (рис. 1).
Доля мутаций в генах саркомерных белков была наибольшей и составила 88,9% (24 из 27 мутаций). Распределение этих мутации, обнаруженных у 21 пробанда с НКМП (у 3 пациентов выявлено сочетание двух патогенных мутаций), представлено на рисунке 2. В гене MYBPC 3 было сосредоточено 37,5% (9 из 24); в гене MYH7 – 25,0% (6 из 24); мутации в гене TTN , приводящие к укороченному белку ( TTNtv ), составили треть из установленных мутаций в саркомерных генах (33,3%), а в гене АСТС1 локализована 1 мутация (4,2%).
Спектр выявленных генетических вариантов IVV классов патогенности в саркомерных генах MYH7 , MYBPC3, TTN, ACTC в обследованной группе пациентов представлен в таблице 1.
-
■ My t ашш I\' и V классов в C-lpKOWCpHWX геках Mui aliens of daises IV and V in wccenenc tenet
-
■ Myraunii IV и V каассов в не саукс* мерных
генах Mui aliens of daises IV and V in 1км>-*м«иасгх
-
■ H.i|muktm UI класса a саркомеримх генах Class III tahanrs in Mfcomcric tenet
-
■ Варианты UI класса в me c ay ко мерных гешах Class III tenants ui псп-мгоотепс genes
-
■ Hei чу laustfi No mutations
Рис. 1. Распространенность мутаций III–V классов патогенности в группе пациентов с некомпактной кардиомиопатией
Fig. 1. Prevalence of mutations of pathogenicity III–V classes in the group of patients with NCM
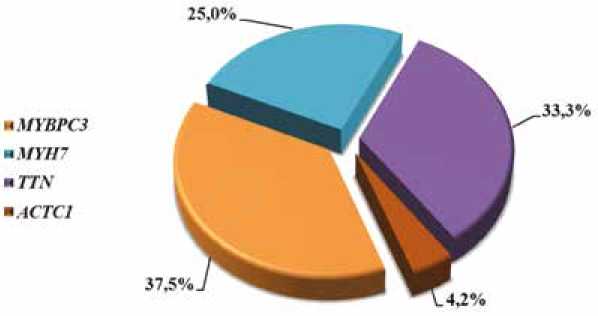
Рис. 2. Распределение генов в группе патогенных саркомерных мутаций
Fig. 2. Distribution of genes in a group of pathogenic sarcomeric mutations
Таблица 1. Спектр генетических вариантов IV–V классов патогенности, выявленных в саркомерных генах
Table 1. Spectrum of genetic variants of IV–V pathogenicity classes detected in sarcomeric genes
|
Пациенты, n = 21 Patients, n = 21 |
Гены Genes |
Нуклеотидная замена Nucleotide substitution |
Изменение белка Protein сhange |
RS |
Дополнительная мутация Additional mutation |
|
1 |
MYBPC3 |
с1201C>T |
p.Gln401Ter |
rs730880637 |
– |
|
2 |
MYBPC3 |
с.3763G>A |
p.Ala1255Thr |
rs727503167 |
– |
|
3 |
MYBPC3 |
с 3640T>C |
р.Trp1214Arg |
new |
– |
|
4 |
MYBPC3 |
c.1037G>A |
p.Arg346His |
rs397515883 |
– |
|
5 |
MYH7 |
c.2809A>C |
p.Thr937Pro |
new |
– |
|
6 |
MYH7 |
c.1169T>G |
p.Leu390Arg |
new |
– |
|
7 |
MYH7 |
с.2791–2793del |
p.Gln931del |
rs397516172 |
– |
|
8 |
MYH7 |
c.1988G>A |
p.Arg663His |
rs371898076 |
– |
|
9 |
TTN |
c.53488G>T |
p.Gly17830* |
rs759231562 |
– |
|
10 |
TTN |
c.57514delA |
p.Arg19172fs |
new |
– |
|
11 |
ACTC1 |
c.701C>A |
p.Ser234Tyr |
new |
– |
|
12 |
TTN |
c.50296C>T |
p.Arg16766* |
rs754866489 |
MYBPC3 :c.1037G>A (p.Arg346His, rs397515883) |
|
13 |
TTN |
c.46591G>T |
p.Gly15531* |
new |
MYBPC3 :c.1037G>A (p.Arg346His, rs397515883) |
|
14 |
MYBPC3 |
c.1505G>A |
р.Arg502Gln |
rs397515907 |
MYH7: с.5134C>T (р.Arg1712Trp, rs121913650) |
|
15 |
TTN |
c.13696C>T |
p.Gln4566* |
rs775072385 |
VUS: RYR2, RBM20 |
|
16 |
TTN |
c.73734G>A |
p.Trp24578* |
new |
VUS: LDB3 |
|
17 |
MYH7 |
c.1324C>T |
p.Arg442Cys |
rs148808089 |
VUS: TGFB3 |
|
18 |
TTN |
c.12283G>T |
p.Glu4095* |
new |
VUS: TMPO, DSP, RYR2 |
|
19 |
MYBPC3 |
c.1037G>A |
p.Arg346His |
rs397515883 |
VUS: АСТА1 |
|
20 |
MYBPC3 |
c.3697C>T |
p.Gln1233* |
rs397516037 |
VUS: DTNA |
|
21 |
TTN |
c.77913T>G |
p.Tyr25971* |
new, rs72648203 |
VUS: JPH2 |
9 из 24 мутаций (37,5%) в саркомерных генах были новыми нуклеотидными вариантами. Мутация c.1037G>A (p.Arg346His, rs397515883) в гене MYBPC3 встретилась у 4 пациентов с НКМП. У 3 пациентов (№ 12–14) наблюдалось сочетание 2 патогенных мутаций в саркомерных генах, у 7 пациентов (№ 15–21) патогенные мутации сочетались с дополнительным вариантом VUS в 9 генах, кодирующих саркомерные ( АСТА1 ) и структурные белки ( LDB3 , TMPO , DTNA , JPH2 ), десмосомы ( DSP ) и субъединицы ионных каналов ( RYR2 ), а также регуляторные белки ( RBM20 , TGFB3 ).
На долю патогенных нуклеотидных изменений в генах, кодирующих структурные белки, пришлось 7,4% (2 из 27) (табл. 2). У одного пробанда патогенная мутация в гене LMNA сочеталась с VUS в гене KCNH2. Обнаружены также патогенная мутация в гене PLN , отвечающем за синтез фосфоламбана, и патогенная мутация в гене
KCNQ1 , кодирующем α-субъединицу калиевого ионного канала.
У 13 пробандов выявлены 15 вариантов III класса патогенности (варианты с неизвестным клиническим значением – VUS) в генах, ассоциированных с кардиомиопатиями и каналопатиями. Доля таких изменений в гене MYH7 была наибольшей и составила 20,0% (3 из 15). Замены в 12 генах ( MYBPC3, CaCNA1C, KCNJ3, RYR2, KCNJ2, NEXN, PKP2, LDB3, KCNQ1, TCAP, KCNH2, NOTCH1 ) встретились по одному разу.
В таблице 3 представлена клиническая характеристика трех групп пациентов: 1-я группа – носители одной мутации IV–V класса патогенности ( n = 13); 2-я группа – пациенты с несколькими генетическими вариантами (> 1), один из которых был IV–V класса патогенности ( n = 11); 3-я группа – обладатели одного или нескольких VUS в генах ( n = 13).
Таблица 2. Спектр генетических вариантов IV–V классов патогенности в сочетании с заменами в разных генах, кодирующих структурные белки Table 2. Spectrum of genetic variants of pathogenicity classes IV–V in combination with substitutions in different genes encoding structural proteins
|
Пациенты, n = 3 Patients, n = 3 |
Гены Genes |
Нуклеотидная замена Nucleotide substitution |
Изменение белка Protein сhange |
RS |
Класс патоген-ности Pathogenicity class |
|
22 |
LMNA KCNH2 |
c.1058A>G c.3107G>A |
p.Gln353Arg p.Gly1036Asp |
new rs199473022 |
P |
|
23 |
PLN |
c.22_23insCTCG |
p.Thr8fs |
new |
P |
|
24 |
KCNQ1 |
c.477+1G>A |
– |
rs762814879 |
P |
Таблица 3. Клиническая и генетическая характеристика пациентов с некомпактной кардиомиопатией
Table 3. Clinical and genetic characteristics of patients with NCM
|
Группы пациентов с различным генотипом Groups of patients with different genotypes |
Пациенты с одной патогенной мутацией IV–V классов, n = 13 Patients with one pathogenic mutation of IV–V classes, n = 13 |
Пациенты с множественными мутациями, n = 11 Patients with multiple mutations, n = 11 |
Пациенты с VUS, n = 13 Patients with VUS, n = 13 |
Значение p p value |
|
Возраст установления диагноза, лет, Me (IQR) Age of diagnosis, years, Me (IQR) |
34 [29; 42] |
42 [27; 51] |
35 [26; 47] |
0,6555 |
|
Пол, n (%) Gender: n (%) Жен. Female Муж. Male |
5 (38,5) 8 (61,5) |
6 (54,5) 5 (45,5) |
7 (53,8) 6 (46,2) |
0,6666 |
|
Устойчивая ЖТ, n (%) Sustained VT, n (%) |
1 (7,7) |
3 (27,3) |
3 (23,1) |
0,4342 |
ЭхоКГ параметры Echo parameters
|
ФВ ЛЖ < 40 %, n (%) LV EF < 40 %, n (%) |
6 (46,2) |
6 (54,5) |
5 (38,5) |
0,9474 |
|
Число пациентов с дилатацией ЛЖ, n (%) Number of patients with LV dilation, n (%) |
3 (23,1) |
5 (45,5) |
6 (46,2) |
0,4752 |
МРТ параметр MRI imaging parameter
|
Наличие фиброза, n (%) Presence of fibrosis, n (%) |
11 (84,6) |
5 (45,5) |
5 (38,5) |
0,0432 |
События и исходы Events and outcomes
|
ИКД/СRT-D, n (%) ICD/CRT-D, n (%) |
1 (7,7) |
3 (27,3) |
3 (23,1) |
0,4342 |
|
Прогрессирование ХСН с госпитализацией, n (%) CHF progression with admission, n (%) |
1 (7,7) |
4 (36,4) |
3 (23,1) |
0,2421 |
|
Сердечная смерть, n (%) Cardiac death, n (%) |
2 (15,4) |
0 (0) |
1 (7,6) |
0,3973 |
Примечание: p – критерий Kruskal – Wallis, ЖТ – желудочковая тахикардия, ФВ ЛЖ – фракция выброса левого желудочка, ИКД – имплантируемый кардиовертер-дефибриллятор, СRT-D – ресинхронизирующее устройство с функцией дефибриллятора, ХСН – хроническая сердечная недостаточность.
Note: Kruskal – Wallis p -criterion, VT – ventricular tachycardia, LV EF – left ventricular ejection fraction, ICD – implantable cardioverter-defibrillator, CRT-D – resynchronizing device with defibrillator function, CHF – chronic heart failure.
Сравнительный анализ между группами пациентов не показал значимых различий по возрасту, полу, клиническим и структурно-функциональным характеристикам за исключением наличия фиброза миокарда по данным МРТ сердца, который чаще был зарегистрирован в 1-й группе пациентов. За период наблюдения (медиана наблюдения – 38 мес.) в общей группе (51 человек) имплантируемые устройства (ИКД/СРТ-Д) были установлены 7 (13,7%) пациентам; прогрессирование хронической сердечной недостаточности (ХСН) с необходимостью госпитализации – у 8 (15,7%); сердечная смерть была у 3 (5,9%) пациентов в связи с развитием тромбоэмболических осложнений на фоне ХСН III ФК NYHA. При сравнительном анализе между группами (таблица 4) обнаружено, что наиболее тяже- лые клинические проявления заболевания с развитием устойчивой ЖТ и имплантацией кардиовертера-дефибриллятора (КД) (27,3%), а также прогрессирование ХСН, требующее госпитализации (36,4%), регистрировались у пациентов с множественными мутациями. Следует отметить, что у пациентов с VUS также наблюдалась тяжелая клиническая картина заболевания, включая внезапную сердечную смерть (ВСС) с последующей реанимацией и имплантацией КД (23,1%), прогрессирование ХСН (23,1%), сердечную смерть (7,6% пациентов).
Анализ клинических проявлений у пациентов с НКМП с мутациями IV–V класса патогенности, независимо от наличия дополнительных мутаций, представлен в таблице 4.
Таблица 4. Клинические и структурно-функциональные показатели у пациентов с некомпактной кардиомиопатией с патогенными мутациями
Table 4. Clinical and structural-functional parameters in patients with NCCM with pathogenic mutations
|
Характеристики Characteristics |
Пациенты с патогенными мутациями ( n = 24) Patients with pathogenic mutations ( n = 24) |
|
Возраст установления диагноза, лет, Me (IQR) Age of diagnosis, years, Me (IQR) |
38,5 (28,4; 46,7) |
|
Пол: Gender: Жен. n (%): Female, n (%): Муж. n (%): Male, n (%): |
11 (45,8) 13 (54,2) |
|
ФК СН NYHA, n (%) NYHA FC, n (%) I II III |
5 (20,8) 16 (66,7) 3 (12,5) |
|
Семейная форма, n (%) Family form, n (%) |
10 (41,7) |
|
ЖЭС > 500 в сутки, n (%) VPB > 500 per day, n (%) |
14 (58,3) |
|
Неустойчивая ЖТ, n (%) Non-sustained VT, n (%) |
13 (54,2) |
|
Устойчивая ЖТ, n (%) Sustained VT, n (%) |
4 (16,7) |
|
ФП, n (%) AF, n (%) |
7 (29,2) |
|
ЭхоКГ параметры Echo parameters |
|
|
иОЛП, мл/м2, Me (IQR) LAVI, ml/m2, Me (IQR) |
38,7 (27,4; 52,5) |
|
Число пациентов с дилатацией ЛЖ, n (%) Number of patients with LV dilation, n (%) |
7 (29,2) |
|
GLS, % |
13,1 (8,7; 17,1) |
|
МРТ параметры CMR imaging parameters |
|
|
иКДО мл/м2, Me (IQR) LV EDVI, / ml/m2, Me (IQR) |
107 (88,7; 140,2) |
|
иКCО, мл/м2, Me (IQR) LV ESVI, ml/m2, Me (IQR) |
64,9 (49; 95,6) |
|
ФВ ЛЖ, % LV EF, % |
40,5 (34; 54,5) |
|
ФВ ЛЖ < 40%, n (%) LV EF < 40 %, n (%) |
12 (50) |
|
Число сегментов с НК, Me (IQR) Number of segments with NC, Me (IQR) |
4 (3; 6) |
|
Наличие фиброза, n (%) The presence of fibrosis, n (%) |
16 (66,7) |
|
% фиброза/ % fibrosis, Me (IQR) |
12,7 (8,2; 42,8) |
|
События и исходы Events and outcomes |
|
|
ИКД/СРТ-Д, n (%) ICD/CRT-D, n (%) |
4 (16,7) |
|
Тромбоэмболические события, n (%) Thromboembolic events, n (%) |
5 (20,8) |
|
Прогрессирование ХСН с госпитализацией, n (%) CHF progression with admission, n (%) |
5 (20,8) |
|
ОТС, n (%) OHT, n (%) |
1 (4) |
|
Сердечная смерть, n (%) Cardiac death, n (%) |
2 (8,3) |
Примечание: данные представлены в виде n (%), Me [IQR], ЖЭС – желудочковая экстрасистолия, ЖТ – желудочковая тахикардия, ФП – фибрилляция предсердий, иОЛП – индекс объема левого предсердия, GLS – глобальная продольная деформация, иКДО – индекс конечно-диастолического объема левого желудочка, иКСО – индекс конечно-систолического объема левого желудочка, ФВ ЛЖ – фракция выброса левого желудочка, ДЛАсист. – систолическое давление в легочной артерии, ИКД – имплантируемый кардиовертер-дефибриллятор, СRT-D – ресинхронизирующее устройство с функцией дефибриллятора, ХСН – хроническая сердечная недостаточность, ОТС – ортотопическая трансплантация сердца.
Note: the data are presented in the form of n (%), Me [IQR], VPB – ventricular premature beat, VT – ventricular tachycardia, AF – atrial fibrillation, LAVI – left atrium volume index; GLS – global longitudinal strain, LV EDVI – left ventricular end-diastolic volume index, LV ESVI – left ventricular end-systolic volume index, LV EF – left ventricular ejection fraction, PASP – pulmonary artery systolic pressure, ICD – implantable cardioverter-defibrillator, CRT-D – resynchronizing device with defibrillator function, CHF – chronic heart failure, OHT – orthotopic heart transplantation.
Как показано в таблице 4, медиана возраста пациентов с патогенными мутациями составляла 38,5 (28,4; 46,7) лет, преобладали мужчины (54,2%). Наиболее частым видом аритмии была желудочковая экстрасистолия (ЖЭ) > 500 в сутки – у 14 (58,3%), неустойчивая желудочковая тахикардия (ЖТ) отмечена у 13 (54,2%), устойчивая ЖТ – у 4 (16,7%), хроническая форма фибрилляции предсердий (ФП) – у 7 (29,2%) пациентов. Симптомы ХСН III ФК NYHA обнаружены у 3 (12,5%) пациентов. По данным ЭхоКГ, доля пациентов с дилатацией ЛЖ составила 7 (29,2%). По данным МРТ с отсроченным контрастированием, у 16 (66,7%) пациентов обнаружены зоны фиброза миокарда, медиана процента объема миокарда составила 12,7% (8,2; 42,8); снижение систолической функции ЛЖ (ФВ ЛЖ < 40%) выявлено у 12 (50%) пациентов.
За период наблюдения имплантируемые устройства (ИКД/СРТ-Д) были установлены 4 (16,7%) пациентам. Наиболее частыми событиями были прогрессирование ХСН с необходимостью госпитализации и тромбоэмболические события у 20,8% пациентов. Одному пациен- ту успешно проведена ортотопическая трансплантация сердца (ОТС). Сердечная смерть была у 2 (8,3%) пациентов в связи с развитием тромбоэмболических осложнений на фоне ХСН III ФК NYHA.
При сравнительном анализе клинических характеристик у пациентов с мутациями в генах, кодирующих сар-комерные белки, выявлено, что у 83% носителей мутаций TTNtv наблюдалась дилатация ЛЖ, что статистически значимо отличалось от остальных групп ( p = 0,0036) и коррелировало с показателями иКДО ( p = 0,0097) и иКСО ( p = 0,0086), таблица 5. По данным МРТ сердца, у 67% носителей мутаций TTNtv выявлено снижение фракции выброса (ФВ) ЛЖ < 40% по сравнению с пациентами с другими саркомерными мутациями ( p = 0,0307). Во всех 3 группах значимых различий по событиям и исходам не было. Однако необходимо отметить, что у носителей мутаций в гене MYBPC3 чаще регистрировались случаи развития ХСН, требующей госпитализации (25%); и кардиальной смерти (25%). Пациенты с мутациями в гене MYH7 имели самый низкий риск неблагоприятных событий по этим показателям.
Таблица 5. Клиническая и генетическая характеристика пациентов с некомпактной кардиомиопатией с мутациями в саркомерных генах
Table 5. Clinical and genetic characteristics of patients with NCM with mutations in sarcomeric genes
|
Характеристики Characteristics |
MYH7 ( n = 6) |
MYBPC3 ( n = 8) |
TTNtv ( n = 6) |
Критерий Пирсона χ2, уровень значимости р Pearson’s criterion χ2, significance level p |
|
Возраст, лет, Me (IQR) Age, years, Me (IQR) |
32 (22,1; 37) |
45 (36,6; 51,4) |
37 (27,4; 50,7) |
χ2=3,1 p = 0,2143 |
|
Пол: Gender: Жен., n (%) Female, n (%) Муж., n (%) Male, n (%) |
3 (50) 3 (50) |
5 (63) 3 (37) |
1 (17) 5 (83) |
χ2=2,8 p = 0,2409 |
|
Неустойчивая ЖТ, n (%) Non-sustained VT, n (%) |
3 (50) |
4 (50) |
4 (67) |
χ2=0,4 p = 0,7994 |
|
Устойчивая ЖТ, n (%) Sustained VT, n (%) |
1 (17) |
1 (13) |
1 (17) |
χ2=0,06 p = 0,9694 |
|
ФП, n (%) AF, n (%) |
2 (33) |
3 (37) |
1 (17) |
χ2=0,7 p = 0,6990 |
ЭхоКГ параметры Echo parameters
|
иОЛП, мл/м2, Me (IQR) LAVI, /ml/m2, Me (IQR) |
32,2 (24,6; 68,2) |
38 (24,3; 51,7) |
38,6 (36,8; 46) |
χ2=0,1 p = 0,9490 |
|
Число пациентов с дилатацией ЛЖ, n (%) Number of patients with LV dilation, n (%) |
0 (0) |
1 (13) |
5 (83) |
χ2=11,3 p = 0,0036 |
|
иКДО, мл/м2, Me (IQR) LV EDVI, ml/m2, Me (IQR) |
56 (52,8; 63,9) |
67,4 (44,7; 76,7) |
90,7 (85,8; 94) |
χ2=9,3 p = 0,0097 |
|
иКСО, мл/м2, Me (IQR) LV ESVI, ml/m2, Me (IQR) |
25 (19; 28,9) |
28,8 (27,7; 44,1) |
50 (44,8; 57,8) |
χ2=9,5 p = 0,0086 |
|
ФВ ЛЖ, %, Me (IQR) LV EF, %, Me (IQR) |
53,5 (50; 65) |
40 (33; 60,5) |
44 (33; 48) |
χ2=4,3 p = 0,1168 |
|
ДЛАсист., мм рт. ст. Me (IQR) PASP, mm Hg, Me (IQR) |
21,5 (20; 24) |
38,5 (31,5; 48) |
26,5 (22; 30) |
χ2=10,8 p = 0,0044 |
|
Число пациентов с ФВ ЛЖ < 40 %, n (%) Number of patients with LVF < 40%, n (%) |
1 (17) |
4 (50) |
4 (67) |
χ2=7,0 p = 0,0307 |
МРТ параметры CMR imaging parameters
|
Наличие фиброза миокарда, n (%) The presence of myocardial fibrosis, n (%) |
4 (67) |
7 (88) |
3 (50) |
χ2=2,2 p = 0,3289 |
|
% массы фиброза, Me (IQR) % of fibrosis mass, Me (IQR) |
12,7 (6,3; 30,8) |
10 (8; 40) |
40 (3,2; 48) |
χ2=0,2 p = 0,8845 |
События и исходы Events and outcomes
|
ИКД/CRT-D, n (%) ICD/CRT-D, n (%) |
1 (17) |
1 (13) |
1 (17) |
χ2=06 p = 0,9694 |
Окончание табл. 5
End of table 5
|
Характеристики Characteristics |
MYH7 ( n = 6) |
MYBPC3 ( n = 8) |
TTNtv ( n = 6) |
Критерий Пирсона χ2, уровень значимости р Pearson’s criterion χ2, significance level p |
|
ХСН, требующая госпитализации, n (%) CHF requiring admission, n (%) |
0 (0) |
2 (25) |
1 (17) |
χ2=1,6 p = 0,4461 |
|
Сердечная смерть, n (%) Cardiac death, n (%) |
0 (0) |
2 (25) |
0 (0) |
χ2=3,2 p = 0,2053 |
Примечание: данные представлены в виде n (%), Me [IQR], Критерий Пирсона – χ2, уровень значимости – р, ЖТ – желудочковая тахикардия, ФП – фибрилляция предсердий, иОЛП – индекс объема левого предсердия, иКДО – индекс конечно-диастолического объема левого желудочка, иКСО – индекс конечно-систолического объема левого желудочка, ФВ ЛЖ – фракция выброса левого желудочка, ДЛАсист. – систолическое давление в легочной артерии, ИКД – имплантируемый кардиовертер-дефибриллятор, СRT-D – ресинхронизирующее устройство с функцией дефибриллятора, ХСН – хроническая сердечная недостаточность.
Note: the data are presented in the form of n (%), Me [IQR], Pearson criterion χ2, significance level p , VT – ventricular tachycardia, AF – atrial fibrillation, LAVI – left atrium volume index, LV EDVI – left ventricular end-diastolic volume index, LV ESVI – left ventricular end-systolic volume index, LV EF – left ventricular ejection fraction, PASP – pulmonary artery systolic pressure, ICD – implantable cardioverter-defibrillator, CRT-D – resynchronizing device with defibrillator function, CHF – chronic heart failure.
Обсуждение
В данном исследовании рассмотрена связь генотипа с клинико-функциональными характеристиками и неблагоприятными событиями в когорте белорусских пациентов с НКМП. Половина мутаций (41,2%) в изучаемой когорте представлена вариантами IV–V классов патогенности в генах саркомерных белков. Среди саркомерных генов мутации в гене MYBPC 3 были наиболее частыми (37,5%), за ними следовали мутации в гене MYH 7 (25,0%); мутации в гене TTN , приводящие к укороченному белку ( TTNtv ), составили треть из установленных мутаций в саркомерных генах (33,3%), мутации в гене АСТС1 были наиболее редкими (4,2%). У 10 из 21 (47,6%) пациентов мутации в сар-комерных генах сочетались с дополнительной мутацией или вариантом неопределенного значения (VUS) в других генах, ассоциированных со структурными и/или электрофизиологическими нарушениями миокарда. Сравнение клинических особенностей пациентов с различными мутациями в генах саркомерных белков показало, что мутации в гене MYBPC3 и мутациями TTNtv ассоциированы с более выраженной систолической дисфункцией и дилатацией ЛЖ и были связаны с повышенным риском развития неблагоприятных событий: жизнеугрожающих аритмий с необходимостью имплантации ИКД, прогрессированием ХСН, требующей госпитализации. Сердечно-сосудистая смерть отмечена у 25% пациентов с мутациями в гене MYBPC3. Пациенты с мутациями в гене MYH7 имели самый низкий риск неблагоприятных событий.
Результаты данного исследования согласуются с предыдущими исследованиями. Так, в многоцентровом исследовании van Waning и соавт. [5] среди 327 пациентов с НКМП в Нидерландах у 32% были обнаружены мутации, при этом 71% мутаций приходился на гены MYH7 , MYBPC3 и TTN . У пациентов с доказанной мутацией значительно чаще встречались неблагоприятные исходы: ВСС, ВСС с успешной реанимацией и имплантацией ИКД, оправданные шоки ИКД, трансплантация сердца, ишемический инсульт. Пациенты с мутациями в гене MYH7 имели более низкий риск неблагоприятных исходов по сравнению с пациентами с мутациями в генах TTN и MYBPC3.
Наши результаты указывают на то, что у пациентов с множественными вариантами в двух или трех генах на- блюдаются более выраженные клинические проявления заболевания в виде жизнеугрожающих аритмий, требующих имплантации ИКД, и прогрессирование ХСН с необходимостью госпитализации. В литературе все активнее обсуждаются вопросы о наличии кумулятивного эффекта нескольких мутаций у пациентов с моногенными заболеваниями миокарда. Относительно недавнее исследование K. Miszalski-Jamka и соавт. описывает когорту пациентов (190 человек, средний возраст – 26 ± 16 лет) с НКМП и повышенной трабекулярностью, которым выполнено МРТ и полноэкзомное секвенирование с целью поиска новых генетических причин НКМП и генотип-фе-нотипических корреляций [12]. У 102 пробандов было выявлено 138 вариантов в 54 генах, многие из которых ранее ассоциировались с другими заболеваниями, например, с синдромом удлиненного интервала QT (KCNH2, KCNE1, KCNQ1, KCNJ2) и миопатиями (FLNC). У пациентов с выявленными мутациями, в отличие от пациентов без них, чаще наблюдались выраженная систолическая дисфункция, фиброз миокарда при МРТ и сочетание с нейромышечной патологией. Кроме того, в этой работе сделан вывод о том, что сочетание нескольких генетических вариантов, в том числе вариантов с неизвестной клинической значимостью (VUS), ассоциируется с более выраженными клиническими проявлениями НКМП и неблагоприятными исxодами, что может отчасти объяснить генетическую гетерогенность НКМП.
В многоцентровом исследовании G. Casas и соавт. [13], в котором описывают когорту пациентов (585 человек, средний возраст – 45 ± 20 лет, из них 57% мужчин), при медиане наблюдения 5,1 лет неблагоприятные события развились у 223 (38%) пациентов: у 110 (19%) – XСН, у 87 (15%) – желудочковые аритмии, у 18 (3%) – системные эмболии, у 34 (6%) – кардиальная смерть. Генетическое тестирование было проведено 354 пациентам. У 61% пробандов обнаружены генетические варианты в саркомерных генах: MYH7 (19%), TTN (13%), MYBPC3 и ACТC1 (по 10%), DSP, LDB3 и BAG3 (по 3%). 21% пациентов имели множественные мутации. Показано, что пациенты с мутациями в гене TTN и с множественными мутациями были ассоциированы с более низкой ФВ ЛЖ и неблагоприятными исxодами, а пациенты с мутациями в гене ACТC1 были связаны с желудочковыми аритмиями, тогда как пациенты с вариантами в гене MYH7 не имели неблагоприятныx исxодов, что согласуется с предыдущими исследованиями. Авторы пришли к выводу, что некоторые генотипы ассоциированы с высоким риском осложненного течения заболевания.
Таким образом, полученные результаты данного исследования показывают, что наличие мутаций в гене MYBPC3, нонсенс-мутаций в гене TTN, а также множественных генетических вариантов у пациентов с НКМП может являться дополнительным генетическим маркером для идентификации пациентов с риском прогрессирования ХСН и развития желудочковых тахиаритмий.
Список литературы Генетические варианты, клиническая характеристика и исходы некомпактной кардиомиопатии
- Oechslin E.N., Attenhofer Jost C.H., Rojas J.R., Kaufmann P.A., Jenni R. Long-term follow-up of 34 adults with isolated left ventricular noncompaction: a distinct cardiomyopathy with poor prognosis. J. Am. Coll. Cardiol. 2000;36(2):493-500. https://doi.org/10.1016/s0735-1097(00)00755-5.
- Oechslin E., Jenni R. Left ventricular non-compaction revisited: a distinct phenotype with genetic heterogeneity? Eur. Heart J. 2011;32(12):1446-1456. https://doi.org/10.1093/eurheartj/ehq508.
- Towbin J.A., Lorts A., Jefferies J.L. Left ventricular non-compaction cardiomyopathy. Lancet. 2015;386(9995):813-825. https://doi.org/10.1016/S0140-6736(14)61282-4.
- Cortés M., Oliva M.R., Orejas M., Navas M.A., Rábago R.M., Martínez M.E. et al. Usefulness of speckle myocardial imaging modalities for differential diagnosis of left ventricular non-compaction of the myocardium. Int. J. Cardiol. 2016;223:813-818. https://doi.org/10.1016/j.ijcard.2016.08.278.
- Van Waning J.I., Caliskan K., Michels M., Schinkel A.F.L., Hirsch A., Dalinghaus M. et al. Cardiac phenotypes, genetics, and risk familiar noncompaction cardiomyopathy. J. Am. Coll. Cardiol. 2019;73(13):1601-1611. https://doi.org/10.1016/j.jacc.2018.12.085.
- Jefferies J.L. Barth syndrome. Am. J. Med. Genet. Semin. Med. Genet. 2013;163(3):198-205. https://doi.org/10.1002/ajmg.c.31372.
- Jenni R., Oechslin E., Schneider J., Attenhofer Jost C., Kaufmann P.A. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: A step towards classification as a distinct cardiomyopathy. Heart. 2001;86(6):666-671. https://doi.org/10.1136/heart.86.6.666.
- Petersen S.E., Selvanayagam J.B., Wiesmann F., Robson M.D., Francis J.M., Anderson R.H. et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging. J. Am. Coll. Cardiol. 2005;46(1):101-105. https://doi.org/10.1016/j.jacc.2005.03.045.
- Jacquier A., Thuny F., Jop B., Giorgi R., Cohen F., Gaubert J.Y. et al. Measurement of trabeculated left ventricular mass using cardiac magnetic resonance imaging in the diagnosis of left ventricular non-compaction. Eur. Heart J. 2010;31(9):1098-104. https://doi.org/10.1093/eurheartj/ehp595.
- Wang K., Li M., Hakonarson H. ANNOVAR: Functional annotation of genetic variants from high-throughput sequencing data. Nucleic Acids Res. 2010;38(16);e164. https://doi.org/10.1093/nar/gkq603.
- Richards S., Aziz N., Bale S., Bick D., Das S., Gastier-Foster J. et al. ACMG Laboratory Quality Assurance Committee. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet. Med. 2015;17(5):405-424. https://doi.org/10.1038/gim.2015.30.
- Miszalski-Jamka K., Jefferies J.L., Mazur W., Głowacki J., Hu J., Lazar M. et al. Novel genetic triggers and genotype-phenotype correlations in patients with left ventricular noncompaction. Circ. Cardiovasc. Genet. 2017;10(4):e001763. https://doi.org/10.1161/CIRCGENETICS.117.001763.
- Casas G., Limeres J., Oristrell G., Gutierrez-Garcia L., Andreini D., Borregan M. et al. Clinical risk prediction in patients with left ventricular myocardial noncompaction. J. Am. Coll. Cardiol. 2021;78(7):643-662. https://doi.org/10.1016/j.jacc.2021.06.016.


