Генотипирование инбредных линий и гибридов подсолнечника селекции Армавирской опытной станции ВНИИМК с помощью микросателлитных локусов
Автор: Гучетль С.З., Зайцев Н.И., Фролов С.С., Фролова И.Н., Кузнецова Е.С.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 3 (179), 2019 года.
Бесплатный доступ
Идентификация линий и гибридов - актуальная задача современной селекции. Цель данной работы - разработка оптимальной системы микросателлитных ДНК-маркеров для генотипирования инбредных линий и гибридов подсолнечника селекции АОС ВНИИМК. Материалом для исследования служили 13 линий (ВА 93, В А 760, ВА 761, ВА 4, ВА 6, ВА 384, ВА 389, ВА 317, ВА 325, ВК 21, ВА 337, ВА 737, ВА 812) и 10 гибридов (Барс, Натали, Ирэн, Мэлин, Медас, Арис, Арнеб, Беркут, Арлин, Арими) коллекции подсолнечника АОС ВНИИМК. Восемнадцать пар праймеров, показавших наличие полиморфизма, были использованы для генотипирования инбредных линий и гибридов подсолнечника. Наиболее полиморфными локусами были Har 514, ORS 610 и Har 1608 (na равное 3-4, PIC - от 0,51 до 0,65 и ne -от 2,04 до 2,85). Локусы Har 1327 и ORS 1079 имели низкие показатели полиморфизма (na равное 2, PIC - от 0,14 до 0,25 и ne - от 1,16 до 1,33). Остальные локусы имели средний уровень полиморфизма (na равное 2-3, PIC - от 0,36 до 0,50, ne -от 1,56 до 2,00)...
Подсолнечник, линии, гибриды, генотипирование, микросателлитные локусы
Короткий адрес: https://sciup.org/142222538
IDR: 142222538 | УДК: 631.523:633.854.78 | DOI: 10.25230/2412-608X-2019-3-179-27-34
Текст научной статьи Генотипирование инбредных линий и гибридов подсолнечника селекции Армавирской опытной станции ВНИИМК с помощью микросателлитных локусов
Identification of lines and hybrids is an actual task of the modern breeding. The purpose of the present work was to develop an optimal system of microsatellite DNA-markers for genotyping of sunflower inbred lines and hybrids bred at the Armavirskaay experi- mental station – a branch of V.S. Pustovoit AllRussian Research Institute of Oil Crops (AOS VNIIMK). As an object of the research we used 13 lines (VA 93, VA 760, VA 761, VA 4, VA 6, VA 384, VA 389, VA 317, VA 325, VK 21, VA 337, VA 737, and VA 812) and 10 hybrids (Bars, Natali, Iren, Melin, Medas, Aris, Arneb, Berkut, Arlin, Arimi) from sunflower collection of AOS VNIIMK. We used 18 pair of primers which showed presence of polymorphism to genotype sunflower inbred lines and hybrids. The most polymorphic loci were Har 514, ORS 610 and Har 1608 (na equal 3–4, PIC – from 0.51 to 0.65, ne – from 2.04 to 2.85). Loci Har 1327 and ORS 1079 showed low polymorphism (na equal 2, PIC – from 0.14 to 0.25, ne – from 1.16 to 1.33). The rest loci had a middle level of polymorphism (na equal 2–3, PIC – from 0.36 to 0.50, ne – from 1.56 to 2.00). The average number of alleles per a locus was 2.3. Accounted values characterize polymorphism of studied samples as average. Analysis of electrophoretic spectra of 18 polymorphic SSR-loci proved uniqueness of each line alleles, except lines which are analogs of each other. Uniqueness of the studied lines was 82%. The most loci inherited amplicons by codominant type but there were also some dominant ones: ORS 366, ORS 307, ORS 610, Har 1442, Har 432. All studied hybrids had discrepant genotypes. Uniqueness of the hybrid collection is 100%. Used SSR-loci can be considered as optimal ones for genotyping of sunflower inbreds and hybrids developed at AOS VNIIMK.
Введение. Использование молекулярных маркеров дает особые преимущества при оценке генетического разнообразия, для идентификации и определения генетической чистоты сортов, а также для изучения полиморфизма и генетического сходства у основных сельскохозяйственных культур, таких как кукуруза [1], соя [2; 3], рис [4], картофель [5], люцерна [6], сорго [7] и т.д. Уровень полиморфизма и генетических отношений изучали с помощью различных молекулярных маркеров, таких как RAPD (Random Amplification of Polymorphic DNA), RFLP (Restriction Fragment Length Polymorphism), AFLP (Amplified Fragment Length Polymorphism) и SSR (Single Sequence Repeats). Из-за своей мультиаллельной и высокополиморфной природы микроса-теллитные маркеры, или SSR, в настоя- щее время являются предпочтительным методом молекулярной селекции у растений. У подсолнечника (Helianthus annuus L.) микросателлиты были особенно информативны при изучении филогенетических взаимоотношений, паспортизации сортов и генетических взаимоотношений между инбредными линиями [8; 9; 10]. Идентификация линий и гибридов – актуальная задача современной селекции. Для идентификации и паспортизации линий и гибридов подсолнечника селекции АОС ВНИИМК ранее были выполнены оптимизация условий ПЦР, подбор микроса-теллитных локусов для создания системы молекулярных маркеров. Некоторые из изученных линий обладали идентичным составом аллелей микросателлитных локусов. Это предполагало дальнейший скрининг SSR-локусов для более точной идентификации генотипов подсолнечника [11]. Цель данной работы – разработка оптимальной системы микросателлитных ДНК-маркеров для генотипирования ин-бредных линий и гибридов подсолнечника селекции АОС ВНИИМК.
Материалы и методы. Материалом для исследования служили 13 линий (ВА 93, ВА 4, ВА 6, ВА 760 [12], ВА 761, ВА 317, ВА 325, ВК 21 ими [13], ВА 337 [14], ВА 384 [15], ВА 389 [16], ВА 737, ВА 812) и 10 гибридов (Барс, Беркут, Арими [17], Медас, Мэлин, Натали [18], Ирэн [19], Арнеб [20], Арис [21], Арлин) коллекции подсолнечника Армавирской опытной станции ВНИИМК. Геномную ДНК выделяли из семядольных листьев 5–7-дневных этиолированных проростков подсолнечника с помощью модифицированного метода Saghai-Maroof et аl. [22] с использованием СТАВ-буфера. Для проведения ПЦР использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5–3 мM MgCl2; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК. Амплификацию проводили в приборе Терцик (ДНК-технология, Россия). Условия амплификации: начальная денатурация при 96 °С в течение 2 мин; затем 30 циклов при соблюдении температурно-временного режима: отжиг при 55–60 °С в течение 40 с, элонгация – 1 мин при 70 °С, денатурация при 94 °С – 30 с, финальная элонгация – 2 мин. В этом исследовании мы использовали 18 праймеров SSR, разработанных N. Paniego et al. и S. Tang et al. [9; 23]. Электрофорез продуктов амплификации проводили в агарозном геле (2 % агароза, 1 х SB-буфер) с использованием камеры для горизонтального электрофореза (SE. 2, ДНК-технология, Россия) в течение 1– 1,5 ч при силе тока 60 mA и напряжении 90–100 V. Последующее окрашивание осуществляли бромистым этидием. Визуализацию и документирование результатов электрофореза обеспечивали при помощи трансиллюминатора ECX-F20.M (WILBER LOURMAT, Франция) и фотоаппарата Canon EOS 550D (Япония). Идентификацию и определение размеров аллелей микросателлитных локусов проводили визуально, путём сравнения со стандартным образцом – маркером молекулярной массы 100 bp (Сибэнзим, Москва). Для определения различий между линиями подсолнечника данные ПЦР-анализа были обработаны кластерным анализом, методом Ward с помощью пакета программ (Statistica 6.0). Генетические дистанции рассчитаны с помощью Евклидова расстояния.
Индекс полиморфного содержания (PIC) [24] и эффективное число аллелей (ne) [25] вычисляли по формулам:
PICi= 1-∑ Рij2, где Р – частота j паттерна для локуса i и суммирование распространяется на n паттернов.
ne=1/ ∑ Рij2, где ne – эффективное число аллелей.
Результаты и обсуждение. Восемнадцать пар праймеров, показавших наличие полиморфизма, были использованы для генотипирования инбредных линий и гибридов подсолнечника селекции Армавирской опытной станции ВНИИМК. Для них была выполнена оптимизация условий ПЦР, при которых продукты амплификации четко визуализировались. Характеристика амплифицированных локусов представлена в таблице 1.
Таблица 1
Характеристика ДНК-локусов, использованных для генотипирования линий подсолнечника АОС ВНИИМК
Армавирская ОС ВНИИМК, 2019 г.
|
Локус |
Молекулярный вес продукта (п.н.) |
PIC |
n a |
n e |
|
Har 1796 |
180; 280 |
0,36 |
2 |
1,56 |
|
ORS 366 |
220; 250 |
0,47 |
2 |
1,88 |
|
ORS 811 |
150; 200 |
0,36 |
2 |
1,56 |
|
ORS 1287 |
200; 210 |
0,47 |
2 |
1,88 |
|
ORS 307 |
160; 190 |
0,36 |
2 |
1,56 |
|
ORS 1079 |
450; 480 |
0,25 |
2 |
1,33 |
|
ORS 561 |
410; 500 |
0,50 |
2 |
2,00 |
|
ORS 533 |
170; 175 |
0,50 |
2 |
2,00 |
|
Har 1327 |
195, 205 |
0,14 |
2 |
1,16 |
|
Har 1442 |
0; 165 |
0,47 |
2 |
1,88 |
|
ORS5 |
320; 350 |
0,42 |
2 |
1,72 |
|
ORS 559 |
100; 150 |
0,50 |
2 |
2,00 |
|
ORS 815 |
180; 200 |
0,47 |
2 |
1,88 |
|
ORS 1144 |
136; 177 |
0,42 |
2 |
1,72 |
|
ORS 610 |
170; 180; 190 |
0,51 |
3 |
2,04 |
|
Har 432 |
170; 175; 180 |
0,37 |
3 |
1,64 |
|
Har 514 |
180; 185; 190 |
0,64 |
3 |
2,85 |
|
Har 1608 |
240; 260; 270, 280 |
0,65 |
4 |
2,85 |
Примечание: PIC – индекс полиморфного содержания; n a – наблюдаемое число аллелей; n e – эффективное число аллелей.
У 14 SSR локусов обнаружено по два аллеля, по три аллеля – у локусов Har 517, ORS 610 и Har 432. У локуса Har 1608 было выявлено четыре аллеля.
Для определения дискриминационного потенциала системы маркеров в пределах использованной группы линий вычисляли такие показатели, как наблюдаемое число аллелей на полиморфный локус (na), ин- декс полиморфного содержания (PIC) и эффективное число аллелей (ne) (табл. 1).
Наиболее полиморфными локусами были Har 514, ORS 610 и Har 1608 (n a равное 3–4, PIC – от 0,51 до 0,65 и n e – от 2,04 до 2,85). Локусы Har 1327 и ORS 1079 имели низкие показатели полиморфизма (n a равное 2, PIC – от 0,14 до 0,25 и n e – от 1,16 до 1,33). Остальные локусы имели средний уровень полиморфизма (n a равное 2–3, PIC – от 0,36 до 0,50, n e – от 1,56 до 2,00) (табл. 1).
Среднее число аллелей на локус составило 2,3, что совпадает с полученным ранее для 12 линий подсолнечника Армавирской опытной станции ВНИИМК [11]. Рассчитанные нами величины характеризуют полиморфизм исследованных образцов коллекции как средний. Анализ электрофоретических спектров 18 полиморфных микросателлитных локусов линий показал индивидуальность аллельного состава каждой из них (табл. 2).
Линии ВА 760 с ВА 761 и ВА 325 с ВК 21, которые являются аналогами по отношению друг к другу, имели идентичные генотипы по 18 локусам. Их идентичность была показана в работе [11] при использовании 11 микросателлитных и 4 изоферментных локусов. Увеличение количества маркерных локусов не выявило различий между данными линиями. Но были идентифицированы линии ВА 93 и ВА 760, не показавшие отличий ранее [11] (табл. 2). Уникальность проанализированной группы линий составила 82 %.
Для определения степени сходства между линиями на основе матрицы состояний бинарных признаков был проведен кластерный анализ методом Ward и построена дендрограмма генетических взаимоотношений между изученными линиями (рис. 1).
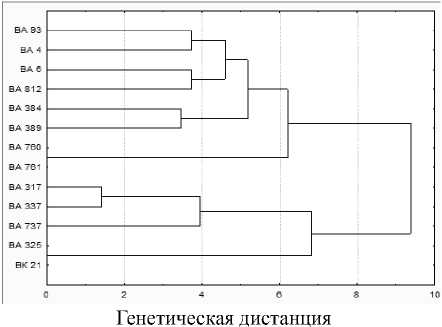
Рисунок 1 – Дендрограмма генетического сходства 13 линий селекции Армавирской ОС ВНИИМК на основе 18 полиморфных SSR-локусов ДНК
Анализ дендрограммы показал, что изученные линии разделились на два кластера, с генетической дистанцией между ними 9,3. В один кластер попали материнские линии ВА 93, ВА 760, ВА 761, ВА 4, ВА 6, а также две отцовские линии ВА 384 и ВА 389. Второй кластер объединил отцовские линии ВА 317, ВА 337, ВА 737, ВА 812, ВА 325, ВК 21. Как было отмечено в работе Гучетль С.З. с соавторами [11], объединение линий в кластеры в большей степени зависело от принадлежности к отцовской или материнской линии.
Наследование микросателлитных локусов обычно носит кодоминантный характер. Это в значительной мере обуславливает их использование для паспортизации гибридов, поскольку позволяет определить наличие обоих родительских аллелей в их генотипах. В нашем исследовании у гибридов некоторые из изучаемых локусов проявили себя как доминантные: ORS 366, ORS 307, ORS 610, Har 1442, Har 432. У этих гибридов маркерный локус был представлен лишь одним из родительских аллелей. Четыре локуса не выявили полиморфизма: ORS 307, ORS 610, Har 1442 и Har 1327. Результаты генотипирования гибридов представлены в таблице 3.
Таблицы 2 и 3
У большинства локусов наследование ампликонов происходило по кодоминантному типу. У локусов, находящихся в гетерозиготном состоянии, мы наблюдали оба родительских ампликона (гибрид Арис), в гомозиготном состоянии – один ампликон (гибрид Натали) (рис. 2).
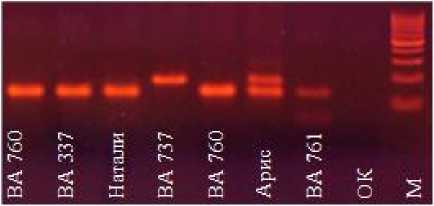
Рисунок 2 – Электрофоретические спектры продуктов амплификации ДНК у гибридов подсолнечника Натали, Арис и их родительских линий по локусу ORS 811.
ОК – отрицательный контроль.
М – маркер молекулярного веса 100 пн
Несмотря на наличие мономорфных локусов, все изученные гибриды имели отличающиеся генотипы. Уникальность коллекции гибридов 100 %.
Таким образом, в результате проведенных исследований показано, что система маркеров из 18 пар микросателлитных локусов выявляет полиморфизм фракций ам-плифицированной ДНК. Дискриминационный потенциал системы маркеров в пределах использованной группы линий характеризуется как средний. Уникальность проанализированной коллекции линий Армавирской опытной станции ВНИИМК составила 82 %, гибридов – 100 %.
Использованные микросателлитные локусы являются оптимальными для генотипирования инбредных линий и гибридов подсолнечника селекции АОС ВНИИМК.
Список литературы Генотипирование инбредных линий и гибридов подсолнечника селекции Армавирской опытной станции ВНИИМК с помощью микросателлитных локусов
- Carvalho V.P., Ruas C.F., Ferreira J.M., Moreira R.M.P. and Ruas P.M. Genetic diversity among maize (Zea mays L.) landraces assessed by RAPD markers // Genetics and Molecular Biology. -2004. - V. 27. - Is 2. - P. 228-236.
- Рамазанова С.А., Гучетль С.З., Челюстникова Т.А., Антонова Т.С. Полиморфизм микросателлитных локусов ДНК у сортов сои селекции ВНИИМК // Современные проблемы научного обеспечения производства подсолнечника. Сб. докл. междунар. науч.-практ. конф., посвященной 120-летию со дня рождения академика В.С. Пустовойта. - Краснодар, 2006. - С. 234-239.
- Narvel J.M., Fehr W.R., Chu W., Grant D. and Shoemaker R.C. Simple sequence repeat diversity among soybean plant introductions and elite genotypes // Crop Sci. - 2000. - V. 40. - P. 1452-1458.
- Супрун И.И., Ковалев В.С., Коротенко Т.Л., Степанов И.В., Лободина Е.В Анализ генетических взаимосвязей сортов риса из разных экологогеографических групп с использованием SSR-маркеров // Биотехнология и селекция растений. -2019. - Т. 2. - № 1. - С. 7-15.
- Solano Solis J., Morales Ulloa D, Anabalon Rodriguez L. Molecular description and similarity relationships among native germplasm potatoes (Solanum tuberosum ssp. tuberosum L.) using morphological data and AFLP markers // Electron. J. Biotechnol. [online]. - 2007. - V. 10 (3). - P. 436-443.
- Смоленская С.Э., Квасова Э.В., Редина О.Е. Тестирование полиморфизма в сортах и инбредных линиях многолетней люцерны // Вестник ВОГиС. - 2008. - Т. 12. - № 4. - С. 629.
- Smith J.S.C., Kresovich S., Hopkins M.S., Mitchell S.E., Dean R.E., Woodman W.L., Lee M. and Porter K. Genetic diversity among elite sorghum inbred lines assessed with simple sequence repeats // Crop Sci. - 2000. - V. 40. - P. 226-232.
- Solodenko A., Sivolap Y. Genotyping of Helianthus based on microsatellite sequences. // Helia. -2005. - V. 28 (42). - P. 19-26.
- Paniego N., Eschaide M., Munoz M., Fernandez L., Torales S., Faccoi P., Fuxan I., Carrera M., Zandomeny R., Suarez E. and Hopp H. Microsatellite isolation and characterization in sunflower (Helianthus annuus L.) // Genome. - 2002. - V. 45. - P. 34-43.
- Гучетль С.З., Челюстникова Т.А., Антонова Т.С., Рамазанова С.А. Микросателлитные локусы как маркеры для идентификации и сертификации линий и гибридов подсолнечника селекции ВНИИМК // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2007. - Вып. 2 (137). - С. 27-32.
- Гучетль С.З., Фролов С.С., Зайцев Р.Н., Кузнецова Е.С. Паспортизация линий и гибридов подсолнечника селекции Армавирской опытной станции ВНИИМК: подбор оптимальных ДНК локусов и условий ПЦР // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2017. - Вып. 3 (171). - С. 23-28.
- Деревенец В.Н., Дудка Н.З., Зайцев Н.И., Мамонов И.Ф., Фролов С.С., Фролова И.Н. Подсолнечник ВА 760: Патент РФ на селекционное достижение № 6982 от 30.07.2013 г., по заявке № 54188/8953101 с датой приоритета 19.04.2010 г.; заявитель и патентообладатель - ГНУ Армавирская опытная станция ВНИИМК.
- Демурин Я.Н., Пихтярёва А.А., Борисенко О.М., Зайцев Н.И., Фролов С.С. Подсолнечник ВК 21 ИМИ: Патент РФ на селекционное достижение № 7503 от 03.09.2014 г., по заявке № 8853881 с датой приоритета 28.11.2011 г.; заявитель и патентообладатель - ГНУ ВНИИМК.
- Деревенец В.Н., Зайцев Н.И., Мамонов И.Ф., Мамонова Р.Н., Фролов С.С., Фролова И.Н. Подсолнечник ВА 337: Патент РФ на селекционное достижение № 6080 от 01.09.2011 г., по заявке № 54394/9154699 с датой приоритета 02.12.2008 г.; заявитель и патентообладатель - ГНУ Армавирская опытная станция ВНИИМК.
- Деревенец В.Н., Дудка Н.З., Зайцев Н.И., Илюхин Д.В., Фролов С.С., Фролова И.Н. Подсолнечник ВА 384: Патент РФ на селекционное достижение № 7880 от 03.06.2015 г., по заявке № 60715/8757285 с датой приоритета 06.12.2012 г.; заявитель и патентообладатель - ФГБНУ "Армавирская опытная станция ВНИИМК им. В.С. Пустовойта".
- Демурин Я.Н., Деревенец В.Н., Зайцев Н.И., Фролов С.С., Фролова И.Н. Подсолнечник ВА 389: Патент РФ на селекционное достижение № 10044 от 03.06.2015 г., по заявке № 66498/8559160 с датой приоритета 12.12.2014 г.; заявитель и патентообладатель - ФГБНУ ФНЦ ВНИИМК.
- Демурин Я.Н., Пихтярёва А.А., Борисенко О.М., Трембак Е.Н., Пикалова Н/А., Лукомец В.М., Зайцев Н.И., Фролов С.С. Подсолнечник АРИМИ: Патент РФ на селекционное достижение № 7391 от 29.05.2014 г., по заявке № 8853879 с датой приоритета 28.11.2011 г.; заявитель и патентообладатель - ГНУ ВНИИМК.
- Деревенец В.Н., Дьяков А.Б., Зайцев Н.И., Мамонов И.Ф., Фролов С.С., Фролова И.Н. Подсолнечник НАТАЛИ: Патент РФ на селекционное достижение № 66849 от 11.03.2013 г., по заявке № 55707/8954285 с датой приоритета 02.12.2010 г.; заявитель и патентообладатель - ГНУ Армавирская опытная станция ВНИИМК.
- Деревенец В.Н., Дудка Н.З., Зайцев Н.И., Илюхин Д.В., Мамонов И.Ф., Фролов С.С., Фролова И.Н. Подсолнечник ИРЭН: Патент РФ на селекционное достижение № 8319 от 16.03.2016 г., по заявке № 60717/8757286 с датой приоритета 06.12.2012 г.; заявитель и патентообладатель -ФГБНУ "Армавирская опытная станция ВНИИМК им. В.С. Пустовойта".
- Демурин Я.Н., Деревенец В.Н., Зайцев Н.И., Фролов С.С., Фролова И.Н. Подсолнечник АРНЕБ: Патент РФ на селекционное достижение № 9576 от 19.03.2018 г., по заявке № 66500/8559161 с датой приоритета 12.12.2014 г.; заявитель и патентообладатель - ФГБНУ "Армавирская опытная станция ВНИИМК им. В.С. Пустовойта".
- Демурин Я.Н., Деревенец В.Н., Зайцев Н.И., Свиридов Н.Н., Фролов С.С., Фролова И.Н. Подсолнечник АРИС: Патент РФ на селекционное достижение № 9704 от 13.06.2018 г., по заявке № 68250/8457277 с датой приоритета 23.11.2015 г.; заявитель и патентообладатель - ФГБНУ "Армавирская опытная станция ВНИИМК им. В.С. Пустовойта".
- Saghai-Maroof M.A., Soliman K.M., Jorgensen R A., Allard R. W. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics // PNAS, USA. - 1984. - V. 81. - P. 8014-8018.
- Tang S., Yu J.K., Slabaugh M.D., Shintani D.K., Knapp S.J. Simple sequence repeat мар of the sunflower genome // Theor. and Appl. Genet. - 2002. - No. 105. - P. 1124-1136.
- Использование ПЦР-анализа в генетикоселекционных исследованиях // Научно-методическое руководство / Под ред. Сиволапа Ю.М. - Киев: Аграрна наука, 1998. - 156 с.
- Айала Ф., Кайгер Д. Современная генетика. Т. 3. - М.: Мир, 1988. - 332 с


