Генотипирование линий подсолнечника с различной устойчивостью к ложной мучнистой росе с помощью STS-маркеров
Автор: Маркин Н.В., Тихобаева В.Е., Усатенко Т.В., Горбаченко О.Ф., Усатов А.В.
Рубрика: Селекция и семеноводство
Статья в выпуске: 2 (151-152), 2012 года.
Бесплатный доступ
Проведена оценка устойчивости 16 Rf-линий подсолнечника селекции Донской опытной станции масличных культур им. Л.А. Жданова ВНИИМК к наиболее распространенным в Ростовской области расам ложной мучнистой росы - 330 и 710. В лабораторных условиях методом искусственного заражения определены линии, контрастно различающиеся по устойчивости к этим расам ЛМР и с помощью 9 STS-маркеров трех Pl-локусов - Pl 5, Pl 6 и Pl 8, ассоциированных с устойчивостью подсолнечника к ЛМР, линии были генотипированы. Два маркера локуса Pl 6 - НаР2 и НаР3 позволяют идентифицировать устойчивые к ЛМР линии.
Ложная мучнистая роса (лмр), sts-маркеры, маркер-вспомогательная селекция, подсолнечник
Короткий адрес: https://sciup.org/142151097
IDR: 142151097 | УДК: 575.12:633.854.78
Текст научной статьи Генотипирование линий подсолнечника с различной устойчивостью к ложной мучнистой росе с помощью STS-маркеров
Введение. Ложная мучнистая роса (ЛМР) подсолнечника, вызываемая грибом Plasmopara halstedii (Farl.) Berl. & de Toni – одно из наиболее вредоносных заболеваний культивируемого подсолнечника. Поражение посевов этим грибом может составлять до 70 % [1]. Поэтому селекция подсолнечника на устойчивость к ЛМР является одной из приоритетных задач.
Селекция сельскохозяйственных культур на устойчивость к болезням и вредителям трудоемка и связана с созданием инфекционных фонов, проведением вегетационных исследований в лабораторных и полевых условиях. Перспективным является использование специфичных молекулярных маркеров для оценки селекционного материала на ранних этапах развития растений, что может существенно сократить объем работ в полевых условиях.
Устойчивость к широкому кругу патогенов, включающему вирусы, бактерии, грибы, насекомые и нематоды обусловливают гены устойчивости – R-гены. Они содержат консервативные последовательности, которые определяют различные функции. Выделяют не менее пяти классов R-генов: внутриклеточные протеин-киназы; рецептор-подобные протеинки-назы, содержащие богатые лейцином повторы (LRR); внутриклеточные LLR белки, содержащие сайт связывания с нуклеотидами (NBS), и мотив «лейциновая молния» (LZ); внутриклеточные NBS-LRR белки, несущие домен гомологичный Toll, и interleukin-1 рецепторам (TIR); LLR белки, обеспечивающие связывание с мембраной внеклеточных белков [2].
Исследования генетических основ резистентности растений подсолнечника к паразиту Plasmopara halstedii позволили определить специфические доминантные гены – Pl-гены, обусловливающие устойчивость к различным расам P. halstedii. По данным литературы, в мировой популяции P. halstedii насчитывают около 37 рас, из которых можно выделить порядка шести-семи рас доминирующих в мире [3]. Гены Pl1 и Pl2 были идентифицированы в 70-е годы прошлого века и связаны с устойчивостью к 100 и 300 расам ЛМР [4]. После успешного внедрения этих генов в инбредные линии в течение последующих двух десятилетий появились новые расы этого патогена, преодолевающие обнаруженные ранее гены устойчивости. Позднее был обнаружен ген Pl6, у дикого вида H. annuus, который отвечает за устойчивость к 11 расам ЛМР. В настоящее время показано, что локус Pl6 содержит, по меньшей мере, 11 тесно сцепленных генов, каждый из которых дает устойчивость к одной из рас ЛМР [2]. Ген Pl8 является аналогом гена Pl6, но идентифицирован не у H. annuus, а у H. argophyllus, а Pl7 – у H. praecox. Дальнейший анализ показал, что гены Pl1/Pl2/Pl6 комплекса относятся к 1-ой группе сцепления и причислены к TIR-NBS-LRR группе устойчивости, а гены Pl5/Pl8 комплекса – к 6-ой группе сцепления и non-TIR-NBS-LRR группе. В последних источниках сообщается об обнаружении новых генов устойчивости Pl13 и Pl16 у линии культурного подсолнечника HA-R5, который обусловливает резистентность к расам: 100, 300, 310, 330, 700, 710, 730, 731 и 770, но чувствителен к расам 307 и 703 [3; 5].
С помощью стандартного набора линий-дифференциаторов подсолнечника в регионах Северного Кавказа идентифицировано 7 рас патогена [6; 7; 8]. Установлено, что доминирующее положение в большинстве районов занимает раса 330 с преобладанием на отдельных полях рас 710 и 730. Исходя из этого, селекцию подсолнечника на устойчивость к ложной мучнистой росе в Южном регионе, в том числе и в Ростовской области, следует акцентировать на расы 330, 710 и 730.
Целью настоящей работы являлась оценка в лабораторных условиях устойчивости селекционного материала подсолнечника к расам 330 и 710 возбудителя ложной мучнистой росы и генотипирование линий подсолнечника с различной устойчивостью к ЛМР с помощью STS-маркеров трех Pl-локусов.
Материалы и методы. Объектом исследования служили 16 линий подсол- нечника – восстановителей фертильности пыльцы ЦМС PET1 из Донской опытной станции масличных культур им. Л.А. Жданова ВНИИМК (табл. 2). Оценку степени устойчивости растений этих линий к расам 330 и 710 ЛМР проводили по методике, описанной в работе Антоновой с соавторами [9]. Критерием восприимчивости при идентификации гриба являлось наличие конидиального спороношения на семядольных и настоящих листьях, некроз и хлороз; критерием устойчивости – отсутствие на растениях проявления болезни. Устойчивость/восприимчивость оценивали как процентное соотношение пораженных и здоровых проростков. Исследование проводили в 3–5 повторах для 50–100 растений каждой линии в камере искусственного климата (Binder, Германия).
Для молекулярно-генетического анализа геномную ДНК выделяли из листовой ткани проростков согласно [10]. Праймеры для идентификации 9 STS-маркеров трех Pl -локусов – Pl 5 , Pl 6 и Pl 8 ассоциированных с устойчивостью подсолнечника к ЛМР были отобраны из данных литературы [2; 11] (табл. 1).
Таблица 1
Характеристика праймеров, использованных для идентификации STS-маркеров Pl-локусов
|
Праймер |
5′–3′последовательность |
Локус |
|
|
HaP1 |
F: R |
GGTAATGGCTGTTGAATTTATGGAGC : AGCATGATCCGGCTAGAGCCTTCTA |
Pl 6 |
|
HaP2 |
F: R |
GTCTACTACATGGTTTCCGTTTTC : TGCTTCTTCCTTCTATCTCACTC |
Pl 6 |
|
HaP3 |
F: R |
GTTTGTGGATCATCTCTATGCG : TGCTTCTTCCTTCTATCTCACTC |
Pl 6 |
|
Ha-P1 |
F: R |
GCCCAAAATTGAAAGAAAGGTGTG : GGCGAAATTGGTTCCCGTGAGTCG |
Pl 5 , Pl 8 |
|
Ha-P2 |
F: R |
AATCTTGAGTCATTACCCGAGC : CAGCGTCTCTGGTAGATCGTTCACC |
Pl 5 |
|
Ha-P3 |
F: R |
TAGTTAACCATGGCTGAAACCGCTG : TTTGAAAGATAAGTTCGCCTCTCG |
Pl 5 , Pl 8 |
|
Ha-P4 |
F: R |
GCTGTTACTGCCCTCTTCAAAGTC : CCCAACTCGACATATCTTCAAACC |
Pl 8 |
|
Ha-P5 |
F: R |
TAGTTAACCATGGCTGAAACCGCTG : CCCCATATTGACAAAGAGTTGAGG |
Pl 8 |
|
Ha-P6 |
F: R |
TAGTTAACCATGGCTGAAACCGCTG : CGTCTCTGGTAGATCGTTCACCTT |
Pl 8 |
Полимеразную цепную реакцию проводили в 25 мкл реакционной смеси сле- дующего состава: 67 мМтрис – HCl, рН 8,8; 16мМ (NH4)2SO4, 2,5 мМ MgSO4, 0,1 мМ меркаптоэтанола, 0,25 мМ каждого ДНТФ (ДАТФ, ДЦТФ, ДТТФ, ДГТФ), по 20 пМ праймеров; 2,5 ед. Taq-полимеразы, 15 нг выделенной ДНК. Амплификацию проводили в термоциклере PalmCycler (Corbett Research, Австралия).
Термальный режим реакций подбирали для каждой пары праймеров с учетом их нуклеотидного состава. Для большинства проведенных реакций оптимальным оказался терморежим с начальной денатурацией при 95 оС в течение 3 мин., затем 35 циклов при соблюдении температурновременного режима: отжиг при 60 оС в течение 30 сек., элонгация – 2 мин. при 72 оС, денатурация при 95 оС – 30 сек., финальная элонгация – 1 мин. Для остальных режим амплификации был следующим: начальная денатурация – 94 ºС – 3 мин., затем 33 цикла: 94 ºС – 10 сек., 60 ºС – 30 сек. и 72 ºС – 1 мин. 30 сек.; финальная элонгация – 5 мин. при 72 ºС.
Продукты амплификации разделяли в 1 %-ном агарозном геле с бромистым этидием, используя трис-боратный буфер. После окончания электрофореза гели фотодокументировали (GelDoc 2000, BioRad, США). В качестве маркера массы, использовали Gene Ruler 1 Kb DNA Ladder (Fermentas).
Результаты и обсуждение. В лабораторных условиях методом искусственного заражения проростков подсолнечника спорами гриба Plasmopara halstedii проведена оценка устойчивости 16 отцовских линий (Rf-линии) к двум расам ложной мучнистой росы – 330 и 710. Из 16 изученных линий (табл. 2) 5 линий – J-6/1285, J-8/154, J-11/420, J-11/536 и J-7/465 устойчивы как к 330, так и 710 расам ЛМР. Шесть линий – J-5/2884, J-7/108, J-10/256, J-10/186, J-9/508 и J-9/428, напротив, неустойчивы к этим расами. Остальные пять линий – J-5/3452, J-5/2586, J-7/381, J-11/385 и J-11/112 не поражались расой 330, но оказались неустойчивыми к расе 710. Таким образом, в результате лабораторных ис- следований были определены линии подсолнечника, контрастно различающиеся по степени поражения ЛМР. Так как устойчивость к возбудителю ЛМР у подсолнечника контролируется доминантными генами, нами протестированы известные STS-маркеры трех Pl-локусов – Pl5, Pl6 и Pl8 ассоциированных с устойчивостью подсолнечника к ЛМР на линиях демонстрирующих различное проявление признака устойчивости к заболеванию с целью определить наиболее информативные для маркер-вспомогательной селекции. Такие ДНК-маркеры могут быть полезными для быстрой идентификации потенциально устойчивых к этому патогену генотипов в больших выборках, что позволит более эффективно решать проблему устойчивости к ЛМР этой сельскохозяйственной культуры.
Таблица 2
Линии подсолнечника, изученные по степени поражения расами 330 и 710 ложной мучнистой росы
|
Линия |
Степень поражения ложной мучнистой росой, % |
|
|
раса 330 |
раcа 710 |
|
|
J-5/3452 |
0 |
100 |
|
J-5/2884 |
100 |
100 |
|
J-5/2586 |
0 |
91,7 |
|
J-6/1285 |
0 |
0 |
|
J-7/108 |
100 |
100 |
|
J-10/256 |
100 |
100 |
|
J-7/381 |
0 |
100 |
|
J-8/154 |
0 |
0 |
|
J-11/385 |
0 |
100 |
|
J-11/420 |
0 |
0 |
|
J-11/536 |
0 |
0 |
|
J-11/112 |
0 |
100 |
|
J-7/465 |
0 |
0 |
|
J-10/186 |
100 |
100 |
|
J-9/508 |
92 |
100 |
|
J-9/428 |
100 |
100 |
Из 9 изученных STS-маркеров (табл. 1) только два – НаР2 и НаР3 – маркирующие локус Pl6 оказались информативными и позволили из 5, устойчивых к ЛМР линий, маркировать 4 линии: J-6/1285, J-8/154, J-11/420 и J-7/465. При этом в генотипе устойчивых линий определены специфичные ПЦР-фрагменты размером около 1200 п.н. (НаР2) и 1800 п.н. (НаР3), что согласуется с данными представленными в работе [2]. Интересно отметить, что третий из маркеров локуса Pl6 – HaP1, праймеры которого фланкируют участок (около 2000 п.н.), включающий маркерные последовательности НаР2 и НаР3, не позволил идентифицировать устойчивые генотипы. Протестированные STS-маркеры локусов – Pl5 и Pl8 (табл. 1) не позволили определить устойчивые к ЛМР генотипы, так как одинаково представлены у всех исследованных линий. Необходимо отметить, что у подсолнечника болезнь может не проявляться на ранних этапах роста растения [12]. Кроме того показано, что здоровые по внешним признакам растения подсолнечника, выросшие в окружении больных, дают семена, которые являются носителями инфекционного начала возбудителя ЛМР [13]. В этой связи растения линии J-11/536 проявившие устойчивость к ЛМР на раннем этапе роста и не маркированные с помощью STS по локусам устойчивости необходимо исследовать в течение всего периода вегетации, а также протестировать семенной материал этих образцов.
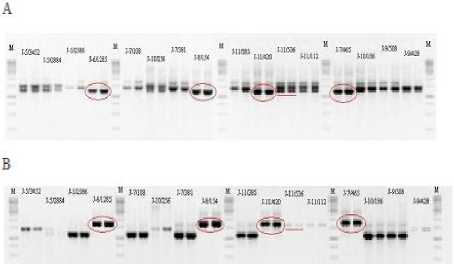
Рисунок – Электрофореграмма продуктов амплификации геномной ДНК линий подсолнечника: А) с праймером НаР2 и В) с праймером НаР3 . Представлены результаты двух независимых ПЦР реакций для каждой линии. Фрагменты уникальные для устойчивых к ЛМР (расы 330 и 710) линий подсолнечника обведены. Чертой отмечен образец, проявивший устойчивость к ЛМР в лабораторных испытаниях, но при этом специфичный ПЦР-фрагмент не идентифицирован.
М – маркер массы (1 Kb).
Заключение. Таким образом, проведена оценка устойчивости Rf -линий подсолнечника селекции Донской опытной станции масличных культур им. Л.А. Жданова ВНИИМК к наиболее распространенным в Ростовской области расам ложной мучнистой росы – 330 и 710. В лабораторных условиях методом искусственного заражения определены линии, контрастно различающиеся по устойчивости к этим расам ЛМР и с помощью 9 STS-маркеров трех Pl -локусов – Pl 5 , Pl 6 и Pl 8 ассоциированных с устойчивостью подсолнечника к ЛМР линии были гено-типированы. Из 9 изученных STS-маркеров только два – НаР2 и НаР3 (локус Pl 6 ) позволили идентифицировать линии продемонстрировавшие устойчивость к ЛМР в условиях искусственного заражения. Изученные ДНК-маркеры НаР2 и НаР3 могут представлять особый интерес в маркер-вспомогательной селекции подсолнечника на устойчивость к заболеванию ЛМР.
Исследование выполнено в рамках государственной темы Министерства образования и науки РФ (регистрационный номер: 4.5642.2011), при финансовой поддержке ФЦП Министерства образования и науки РФ (госконтракт № 16.740.11.0485).


