Гены антибиотикорезистентности, патогенности и вирулентности Staphylococcus aureus и Escherichia coli, выделенных из репродуктивного тракта и молочной железы коров (Bos taurus) при воспалении
Автор: Соколова О.В., Зубарева В.Д., Безбородова Н.А., Бытов М.В., Шкуратова И.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная микробиология
Статья в выпуске: 6 т.59, 2024 года.
Бесплатный доступ
Маститы и метриты - основные заболевания, наносящие молочному скотоводству значительный экономический ущерб, который связан со снижением фертильности и продуктивности, преждевременной выбраковкой высокопродуктивных коров, а также затратами на диагностику и лечение больных животных. В настоящей работе нами впервые проведено генотипирование по генам антибиотикорезистентности, патогенности, вирулентности изолятов Staphylococcus aureus и Escherichia coli , выделенных от крупного рогатого скота на территории Свердловской области. Отмечено наличие изолятов с комбинацией генов, детерминирующих резистентность к антибиотикам и одновременное проявление патогенных и вирулентных свойств. Выявлено, что высокая частота встречаемости генов вирулентности fimA и fimH может иметь важное значение при колонизации E. coli эпителиальных клеток молочной железы и репродуктивного тракта коров. Нашей целью стало изучение генетического профиля изолятов Staphylococcus aureus и Escherichia coli по генам, отвечающим за резистентность к антибактериальным препаратам группы фторхинолонов, цефалоспоринов 2-го поколения, макролидов, аминогликозидов, амфениколов, тетрациклинов, оксазолидинонов, гликопептидов, а также по генам патогенности и вирулентности S. aureus ( sea , seb , sec , seg , tst , luks-PV , lukED , fnbA , fnbB , cna ) и E. coli ( K99 , fim A, fimH , F41 , Sta , STΙa , STΙb , stx1 , stx2 ). Объектом исследования, выполненного в 2021 году, были изоляты E. coli ( n = 26) и S. aureus ( n = 16), выделенные из проб секрета молочной железы и цервико-вагинальных смывов от 29 коров голштинской породы с признаками воспалительного процесса репродуктивного тракта и молочной железы. При микробиологическом исследовании использовали готовые питательные среды: среду Эндо (ФБУН ГНЦ ПМБ), солевой бульон, желточно-солевой агар, элективную солевую среду (агар маннит-солевой) (ООО «BioMedia», Россия), хромогенную среду для E. coli , агар хромогенный для уропатогенных бактерий («Condalab», Испания), двухсахарный агар по Росселю («HiMedia Laboratories Private Limited», Индия). ДНК выделяли с помощью тест-системы для выделения ДНК бактерий Рибо-сорб (ООО «ИнтерЛабсервис», Россия). Чувствительность изолятов к антимикробным препаратам определяли диско-диффузионным методом. Использовали диски с антибиотиками известной концентрации: цефокситин (30 мкг), ципрофлоксацин (5 мкг), левомицетин (30 мкг), тобрамицин (10 мкг), тигециклин (15 мкг), линезолид (30 мкг) (ООО «НИЦФ», Россия). Тестирование на резистентность к линезолиду диско-диффу-зионным методом проводили только в отношении S. aureus в соответствии с Eucast clinical Breakpoint Tables V.12.0. ПЦР-детекцию генетических маркеров антибиотикорезистентности mecA , blaDHA , blaOXA-48 , blaСTX-M выполняли в режиме Real-Time с использованием коммерческих наборов компании ООО НПФ «Литех» (Россия) на анализаторе QuantStudio 5 («Thermo Fisher Scientific», США). Для определения генов антибиотикорезистентности mecA , tetM , vanA , blaFOX , blaEBC , blaACC , blaDHA , blaCITM , blaMOX , blaIMP , генов патогенности E. coli ( stx1 , stx2 ), а также генов вирулентности E. coli ( K99 , fimA , fimH , F41 , Sta , STIa , STIb ) и S. aureus ( sea , seb , sec , seg , tst , luks-PV , lukED , fnbA , fnbB , cna ) использовали специфические олигонуклеотидные праймеры, синтезированные компанией ООО «ДНК-Синтез» (Россия). По результатам ПЦР рассчитывали относительную долю изолятов, положительных по генам патогенности, вирулентности и анибиотикорезистентности, выраженную в процентах. У 12,5 % изолятов S. aureus c фенотипом антибиотикорезистентности были обнаружены гены lukED , кодирующие лейкоцидины. Гены fnbA / B , кодирующие фибронектин-связывающие белки, обнаружены у S. aureus : fnbA - у 18,75 % изолятов, fnbB - у 12,5% (из секрета молочной железы при мастите), fnbB - у 6,25 % (из репродуктивного тракта при эндометрите). В исследованных изолятах S. aureus выявлены паттерны распространения комбинаций генов антибиотикорезистентности с генами вирулентности и патогенности. Для 6,25 % изолятов из репродуктивного тракта коров была характерна комбинация fnbA / fnbB / ermB . У 12,5 % изолятов из секрета молочной железы обнаружено сочетание lukED / fnbB / fnbA / ermB . В 6,25 % изолятов из секрета молочной железы установлена комбинация ermB / ermC / fnbA . В 100% изолятов E. coli с фенотипом антибиотикорезистентности был детектирован ген fimA , при этом в 88,46 % случаев также обнаружен ген fimH , оба гена кодируют факторы адгезии. У одного изолята E. coli , выделенного из цервико-вагинальных смывов коровы с эндометритом, детектирован ген stx2 . Наиболее распространенным сочетанием была комбинация генов fimA / fim H, кодирующих факторы адгезии и регулирующих образование биопленок, она встречалась у 92,31 % изолятов.
Генетический профиль, антибиотикорезистентность, патогенность, вирулентность, escherichia coli, staphylococcus aureus, репродуктивный тракт, молочная железа, крупный рогатый скот
Короткий адрес: https://sciup.org/142244144
IDR: 142244144 | УДК: 619:636.2:577.21:579.62 | DOI: 10.15389/agrobiology.2024.6.1221rus
Текст научной статьи Гены антибиотикорезистентности, патогенности и вирулентности Staphylococcus aureus и Escherichia coli, выделенных из репродуктивного тракта и молочной железы коров (Bos taurus) при воспалении
Заболевания молочной железы и репродуктивного тракта крупного рогатого скота считаются наиболее распространенными и затратными в молочном животноводстве (1). Мастит и эндометрит чаще всего развиваются в результате дисбиотических нарушений и/или инфицирования патогенными и условно-патогенными микроорганизмами, среди которых основными грамположительными и грамотрицательными возбудителями считаются соответственно Staphylococcus aureus и Escherichia coli .
Метриты в послеродовой период обычно возникают из-за неполного закрытия шейки матки и контаминации возбудителями с кожи ( S. aureus ) или вследствие фекального загрязнения ( E. coli ) (2). Маститы, вызываемый этими патогенными агентами, значительно различаются. Ин-трамаммарные инфекции, связанные с E. coli , часто приводят к острому маститу с тяжелыми клиническими проявлениями, реконвалесценция которого наступает в течение нескольких суток. Напротив, симптомы, вызванные S. aureus , обычно менее выражены или отсутствуют, и инфекция может сохраняться в течение длительного периода времени.
Штаммы E. coli и S. aureus , циркулирующие в условиях сельскохозяйственных предприятий, могут представлять значительный риск и для здоровья человека. С одной стороны, возможна передача патогенных кишечной палочки и золотистого стафилококка через пищевые продукты, с мясом или молоком (3-5). С другой стороны, наличие сходных филогрупп, серотипов и генетических детерминант патогенности у представителей E. coli и S. aureus , вызывающих заболевания человека, и изолятов от животных, предполагает, что последние могут быть резервуаром условно-патогенных бактерий, а также возбудителями зоонозных инфекций. Например, испанские ученые описали возможность передачи mcr-1 — гена устойчивости к колистину — антибиотику «последней надежды» в медицине от животных человеку посредством горизонтального переноса генов, обмена плазмидами между изолятами E. coli (6). В публикации E.J. Richardson с соавт. (7) коровы были идентифицированы как основной источник новых патогенных для человека клонов S. aureus .
Мобильный перенос генетических детерминант антибиотикорези-стентности, вирулентности и патогенности представляет собой проблему для здоровья и благополучия животных, а также для общественного здравоохранения. Субклинические формы заболевания могут становиться хроническими, трудноизлечимыми при наличии мультирезистентных токсин-продуцирующих изолятов микроорганизмов, что приводит к увеличению затрат на лечение, а также к преждевременной выбраковке животных. Изучение этих фенотипических и генотипических характеристик изолятов 1222
имеет важное значение для рациональной антибиотикотерапии и профилактики вспышек заболевания (4).
В настоящей работе нами впервые проведено генотипирование по генам антибиотикорезистентности, патогенности, вирулентности изолятов Staphylococcus aureus и Escherichia coli , выделенных от крупного рогатого скота на территории Свердловской области. Отмечено наличие изолятов с комбинацией генов, детерминирующих резистентность к антибиотикам и одновременное проявление патогенных и вирулентных свойств. Выявлено, что высокая частота встречаемости генов вирулентности fimA и fimH может иметь важное значение при колонизации E. coli эпителиальных клеток молочной железы и репродуктивного тракта коров.
Нашей целью стало изучение генетического профиля изолятов Staphylococcus aureus и Escherichia coli по генам, отвечающим за резистентность к антибактериальным препаратам группы фторхинолонов, цефалоспоринов 2-го поколения, макролидов, аминогликозидов, амфениколов, тетрациклинов, оксазолидинонов, гликопептидов, а также по генам патогенности и вирулентности S. aureus ( sea , seb , sec , seg , tst , luks-PV , lukED , fnbA , fnbB , cna ) и E. coli ( K99 , fimA , fimH , F41 , Sta , STIa , STIb , stx1 , stx2 ).
Ìåòîäèêà. Объектом исследования, выполненного в 2021 году, были изоляты E. coli ( n = 26) и S. aureus ( n = 16), выделенные из проб секрета молочной железы и цервико-вагинальных смывов от 29 коров голштинской породы с признаками воспалительного процесса репродуктивного тракта и молочной железы. Животные содержались в условиях сельскохозяйственных предприятий на территории Свердловской области,
Микроорганизмы в биологическом материале выявляли в соответствии со следующими нормативными документами: МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам»; ГОСТ Р ИСО 20776-1-2010 «Клинические лабораторные исследования и диагностические тест-системы in vitro» (М., 2011); ГОСТ 329012014 «Молоко и молочная продукция. Методы микробиологического анализа» (М., 2015); «Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных» ¹ 13-7-2/2117 (утверждены Департаментом ветеринарии Министерства сельского хозяйства 27 июля 2000 года); «Клинические рекомендации. Определение чувствительности микроорганизмов к антимикробным препаратам» (утверждены на расширенном совещании Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии; М., 15.05.2017 г.); CLSI VET06.2017 Methods for antimicrobial susceptibility testing of infrequently isolated or fastidious bacteria isolated from animals. 1st edition; Критерии для интерпретации категорий чувствительности по EUCAST: Clinical breakpoints — bacteria (vv. 8.0, 9.0, 10.0); Экспертные правила EUCAST (2018-2021 г.г.).
При микробиологическом исследовании использовали готовые питательные среды: среду Эндо (ФБУН ГНЦ ПМБ), солевой бульон, желточно-солевой агар, элективную солевую среду (агар маннит-солевой) (ООО «BioMedia», Россия), хромогенную среду для E. coli , агар хромогенный для уропатогенных бактерий («Condalab», Испания), двухсахарный агар по Росселю («HiMedia Laboratories Private Limited», Индия).
Для проверки питательных сред и постановки контроля (подтверждения ростовых свойств) использовали референсные штаммы микроорганизмов Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922.
Учет данных, интерпретацию результатов роста колоний на питательных средах, определение биохимических свойств изолятов проводили в соответствии с инструкциями производителя ООО «НПО «Диагностиче- ские системы» (Россия) к наборам ДС-ДИФ-СТАФИ-16 и Пластины биохимические, дифференцирующие энтеробактерии (ПБДЭ). Морфологические и тинкториальные свойства бактерий проверяли окрашиванием по Граму с микроскопией в проходящем свете (микроскоп Биолан АУ-12, «ЛОМО», СССР).
Чувствительность изолятов к антимикробным препаратам (АМП) определяли диско-диффузионным методом согласно МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» и в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI VET06.2017 1st ed. и CLSI M100-Ed30, 01.01.2020) и EUCAST (версия 12.0, действующая с 01.01.2022 г., .
Использовали диски с антибиотиками известной концентрации: це-фокситин (30 мкг), ципрофлоксацин (5 мкг), левомицетин (30 мкг), тобрамицин (10 мкг), тигециклин (15 мкг), линезолид (30 мкг) (ООО «НИЦФ», Россия). Тестирование на резистентность к линезолиду диско-диффузионным методом проводили только в отношении S. aureus в соответствие с EUCAST Clinical Breakpoint Tables V.12.0.
ДНК выделяли с помощью тест-системы для выделения ДНК бактерий Рибо-сорб (ООО «ИнтерЛабсервис», Россия). Для определения в пробах специфического участка ДНК бактериальных патогенов применяли комплект реагентов тест-систем «ВЕТСКРИН. Стафипол», «ВЕТСКРИН. Колипол» (OOO «Литех», Россия).
ПЦР-детекцию генетических маркеров антибиотикорезистентности mecA , blaDHA , blaOXA-48 , blaÑTX-M проводили в режиме Real-Time с использованием коммерческих наборов компании ООО «НПФ «Литех» (Россия) на анализаторе QuantStudio 5 («Thermo Fisher Scientific», США).
Для определения генов антибиотикорезистентности mecA , tetM , vanA , blaFOX , blaEBC , blaACC , blaDHA , blaCITM , blaMOX , blaIMP , генов патогенности E. coli ( stx1 , stx2 ), а также генов вирулентности E. coli ( K99 , fimA , fimH , F41 , Sta , STIa , STIb ) и S. aureus ( sea , seb , sec , seg , tst , luks-PV , lukED , fnbA , fnbB , cna ) применяли методы ПЦР в реальном времени (RT) или ПЦР по конечной точке с разделением продуктов в агарозном геле. Использовали следующие специфические олигонуклеотидные праймеры, синтезированные компанией ООО «ДНК-Синтез» (Россия):
Ген I Последовательность 5´ → 3´ I Ампликон н.п. J Мишень I Ссылка
Staphylococcus aureus
|
mecA |
F: GTTGTAGTTGTCGGGTTTGG R: CTTCCACATACCATCTTCTTTAAC |
336 |
Пенициллин-связыва-ющий белок PBP 2A |
(8) |
|
tetM |
F: GTGGACAAAGGTACAACGAG R: CGGTAAAGTTCGTCACACAC |
406 |
Ген, кодирующий белки защиты рибосом |
(9) |
|
vanA |
F: ATGAATAGAATAAAAGTTGC R: TCACCCCTTTAACGCTAATA |
1032 |
Ген, контролирующий изменение путей синтеза пептидогликана |
(9) |
|
sea |
F: AGATCATTCGTGGTATAACG R: TTAACCGAAGGTTCTGTAGA |
408 |
Энтеротоксин А |
(9) |
|
sea (RT) |
F: AAAATACAGTACCTTTGGAAACGGTT R: TTTCCTGTAAATAACGTCTTGCTTGA Probe: AACGAATAAGAAAAATGTAAC-TGTTCAGGAGTTGGATC (FAM) |
92 |
(10) |
|
|
seb |
F: ACACCCAACGTTTTAGCAGAGAGTCA R: TCCTGGTGCAGGCATCATGTCA |
633 |
Энтеротоксин В |
(11) |
|
Seb (RT) |
F: ACACCCAACGTTTTAGCAGAGAG R: CCATCAAACCAGTGAATTTACTCG Probe: CAACCAGATCCTAAACCAGATGAG- TTGCACA (FAM) |
81 |
(10) |
|
|
sec |
F: CTCAAGAACTAGACATAAAAGCTAGG R: TTATATCAAAATCGGATTAACATTATC |
271 |
Энтеротоксин С |
(12) |
|
Sec (RT) |
F: AATAAAACGGTTGATTCTAAAAGTGTGAA R: ATCAAAATCGGATTAACATTATCCATTC Probe: TAGAAGTCCACCTTACAACAA (FAM) |
80 |
(10) |
Ïðîäîëæåíèå
|
seg |
F: TGCTATCGACACACTACAACC R: CCAGATTCAAATGCAGAACC |
704 |
Энтеротоксин G |
(13) |
|
tst |
F: TTATCGTAAGCCCTTTGTTG R: TAAAGGTAGTTCTATTGGAGTAGG F: AAGCCCTTTGTTGCTTGCG R: ATCGAACTTTGGCCCATACTTT |
398 445 |
Токсин синдрома токсического шока |
(9) (14) |
|
luks-PV F: ATCATTAGGTAAAATGTCTG-GACATGATCCA R: GCATCAAGTGTATTGGATAGCAAAAGC |
433 |
Субъединица PVL |
(9) |
|
|
lukED |
F: TGAAAAAGGTTCAAAGTTGATACGAG R: TGTATTCGATAGCAAAAGCAGTGCA |
269 |
Экзотоксины лейкоцидины |
(15) |
|
fnbA fnbA (RT) |
F: GTGAAGTTTTAGAAGGTGGAAAGATTAG R: GCTCTTGTAAGACCATTTTTCTTCAC F: AGTGAGCGACCATACAACAG R: CATAATTCCCGTGACCATTT Probe: AAGCACAAGGACCAATCGAGG (FAM) |
643 185 |
Фибронектин-связыва-ющий белок А |
(16) (17) |
|
fnbB |
F:GTAACAGCTAATGGTCGAATTGATACT R:CAAGTTCGATAGGAGTACTATGTTC |
524 |
Фибронектин-связыва-ющий белок B |
(16) |
|
cna |
F: GTCAAGCAGTTATTAACACCAGAC R: AATCAGTAATTGCACTTTGTCCACTG F: AAAGCGTTGCCTAGTGGAGA R: AGTGCCTTCCCAAACCTTTT Escherichia |
423 192 coli |
Коллаген-связывающий белок |
(16) (18) |
|
blaFOX F: AACATGGGGTATCAGGGAGATG R: CAAAGCGCGTAACCGGATTGG blaEBC F: TCGGTAAAGCCGATGTTGCGG R: CTTCCACTGCGGCTGCCAGTT blaACC F: AACAGCCTCAGCAGCCGGTTA R: TTCGCCGCAATCATCCCTAGC blaDHA F: AACTTTCACAGGTGTGCTGGGT R: CCGTACGCATACTGGCTTTGC blaCIT F: TGGCCAGAACTGACAGGCAAA M R: TTTCTCCTGAACGTGGCTGGC blaMOX F: GCTGCTCAAGGAGCACAGGAT R: CACATTGACATAGGTGTGGTGC |
190 302 346 405 462 520 |
Бета-лактамазы типа AmpC |
(19) |
|
|
blaIMP |
F: GGAATAGAGTGGCTTAACTCTC R: CCAAACTACTAGGTTATCT |
189 |
Металло-бета-лактамазы |
(20) |
|
blaVIM |
F: AGTGGTGAGTATCCGACAG R: TGCAACTTCATGTTATGCCG |
740 |
Карбапенемазы |
(21) |
|
tetM |
F: ACAGAAAGCTTATTATATAAC R: TGGCGTGTCTATGATGTTCAC |
850 |
Ген, кодирующий белки защиты рибосом |
(22) |
|
arr2 |
F: AATTACAAGCAGGTGCAAGGA R: TTCAATGACGTGTAAACCACG |
414 |
Ген, кодирующий АДФ-риболизирование |
(23) |
|
K99 |
F: TATTATCTTAGGTGGTATGG R: GGTATCCTTTAGCAGCAGTATTTC |
314 |
Пили К99 |
(24) |
|
fimA fimH |
F: TGGTGGGACCGTTCACTTTA R: AAGGTCGCATCCGCATTAG F: ATGAAACGAGTTATTACCCTGTTTG R: TTATTGATAAACAAAAGTCACGCC |
443 903 |
Белковая субъединица пили FimA Адгезин fimH |
(25) |
|
F41 |
F: GCATCAGCGGCAGTATCT R: GTCCCTAGCTCAGTATTATCACCT |
380 |
Пили F41 |
(26) |
|
STa |
F: GCTAATGTTGGCAATTTTTATTTCTGTA R: AGGATTACAACAAAGTTCACAGCAGTAA |
190 |
Энтеротоксин STa |
(27) |
|
ST Ι a ST Ι b |
F: TTTCCCCTCTTTTAGTCAGTCAA R: GCAGGATTACAACACAATTCACAGCAG F: TGCTAAACCAGTAGAGTCTTCAAAA R: GCAGGATTACAACACAATTCACAGC |
159 138 |
Подтип энетеротоксина STa |
(28) |
|
stx1 stx1 (RT) stx2 stx2 |
F: CAGTTAATGTGGTGGCGAAGG R: CACCAGACAATGTAACCGCTG F: GTGGCATTAATACTGAATTGTCATCA R: GCGTAATCCCACGGACTCTTC Probe: TGATGAGTTTCCTTC-TATGTGTCCGGCAGAT (ROX) F: ATCCTATTCCCGGGAGTTTACG R: GCGTCATCGTATACACAGGAGC F: GATGTTTATGGCGGTTTTATTTGC |
348 109 584 83 |
Шигатоксин |
(24) (29) (24) (29) |
(RT) R: TGGAAAACTCAATTTTACCTTTAGCA
Probe: TCTGTTAATGCAATGGCGGCGGATT
(FAM)
П римечание. RT — ПЦР в реальном времени. Для остальных генов продукты разделяли в агарозном геле.
Амплификацию геномной ДНК в обоих вариантах ПЦР проводили в объеме 10,75 мкл реакционной смеси, включающей 1,075 мкл SE-буфера (НПК «SibEnzyme», Россия), по 0,375 мкл прямого и обратного праймеров с концентрацией рабочей смеси 10 мкМ, 0,25 мкл MgCl2 с концентрацией рабочей смеси 50 мМ, 0,2 мкл dNTP, 0,125 мкл полимеразы (НПК «SibEn-zyme», Россия), а также по 0,375 мкл зонда (в RT-ПЦР). Реакция амплификации в обоих вариантах ПЦР выполнялась в автоматически программируемом термоциклере Real-time CFX96 Touch («Bio-Rad Laboratories, Inc.», США) по программам, подобранным для соответствующих праймеров с учетом их структуры и ожидаемого размера продукта ПЦР:
|
Гены |
Программа амплификации |
||
|
начальная денатурация |
денатурация, отжиг, пролонгация |
окончательная пролонгация |
|
°
°
°
°
blaFOX , blaEBC , blaACC , blaDHA , blaCITM , blaMOX mecA , tetM , vanA , sea , seb , sec , seg , tst , luks-PV , lukED , fnbA , fnbB , cna , blaIMP , bla-VIM , arr2 , K99 , fimA , fimH , F41 , STa , ST Ι a , ST Ι b , stx1 , stx2 sea , seb , sec , fnbA , stx1 , stx2 Real Time ПЦР
5 мин при 95 (1 цикл)
5 мин при 95 (1 цикл)
5 мин при 95 (1 цикл)
°
С
°
С
°
С
с с с с
при при при при
С, 30 с при 65
С (35 циклов)
С, 30 с при 60
С (35 циклов)
С,
°
°
С,
мин
при
мин
°
при
С (1 цикл)
°
С (1 цикл)
с
с
при 94
при 72
°
°
С, 30 с при 60
С (35 циклов)
° с,
мин
при
°
С (1 цикл)
Электрофорез продуктов амплификации проводили с использованием 3 % агарозного геля, окрашенного бромистым этидием, при напряжении 190 В. Размер ампликонов определяли с использованием маркера длин ДНК с шагом 100 н.п. (НПК «SibEnzyme», Россия).
По результатам ПЦР-исследований рассчитывали относительную долю изолятов с выявленными генами патогенности, вирулентности и ан-тибиотикорезистентности, выраженную в процентах.
Ðåçóëüòàòû . Для выделения и идентификации микроорганизмов рода Staphylococcus использовали солевой бульон с пересевом на желточносолевой агар и элективную солевую среду. В процессе микробиологических исследований наблюдали круглые блестящие желтые колонии с ровными краями (0,5-1,5 мм в диаметре), окруженные зоной пожелтения. После получения чистой суточной культуры под микроскопом визуализировали грамположительные кокки, располагающиеся единично, попарно, в виде гроздевидных скоплений. Эти изоляты были отнесены к коагулазоположительным стафилококкам, поскольку обладали способностью коагулировать плазму крови кролика, что подтверждало их принадлежность к S. aureus . Также изоляты, ферментирующие маннит, сахарозу, трегалозу, лактозу, мальтозу, маннозу, целлобиозу и не расщепляющие арабинозу, ксилозу, рибозу, но продуцирующие ферменты р -глюкозидазу, аргининдигидролазу, уреазу, нитритредуктазу в соответствии с инструкцией к набору ДС-ДИФ-СТАФИ-16 были отнесены к S. aureus ssp. aureus .
Для выделения и идентификации представителей группы Enterobac-teriaceae посев осуществляли на МПБ с последующим пересевом на дифференциально-диагностические среды. На среде Эндо наблюдали рост плоско-выпуклых колоний темно-красного цвета с металлическим блеском. Кроме того, проводили посевы на хромогенный агар для E. coli и хромогенный агар для уропатогенных бактерий для дополнительной идентификации изолятов E. coli. Для получения чистых изолятов колонии пересевали на скошенный агар МПА. При микроскопии мазков наблюдали гра-мотрицательные палочки. Далее проводили пересев изолятов на двухсахарный агар по Росселю и Пластины биохимические, дифференцирующие энтеробактерии (ПБДЭ). Колонии бактерий, ферментирующие глюкозу, сахарозу, образующие газ, цитрат-отрицательные, грамотрицательные па- лочки, были отнесены к виду Escherichia coli.
По результатам микробиологических исследований выделенных изо-лятов на антибиотикорезистентность диско-диффузионным методом было установлено, что 100 % изолятов E. ñoli обладали резистентностью к тобрамицину, 69,23 % — к тигециклину, 50 % — к цефокситину, 30,77 % — к ципрофлоксацину, 23,08 % — к левомицетину; 100 % изолятов S. aureus оказались устойчивы к ципрофлоксацину, 50 % — к тигециклину, 37,5 % — к тобрамицину, 25 % — к цефокситину и линезолиду, 12,5 % — к левомицетину.
При определении генетических детерминант антибиотикорезистент-ности выявлено, что среди изолятов золотистого стафилококка преимущественно преобладали гены семейства erm — ermA , ermB и ermC . По данным литературы, ermA и ermÑ встречаются наиболее часто (30, 31), однако в наших исследованиях у 100 % изолятов обнаружен ген ermB , у 37,5 % — ermC , у 18,75 % — ermA . Ген ermA находится в транспозоне Tn554, расположенном в стафилококковой хромосомной кассете (SCC mec ) II и III типа (32). Ген ermB локализуется в Tn1545 на плазмиде pMCCL2 (22). Ген ermC у стафилококков обычно находится на небольших плазмидах размером от 2,5 до 5 тыс. п.н. (33). Уже имеются данные об обнаружении этого семейства генов при мастите у крупного рогатого скота (34, 35). В наших исследованиях 68,75 % изолятов S. aureus , в которых обнаруживали гены резистентности семейства erm , были выделены из секрета молочной железы коров при воспалении, что согласуется с данными литературы.
Гены tetM и mecA детектировали у 18,75 % изолятов S. aureus . Ген mecA определяет устойчивость стафилококков к метициллину, изучение частоты его распространения имеет важное значение в эпидемиологическом мониторинге нозокомиальных инфекций. Ген mecA кодирует низкоаффинный пенициллин-связывающий белок PBP 2A. Метициллин-резис-тентный золотистый стафилококк (Methicillin-resistant Staphylococcus aureus , MRSA) приобретает устойчивость к β -лактамным антибиотикам за счет получения дополнительной копии связывающего пенициллин белка 2a (PBP2a), который служит мишенью для β -лактамных антибиотиков и сохраняет свою функциональность в их присутствии (36, 37).
Ген mecA — часть стафилококковой хромосомной кассеты mec размером от 21 до 60 тыс. п.н. (SCC mec ), мобильного генетического элемента, который также может содержать генетические структуры, такие как Tn554, pUB110 и pT181, кодирующие устойчивость и к другим антибиотикам, помимо β -лактамных (8, 38). Сообщалось, что у коров метициллин-устой-чивые изоляты S. aureus были выделены разными методами из проб молока при маститах (39, 40). В наших исследованиях 12,5 % изолятов S. aureus с геном mecA были также выделены из молока коров при мастите, а 6,25 % изолятов с этим геном были изолированы из цервико-вагинальных соско-бов коров с эндометритом. При этом 31,25 % изолятов с геном mecA были определены как MRSA при культуральном исследовании с постановкой диско-диффузионного метода с тигециклином, линезолидом (при одновременной устойчивости к каждому из препаратов).
Резистентность к тетрациклинам у S. aureus была обусловлена геном tetM, который, как известно, располагается в транспозонах Tn916 и Tn1545 и опосредует защиту противомикробной мишени — рибосомы. Несмотря на высокое содержание лекарственного средства внутри бактериальной клетки, рибосома все еще может функционировать из-за сложных взаимодействий с другими белками, которые производятся бактериями; белки препятствуют связыванию тетрациклина с рибосомой и обеспечи- вают некоторую степень защиты от него (9). Исследователи в основном выявляли гены tetM у изолятов от коров с субклиническим и острым маститом, при этом изоляты золотистого стафилококка были охарактеризованы при помощи фенотипических методов, определения чувствительности к антибиотикам, ПЦР и полногеномного секвенирования (41, 42). Из 18,75 % изолятов S. aureus с геном tetM, выявленных в настоящем исследовании, 12,5 % были также детектированы от коров с субклиническим воспалением молочной железы.
При генотипировании E. coli в 15,38 % изолятах был обнаружен ген blaDHA , определяющий один из механизмов устойчивости E. coli к β -лактамам (цефалоспоринам широкого спектра действия). Этот ген расположен в плазмиде и кодирует фермент DHA-1 — β -лактамазу ampC (43). В ответ на действие цефалоспоринов увеличивается транскрипция мРНК этого фермента, гидролизующего β -лактамное кольцо, что приводит к деактивации антибиотика. Ген blaOXA-48 , который определяет еще один механизм устойчивости к β -лактамам, обнаружен у 11,54 % изолятов кишечной палочки. Ген blaOXA-48 E. coli кодирует карбапенемазу класса D, встречается на плазмидах из группы несовместимости IncL и IncFII, характеризующихся малыми размерами (60-70 Кб), на транспозонах Tn1999 и Tn1999.2 и на хромосоме в составе транспозона Tn6237 (44). Этот ген и был обнаружен в изолятах E. coli, полученных из проб фекалий от крупного рогатого скота (45). В нашей работе все изоляты E. coli с геном blaOXA-48 были выделены из репродуктивного тракта коров при эндометрите.
Распространение генов антибиотикорезистентности у изолятов S. aureus и E. coli представлено на рисунке 1.
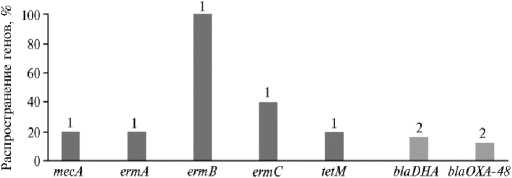
Рис. 1. Распространение генов антибиотикорезистентности у изолятов Staphylococcus aureus (1) и Escherichia coli (2) , выделенных из проб секрета молочной железы и цервико-вагинальных смывов коров голштинской породы c признаками воспалительного процесса репродуктивного тракта и молочной железы (Свердловская обл., 2021 год).
Гены tetM , blaCTX-M , blaFOX , blaEBC , blaACC , blaDHA , blaCITM , blaMOX , blaIMP , arr2 у изолятов E. coli , выделенных из репродуктивного тракта и молочной железы коров, не были обнаружены. Также не были детектированы гены blaVIM , vanA у изолятов S. aureus.
Сопоставление данных о фенотипической и генетически детерминированной антибиотикорезистентности показало, что 100 % изолятов E. coli , в ДНК которых идентифицирован ген blaDHA , были чувствительны к це-фокситину. Половина изолятов S. aureus с генотипом tetM были резистентны к тигециклину, тогда как остальные 50 % оказались к нему чувствительны. Следовательно, различные эндогенные и экзогенные факторы влияют на реализацию механизма резистентности, кодируемого тем или иным геном, то есть наличие гена антибиотикорезистентности не всегда сопровождается ее фенотипическим проявлением.
Значимые для этиологии заболеваний репродуктивного тракта и молочной железы патогенные E. coli и S. aureus имеют широкий спектр генов, кодирующих факторы вирулентности. Вирулентность золотистого стафилококка детерминируется генами, опосредующими адгезию (фибро-нектин-связывающие белки, коллаген-связывающие белки), инвазивность (лейкоцидины, экзотоксины), альтерацию и иммунорезистентность.
В нашей работе у изолятов S. aureus c фенотипом антибиотикоре-зистентности не были обнаружены гены, кодирующие стафилококковые энтеротоксины A, B, C1 и D ( sea , seb , sec ), ген токсина синдрома токсического шока 1, ген luks-PV лейкоцидина Пантона-Валентайна (PVL), ген cna , кодирующий коллаген-связывающий белок.
Среди выделенных из репродуктивного тракта и молочной железы коров изолятов S. aureus с фенотипом антибиотикорезистентности гены lukED , кодирующие лейкоцидины, выявлены у 12,5 % исследованных микроорганизмов. Известно, что гены lukED , наряду с другими генами вирулентности ( tst , egc ), располагаются на островках патогенности (46). LukED — это токсин, формирующий поры в мембранах клеток-хозяев и вызывающий гемолиз. Этот лейкоцидин состоит из двух растворимых мономеров: S-субъединицы, которая распознает эритроциты с помощью антиген рецептора Даффи, и F-субъединицы, которая связывается с S-субъединицей и также способна связываться с эритроцитами (47). Этот фактор вирулентности описан при различных инфекциях у людей, однако у коров не изучен (15, 48).
Генотипирование изолятов E. coli из репродуктивного тракта и молочной железы коров не выявило адгезивных штаммов K99 и F41. Патогенность E. coli обусловлена наличием генов, детерминирующих факторы вирулентности. К факторам патогенности у E. coli относят фимбриальные и нефимбриальные адгезины, экзотоксины, липополисахарид, факторы инвазии. Важными факторами, определяющими вирулентность кишечной палочки и тяжесть патологического процесса, служат экзотоксины, которые участвуют в адгезии и инвазии, альтерации и апоптозе клеток (49).
Ген fnbA был обнаружен у изолятов S. aureus в 25 % случаев, fnbB — в 31,25 % случаев. Фибронектин-связывающие белки А и В (FnBPA и FnBPB) опосредуют адгезию Staphylococcus aureus к фибриногену, эластину и фибронектину. FnBPA и FnBPB кодируются двумя близко сцепленными генами fnbA и fnbB , соответственно (50). Фибронектин-связывающие белки (FnBPA и FnBPB) выявлялись при различных патологических состояниях, таких как глазной кератит и остеомиелит у людей (51). FnBPA/B также относятся к медиаторам сигнальных клеток и актиновой перестройки цитоскелета (52). Гены fnbA / B влияют на формирование биопленки с помощью механизма самоассоциации, который отличается от связывания лиганда и вирулентности (53). У коров эти гены вирулентности были обнаружены в пробах молока, отобранных из общих резервуаров для хранения молока, то есть от клинически здоровых животных. Наличие генов вирулентности в молоке исследователи связывают с нарушением санитарно-гигиенических условий содержания животных, нарушением техники доения, неблагополучным санитарным состоянием доильного оборудования (54). В нашей работе в изолятах, выделенных из секрета молочной железы коров при мастите, ген fnbA был обнаружен в 18,75 % случаев, ген fnbB — в 12,5 %. Среди изолятов, выделенных из цервико-вагинальных смывов коров при эндометрите, эти гены обнаружены у 6,25 % образцов.
В изолятах S. aureus мы выявили паттерны распространения комбинаций генов антибиотикорезистентности с генами вирулентности и патогенности. Для 6,25 % изолятов из репродуктивного тракта коров была характерна комбинация fnbA/fnbB/ermB. У 12,5 % изолятов из секрета молочной железы обнаружено сочетание lukED/fnbB/fnbA/ermB. В 6,25 % изолятов из секрета молочной железы была установлена комбинация ermB/ermC/fnbA.
В 100 % изолятов E. coli с фенотипом антибиотикорезистентности был детектирован ген fimA , при этом в 88,46 % случаев обнаружен ген fimH . Известно, что ген fim — наиболее распространенный фактор адгезии, встречающийся у более чем 95 % всех уропатогенных E. coli. Белковые субъединицы FimA, которые собираются в спиральную четвертичную структуру, служат составной частью стержней пилей типа 1 (F1) E. coli. Также имеются сообщения об ингибировании апоптоза клеток растворимой формой белка FimA. FimA связывается с митохондриями посредством взаимодействия с VDAC1 (потенциал-зависимый анионный канал-1) на ранней стадии инфицирования и диссоциирует от митохондрий непосредственно перед началом высвобождения цитохрома C, служащего фактором апоптоза (55). Этот фактор вирулентности был обнаружен бразильскими исследователями в образцах молока коров с клиническим маститом, диагностику проводили с помощью ПЦР (56, 57). Мы обнаружили ген fimA в изолятах как из цервико-вагинальных соскобов (69,23 % изолятов), так и из секрета молочной железы (30,77 % изолятов).
Адгезин fimH содержится в пилях F1 уропатогенной E. coli (UPEC). Он распознает маннозные единицы в гликопротеиновом рецепторе Uroplakin Ia. Такое связывание необходимо для инициации инфекции, поскольку оно позволяет бактериям закрепиться на поверхности уротелия и препятствует их удалению. Также FimH-опосредованное связывание бактерий с рецепторами поверхности клеток может активировать основные ответы клеток-хозяев, что приводит к локальной реорганизации актинового цитоскелета и поглощению бактерий. Подобная инвазия в клетки уротелия изолирует патогены от широкого набора внеклеточных механизмов защиты хозяина, способствует апоптозу и отслоению клеток уротелия, позволяет патогену размножаться внутриклеточно или сохраняться в состоянии покоя в клетках-хозяевах и обеспечивает бактериальный резервуар для рецидивирующей инфекции (58). Наличие гена вирулентности fimH в геноме UPEC приводит к повышению не только их адгезивной активности, но и способности формировать биопленки (56). Ген fimH был обнаружен в образцах фекалий и молока здоровых коров, что позволило считать их резервуаром уропатогенной E. coli (59). В наших исследованиях ген fimH в 80,77 % случаев был обнаружен в изолятах из репродуктивного тракта коров и только в 11,54 % — в изолятах из секрета молочной железы.
У одного изолята E. coli (3,85 %), выделенного из цервико-вагинальных смывов коровы с эндометритом, был детектирован ген stx2 . Он служит одним из основных факторов патогенности E. coli , отвечая за продукцию шига-токсина. Цитотоксин проникает в клетку и отщепляет специфическое адениновое основание от 28S РНК 60S субъединицы рибосомы, тем самым останавливая синтез белка, что приводит к разрушению слизистой оболочки и кровоизлиянию (60). Ген stx2 обнаруживали у изо-лятов кишечной палочки, выделенных из фекалий как здоровых коров, так и животных с признаками энтерита (61, 62). В связи с этим можно предположить, что желудочно-кишечный тракт животных становится резервуаром для энтерогеморрагических подтипов E. coli , которые поступают в репродуктивную систему животных через загрязнения фекалиями или гематогенным путем.
Распространение генетических факторов вирулентности и патогенности у изолятов S. aureus и E. coli представлено на рисунке 2. Наиболее частой была комбинация адгезинов fimA / fimH (у 92,31 % изолятов E. coli ). 1230
Ген адгезина fimA вместе с геном антибиотикорезистентности blaDHA выявлен у 3,85 % изолятов, выделенных из секрета молочной железы коров. Наличие двух генов адгезина с одновременным присутствием гена резистентности blaDHA отмечали у 3,85 % изолятов из репродуктивного тракта коровы при эндометрите. Комбинацию fimA / fimH / blaDHA / blaOXA-48 обнаружили у 3,85 % изолятов из секрета молочной железы при мастите. Одновременное присутствие 5 генов в комбинации адгезинов, цитотоксина и резистентности к АМП fimA / fimH / stx2 / ermA / ermB было установлено у 3,85 % изолятов кишечной палочки, выделенной из цервико-вагинального соско-ба коровы с воспалением репродуктивного тракта.
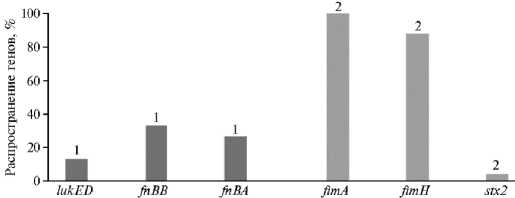
Рис. 2. Распространение генов вирулентности и патогенности у изолятов Staphylococcus aureus (1) и Escherichia coli (2) , выделенных из проб секрета молочной железы и цервико-вагинальных смывов коров голштинской породы с признаками воспалительного процесса репродуктивного тракта и молочной железы (Свердловская обл., 2021 год).
Таким образом, мы провели генотипирование по детерминантам антибиотикорезистентности, патогенности, вирулентности этиологически значимых в индуцировании воспалительных заболеваний крупного рогатого скота изолятов Staphylococcus aureus и Escherichia coli . Выявлено, что наличие определенных генов не всегда приводит к фенотипическому проявлению признака и зависит от ряда экзогенных и эндогенных факторов. Обнаружены изоляты с комбинацией генов, обусловливающих резистентность к антибиотикам и одновременное проявление патогенных и вирулентных свойств. У изолятов S. aureus , выделенных из секрета молочной железы, наиболее распространенной комбинацией генов антибиотикоре-зистентности и вирулентности была seg / lukED / lukS-PV / ermB . Практически у всех изолятов E. coli выявлено сочетание адгезинов fimA / fimH . Можно сделать вывод, что эта комбинация генов участвует в колонизации E. coli эпителиальных клеток молочной железы и репродуктивного тракта коров. Полученные нами данные следует учитывать при мониторинге по-лирезистентных форм оппортунистических и патогенных микроорганизмов на сельскохозяйственных предприятиях, обосновании регламентов применения антибактериальных препаратов, подборе оптимальных схем лечения, предотвращении новых вспышек заболеваний за счет ингибирования горизонтального переноса генов, ассоциированных с патогенными свойствами, между микроорганизмами. Дальнейшие исследования могут быть направлены на генотипирование по генам антибиотикорезистентности, патогенности, вирулентности других наиболее распространенных возбудителей воспалительных заболеваний крупного рогатого скота, например Pseudomonas aeruginosa или Trueperella pyogenes .


