Гепатопротекторное действие модифицированного фитобактериального средства при остром токсическом гепатите
Автор: Максарова Дарима Дамбаевна
Журнал: Вестник Бурятского государственного университета. Биология, география @vestnik-bsu-biology-geography
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
В работе приводятся данные по экспериментальному исследованию гепа- то протекторно го действия модифицированного фитобактериального средства при остром токсическом гепатите в опытах на белых крысах. Обоснованы особенности механизма действия исследуемого средства при острых токсических повреждениях печени. Значительный терапевтический эффект модифицированного фитобактериального средства и нормализация морфофункционального состояния печени характеризуется торможением перекисного окисления липидов в биологических мембранах гепатоцитов, снижением проявлений синдромов воспаления печени, благодаря чему предотвращалась грубая деструкция клеточных и субклеточных образований в органах и тканях, достигалось ускорение митоза клеток и внутриклеточной регенерации.
Белые крысы, заболевания печени, бифидобактерии, штаммы, фитотерапия
Короткий адрес: https://sciup.org/148316868
IDR: 148316868 | УДК: 591.1
Текст научной статьи Гепатопротекторное действие модифицированного фитобактериального средства при остром токсическом гепатите
Гепатопротекторное действие модифицированного фитобактериально-го средства (МФС) исследовано на общепринятых экспериментальных моделях в условиях острого токсического поражения печени белых крыс тет-рахлорметаном CCl 4 .
По данным ВОЗ, заболевания печени также занимают существенное место в мире среди причин нетрудоспособности и смертности населения. Так, гепатит В является самой распространенной вирусной инфекцией, в мире около 2000 млн. инфицированных и 350 млн хронических носителей. Многообразными стали токсические и аллергические повреждения органов гепатобилиарной системы, как результат попадания с пищей и водой различных ксенобиотиков, включая фармакологические препараты. Это обусловливает большое социальное и медицинское значение создания и применения новых лекарственных средств для профилактики и лечения заболеваний органов гепатобилиарной системы, среди которых особого внимания заслуживают лекарственные средства природного происхождения [6].
Печень — самый крупный и сложный в метаболическом отношении орган, выполняющий разнообразные функции по синтезу и детоксикации различных веществ. Заболевания печени — острые и хронические воспалительные заболевания (гепатиты), лекарственные и алкогольные поражения печени, синдром почечной недостаточности, цирроз печени требуют осторожного назначения синтетических лекарственных средств, альтернативой которым является фитотерапия [1].
Комплексное МФС представляет собой сочетанное действие трех компонентов природного происхождения: минерального, растительного происхождения и пробиотика. В современном мире, в условиях усугубляющейся экологической ситуации, все больше внимания уделяется изысканию новых лекарственных средств природного происхождения [2].
Материал и методы исследования
МФС готовили на стерильном обезжиренном коровьем молоке с использованием активизированной чистой культуры бифидобактерий шт. B. longum B 379 M, сухого экстракта плодов шиповника Rosa (ГФ XI, ст. 38) (в экстракте из плодов шиповника аскорбиновой кислоты не менее 0,2%) и природный цеолит (ПЦ) Холинского месторождения (клиноптилолит) фракцией 0,1–1,0 мм (ТУ 2163-002-12763074-97). Содержание клеток бифидобактерий в готовом средстве 8-9 lg КОЕ/см3.
При исследовании возможности культивирования бифидобактерий на молочной основе с экстрактом плодов шиповника и ПЦ выявлено ускорение роста бифидобактерий с повышением их кислотообразующей способности [3].
Морфология клеток бифидобактерий в МФС сохраняла характерную для них бифуркацию, свойственную при культивировании бифидобактерий на среде Блаурокк (рис. 1).
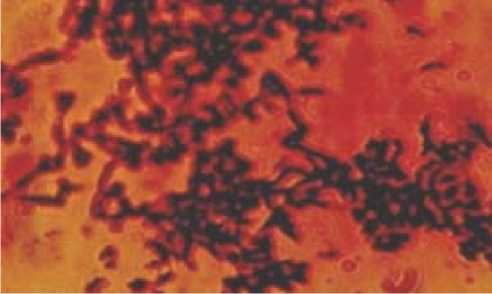
Рис. 1. Бифидобактерии шт. В. longum B 379 M, выращенные на среде Blaurock. Окраска по Граму. Увел. 7 х 90
Характерная для бифидобактерий штамма B.longum B379M микроскопическая картина свидетельствует о том, что условия культивирования, состав питательной среды МФС отвечают требованиям нормального роста бифидобактерий в молоке.
В процессе приготовления бифидосодержащих средств на молочной основе самым важным свойством бактерий считают их быстрый рост и способность сквашивать молоко.
Известно, что бифидобактерии (облигатные анаэробы) почти не растут в молоке, в отличие от молочнокислых бактерий. Развитие бифидобактерий может зависеть от особых веществ, так называемых бифидус-факторов, которые практически отсутствуют в коровьем молоке. Химические исследования показали, что бифидус-факторы представляют собой смесь близких по составу олигосахаридов.
В настоящее время существует несколько направлений для получения олигосахаридов-промоторов (стимуляторов роста) для бифидобактерий. Одним из таких направлений является выделение олигосахаридов из растительного сырья. Стимулирующее действие олигосахаридов объясняется тем, что они играют важную роль в синтезе пептидогликана клеточных стенок бифидибактерий.
МФС вводили per os в дозе 1 мл/100 мг массы животных. В качестве препарата сравнения использовали кверцетин в изоэффективной дозе 50 мг/кг массы 1 раз в сутки. Контрольная группа животных получала дистиллированную воду в эквиобъемном количестве.
Опыты по моделированию острого токсического гепатита проводили на белых беспородных крысах введением 50%-ного масляного раствора тетрахлорметана (CCl 4 ) (ГОСТ 20288-86) в объеме 0,4 мл/100 г массы крысы ежедневно в течение четырех дней, который разводили ex tempore в стерильном оливковом масле в соотношении 1:1 [4, 6].
Экспериментальные исследования проводились в соответствии с Конвенцией по защите животных, используемых в эксперименте и других научных целях, принятой Советом Европы в 1986 г., и требованиями, регламентирующими работу с экспериментальными животными.
Результаты исследования и их обсуждение
По патогистологических исследованиях на 7-е сутки с момента вве-
дения четыреххлористого углерода в печени животных выявлены резкие структурные изменения, которые сводятся к значительным гемодинамическим нарушениям в виде полнокровия междольковых сосудов, расширения просвета центральных вен, утолщения их стенок с миграцией элементов крови в паренхиму органа, периваскулярного отека и расширения перивас- кулярного пространства, а также к выраженным изменениям в форме жировой дистрофии.
В ранние сроки исследования в центре и вокруг некротических очагов отмечено снижение активности сукцинатдегидрогеназы (рис. 2).
В паренхиме органа наблюдается в различной степени выраженная клеточная инфильтрация. Острый процесс повреждения печени тет-рахлорметаном протекает с участием пролиферативно-инфильтрационных реакций с образованием инфильтратов в портальных и перипортальных зонах по ходу кровеносных сосудов и внутри долек.
В печени животных на 7-е сутки (контрольная группа) выявлены резкие структурные изменения в виде периваскулярного отека с очагами некроза. Повреждения носят характер мелкокапельной и среднекапельной жировой дистрофии и клеточной инфильтрации. Характерны гемодинамические нарушения.
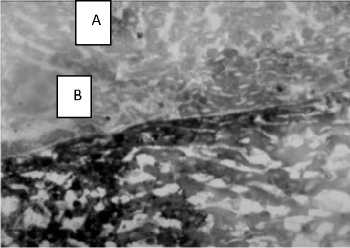
Рис. 2. Острый токсический гепатит, 7-е сутки. Печень белой крысы. Снижение активности сукцинатдегидрогеназы (А) по сравнению с ин-тактом (В). Окраска по Нахласу. Увел. 10 х 10
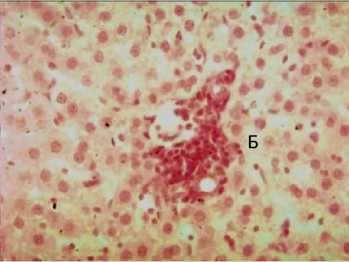
Рис. 3. Острый токсический гепатит, 14-е сутки. Контрольная группа. Печень белой крысы. Выраженная клеточная инфильтрация внутри долек по ходу сосудов и желчному протоку. Окраска гематоксилином и эозином. Увел. 10 х 20
На 14-е сутки все отмеченные нарушения продолжают сохраняться. Также выявлена деструкция стенок кровеносных сосудов, краевое стояние лейкоцитов у стенки сосуда с миграцией клеточных элементов в паренхиму органа. Гепатоциты с боковым или центральным расположением ядра, увеличены в размерах. Выражена клеточная инфильтрация внутри долек по ходу сосудов (рис. 3).
В паренхиме печени обнаруживали очаги некроза, локализованные чаще в центролобулярных зонах.
На фоне введения МФС в печени слабее выражены признаки токсического гепатита, в частности, жировая и клеточная инфильтрация, гемодинамические нарушения. На 7-е сутки введения модифицированного фитобактериального средства в паренхиме органа выявлены гипертрофированные и двуядерные гепатоциты и клетки Купфера. В большинстве случаев отсутствовали выраженные альтеративные изменения, отмечалась сохранность структуры долек и балок.
У животных, получавших МФС, на 14-е сутки опытов гемодинамические нарушения и изменения в печени были выражены в гораздо меньшей степени, чем у контрольных животных. Центролобулярные очаги некроза исчезли, хотя гепатоциты, заполнившие их, еще не приближались к норме. Об активности регенераторных процессов судили по выявлению крупных темноокрашенных клеток с гипохромными ядрами, по частоте митозов и увеличению числа двуядерных гепатоцитов.
Клеточная инфильтрация внутри долек и по ходу сосудов менее выражена. В инфильтратах преобладали гистиолимфоцитарные и макрофагальные элементы.
У животных, получавших МФС, быстрее проходили гемодинамические нарушения, отечный процесс, гораздо раньше по сравнению с контролем происходило замещение некротических очагов в центре долек вновь образованными гепатоцитами и за счет гипертрофии печеночных клеток, не подвергавшихся альтеративным изменениям, быстрее исчезали клеточные инфильтраты.
Во все сроки исследования вышеописанные признаки регенерации выявляли в печени животных, получавших МФС гораздо чаще, чем у животных контрольной группы [3].
При микробиологическом исследовании содержимого толстого отдела кишечника крыс отмечали, что МФС оказывало положительное действие на состав микрофлоры толстого отдела кишечника (табл. 1).
Так, повышался титр бифидобактерий и лактобацилл, снижалось количество энтерококков, стафилококков, клостридий, грибов рода Кандида, возрастало по сравнению с данными у животных контрольной группы количество полноценной формы кишечной палочки и, соответственно, снижалось число бактерий с ослабленными свойствами.
Таблица 1
Влияние модифицированного фитобактериального средства на состав микрофлоры кишечника белых крыс при остром токсическом гепатите (М±m, n=6) lgKOE/см3
|
Группы бактерий |
Интактная группа ( Н2О ) |
Контрольная группа |
Опытные группы, получавшие МФС |
||
|
7 сутки |
14 сутки |
21 сутки |
|||
|
Bifidobacterium sp. |
7,26±0,39 |
4,71±0,32* |
5,84 ±0,22 |
6,08 ±0,31** |
6,63 ±0,26** |
|
Lactobacillussp. |
6,07±0,29 |
4,30±0,18* |
4,39 ±0,26 |
4,92 ±0,17 |
5,53 ±0,24** |
|
Clostridiumsp. |
1,48±0,13 |
3,62±0,19* |
2,83 ±0,20** |
2,53 ±0,14** |
2,00 ±0,16** |
|
E.coli |
5,31±0,23 |
5,58±0,26 |
5,44 ±0,16 |
5,53 ±0,18 |
5,64 ±0,14 |
|
Enterococcussp. |
4,35±0,20 |
6,63±0,25* |
6,21 ±0,23 |
4,93 ±0,22** |
4,09 ±0,21** |
|
Staphylococcus |
3,16±0,15 |
5,00±0,18* |
4,77 ±0,21 |
4,58 ±0,17 |
4,31 ±0,18 ** |
|
Candidasp. |
1,29±0,10 |
3,64±0,18* |
3,23 ±0,14 |
3,08 ±0,22 |
2,63 ±0,18** |
Примечание: * — данные достоверны по сравнению с интактной группой при Р≤ 0,05; ** — данные достоверны по сравнению с контрольной группой при Р≤ 0,05.
Положительный эффект МФС на организм проявляется через нормализацию микробной экологии кишечника за счет стимуляции роста представителей индигенной микрофлоры, в результате синтеза витаминов и других ростстимулирующих факторов, нормализации рН, нейтрализации токсинов, изменения микробного метаболизма.
МФС реализует свое положительное влияние на физиологическую функцию и биохимические реакции либо непосредственно вмешиваясь в метаболическую активность клеток соответствующих органов и тканей, либо опосредовано через регуляцию функционирования биопленок на слизистых организма.
Заключение
В экспериментальных исследованиях на модели острого гепатита выявлена способность МФС подавлять процессы цитолиза, нормализовать активность ферментов и метаболизм в клетках печени. Гепатопро-текторное действие МФС сочетается с гиполипидемическим эффектом, тем самым предупреждая развитие дегенеративных процессов, перерождение клеток печени и возникновение фиброза.
Курсовое назначение исследуемого средства привело к торможению свободнорадикальных реакций в биологических мембранах гепатоцитов.
Скорость накопления МДА к 7 суткам развития токсического гепатита снижалась под действием модифицированного фитобактериального средства в 2,4 раза. Регуляция интенсивности ПОЛ данным средством уменьшала проницаемость и стабилизировала клеточные мембраны гепатоцитов, о чем свидетельствовало снижение активности аланинаминотрансферазы АлАТ под действием МФС на 61%. Активность щелочной фосфатазы в сыворотке крови при введении МФС снижалась почти в 2 раза, содержание общего билирубина также в значительной степени снижалось.
К 14-м суткам развития острого токсического гепатита у крыс исследуемое средство также оказывало благоприятное воздействие. Активность щелочной фосфатазы в сыворотке крови при введении МФС снижалась на 38%. Концентрация гликогена возрастала, по сравнению с показателями в контроле, в 1,5 раза.
К 21-м суткам эксперимента при введении МФС у животных с экспериментальным гепатитом в значительной степени тормозился процесс ПОЛ: содержание МДА в печени снижалось под действием МФС в 1,8 раза. Также стимулировались процессы синтеза гликогена в ткани печени.
Список литературы Гепатопротекторное действие модифицированного фитобактериального средства при остром токсическом гепатите
- Насыбуллина Н. М. Фитотерапия хронических заболеваний печени // Consilium provisorum, 2007. № 5. С. 43-44.
- Максарова Д. Д. Микроэкологические нарушения печени крыс при остром токсическом гепатите // Проблемы охраны окружающей среды и рационального природопользования Прикаспия и сопредельных регионов: материалы IX Междунар. науч.-практ. конф. Элиста, 2010. С. 133-136.
- Максарова Д. Д.Оценка функционального состояния печени белых крыс при фармакотерапии модифицированным фитобактериальным средством в условиях острого токсического гепатита // Структура, функционирование биосистем и экологическая безопасность: материалы науч.-практ. конф., посвящ. 80-летию Бурят, гос. ун-та. Улан-Удэ, 2012. Ч. 2. С. 151-157.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под общ. ред. Р. У. Хабриева. 2-е изд., перераб. и доп. М.: Медицина, 2005. 832 с.
- Экспериментальное моделирование токсического повреждения печени / Скуратов А. Г. [и др.] // Проблемы здоровья и экологии. 2011. № 4(30). С. 27-33.
- Убашеев И. О., Бальхаев И. М., Плеханов А. Н. Коррекция печеночной недостаточности у белых крыс при остром ССЬ-гепатите тибетским лекарственным средством «Манушитан» // Вестник Бурятского госуниверситета. 2011. №12. С. 41-45.


