Гетеротопическая оссификация как побочный эффект применения рекомбинантных человеческих костных морфогенетических белков
Автор: Мухаметов Урал Фаритович, Люлин Сергей Владимирович, Борзунов Дмитрий Юрьевич, Гареев Ильгиз Фанилевич, Бейлерли Озал Арзуман Оглы, Суфианов Альберт Акрамович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Обзор литературы
Статья в выпуске: 1 т.28, 2022 года.
Бесплатный доступ
Введение. Гетеротопическая оссификация (ГО), также известная как оссифицирующий миозит, параостеоартопатия и гетеротопическая кальцификация, среди прочего, является часто встречающимся патологическим состоянием, которое относится к эктопическому образованию кости в мягких тканях. Хотя не до конца понятным остаётся молекулярный механизм ГО, cчитается, что передача сигналов костных морфогенетических белков (BMPs) играет ключевую роль в общем процессе ГО. На сегодняшний день уже активно используются в клинической практике рекомбинантный человеческий BMP-2 (rhBMP-2) и рекомбинантный человеческий BMP-7 (rhBMP-7) в восстановлении костных дефектов. Однако, несмотря на положительные стороны использования rhBMPs, имеется ряд побочных эффектов, одним из которых является ГО. Цель. В данной работе мы продемонстрируем случаи ГО после использования rhBMPs как в клинических, так и в доклинических исследованиях; попытаемся объяснить связь между сигнальными путями BMPs и процессом ГО, а также возможности предотвращения и лечения процесса ГО. Материалы и методы. Используя базы данных PubMed, Embase, базу данных Кокрановской библиотеки (Cochrane Database) и Google Scholar, мы провели всесторонний поиск оригинальных работ, обзоров литературы, клинических случаев и мета-анализов, демонстрирующих причинно-следственную связь между применением rhBMPs в терапевтических целях и ГО как осложнением. Результаты. В данной обзорной статье проанализированы возможности терапевтического применения rhBMPs в нейрохирургии и травматологии и ортопедии как в клинических, так и в доклинических исследованиях. В частности, эти исследования подтверждают, что формирование эктопической кости является одним из побочных эффектов после применения rhBMPs. Кроме того, освещены молекулярные механизмы процесса ГО, а также возможности современных методов профилактики и лечения ГО. Заключение. Согласно базе данных FDA по безопасности применения rhBMP-2 и rhBMP-7, частота нежелательных эффектов в виде ГО колеблется от 1 до 10 %. Тем не менее, на сегодняшний день клиническое применение rhBMP-2 и rhBMP-7 оправдано, особенно когда отсутствуют альтернативные заменители костного трансплантата.
Гетеротопическая оссификация, рекомбинантный, костные морфогенетические белки, механизм, лечение
Короткий адрес: https://sciup.org/142231940
IDR: 142231940 | УДК: 577.112:616.71-004.8-06:616.74-003.974-08(048.8) | DOI: 10.18019/1028-4427-2022-28-1-123-132
Текст обзорной статьи Гетеротопическая оссификация как побочный эффект применения рекомбинантных человеческих костных морфогенетических белков
Гетеротипическая оссификация (ГО), также известная как оссифицирующий миозит, параостеоартопатия и гетеротопическая кальцификация – это образование эктопической пластинчатой кости в мягких тканях [1]. Если говорить о приобретённой ГО, то данный патологический процесс является осложнением травм центральной нервной системы (ЦНС), повреждений мягких тканей при ожогах, травмах или хирургических вмешательствах [1]. Знания о молекулярных механизмах, которые приводят к образованию ГО, и клетках-предшественниках, участвующих в этом процессе, все еще ограничены. Различные популяции клеток-предшественников могут быть возможными предвестниками развития ГО. Исследования in vivo показывают, что клетки-предшественники могут варьировать в зависимости от подтипа ГО. Данные исследования демонстрируют, что эндотелиальные клетки (ЭК), мезенхимальные стволовые клетки (МСК) и перициты, присутствующие в поперечно-полосатой мускулатуре, сухожилиях и соединительной ткани, или даже циркулирующие стволовые клетки / клетки-предшественники могут быть источником развития ГО [1, 2]. Также известно, что травма, которая приводит к местной воспалительной реакции, активирует определённые сигнальные пути, участвующие непосредственно в развитии ГО. К тому же, недавние исследования in vitro и in vivo доказали роль клеток иммунной системы, особенно моноцитов / макрофагов, на ранних стадиях развития ГО [2, 3]. В частности, эти исследования подтверждают важность моноцитов / макрофагов в индукции нейрогенных и генетических форм ГО. Ак- тивированные моноциты / макрофаги экспрессируют остеоиндуктивные сигнальные факторы в ходе ГО (рис. 1). Таким образом, присутствие клеток отражает повышенную секрецию факторов роста, цитокинов / хемокинов, стимулирующих ГО, таких как интерлейкины (IL-6 и IL-10), трансформирующий фактор роста бета-1 (TGF-β1), нейротрофин 3 (NT3) и костные морфогенетические белки (BMPs) (BMP-2, 4 и 7) [4, 5].
Одним из наиболее мощных остеоиндуктивных факторов роста являются многофункциональные цитокины, принадлежащие к суперсемейству TGF- β , а именно BMPs. BMPs оказывают значительное остео-индуктивное воздействие на различные стадии процесса заживления костей после травм, такие как воспалительная реакция, ангиогенез, образование мягкой и твердой мозоли и ремоделирование кости [6]. Как было показано в доклинических и клинических исследованиях, применение рекомбинантных человеческих костных морфогенетических белков (rhBMPs) обеспечивает образование кости de novo, ускоряет время восстановления костной ткани после травм и предотвращает несращение или отсроченное сращение [7]. Например, одно из обоснований их использования при открытых переломах основано на концепции, согласно которой ускорение регенерации костной ткани и предотвращение несращений снизят частоту осложнений и уменьшат потребность в повторных хирургических вмешательствах [8]. Помимо того, что BMPs обладают остеоиндуктивными свойствами, существуют научные исследования с доказательством того, что BMPs могут стимулировать ангиогенез [7].
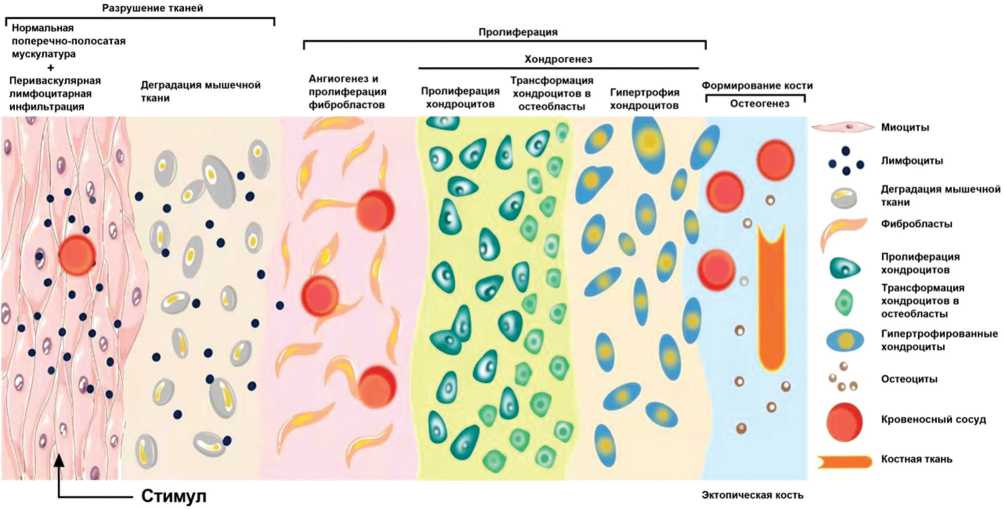
Рис. 1. Схематическое изображение стадии процесса гетеротопической оссификации (ГО). Формирование эктопической кости можно разделить на три стадии: 1) под воздействием различных стимулов или факторов происходит скопление большого количества периваскулярных лимфоцитов за счет преодоления сосудистого барьера и их миграции в раннюю область ГО в пределах поперечнополосатой мускулатуры, что сопровождается разрушением соединительнотканной структуры; 2) пролиферация клеток соединительной ткани с разрушением поперечнополосатой мускулатуры с высвобождением воспалительных медиаторов, которые, в свою очередь, стимулируют фиброплазию и ангиогенез; 3) прослеживается синтез ряда факторов роста, индуцирующих остеогенез, которые вызывают образование и дифференцировку мезенхимальных стволовых клеток (МСК) в хондроциты и остеобласты в локальном воспалительном микроокружении. Результатом этих процессов дифференциации является образование эктопической кости в области повреждения ткани (авторский рисунок)
Однако, несмотря на значительные положительные эффекты rhBMPs, их широкое использование в практической медицине ограничено из-за ряда недостатков: быстрая деградация, высокая стоимость производства, необходимость применения в высоких дозах, остеолиз и ГО. В данной работе мы продемонстрируем слу- чаи ГО после использования rhBMPs как в клинических, так и в доклинических исследованиях. В дополнение к этому мы попытаемся объяснить связь между сигнальными путями BMPs и процессом ГО, а также возможности предотвращения возникновения ГО после применения rhBMPs.
МАТЕРИАЛЫ И МЕТОДЫ
Мы провели всесторонний поиск оригинальных работ, обзоров литературы, клинических случаев и метаанализов, демонстрирующих причинно-следственную связь между применением rhBMPs в терапевтических целях и ГО как осложнением. Базы данных, включая PubMed, Embase, базу данных Кокрановской библиотеки (Cochrane Database) и Google Scholar, были использованы для получения всех соответствующих исследований в период август-сентябрь 2021 года. Ключевые слова, включая «костные морфогенетические белки» или «рекомбинантные костные морфогенетические белки», или «факторы роста», или «семейство TGF-β», «гетеротопическая оссификация» или «эктопическая кость», или «оссифицирующий миозит», или «патоморфология», или «осложнения» и «клинические исследования», или «доклинические исследования», или «терапия и профилактика», или «молекулярный механизм», или «побочный эффект». Кроме того, выполнялся поиск в списке литературы каждого соответствующего исследования для выявления других актуальных работ. Блок-схема систематического обзора представлена на рисунке 2.
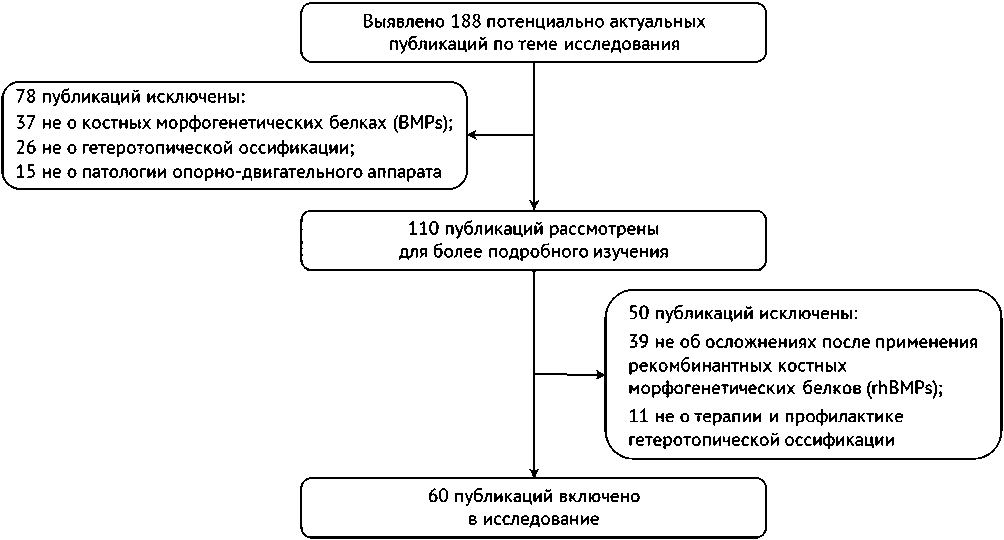
Рис. 2. Блок-схема систематического обзора
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. BMPs и ГО
Местный воспалительный процесс приводит к миграции, размножению и дифференцировке множества типов клеток, включая клетки-предшественники [2]. Однако молекулярный механизм, лежащий в основе процесса различных форм ГО, до сих пор полностью не изучен. Считается, что популяция клеток-предшественников, индуктивные факторы роста и благоприятная среда могут способствовать ГО. Хорошо известно, что дифференцировке клеток-предшественников по хондрогенному пути и эндохондральному окостенению способствуют различные факторы, включая передачу сигналов BMPs и факторы транскрипции [8].
Согласно теории Kan и др., вероятно, существует один консервативный механизм, участвующий одновременно во многих типах ГО [9]. Более того, недавние данные предполагают вероятность центральной роли BMPs в патогенезе ГО, наряду с другими факторами роста и факторами транскрипции, участвующими в перекрестном взаимодействии между нижестоящими сигнальными путями BMPs [10].
BMPs является членом суперсемейства TGF-β, которые необходимы для эмбрионального развития и поддержания тканевого гомеостаза. BMP-индуцированное костеобразование происходит не только в нормальных условиях, но и при патоло- гических процессах. Повышенная передача сигналов BMPs, вызванная дефектом ауторегулирующей петли, уже была подтверждена в лимфоцитах пациентов с ГО [11]. Более того, высокие уровни BMP-2 и BMP-7 наблюдались в сыворотке крови пациентов после травм ЦНС [12, 13]. Также экспрессия BMP-2, 4, 7 и 9 была значительно увеличена в животных моделях ГО, вызванной повреждением спинного мозга [14]. BMP-2, 4, 7 и 9 следует рассматривать как одних из основных кандидатов BMPs в патофизиологии ГО. Лиганды BMPs передают сигнал через тетрамерный комплекс рецепторов типа I и типа II. Было идентифицировано семь рецепторов типа I (Активин-рецеп-тор-подобная киназа 1-7 (ALK1-7)), среди которых BMPs преимущественно связывается с ALK 1, 2, 3 и 6. Как только лиганды связываются с рецепторами костного морфогенетического белка типа II (рецептор активина А типа II (ACVR2A или Act 2A) и рецептор активина 2B типа II (ACVR2B или Act 2B)), они трансфосфорилируют друг друга с активацией киназы рецепторов типа I, где в последующем активированные киназы рецепторов I типа фосфорилируют R-Smads (Smad 1, Smad 5 и Smad 8), чтобы вызвать образование комплекса со Smad 4. Впоследствии комплекс перемещается в ядро клетки, где активирует экспрессию целевого гена (рис. 3) [6, 15]. Таким образом, широко признано, что нарушение регуляции передачи сигналов BMPs ведет к ГО.
2. Дозирование и носители
Было высказано предположение, что высокие дозы вводимых rhBMPs могут привести к формированию эктопической кости [16–18]. Во всех проведенных клинических испытаниях диапазон дозирования rhBMP сильно варьирует. Считается, что ГО может быть вызвана супра-физиологическими дозами rhBMPs, которые должны использоваться у людей для эффективного лечения, чтобы преодолеть короткий период полувыведения BMPs и быстрый их клиренс in vivo (~ 6–7 мин.) [19]. Например, Boraiah и др. сообщили о высоком риске образования ГО при лечении сложных переломов большеберцовой кости с использованием высоких доз rhBMP-2 [20]. Клинические дозы rhBMP-2 обычно могут варьировать от 0,1 до 0,5 мг/кг массы тела, хотя также сообщалось о применении таких высоких доз как 1 мг/кг массы тела [21]. Представленные в таблице 1 дозы применения rhBMPs в клинических исследованиях в основном составляли от 1,4 до 12 мг [16–18, 22–28]. Результаты некоторых из этих работ представляют доказательства того, что положительный результат может быть достигнут при использовании низких доз rhBMPs, и предполагают, что этим обусловлен более низкий показатель частоты осложнений ГО. Однако ограничения существующих исследований значительны и не позволяют сделать однозначных выводов о дозозависимых осложнениях в виде формирования эктопической кости при использовании rhBMPs.
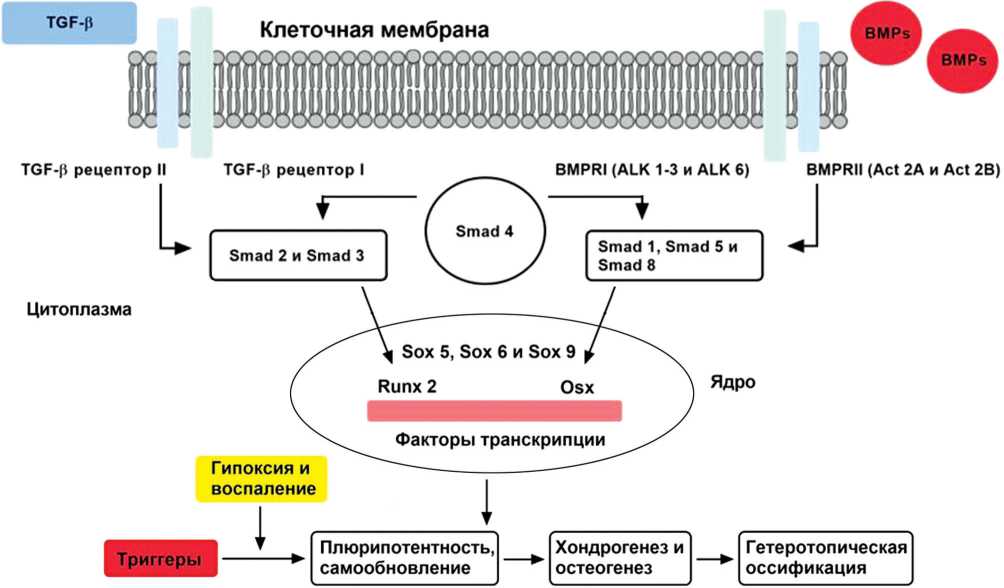
Рис. 3. Регуляция сигнального пути BMP / TGF- β / Smad при гетеротопической оссификации. Сигнальный путь BMP / TGF- β инициируется тетрамерным комплексом рецепторов типа I и типа II. Как только лиганды связываются с рецепторами типа II, они трансфос-форилируют друг друга и активируют киназы рецепторов типа I с последующим фосфорилированием комплекса R-Smads (Smad 1, Smad 2, Smad 3, Smad 5 и Smad 8) со Smad 4. Комплексы перемещаются в ядро, где они привлекают факторы транскрипции для регулирования экспрессии генов-мишеней. Путь передачи сигналов BMPs участвует в общем развитии гетеротопической оссификации, включая воспаление и гипоксию. BMPs, костные морфогенетические белки; TGF- β , трансформирующий фактор роста- β ; ALK, ак-тивин-рецептор-подобная киназа; Sox, SRY-бокс транскрипционный фактор; BMPR I, рецептор костного морфогенетического белка типа I; BMPR II, рецептор костного морфогенетического белка типа II; Runx 2, cвязанный с Runt фактор транскрипции 2; Osx, осте-рикс; Act, актин (авторский рисунок)
Таблица 1
Применение рекомбинантных костных морфогенетических белков (rhBMPs) в клинической практике с последующим развитием гетеротопической оссификации (по данным литературы)
|
rhBMPs |
Процедура |
Дизайн исследования |
Количество пациентов, n |
Дозировка, мг |
Носитель |
Успешность процедуры, n (%) |
Гетеротопическая оссификация, n (%) |
№ источника |
|
rhBMP-2 |
PLIF |
Рандомизированное проспективное многоцентровое исследование |
34 |
4–8 |
Абсорбируемая коллагеновая губка |
31 (92) |
26 (75) |
16 |
|
rhBMP-2 |
TLIF и PLIF |
Проспективное обсервационное исследование |
23 |
4.2 |
Абсорбируемая коллагеновая губка |
23 (100) |
5 (21) |
22 |
|
rhBMP-2 |
PLIF |
Проспективное обсервационное исследование |
17 |
12 |
Абсорбируемая коллагеновая губка |
17 (100) |
1 (6) |
23 |
|
rhBMP-2 |
PLIF |
Проспективное обсервационное исследование |
30 |
1,4 |
Абсорбируемая коллагеновая губка |
29 (97) |
2 (7) |
24 |
|
rhBMP-2 |
TLIF |
Ретроспективное когортное исследование |
933 |
1,0 |
INFUSE (Medtronic) |
863 (92,5) |
125 (13,5) |
25 |
|
rhBMP-2 |
Лечение дефекта вертлужной впадины при ревизионном эндопротезировании тазобедренного сустава |
Клинический случай |
1 |
2,8 |
– |
1 (100) |
1 (100) |
17 |
|
rhBMP-2 |
Остеонекроз головки бедренной кости |
Ретроспективное когортное исследование |
46 |
4 |
– |
38 (83,3) |
8 (17,3) |
18 |
|
rhBMP-7 |
Лечение несращений длинных трубчатых костей |
Ретроспективное когортное исследование |
84 |
3,3 |
Бычий коллаген I типа |
68 (80,9) |
15 (17,8) |
26 |
|
rhBMP-2 и rhBMP-7 |
Лечение острых переломов и отсроченного сращения |
Серия клинических случаев |
4 |
По протоколу продукта |
Infuse и OP-1 |
4 (100) |
4 (100) |
27 |
|
rhBMP-7 |
Лечение несращения дистального отдела плечевой кости |
Клинический случай |
1 |
3,5 |
OP-1 |
1 (100 %) |
1 (100 %) |
28 |
Аббревиатуры : PLIF – задний поясничный межтеловой спондилодез; TLIF – трансфораминальный поясничный межтеловой спондилодез; rhBMP – рекомбинантный человеческий костный морфогенетический белок; OP-1 – остеогенный белок-11.
Текущий стандартный носитель – абсорбируемая коллагеновая губка, которая доставляет rhBMPs посредством физической абсорбции белка на материале имплантата. Тем не менее, это ограничено “взрывным” высвобождением и просачиванием белков за пределы предполагаемого места имплантации [29]. Поэтому данные супрафизиологические дозы rhBMPs обусловили возникновение осложнений в виде ГО, упомянутых ранее [22–24]. Недавно было показано, что новые носители на основе полиэлектролитных комплексов (PECs), включающих гепарин на поверхности альгинатных микрогранул, изготовленных с использованием принципа послойной самосборки полиэлектролита, доставляют rhBMP-2 контролируемым образом и значительно снижают выброс белка [30]. Например, в своей работе Wang и др. продемонстрировали, что по-лиэлектролитный комплекс на основе гепарина в качестве материала-носителя для rhBMP-2 продемонстрировал способность минимизировать образование ГО за счет снижения эффективной дозы в животной модели спондилодеза [31]. Результаты этого исследования показывают, что альгинатные микрогранулы, функционализированные гепарином, могут представить новую возможность для поиска эффективного носителя rhBMP-2 с меньшими осложнениями и стоимостью. С молекулярной точки зрения известно, что несколько эндогенных факторов роста, включая BMPs, существуют в компартменте внеклеточного матрикса посредством секвестрации (или прочного нековалентного закрепления) отрицательно заряженных высокосульфатирован-ных гепариноподобных гликозаминогликанов. Таким образом сохраняется биологическая активность BMPs. Следуя этой модели хранения и регуляции, многие исследования in vitro и in vivo продемонстрировали, что ключевые молекулы гликозаминогликанов, такие как гепарин и гепарансульфат, могут использоваться для модуляции биологической активности различных экзогенных факторов роста, включая BMPs [32, 33].
Тем самым, минимально инвазивные методы нанесения rhBMPs, низкие их концентрации и использование современных носителей для BMPs могут снизить риск образования эктопической кости.
3. Клинические исследования
RhBMP-7 и rhBMP-2, также известные по торговым маркам как остеогенный белок-1 (OP-1) и INFUSE, одобрены Управлением по контролю за продуктами и лекарствами США (FDA) и нашли своё применение в клинической практике. Одним из побочных эффектов, связанных с использованием rhBMP-2 и rhBMP-7, является образование эктопической кости [34]. Оче- видно, что множество неостеобластных клеток подвергается остеогенному программированию при воздействии BMPs, включая миобласты, адипоциты и фибробласты. По оценкам, образование эктопической кости в клинических исследованиях происходит почти в шесть раз чаще, чем у контрольной группы (группа с применением аллотрансплантантов без использования rhBMPs). Оценка c помощью компьютерной томографии показала образование эктопической кости у 70,1 % пациентов, которым вводили rhBMP-2, по сравнению с 12,9 % пациентов, которым не вводили rhBMP-2 [35]. Например, при операциях на позвоночнике распространение rhBMPs за пределы имплантатов может происходить в эпидуральное пространство и приводить к формированию в мягких тканях эктопической кости с последующей компрессией корешков периферических нервов. При этом частота послеоперационного радикулита может составлять 14,0 % по сравнению с 3,0 % в контрольных группах [35]. Кроме того, производители rhBMP-2 и rhBMP-7 рекомендует соблюдать некоторые меры предосторожности при манипуляциях с продуктом rhBMP / абсорбируемая коллагеновая губка, чтобы минимизировать экстравазацию BMPs. Согласно инструкциям коммерческих продуктов кампании Medtronic по rhBMP-2 и rhBMP-7, крайне важно избегать «использования орошения или аспирации рядом с имплантатом» и «чрезмерного сдавливания смоченной губки» [34]. В таблице 1 приведены клинические исследования по использованию rhBMP-2 и rhBMP-7 при ортопедических операциях, осложнившихся ГО [16– 18, 22–28].
4. Стандартные методы профилактики и лечения ГО
Лечение ГО можно разделить на действия, направленные преимущественно на профилактику заболевания, и действия, направленные на ликвидацию уже сформировавшейся ГО. В случае профилактики обычно используют фармакологическое лечение и лучевую терапию. В фармакологической профилактике наиболее часто используются ингибиторы циклооксигеназы-2 (Cox2) и нестероидные противовоспалительные препараты (НПВП), обе группы препаратов воздействуют на провоспалительные простагландины [36]. Традиционные НПВП, такие как аспирин, ибупрофен и индометацин, подавляют образование как физиологических, так и воспалительных простагландинов. Ингибиторы Cox2 в первую очередь подавляют воспалительные простагландины и оставляют физиологические простагландины относительно нетронутыми [36]. Предполагается, что воспалительные простагландины являются мощными регуляторами, наряду с BMPs, формирования оссификатов [2]. Ингибиторы Cox2 и НПВП, помимо воздействия на воспалительные простагландины, могут подавлять миграцию и пролиферацию индуцибельных МСК [37]. На животной модели ГО, индуцированной BMP-деминерализованным костным матриксом, ингибиторы Cox2 и НПВП эффективно ослабляли эктопическое образование кости, ингибируя синтез воспалительных простагландинов [38]. Однако ингибиторы Cox2 и НПВП продемонстрировали минимальный эффект остановки или задержки роста эктопической кости. Большинство специалистов согласны с тем, что индометацин – лучший выбор среди НПВП не только для предотвращения ГО, но и для замедления процесса развития ГО [39]. Однако использование НПВП было ограничено из-за побочных явлений, таких как язвенная болезнь, снижение агрегации тромбоцитов и почечная недостаточность. Длительный прием НПВП увеличивает риск развития сердечнососудистых заболеваний, а также замедляет заживление переломов [40]. Ранее профилактика ГО с применением ингибиторов Cox2 и НПВП широко применялась после тотального эндопротезирования и артроскопии тазобедренного сустава, черепно-мозговых травм, травм спинного мозга и т.д. [36].
Бисфосфонаты подавляют ремоделирование костей и оказывают свое основное действие, сокращая продолжительность жизни остеокластов. Бисфосфонаты используются для лечения многочисленных заболеваний костей, при которых разрушение (резорбция) костей превышает их образование, таких как остеопороз, несовершенный остеогенез и онкология. Была доказана эффективность применения этидроната натрия в лечении ГО после травм спинного мозга. Этидронат натрия подавляет минерализацию остеоидов, связывается с фосфатом кальция и предотвращает кристаллизацию гидроксиапатита [41].
Лучевая терапия (рентгенотерапия) является еще одним эффективным методом профилактики ГО. Считается, что лучевая терапия предотвращает образование и/или прогрессирование ГО путем ингибирования дифференцировки МСК или остеопрогениторных клеток [42]. В частности, исследования in vitro продемонстрировали, что лучевая терапия подавляет передачу сигналов BMP-2, снижает пролиферацию и дифференцировку остеобластов и способствует их апоптозу [43]. В первоначальном доклиническом исследовании взрослым крысам с имплантированным деминерализованным костным матриксом проводили облучение в периоде 2, 4, 6, 8, 10 и 12 дней после имплантации [44]. Было выявлено, что у крыс формировалась эктопическая кость через 11 дней после имплантации. При этом было отмечено, что крысы, подвергшиеся облучению через 2 и 4 дня после имплантации, имели снижение объема ГО на ~ 60 и 24 % соответственно. Однако, когда облучение было отложено до 8 дней после имплантации, авторы не наблюдали разницы в объеме ГО между облученными крысами и контрольной группой. В нескольких исследованиях сообщалось о положительных эффектах лучевой терапии для профилактики ГО после ЧМТ и травм спинного мозга. Например, в одном из клинических исследований фазы I/II у 33 пациентов с ГО после травмы спинного мозга, прошедших лучевую терапию, не наблюдалось дальнейшего роста эктопической кости, однако у трех пациентов подвижность суставов была незначительно нарушена [45]. При этом возможный побочный эффект, который клиницисты должны учитывать – это канцерогенез. Однако на сегодняшний день нет задокументированных случаев радиационно-индуцированных опухолей после лучевой терапии для профилактики ГО. Считается, что отсутствие опухолей связано с низкой дозировкой радиации.
Еще одно серьезное осложнение лучевой терапии – это замедление регенерации костной ткани, а именно, не-сращение переломов. Согласно отчету исследования Morcos и др., нарушение восстановления переломов костей можно увидеть в 12–30 % случаев после лучевой терапии [46].
В настоящее время хирургическая резекция является единственным эффективным методом лечения ГО. Однако рекомендуется рассматривать операцию только в том случае, если пациенты с ГО соответствуют следующим критериям: (1) значительное уменьшение диапазона движений из-за анкилоза суставов; (2) отсутствие острого воспалительного ответа; (3) наличие зрелого гетеротопического оссификата (достаточно минерализован), чтобы его можно было удалить [47, 48]. Тем не менее, при выборе срока хирургического вмешательства следует учитывать и несколько других факторов. Предыдущие исследования показали, что для снижения риска рецидива хирургическое удаление предпочтительнее после полной минерализации эктопической кости [49]. Однако за последнее десятилетие в ведении больных с ГО произошел сдвиг в сторону более ранней резекции эктопической кости, то есть хирургическое вмешательство проводится, как только пациент становится достаточно стабильным, и поражение достаточно минерализовано, чтобы сделать возможным резекцию [50]. Кроме того, недавние результаты клинических исследований свидетельствуют о том, что раннее иссечение эктопической кости может снизить риск операционных осложнений (например, периоперационный перелом) или уменьшить негативные изменения со стороны нервно-мышечного аппарата (например, атрофию мышц) [50]. Однако резекция эктопической кости связана с рядом осложнений. Например, полное удаление околосуставного оссификата является особенно проблематичным, поскольку пациенты часто остаются со стойким уменьшением диапазона движений. Как и любые другие инвазивные процедуры, резекция эктопической кости связана с потенциальной кровопотерей во время хирургического вмешательства и возможными инфекционными осложнениями в постоперационном периоде. Более того, хирургическое удаление может повредить прилегающие периферические ткани [51]. Таким образом, хирургическое вмешательство не является оптимальной терапией ГО и должно быть тщательно продумано.
5. Новые потенциальные методы профилактики и лечения ГО
В настоящее время в разработке наиболее эффективных препаратов по профилактике и лечению ГО проводятся исследования по изучению экспрессии сигнальных молекул BMP-Smad [2]. Препараты, нацеленные на решение данной проблемы, включают, среди прочего, агонисты рецепторов ретиноевой кислоты (RAR), антагонисты BMPs и вещества, влияющие на фосфорилирование Smad. Кроме того, изучается профилактический эффект антиоксидантов и акцепторов (поглотителей) свободных радикалов.
RAR, представленный в трех формах (RARα, RARβ и RARγ), является мощным ингибитором хондрогенеза. Стимуляция этого рецептора достигается за счет использования его агонистов: неселективной активной формы витамина А и селективного агониста RARγ, блокирующих хондрогенез in vitro [52]. Однако блокирование RARα и RARβ не влияет на процесс хондрогенеза. Агонист RARγ паловаротен показал свою эффективность в предотвращении начальных стадий ГО in vitro и in vivo [53]. Паловаротен значительно замедляет процесс ГО, ингибируя рост и дифференцировку клеток остеопрогениторов в хондроциты [53]. Кроме того, было обнаружено, что терапия паловаротином подавляет экспрессию SRY-бокс транскрипционного фактора 9 (Sox-9) и коллагена 2α1 у хондроцитов и экспрессию остеокальцина, остеопоэтина, BMP-2, BMP-4, POU класса 5 гомебокса 1 (POU5FL) и связанного с Runt фактора транскрипции 2 (RUNX2) у остеобластов. Также было доказано, что введение агонистов RARγ приводит к снижению передачи сигналов BMPs за счет снижения фосфорилирования Smad 1, Smad 5, Smad 8 и, возможно, с их деструкцией в протеасомах. Этот эффект может сохраняться и навсегда ингибировать дифференцировку МСК в клетки с остеогенным потенциалом [54, 55].
Другая стратегия, направленная на путь BMP-Smad, которая может быть полезной для профилактики ГО – это снижение уровня фосфора, доступного в форме аденозинтрифосфата (АТФ) или аденозиндифосфата (АДФ). Как было уже сказано, фосфорилирование Smad 1, Smad 5 и Smad 8 приводит к ингибированию дифференцировки МСК в клетки с остеогенным потенциалом [55]. Результаты исследований in vitro и in vivo на моделях ГО, где ГО была результатом ожога, показывают, что местное применение апиразы, гидролизующей АТФ и АДФ, снижает вероятность формирования эктопической кости. Более того, в группе, где использовалась апираза, не наблюдалось остеопении [56]. Кроме того, антагонисты рецептора BMPs представляют собой группу веществ, которые обладают потенциалом ингибирования образования ГО. Например, LDN-193189 (мощный ингибитор сигнальных путей BMPs, ингибирующий ALK 1, 2, 3 и 6) ингибирует экспрессию BMP-1 и эффективно снижает дифференцировку МСК в остеобласты на мышиной модели ГО [57].
Другой антагонист BMPS, Noggin (NOG), также может быть рассмотрен в качестве профилактики ГО. В одном из исследований была продемонстрирована доставка NOG в клетку с использованием вирусного вектора, где NOG эффективно подавлял экспрессию BMP-4 и, тем самым, процесс ГО [58]. Однако из-за потенциальных побочных эффектов разработанные ингибиторы BMPs до сих пор не имеют достаточного безопасного профиля действия для использования в клинических испытаниях на людях.
Недавние исследования связывают образование эктопической кости не только с воспалением, но и с ангиогенными факторами, высвобождающимися во время гипоксии тканей. Доказано, что фармакологическое ингибирование фактора, индуцируемого гипоксией 1-альфа (HIF-1 α ) в клетках, взятых у людей с прогрессирующей оссифицирующей фибродисплази-ей, снижает передачу сигналов BMPs. Также в модели ГО in vivo с активным рецептором активина А типа I
(ACVR1) фармакологическое ингибирование HIF-1 α рование HIF-1 α с использованием PX-478 или рапами-ингибирует процесс ГО. Фармакологическое ингиби- цина также значительно замедлило процесс ГО [59, 60]
ЗАКЛЮЧЕНИЕ
BMPs обладают многообещающим потенциалом в восстановлении дефектов кости после травм благодаря их превосходной остеидуктивной способности. Однако, как и в случаях с другими факторами роста, их доставка должна быть оптимизирована с точки зрения вводимой дозы и локализации в зоне дефекта для повышения эффективности и уменьшения побочных эффектов, связанных с плейотропным действием BMPs при их присутствии в системном кровотоке. Особое беспокойство вызывают результаты недавних клинических исследований, демонстрирующие формирование эктопической кости, связанное с применением rhBMP-2 и rhBMP-7 при ортопедических операциях. Согласно базе данных по безопасности коммерческих продуктов rhBMP-2 и rhBMP-7, частота нежелательных эффектов в виде ГО колеблется от 1 до 10 %. Тем не менее, на сегодняшний день клиническое применение rhBMP-2 и rhBMP-7 оправдано, особенно когда отсутствуют альтернативные заменители костного трансплантата. Несмотря на множество исследований, которые уже были выполнены за последние десятилетия, дальнейшее изучение BMPs позволит лучше оценить долгосрочные результаты, выявить новые альтернативные носители и изучить рентабельность применения rhBMP в клинической практике. Наконец, мы хотели бы подчеркнуть, что лучшее понимание процесса ГО поможет клиницистам в ее профилактике и лечении, в том числе после применения rhBMPs.
Список литературы Гетеротопическая оссификация как побочный эффект применения рекомбинантных человеческих костных морфогенетических белков
- Гареев И.Ф., Бейлерли О.А., Вахитов А.К. Гетеротопическая оссификация после травм центральной нервной системы: понимание патогенеза // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2018. Т. 25, № 3-4. С. 119-124. URL: https://doi.org/10.17116/vto201803-041119.
- The traumatic bone: trauma-induced heterotopic ossification / D. Dey, B.M. Wheatley, D. Cholok, S. Agarwal, P.B. Yu, B. Levi, T.A. Davis // Transl. Res. 2017. Vol. 186. P. 95-111. DOI: 10.1016/j.trsl.2017.06.004.
- Lees-Shepard J.B., Goldhamer D.J. Stem cells and heterotopic ossification: lessons from animal models // Bone. 2018. Vol. 109. P. 178-186. DOI: 10.1016/j.bone.2018.01.029.
- Bioinformatics Analysis of the Molecular Mechanism of Late-Stage Heterotopic Ossification / O. Zhang, Y. Zhang, M. Yan, K. Zhu, D. Zhou, J. Tan // Biomed. Res. Int. 2020. Vol. 2020. 5097823. DOI: 10.1155/2020/5097823.
- Potential genes and pathways associated with heterotopic ossification derived from analyses of gene expression profiles / Z. Yang, D. Liu, R. Guan, X. Li, Y. Wang, B. Sheng // J. Orthop. Surg. Res. 2021. Vol. 16, No 1. Р. 499. DOI: 10.1186/s13018-021-02658-1.
- Bone morphogenetic protein receptor signal transduction in human disease / M.C. Gomez-Puerto, P.V. Iyengar, A. Garcia de Vinuesa, P. Ten Dijke, G. Sanchez-Duffhues // J. Pathol. 2019. Vol. 247, No 1. Р. 9-20. DOI: 10.1002/path.5170.
- Herford A.S. The use of recombinant human bone morphogenetic protein-2 (rhBMP-2) in maxillofacial trauma // Chin. J. Traumatol. 2017. Vol. 20, No 1. P. 1-3. DOI: 10.1016/j.cjtee.2016.05.004.
- The effect of bone morphogenetic protein 2 composite materials combined with cannulated screws in treatment of acute displaced femoral neck fractures / H. Gao, D. Xing, Z. Liu, J. Zheng, Z. Xiong, M. Gong, L. Liu // Medicine (Baltimore). 2020. Vol. 99, No 6. P. e18976. DOI: 10.1097/ MD.0000000000018976.
- Conserved signaling pathways underlying heterotopic ossification / C. Kan, L. Chen, Y. Hu, N. Ding, H. Lu, Y. Li, J.A. Kessler, L. Kan // Bone. 2018. Vol. 109. P. 43-48. DOI: 10.1016/j.bone.2017.04.014.
- Challenges of heterotopic ossification - Molecular background and current treatment strategies / P. L^gosz, K. Drela, L. Pulik, S. Sarzynska, P. Maldyk // Clin. Exp. Pharmacol. Physiol. 2018. Vol. 45, No 12. P. 1229-1235. DOI: 10.1111/1440-1681.13025.
- Rifas L. T-cell cytokine induction of BMP-2 regulates human mesenchymal stromal cell differentiation and mineralization // J. Cell. Biochem. 2006. Vol. 98, No 4. Р. 706-714. DOI: 10.1002/jcb.20933.
- Local expression and role of BMP-2/4 in injured spinal cord / Z.S. Cui, P. Zhao, C.X. Jia, H.J. Liu, R. Oi, J.W. Cui, J.H. Cui, O. Peng, B. Lin, Y.J. Rao // Genet. Mol. Res. 2015. Vol. 14, №э 3. P. 9109-9117. DOI: 10.4238/2015.
- Neuroprotective effects of bone morphogenetic protein 7 (BMP7) treatment after spinal cord injury / J.P. de Rivero Vaccari, A. Marcillo, D. Nonner, W.D. Dietrich, R.W. Keane // Neurosci. Lett. 2009. Vol. 465, No 3. P. 226-229. DOI: 10.1016/j.neulet.2009.09.013.
- Novel mouse model of spinal cord injury-induced heterotopic ossification / H. Kang, A.B. Dang, S.K. Joshi, B. Halloran, R. Nissenson, X. Zhang, J. Li, H.T. Kim, X. Liu // J. Rehabil. Res. Dev. 2014. Vol. 51, No 7. P. 1109-1118. DOI: 10.1682/JRRD.2014.01.0019.
- Bone morphogenetic proteins in fracture repair / I. Dumic-Cule, M. Peric, L. Kucko, L Grgurevic, M. Pecina, S. Vukicevic // Int. Orthop. 2018. Vol. 42, No 11. P. 2619-2626. DOI: 10.1007/s00264-018-4153-y.
- Posterior lumbar interbody fusion using recombinant human bone morphogenetic protein type 2 with cylindrical interbody cages / R.W. Haid Jr., C.L. Branch Jr., J.T. Alexander, J.K. Burkus // Spine J. 2004. Vol. 4, No 5. P. 527-538; discussion Р. 538-539. DOI: 10.1016/j.spinee.2004.03.025.
- Arzeno A., Wang T., Huddleston J.I. 3rd. Abundant heterotopic bone formation following use of rhBMP-2 in the treatment of acetabular bone defects during revision hip arthroplasty // Arthroplast. Today. 2018. Vol. 4, No 2. P. 162-168. DOI: 10.1016/j.artd.2017.12.004.
- Heterotopic ossification related to the use of recombinant human BMP-2 in osteonecrosis of femoral head / L. Shi, W. Sun, F. Gao, L. Cheng, Z. Li // Medicine (Baltimore). 2017. Vol. 96, No 27. P. e7413. DOI: 10.1097/MD.0000000000007413.
- A novel mouse model of trauma induced heterotopic ossification / X. Liu, H. Kang, M. Shahnazari, H Kim, L. Wang, O. Larm, L. Adolfsson, R. Nissenson, B. Halloran // J. Orthop. Res. 2014. Vol. 32, No 2. P. 183-188. DOI: 10.1002/jor.22500.
- Complications of recombinant human BMP-2 for treating complex tibial plateau fractures: a preliminary report / S. Boraiah, O. Paul, D. Hawkes, M. Wickham, D.G. Lorich // Clin. Orthop. Relat. Res. 2009. Vol. 467, No 12. P. 3257-3262. DOI: 10.1007/s11999-009-1039-8.
- Synergistic Effect of NELL-1 and an Ultra-Low Dose of BMP-2 on Spinal Fusion / L. Liu, W.M.R. Lam, M. Naidu, Z. Yang, M. Wang, X. Ren, T. Hu, R .Kumarsing, K. Ting, J.C. Goh, H.K. Wong // Tissue Eng. Part. A. 2019. Vol. 25, No 23-24. P. 1677-1689. DOI: 10.1089/ten. TEA.2019.0124.
- Joseph V., Rampersaud Y.R. Heterotopic bone formation with the use of rhBMP2 in posterior minimal access interbody fusion: a CT analysis // Spine (Phila Pa 1976). 2007. Vol. 32, No 25. P. 2885-2890. DOI: 10.1097/BRS.0b013e31815b7596.
- Posterior lumbar interbody fusion using rhBMP-2 / H.J. Meisel, M. Schnöring, C. Hohaus, Y. Minkus, A. Beier, T. Ganey, U. Mansmann // Eur. Spine J. 2008. Vol. 17, No 12. P. 1735-1744. DOI: 10.1007/s00586-008-0799-2.
- Mannion R.J., Nowitzke A.M., Wood M.J. Promoting fusion in minimally invasive lumbar interbody stabilization with low-dose bone morphogenic protein-2 - but what is the cost? // Spine J. 2011. Vol. 11, No 6. P. 527-533. DOI: 10.1016/j.spinee.2010.07.005.
- Evaluation of Heterotopic Ossification after using Recombinant Human Bone Morphogenetic Protein-2 in Transforaminal Lumbar Interbody Fusion: A Computed Tomography Review of 996 Disc Levels / S. Niu, A.T. Anastasio, R.R. Faraj, J.M. Rhee // Global Spine J. 2020. Vol. 10, No 3. P. 280-285. DOI: 10.1177/2192568219846074.
- Heterotopic ossification after the use of recombinant human bone morphogenetic protein-7 / M. Papanagiotou, Z.H. Dailiana, T Karachalios, S. Varitimidis, M. Hantes, G. Dimakopoulos, M. Vlychou, K.N. Malizos // World J. Orthop. 2017. Vol. 8, No 1. P. 36-41. DOI: 10.5312/wjo.v8.i1.36.
- Heterotopic ossification after the use of commercially available recombinant human bone morphogenetic proteins in four patients / T.W. Axelrad, B. Steen, D.W. Lowenberg, W.R. Creevy, T.A. Einhorn // I. Bone Joint Surg. Br. 2008. Vol. 90, No 12. P. 1617-1622. DOI: 10.1302/0301-620X.90 B12.20975.
- Wysocki R.W., Cohen M.S. Ectopic ossification of the triceps muscle after application of bone morphogenetic protein-7 to the distal humerus for recalcitrant nonunion: a case report // J. Hand Surg. Am. 2007. Vol. 32, No 5. P. 647-650. DOI: 10.1016/j.jhsa.2007.03.001.
- Spagnoli D., Choi C. Extraction socket grafting and buccal wall regeneration with recombinant human bone morphogenetic protein-2 and acellular collagen sponge // Atlas Oral Maxillofac. Surg. Clin. North. Am. 2013. Vol. 21, No 2. P. 175-183. DOI: 10.1016/j.cxom.2013.05.003.
- Zhang Y., Sun T., Jiang C. Biomacromolecules as carriers in drug delivery and tissue engineering // Acta Pharm. Sin. B. 2018. Vol. 8, No 1. P. 3450. DOI: 10.1016/j.apsb.2017.11.005.
- Minimizing the Severity of rhBMP-2-induced inflammation and heterotopic ossification with a polyelectrolyte carrier incorporating heparin on microbead templates / M. Wang, S.A. Abbah, T. Hu, S.Y. Toh, R.W. Lam, J.C. Goh, H.K. Wong // Spine (Phila Pa 1976). 2013. Vol. 38, No 17. P. 1452-1458. DOI: 10.1097/BRS.0b013e31828a3504.
- Design of hydrogels to stabilize and enhance bone morphogenetic protein activity by heparin mimetics / S. Kim, Z.K. Cui, P.J. Kim, L.Y. Jung, M. Lee // Acta Biomater. 2018. Vol. 72. P. 45-54. DOI: 10.1016/j.actbio.2018.03.034.
- Heparan sulfate deficiency leads to hypertrophic chondrocytes by increasing bone morphogenetic protein signaling / K. Kawashima, H. Ogawa, S. Komura, T. Ishihara, Y. Yamaguchi, H. Akiyama, K. Matsumoto // Osteoarthritis Cartilage. 2020. Vol. 28, No 11. P. 1459-1470. DOI: 10.1016/j. joca.2020.08.003.
- Lykissas M., Gkiatas I. Use of recombinant human bone morphogenetic protein-2 in spine surgery // World J. Orthop. 2017. Vol. 8, No 7. P. 531535. DOI: 10.5312/wjo.v8.i7.531.
- Complications associated with the use of the recombinant human bone morphogenetic proteins for posterior interbody fusions of the lumbar spine / J. Chrastil, J.B. Low, P.G. Whang, A.A. Patel // Spine (Phila Pa 1976). 2013. Vol. 38, No 16. P. E1020-E1027. DOI: 10.1097/BRS.0b013e3182982f8e.
- The prophylaxis and treatment of heterotopic ossification following lower limb arthroplasty / T.N. Board, A. Karva, R.E. Board, A.K. Gambhir, M.L. Porter // J. Bone Joint Surg. Br. 2007. Vol. 89, No 4. P. 434-440. DOI: 10.1302/0301-620X.89B4.18845.
- COX-2 inhibitors for the prevention of heterotopic ossification after THA / G.I. Vasileiadis, I.C. Sioutis, A.F. Mavrogenis, K. Vlasis, G.C. Babis, P.J. Papagelopoulos // Orthopedics. 2011. Vol. 34, No. 6. P. 467. DOI: 10.3928/01477447-20110427-23.
- Zhu X.T., Chen L., Lin J.H. Selective COX-2 inhibitor versus non-selective COX-2 inhibitor for the prevention of heterotopic ossification after total hip arthroplasty: A meta-analysis // Medicine (Baltimore). 2018. Vol. 97, No 31. P. e11649. DOI: 10.1097/MD.0000000000011649.
- Wentworth K.L., Masharani U., Hsiao E.C. Therapeutic advances for blocking heterotopic ossification in fibrodysplasia ossificans progressiva // Br. J. Clin. Pharmacol. 2019. Vol. 85, No 6. P. 1180-1187. DOI: 10.1111/bcp.13823.
- Treatment methods for post-traumatic elbow stiffness caused by heterotopic ossification / C.E. Freibott, H.C. Bäcker, S.C. Shoap, L.J. Tedesco, S.E. Galle, M.P. Rosenwasser // J. Shoulder Elbow Surg. 2020. Vol. 29, No 7. P. 1380-1386. DOI: 10.1016/j.jse.2020.02.026.
- History of etidronate / N.B. Watts, C.H. Chesnut 3rd, H.K. Genant, S.T. Harris, R.D. Jackson, A.A. Licata, P.D. Miller, W.J. Mysiw, B. Richmond, D. Valent // Bone. 2020. Vol. 134. P. 115222. DOI: 10.1016/j.bone.2020.115222.
- Radiotherapy for the prophylaxis of heterotopic ossification after total hip arthroplasty: A systematic review and meta-analysis of randomized controlled trails / Z.H. Hu, W. Chen, J.N. Sun, Y. Zhang, Y. Zhang, X.Y. Chen, S. Feng // Med. Dosim. 2021. Vol. 46, No 1. P. 65-73. DOI: 10.1016/j. meddos.2020.07.010.
- Radiation-induced suppression of the Bmp2 signal transduction pathway in the pluripotent mesenchymal cell line C2C12: an in vitro model for prevention of heterotopic ossification by radiotherapy / F. Pohl, S. Hassel, A. Nohe, M. Flentje, P. Knaus, W. Sebald, O. Koelbl // Radiat. Res. 2003. Vol. 159, No 3. P. 345-350. DOI: 10.1667/0033-7587(2003)159[0345:risotb]2.0.co;2.
- Craven P.L., Urist M.R. Osteogenesis by radioisotope labelled cell populations in implants of bone matrix under the influence of ionizing radiation // Clin. Orthop. Relat. Res. 1971. Vol. 76. P. 231-243. DOI: 10.1097/00003086-197105000-00030.
- Sautter-Bihl M.L., Liebermeister E., Nanassy A. Radiotherapy as a local treatment option for heterotopic ossifications in patients with spinal cord injury // Spinal Cord. 2000. Vol. 38, No 1. P. 33-36. DOI: 10.1038/sj.sc.3100847.
- Morcos M., Smith K., Tanzer M. The effect of late radiotherapy on the progression of heterotopic ossification following total hip arthroplasty // Eur. J. Orthop. Surg. Traumatol. 2018. Vol. 28, No 6. P. 1125-1131. DOI: 10.1007/s00590-018-2185-z.
- Romero-Muñoz L.M., Barriga-Martín A., DeJuan-García J. Surgical treatment of hip ankylosis due to heterotopic ossification secondary to spinal cord injury // Rev. Esp. Cir. Ortop. Traumatol. (Engl. Ed). 2018. Vol. 62, No 6. P. 458-466. DOI: 10.1016/j.recot.2018.01.003.
- Treatment methods for post-traumatic elbow stiffness caused by heterotopic ossification / C.E. Freibott, H.C. Bäcker, S.C. Shoap, L.J. Tedesco, S.E. Galle, M.P. Rosenwasser // J. Shoulder Elbow Surg. 2020. Vol. 29. No 7. P. 1380-1386. DOI: 10.1016/j.jse.2020.02.026.
- A Surgical Protocol for Management of Post Traumatic Heterotopic Ossification of Elbow / D. Jayamaraju, A.S. Sarkar, S.K. Patra, S.K. Palanivelayutham, S. Rajasekaran // Indian J. Orthop. 2021. Vol. 55, No 4. P. 898-906. DOI: 10.1007/s43465-021-00381-x.
- Heterotopic ossification on the volar surface of the distal radius in a child with fibrodysplasia ossificans progressiva: challenges in surgical excision of a rare condition / E. Sirin, E. Okay, T. Khalilov, K. Turkoz, B. Erol, C. Tetik // Hand Surg. Rehabil. 2021. Vol. 40, No 2. P. 194-197. DOI: 10.1016/j.hansur.2020.11.011.
- Surgical resection of heterotopic bone about the elbow: an institutional experience with traumatic and neurologic etiologies / K. Baldwin, H.S. Hosalkar, DJ. Donegan, N. Rendon, M. Ramsey, M.A. Keenan // J. Hand Surg. Am. 2011. Vol. 36, No 5. P. 798-803. DOI: 10.1016/j.jhsa.2011.01.015.
- Galdones E., Hales B.F. Retinoic acid receptor gamma-induced misregulation of chondrogenesis in the murine limb bud in vitro // Toxicol. Sci. 2008. Vol. 106, No 1. P. 223-232. DOI: 10.1093/toxsci/kfn169.
- Palovarotene reduces heterotopic ossification in juvenile FOP mice but exhibits pronounced skeletal toxicity / J.B. Lees-Shepard, S.E. Nicholas, S.J. Stoessel, P.M. Devarakonda, M.J. Schneider, M. Yamamoto, D.J. Goldhamer // Elife. 2018. Vol. 7. P. e40814. DOI: 10.7554/eLife.40814.
- Chondrocyte phenotype and ectopic ossification in collagenase-induced tendon degeneration / P.P. Lui, S.C. Fu, L.S. Chan, L.K. Hung, K.M. Chan // J. Histochem. Cytochem. 2009. Vol. 57, No 2. P. 91-100. DOI: 10.1369/jhc.2008.952143.
- Potent inhibition of heterotopic ossification by nuclear retinoic acid receptor-y agonists / K. Shimono, W.E. Tung, C. Macolino, A.H. Chi, J.H. Didizian, C. Mundy, R.A. Chandraratna, Y. Mishina, M. Enomoto-Iwamoto, M. Pacifici, M. Iwamoto // Nat. Med. 2011. Vol. 17, No 4. P. 454460. DOI: 10.1038/nm.2334.
- Liang O.D., Reginato A.M., Medici D. Apyrase as a novel therapeutic inhibitor of heterotopic ossification // Ann. Transl. Med. 2015. Vol. 3, No Suppl. 1. P. S32. DOI: 10.3978/j.issn.2305-5839.2015.03.45.
- BMP type I receptor inhibition reduces heterotopic [corrected] ossification / P.B. Yu, D.Y. Deng, C.S. Lai, C.C. Hong, G.D. Cuny, M.L. Bouxsein, D.W. Hong, P.M. McManus, T. Katagiri, C. Sachidanandan, N. Kamiya, T. Fukuda, Y. Mishina, R.T. Peterson, K.D. Bloch // Nat. Med. 2008. Vol. 14, No 12. P. 1363-1369. DOI: 10.1038/nm.1888.
- Retroviral delivery of Noggin inhibits the formation of heterotopic ossification induced by BMP-4, demineralized bone matrix, and trauma in an animal model / D. Hannallah, H. Peng, B. Young, A. Usas, B. Gearhart, J. Huard // J. Bone Joint Surg. Am. 2004. Vol. 86, No 1. P. 80-91. DOI: 10.2106/00004623-200401000-00013.
- ACVR1R206H FOP mutation alters mechanosensing and tissue stiffness during heterotopic ossification / J. Haupt, A. Stanley, C.M. McLeod, B.D. Cosgrove, A.L. Culbert, L. Wang, F. Mourkioti, R.L. Mauck, E.M. Shore // Mol. Biol. Cell. 2019. Vol. 30, No 1. P. 17-29. DOI: 10.1091/mbc. E18-05-0311.
- Huang Y., Wang X., Lin H. The hypoxic microenvironment: a driving force for heterotopic ossification progression // Cell Commun. Signal. 2020. Vol. 18, No 1. P. 20. DOI: 10.1186/s12964-020-0509-1.


