Гибридный подход в лечении терминальной сердечной недостаточности в сочетании с нарушениями ритма сердца
Автор: Сапельников Олег Валерьевич, Чапурных А.В., Черкашин Д.И., Гришин И.Р., Николаева оА., Ускач Т.М., Жиров И.В., Терещенко С.Н., Саидова мА., Акчурин Р.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 2 т.21, 2017 года.
Бесплатный доступ
Лечение больных с терминальной сердечной недостаточностью является на сегодняшний день наиболее сложной задачей. В ряде случаев клиническое течение заболевания осложняется нарушениями сердечного ритма. Одной из наиболее частых форм нарушения ритма считается фибрилляция / трепетание предсердий. При отсутствии адекватной тактики ведения прогноз таких пациентов крайне неблагоприятный. Развитие интервенционной малоинвазивной хирургии расширило возможности лечения этих больных. Мы хотим рассмотреть особенности применения гибридного подхода на примере больного с трепетанием предсердий и терминальной стадией хронической сердечной недостаточности.
Сердечная недостаточность, радиочастотная аблация, ресинхронизирующая терапия
Короткий адрес: https://sciup.org/142140792
IDR: 142140792 | DOI: 10.21688/1681-3472-2017-2-112-117
Текст научной статьи Гибридный подход в лечении терминальной сердечной недостаточности в сочетании с нарушениями ритма сердца
Распространенность терминальной сердечной недостаточности (СН) в России составляет около 2,4 млн человек, при этом годовая летальность достигает 12% [1]. Лечение таких пациентов является на сегодняшний день наиболее сложной задачей. В большинстве случаев основным методом остается трансплантация сердца. Вместе с тем отсутствие достаточного количества донорского материала и проблема отторжения трансплантата лишь подтверждает необходимость поиска альтернативных возможностей ведения больных с терминальной СН. К сожалению, нарушения сердечного ритма являются очень распространенным элементом клинической картины СН. Одной из наиболее частых форм нарушения ритма считается фибрилляция / трепетание предсердий (ФП/ТП). Так, по данным крупных европейских исследований, распро- страненность ФП у больных с сердечной недостаточностью достигала 42% в Euro Heart Failure Survey, 38% в Euro Heart Failure Survey II и 35% в Euro Observational Research Program [2]. Отсутствие вклада систолы предсердий при мерцательной аритмии влияет на сердечный выброс и существенно осложняет течение СН, а при отсутствии адекватной тактики ведения прогноз таких пациентов крайне неблагоприятный. Развитие интервенционной малоинвазивной хирургии расширило возможности лечения этих больных.
На данном клиническом примере мы хотим рассмотреть особенности применения гибридного подхода у больного с трепетанием предсердий и терминальной стадией хронической сердечной недостаточности.
Пациент З. 72 лет госпитализирован в тяжелом состоянии, с жалобами на одышку при минимальной физи-
@ (D
Статья доступна по лицензии Creative Commons Attribution 4.0.
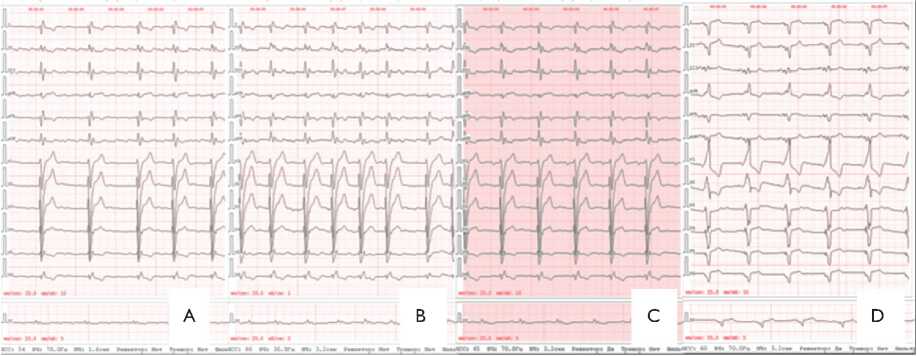
Рис. 1. Электрокардиография пациента: А, B — при госпитализации (трепетание предсердий); C — после радиочастотной аблации кавотрикуспидального истмуса; D — после имплантации CRT-D
Fig. 1. Patient’s echocardiography: (A, B) when hospitalized (atrial flutter); (C) after radiofrequency ablation of cavotricuspid isthmus; (D) after cardiac resynchronization therapy defibrillator (CRT-D) implantation ческой нагрузке, удушье в горизонтальном положении, учащенное неритмичное сердцебиение, эпизоды синко-пальных состояний, общую слабость, быструю утомляемость, снижение толерантности к физическим нагрузкам, отеки нижних конечностей, сухость во рту.
При поступлении обращали внимание: бледность, синюшность кожных покровов в области груди, живота, трофические изменения кожи голеней, иктеричность склер, увеличение размеров печени, отеки нижних конечностей до колена, набухшие вены шеи. В легких в нижних отделах дыхание ослаблено, ниже угла лопатки выслушивались влажные мелкопузырчатые хрипы. Тоны сердца неритмичны.
Из анамнеза: в 2007 г. перенес инфаркт миокарда, диагностирован сахарный диабет 2-го типа (инсулин потребный с 2010 г.). По результатам проведенной коро-нароангиографии выявлено критическое многососудистое поражение коронарных артерий, выполнена операция аортокоронарного/маммарокоронарного шунтирования с аневризмэктомией в 2007 г. С 2009 г. отметил ухудшение самочувствия в виде появления и нарастания одышки, отеков нижних конечностей, тогда же впервые зафиксировано повышение уровня креатинина крови. По данным электрокардиографии (ЭКГ) регистрировалась блокада левой ножки пучка Гиса. В последующем неоднократные госпитализации в стационар в связи с декомпенсацией хронической СН. Ввиду тяжести течения сердечной недостаточности и сопутствующей почечной недостаточности отказано в проведении ресинхронизирующей терапии. В 2014 г. выполнена имплантация кардиовертера-дефибриллятора. После чего, несмотря на медикаментозную терапию, состояние прогрессивно ухудшалось.
С 2015 г. регистрируется постоянная форма трепетания предсердий. В инвазивном лечении также отказано ввиду тяжести состояния. Пациент поставлен в лист ожидания трансплантации сердца.
На основании анамнеза и проведенных исследований вынесен диагноз: ишемическая болезнь сердца. Постинфарктный кардиосклероз: инфаркт миокарда от 2004 г. Атеросклероз аорты, коронарных артерий (критическое трехсосудистое поражение). Операция маммарокоронарного шунтирования передней нисходящей артерии, аортокоронарное шунтирование артерии тупого края, огибающей артерии, задней межжелудочковой ветви, аневризмэктомии, вентрикулопластики в 2007 г. Нарушения ритма и проводимости сердца: персистирующая форма трепетания предсердий. Желудочковая экстрасистолия, пробежки желудочковой тахикардии, блокада левой ножки пучка Гиса. Имплантация кардиовертера-дефибриллятора в 2014 г. Хроническая сердечная недостаточность II Б стадии IV функционального класса (ФК).
А
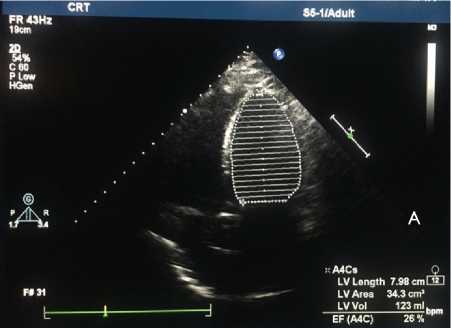
Рис. 2. Трансторакальная эхокардиография: А — первично при госпитализации в стационар; B — при контрольном визите через 6 мес.
B
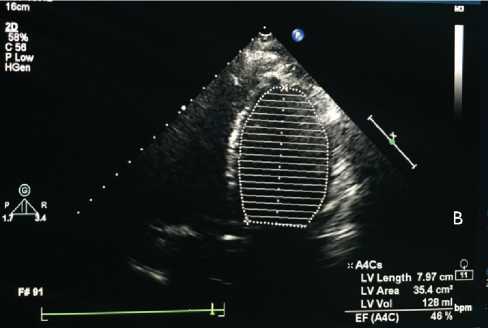
Fig. 2. Transthoracic echocardiography: ( A ) when hospitalized; ( B ) at 6-month follow-up visit
Сопутствующие заболевания: сахарный диабет 2-го типа, инсулин потребный; диабетическая микро-макроангиопатия; хроническая болезнь почек; нефропатия смешанного генеза; хроническая почечная недостаточность IV стадии. Желчекаменная болезнь вне обострения.
Трудоспособность: в 2015 г. в связи с частыми декомпенсациями СН и тяжестью состояния вынужден прекратить трудовую деятельность (преподает в университете).
Клинико-инструментальное обследование
При поступлении тяжесть состояния обусловлена терминальной сердечной недостаточностью ишемической этиологии, сопутствующей хронической почечной недостаточностью IV стадии, декомпенсированным сахарным диабетом 2-го типа, что подтверждалось данными проведенного лабораторно-инструментального обследования.
В лабораторных анализах обращали внимание гиперкалиемия (К — 6,8 ммоль/л), повышение креатинина крови до 223 мкмоль/л (скорость клубочковой фильтрации по формуле Chronic Kidney Disease Epidemiology Collaboration, CKD-EPI — 24 мл/мин/1,73м2), повышение билирубина крови до 35,5 мкмоль/л, гликированного гемоглобина до 11,5%. В общем анализе крови тромбоцитопения — 96 х 109/л.
Тяжесть декомпенсации СН подтверждена повышением уровня мозгового натрийуретического пептида (англ. brain natriuretic peptide, BNP) до 1 099,9 пг/мл. Тест шестиминутной ходьбы — 136 м, что соответствовало IV ФК СН по классификации Нью-Йоркской ассоциации сердца (англ. New York Heart Association, NYHA).
По данным ЭКГ трепетание предсердий с частотой сокращения желудочков 60–93 уд. в мин., блокада левой ножки пучка Гиса с расширением QRS до 170 мс (рис. 1, А, B). При рентгенографии органов грудной клетки венозный застой 2-й степени. По данным трансторакальной эхокардио графии, снижение фракции выброса левого желудочка (ФВ ЛЖ) до 26% (рис. 2), дилатация всех камер сердца.
Тактика лечения
С учетом клиники декомпенсации хронической СН по обоим кругам кровообращения пациенту проводилось медикаментозное лечение диуретиками внутривенно, а также стандартная терапия сердечной недостаточности: валсартан 40 мг в сутки, антикоагулянтная терапия ривароксабаном 15 мг, бисопролол 5 мг в сутки, дигоксин 0,125 мг.
Течение сердечной недостаточности существенно усугублялось наличием трепетания предсердий. Ввиду низкой
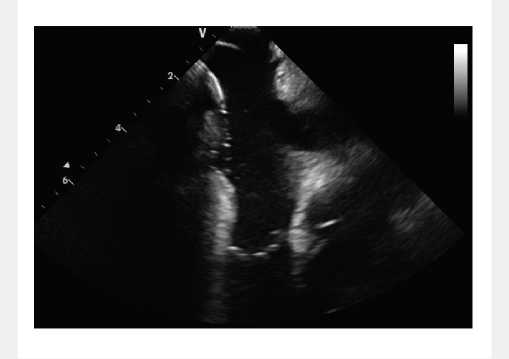
Рис. 3. Внутрисердечная эхокардиография — позиционирование аблационного катетера в области кавотрикуспидального перешейка
Fig. 3. Intracardiac echocardiography: positioning the ablation catheter in the cavotricuspid isthmus area эффективности проводимого медикаментозного лечения и тяжести сердечной недостаточности принято решение о радиочастотной аблации (РЧА) кавотрикуспидального перешейка. Под контролем внутрисердечной эхокардиографии (ЭхоКГ) выполнена аблация кавотрикуспидального перешейка (рис. 3).
После операции пациент отметил улучшение самочувствия. При контрольном обследовании, по данным ЭКГ, синусовый ритм с частотой сердечных сокращений 66 уд. в мин, QRS — 172 мс (см. рис. 1, C). Нарушения легочной гемодинамики отсутствовали. По данным ЭхоКГ отмечено увеличение ФВ ЛЖ до 33%.
С учетом полученных данных принято решение о выполнении вторым этапом имплантации CRT-D (рис. 4). Ситуация осложнялась наличием у больного тяжелой степени хронической почечной недостаточности. Так, введение контрастных веществ гарантированно потребовало бы процедуры гемодиализа.
Имплантация CRT-D (c 4-полюсным левожелудочковым электродом) проведена без использования контрастных препаратов под электрофизиологическим контролем и внутрисердечной ЭхоКГ: катетеризация коронарного синуса выполнена диагностическим катетером под контролем флюороскопии, электрофизиологического исследования и внутрисердечной эхокардиографии. По катетеру в устье коронарного синуса установлена система доставки левожелудочкового электрода. Поиск и катетеризация боковой вены сердца осуществлены с помощью субселективной системы и коронарного проводника. Это позволило избежать усугубления почечной дисфункции после введения контраста.
Послеоперационный период протекал без осложнений. В стационаре выполнено программирование устройства c подбором межжелудочковой (VV) задержки под контролем ЭхоКГ. По данным тканевого миокардиального допплера достигнута ресинхронизация (рис. 5), на фоне чего отмечен прирост ФВ до 38%. На ЭКГ р-синхрони-зированная бивентрикулярная стимуляция с частотой 60 в мин, QSR 140 мс (см. рис. 1, D). Креатинин крови в пределах 140–150 мкмоль/л (скорость клубочковой фильтрации по формуле CKD-EPI — 41 мл/мин/1,73 м2). Кроме того, отмечалось почти двукратное снижение уровня BNP — 548,0 пг/мл. Значительно повысилась толерантность к физическим нагрузкам, что подтверждено тестом шестиминутной ходьбы — 378 м и соответствовало II ФК СН по NYHA. Пациент выписан на 12-е сут. в удовлетворительном состоянии.
При контрольном обследовании через 6 мес. самочувствие удовлетворительное, явления сердечной недостаточности не прогрессируют.
Тест шестиминутной ходьбы 427 м. При проверке ресинхронизирующего устройства нарушения ритма не зарегистрированы, процент желудочковой стимуля-
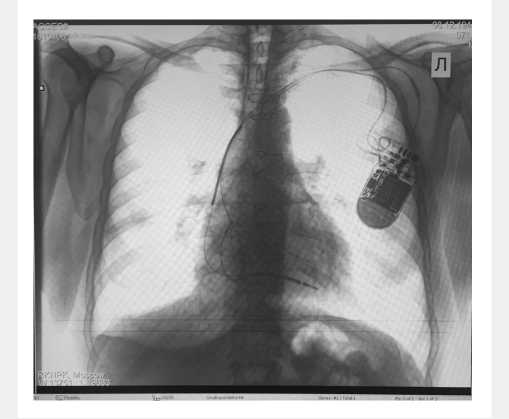
Рис. 4. Рентгенография органов грудной клетки после имплантации CRT-D (левожелудочковый электрод в задней вене сердца)
Fig. 4. Chest X-ray examination following cardiac resynchronization therapy defibrillator (CRT-D) implantation (left ventricular electrode in posterior cardiac vein)
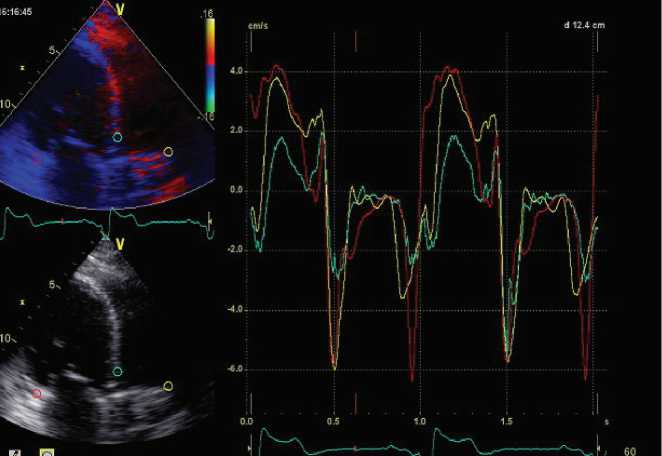
Рис. 5. Ресинхронизация по данным тканевой миокардиальной допплерографии (LV–RV задержка 40 мс)
Fig. 5. Resynchronization based on tissue myocardial Doppler sonography (right to left ventricular activation delay 40 ms)
ции — 99. По данным ЭхоКГ, ФВ ЛЖ 46% (см. рис. 2, B). Пациент возобновил трудовую деятельность.
Обсуждение
Как видно из клинического случая, трепетание предсердий осложняло течение сердечной недостаточности. Радиочастотная аблация позволила стабилизировать состояние пациента, улучшив функциональный класс и течение сердечной недостаточности, что дало возможность имплантировать пациенту CRT-D.
Следует отметить, что наличие у пациента хронической болезни почек, IV стадии почечной недостаточности исключало возможность использования контрастного вещества в качестве визуализирующей методики. Применение метода электрофизиологического контроля и внутрисердечной эхокардиографии позволило решить эту задачу.
Согласно действующим рекомендациям, пациентам с терминальной стадией сердечной недостаточности не показана ресинхронизирующая терапия. Тем не менее необходимость разработки рациональной тактики ведения таких больных очевидна.
Недавно опубликованы исследования по сравнению РЧА с терапией амиодароном для лечения ФП у больных с застойной сердечной недостаточностью и имплантированными кардиовертерами-дефибрилляторами / CRT-D, показавшие многообещающие результаты в группе аблации по удержанию синусового ритма [3]. Кроме того, в пилотном исследовании PABA-CHF в группе РЧА ФП у 71% пациентов сохранялся синусовый ритм без назначения антиаритмичес-кой терапии, а также были выше показатели качества жизни, теста шестиминутной ходьбы и ФВ ЛЖ по сравнению с группой аблации атриовентрикулярного соединения [4].
Заключение
На данном примере мы продемонстрировали, что комплексный подход в лечении таких больных является эффективной тактикой в достижении длительной ремиссии сердечной недостаточности, позволяет значительно улучшить прогноз и может быть рассмотрен как альтернатива трансплантации сердца.
Финансирование
Исследование не имело финансовой поддержки.
Список литературы Гибридный подход в лечении терминальной сердечной недостаточности в сочетании с нарушениями ритма сердца
- Фомин И.В., Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., Бадин Ю.В., Галявич А.С., Даниелян М.О., Камалов Г.М., Колбин А.А., Кечеджиева С.Г., Макарова В.Г., Макарова Н.В., Маленкова В.Ю., Сайфутдинов Р.И., Тарловская Е.И., Хохлов Р.А., Щербинина Е.В., Якушин С.С. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации -данные ЭПОХА-ХСН. Сердечная недостаточность. 2006;7(3):112-5.
- Осмоловская Ю.Ф., Романова Н.В., Жиров И.В., Терещенко С.Н. Эпидемиология и особенности терапии хронической сердечной недостаточности в сочетании с фибрилляцией предсердий. Медицинский совет. 2016;10:93-7. http://dx.doi. org/10.21518/2079-701X-2016-10-93-97 DOI: rg/10.21518/2079-701X-2016-10-93-97]
- Di Biase L., Mohanty P., Mohanty S., Santangeli P., Trivedi C., Lakkireddy D., Reddy M., Jais P., Themistoclakis S., Dello Russo A., Casella M., Pelargonio G., Narducci M., Schweikert R., Neuzil P., Sanchez J., Horton R., Beheiry S., Hongo R., Hao S., Forleo G., Tondo C., Burkhardt J.D., Haissaguerre M., Natale A. Ablation versus amiodarone for treatment of persistent atrial fibrillation in patients with congestive heart failure and an implanted device: Results from the AATAC multicenter randomized trial. Circulation. 2016;133(17):1637-44. http://dx.doi.o DOI: rg/10.1161/aRCULATIONAHA.115.019406
- Khan M.N., Jais P., Cummings J., Di Biase L., Sanders P., Martin D.O., Kautzner J., Hao S., Themistoclakis S., Fanelli R., Potenza D., Massaro R., Wazni O., Schweikert R., Saliba W., Wang P., Al-Ahmad A., Beheiry S., Santarelli P., Starling R.C., Dello Russo A., Pelargonio G., Brachmann J., Schibgilla V., Bonso A., Casella M., Raviele A., Haissaguerre M., Natale A., PABA-CHF Investigators. Pulmonary-vein isolation for atrial fibrillation in patients with heart failure. N Engl J Med. 2008;359(17):1778-85.http://dx.doi. org/10.1056/NEJMoa0708234


