Гидратационный механизм гетерогенного щелочного деацетилирования хитина
Автор: Новиков Виталий Юрьевич, Коновалова Ирина Никандровна, Кучина Юлия Анатольевна, Долгопятова Наталия Владимировна, Черкун Юлия Александровна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология пищевых продуктов и биологически активных веществ
Статья в выпуске: 3 т.20, 2017 года.
Бесплатный доступ
В работе предложена гипотеза, объясняющая особенности кинетики реакции щелочного деацетилирования хитина/хитозана в высококонцентрированных растворах гидроксида натрия, которая практически полностью прекращается через 30-60 мин после начала реакции и не позволяет получать полностью деацетилированный продукт - хитозан. Проведен анализ известных публикаций, в которых предложено объяснение наблюдаемого снижения скорости реакции деацетилирования, и представлены новые экспериментальные результаты, подтверждающие выводы авторов статьи. Показано, что наибольшее влияние на кинетику деацетилирования хитина оказывает вода, которая присутствует в реакционной смеси и может приводить к гидратации как молекул хитина, так и ионов щелочи. Предложена гипотеза, по которой в реакционной смеси существует динамическое равновесие между гидратированными ионами щелочи, молекулами хитина и образующимся ионом ацетата, которое может смещаться в зависимости от концентрации реагирующих частиц. Сделано предположение, что в концентрированных растворах щелочи вода присутствует практически полностью или частично в форме гидратных оболочек ионов щелочи и в меньшей степени в виде "свободной" воды. По-видимому, лимитирующей стадией реакции деацетилирования является гидратация макромолекул хитина молекулами воды, которые высвобождаются при нуклеофильном замещении гидроксил-ионами ацетильных радикалов, связанных с аминогруппами хитина. Продуктом реакции деацетилирования является ацетат-ион. Энергия гидратации ацетат-иона меньше энергии гидратации гидроксил-иона, поэтому ацетат-ион является менее гидратированным, в результате чего высвобождается некоторое количество воды. В этих условиях гидратация макромолекул хитина происходит в локальной области вблизи молекулы хитина, где после деацетилирования создается повышенная концентрация воды. При этом концентрация щелочи во всем реакционном объеме остается практически постоянной.
Хитин, хитозан, деацетилирование, кинетика, механизм реакции, гидратация
Короткий адрес: https://sciup.org/14295015
IDR: 14295015 | УДК: 547.995.12:664.951 | DOI: 10.21443/1560-9278-2017-20-3-515-525
Текст научной статьи Гидратационный механизм гетерогенного щелочного деацетилирования хитина
Реакция деацетилирования хитина/хитозана в промышленном производстве хитозана и его производных обычно проводится в гетерогенных условиях. Установление механизма щелочного деацетилирования хитина имеет практическое значение для совершенствования промышленного производства хитозана и вносит теоретический вклад в развитие представлений о влиянии растворителя и процессов гидратации на кинетику гетерогенного деацетилирования хитина.
В данной работе на основании анализа научных публикаций, предыдущих работ авторов и новых экспериментальных результатов сделаны выводы о возможном механизме щелочного деацетилирования хитина.
Материалы и методы
Объектами исследования служили хитин и хитозан, полученные из панциря северной креветки Pandalus borealis по известной технологии, включающей депротеинизацию панцирьсодержащего сырья раствором гидроксида натрия (концентрация 1 моль/дм 3 ) при 95 °C, деминерализацию раствором HCl (концентрация 1 моль/дм 3 ) при 20 °C и повторную депротеинизацию [1]. Деацетилирование хитина проводили на водяной бане при температуре (95 ± 1) °C с периодическим перемешиванием.
При исследовании влажных образцов пробы сухого хитина предварительно выдерживали в воде или 50%-м растворе гидроксида NaOH заданное время при комнатной температуре, затем помещали на водяную баню, нагретую до (95 ± 1) °C.
Полученный продукт промывали дистиллированной водой до pH не более 8,0. Осадок высушивали при температуре не выше 60 °C при атмосферном давлении и измельчали на планетарной шаровой мельнице.
Степень деацетилирования (СД) хитина/хитозана определяли по методике, описанной в работе Y. Shigemasa и др. [2]. Инфракрасные спектры поглощения регистрировали на Фурье ИК-спектрофотометре IRTracer 100 (Shimadzu Corp., Япония) в таблетках KBr в диапазоне волновых чисел 700–2000 см –1 .
Степень деацетилирования СД (%) рассчитывали по формуле:
СД =
А 0,7568 — 1560 д 1070
0,0069
где A 1560 , A 1070 – оптическая плотность при волновых числах 1 560 и 1 070 см –1 (базовые линии – касательные между 850–1 250 см –1 и 1 500–1 900 см –1 соответственно); 0,7568 и 0,0069 – коэффициенты линейной корреляции.
Результаты и обсуждение
Кинетика гомогенного щелочного N-деацетилирования хитина является реакцией псевдопервого порядка [3], так как гидроксил-ионы, играющие роль катализатора гидролиза ацетамидной связи (рис. 1), присутствуют в избытке и их концентрация в растворе остается практически постоянной.
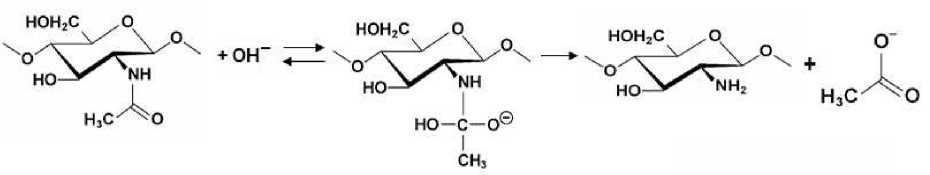
Рис. 1. Схема реакции деацетилирования хитина в щелочной среде Fig. 1. The scheme of chitin deacetylation reaction in the alkaline medium
Установлено, что при гетерогенном деацетилировании наблюдается быстрое снижение скорости реакции, которое не позволяет получать хитозан с СД = 100 % [4], поэтому типичная кинетическая кривая деацетилирования хитина в концентрированной щелочи имеет характерную форму с начальным участком резкого увеличения степени деацетилирования и с последующим пологим участком.
Получить практически полностью деацетилированный хитозан удалось с использованием приема "дискретного" деацетилирования, при котором на каждом шаге используется только первый быстрый участок кинетической кривой. После каждого шага обработки раствором щелочи выполняется промывка хитозана водой и сушка [5–7].
Особенность кинетики деацетилирования хитина, выражающаяся в наличии участка быстрого и медленного деацетилирования, объяснена в ранних работах японских исследователей с точки зрения наличия в хитине кристаллических и аморфных областей [8]. В настоящее время накопленный экспериментальный материал вызывает сомнение в правильности гипотезы об исключительном влиянии кристалличности хитина на наблюдаемый эффект "остановки" реакции деацетилирования. Существующие в настоящее время гипотезы о природе замедления скорости реакции деацетилирования хитина/хитозана рассмотрены ниже.
Влияние кристалличности полисахарида
Японские ученые предположили, что в кристаллических областях скорость деацетилирования ниже, чем в аморфных: вначале наблюдается быстрый процесс деацетилирования аморфных областей, а затем продолжается медленное деацетилирование в кристаллических [8; 9].
На основе исследования деацетилирования образцов с разной кристалличностью нами было показано, что кристалличность не оказывает решающего действия на кинетику деацетилирования [10]. Наибольшая скорость деацетилирования наблюдалась в исходном сухом образце с максимальной кристалличностью (χ кр = 61,1 %), во влажном исходном хитине она была меньше. В сухом переосажденном хитине с кристалличностью (χ кр = 55,5 %) начальная скорость деацетилирования была еще меньше. Наименьшая скорость деацетилирования оказалась у влажного переосажденного образца с наименьшей кристалличностью (χ кр = 8,8 %).
Еще одним подтверждением независимости кинетики реакции деацетилирования от степени кристалличности хитина, видимо, может быть одинаковая форма кинетических кривых деацетилирования образцов хитина с разной начальной степенью деацетилирования, не зависящая от изменения кристаллической структуры при увеличении СД [8; 11]. Нами установлено, что кинетика деацетилирования хитина/хитозана не зависит от начальной степени деацетилирования полисахарида вплоть до 95 %. Форма кинетических кривых в координатах приведенной СДпр = (СД – СД0)/(100 – СД0) оказалась одинаковой для хитина/хитозана с различной исходной СД0 = (15–95) %. Все кинетические кривые были трансформированы в "стандартную" кривую X(t) (рис. 2) [7; 12; 13].
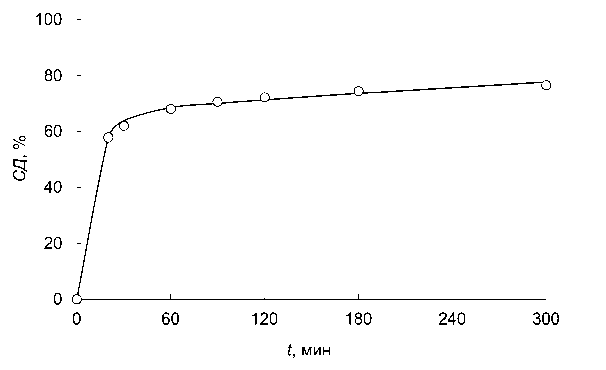
Рис. 2. "Стандартная" кинетическая кривая деацетилирования хитина при 100 ° C в 50 % NaOH [12] Fig. 2. The "standard" kinetic curve of chitin deacetylation at 100 ° C in 50 % NaOH
Если предположить, что все кинетические кривые в выбранной системе координат одинаковы, то скорее всего реакция определяется только соотношением скоростей химических реакций, участвующих в процессе деацетилирования, а не кристаллической структурой, которая изменяется при увеличении степени деацетилирования.
Изменение морфологии при промывках
В работе [14] авторы предположили, что исходная структура хитина препятствует проникновению молекул NaOH ко всем макромолекулам полисахарида. Промывка промежуточного продукта ведет к изменению морфологии хитина, вызывая его набухание и обеспечивая доступ молекул NaOH к ранее недоступным макромолекулам. Это объяснение в некоторой степени перекликается с положением об изменении соотношения кристаллических и аморфных областей в процессе деацетилирования. Вызывает сомнение, что с каждым новым шагом доля новых аморфных областей в хитине оказывается величиной постоянной, обеспечивающей независимость кинетики реакции деацетилирования от начальной СД .
Диффузионный механизм деацетилирования
По мнению норвежских исследователей [15–17], данные 1 H и 13 C ЯМР спектроскопии и растворимости различных фракций частично деацетилированных хитозанов свидетельствуют в пользу диффузионного механизма реакции, в котором основную роль играет не деление хитина на аморфные и кристаллические области, а скорость диффузии щелочи внутрь твердых частиц хитина.
Подтверждение вклада диффузии на скорость деацетилирования, но не на остановку реакции, приводится в работах G. Lamarque с коллегами [18; 19]. Авторы этих работ установили резкое увеличение скорости деацетилирования на первых участках при предварительном деаэрировании хитина методом замораживания – вакуумирования – оттаивания по сравнению с образцами, которые деацетилировали в атмосфере аргона. Надо полагать, после вакуумирования и сбрасывания вакуума происходит резкое впитывание щелочи, которое ускоряет ее доступ во внутренние области хитина.
Причину остановки реакции в этом случае, вероятно, можно объяснить заполнением пор полисахарида молекулами щелочи, а после протекания реакции деацетилирования – локальным уменьшением концентрации щелочи и увеличением концентрации ацетат-ионов, которые препятствуют диффузии новых молекул щелочи к ацетилированным группам хитина. Удалить продукты деацетилирования из пор позволяет промывка образцов хитина дистиллированной водой.
Учитывая, что на скорость реакции гетерогенного деацетилирования хитина могут оказывать влияние такие факторы, как пористость частиц, их кристалличность и сольватация макромолекул хитина в процессе реакции, мы более подробно изучили деацетилирование образцов хитина с разной надмолекулярной структурой – степенью кристалличности, удельной поверхностью, объемом пор и их диаметром [20].
Отличие в кинетике деацетилирования наблюдалось для образцов хитина, переосажденных в растворе щелочи, по сравнению с исходными образцами. Установлено, что кинетическая кривая деацетилирования переосажденного образца хитина, высушенного в лиофильной сушилке, проходит выше кинетических кривых деацетилирования исходного хитина. По всей видимости, вспененный после лиофильной сушки образец, имеющий практически одинаковые удельные поверхность и объем с образцом исходного хитина, оказался более проницаем для раствора гидроксида натрия за счет пор большего диаметра.
Для переосажденного хитина, высушенного на воздухе и имеющего минимальные удельные поверхность и объем пор, получена S-образная кинетическая кривая, постепенно приближающаяся к кривой деацетилирования переосажденного хитина, высушенного лиофильно. По-видимому, это объясняется медленным смачиванием частиц хитина раствором гидроксида натрия и преобладанием диффузионного механизма доставки реагента к молекулам хитина в первые 10 мин реакции.
Влияние кристалличности на скорость реакции подтверждает более высокая скорость деацетилирования переосажденных образцов хитина, у которых кристалличность была примерно в 1,5 раза ниже кристалличности исходного хитина.
При длительном деацетилировании всех образцов хитина (в течение более 90 мин) получены классические кинетические кривые, не достигающие СД = 100 %. При обработке исходного и переосажденного образцов хитина в течение шести часов степень деацетилирования составила 74 и 82 % соответственно.
Полученные результаты позволили сделать вывод о том, что пористость и кристалличность оказывают не основное влияние на замедление деацетилирования хитина. Основными, вернее всего, являются кинетические факторы, в частности гидратация (или сольватация) молекул хитина.
Существование обратной реакции ацетилирования
Некоторые авторы высказали предположение о существовании равновесного процесса деацетилирование – ацетилирование [21]. Этот вывод вызывает сомнение, так как ацетилирование аминогрупп в аминах проводят в ледяной уксусной кислоте или в присутствии кислотных катализаторов [22].
Деацетилирование хитина протекает в сильно щелочной среде (в 50%-м растворе гидроксида натрия), при этом концентрация образующегося в этих условиях ацетата натрия не превышает 5 %.
Проведенный нами эксперимент с деацетилированием частично деацетилированного хитина (СД = 12–16 %) в растворе 50 % NaOH с добавлением 5 % ацетата натрия не показал заметного замедления реакции деацетилирования, на основании чего сделан вывод о том, что обратная реакция ацетилирования, скорее всего, не имеет места [23; 24].
Снижение концентрации щелочи
Некоторые исследователи пытаются объяснить снижение скорости деацетилирования уменьшением концентрации NaOH с 50 до 43 в процессе протекания реакции деацетилирования [14]. Однако такое объяснение противоречит полученным нами экспериментальным данным. Показано, что концентрация NaOH при деацетилировании снижается незначительно c 50 до 49,4 % и добавление избытка NaOH в реакционную смесь не увеличивает скорость деацетилирования [23]. В макрообъеме предлагаемая теория не подтверждается. В то же время снижение концентрации NaOH, вероятно, может происходить локально в микрообъемах, например, в порах хитина, что по всей вероятности влияет на скорость реакции деацетилирования.
Гидратация (сольватация) макромолекул хитина/хитозана и гидроксида натрия
Наиболее вероятным, на наш взгляд, является предположение об образовании сольватных комплексов в результате взаимодействия макромолекул полисахаридов и низкомолекулярного электролита с растворителем.
Например, в [21] предполагается образование гидратов NaOH, которые являются менее активными в реакции деацетилирования хитина по сравнению с негидратированными молекулами щелочи, и образование комплексов ацетилированных звеньев хитина с гидратированными молекулами NaOH.
В ранее опубликованных работах мы предположили образование комплексов OH – с хитином [7; 13; 25] и показали, что реакция деацетилирования может описываться двумя параллельными реакциями псевдопервого порядка, одна из которых заключается в деацетилировании, а другая – в образовании комплекса.
Полученные результаты позволяют утверждать, что образование гидратной оболочки вокруг макромолекул полисахарида оказывает более значительное действие на замедление деацетилирования по сравнению с кристалличностью хитина. Предполагается протекание двух параллельных реакций – деацетилирования и образования малоактивного интермедиата, который разрушается при промывке (рис. 3).
Аналитическое решение можно было получить только для очень ограниченного набора систем дифференциальных уравнений. Такой подход позволил описать механизм деацетилирования, введя в систему два разных комплекса, отличающихся реакционной способностью: первичный (может быть мономерный слой лигандов OH – ), который еще способен деацетилироваться при атаке гидроксил-иона, и вторичный (многослойная оболочка OH – ), который практически полностью защищает амидную связь от гидролиза.
Нейтральный гидролиз ацетамидной связи возможно расценивать как незначительный. Поэтому основной реакцией деацетилирования в щелочной среде можем считать специфический основной гидролиз под действием гидроксил-ионов – бимолекулярную реакцию нуклеофильного замещения. При избытке щелочи реакция имеет псевдопервый порядок, что позволяет описать весь процесс системой уравнений первого порядка.
Рис. 3. Модель гетерогенного щелочного деацетилирования хитина
Fig. 3. The model of heterogeneous alkaline deacetylation of chitin
Методами численной оптимизации решения такой системы дифференциальных уравнений в системе Maple получена модель, адекватно описывающая экспериментальную кинетическую кривую.
Необходимо было определить природу участвующих в образовании сольватного комплекса частиц.
Мы попытались разделить реакцию сольватации и реакцию деацетилирования, учитывая, что последняя реакция начинается с заметной скоростью при высокой температуре. Предварительная обработка хитина (замачивание) в растворе щелочи при комнатной температуре, вероятно, должна приводить к постепенному смачиванию хитина и образованию предполагаемой сольватной оболочки. При высокой температуре скорость деацетилирования в этом случае может оказаться ниже за счет образования малоактивного комплекса.
Предварительная обработка хитина 50%-м раствором гидроксида натрия NaOH не привела к уменьшению СД после последующего деацетилирования. Степень деацетилирования после 30 мин обработки в 50 % NaOH высушенного хитина и хитина, предварительно выдержанного разное время в холодной 50 % NaOH, оказалась одинаковой и составила (59 ± 1) %. По всей вероятности, гидроксилионы не участвуют в сольватации молекул хитина.
Предварительная обработка хитина водой привела к уменьшению степени деацетилирования по сравнению с аналогичным деацетилированием хитина, предварительно обработанного 50 % NaOH. Степень деацетилирования хитина, предварительно обработанного водой, через 30 мин оказалась равной (39 ± 3) % (рис. 4). По-видимому, вода участвует в сольватации (гидратации) хитина.
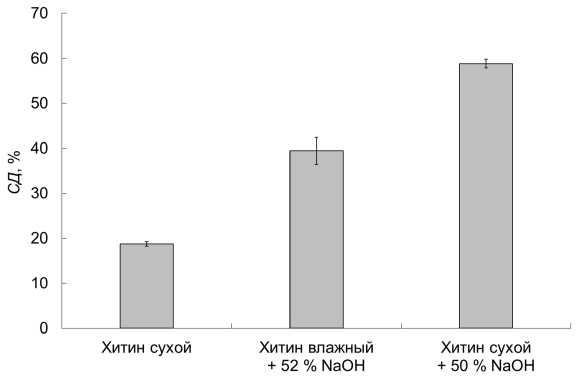
Рис. 4. Зависимость степени деацетилирования (СД) от состояния хитина при 100 ° C
Fig. 4. The degree deacetylation dependence on the chitin state at 100 ° C
Таким образом, можно предположить, что в воде образовалась гидратная оболочка хитина, а в 50 % NaOH гидратная или иная сольватная оболочка не образовалась.
Скорость реакции деацетилирования растет с ростом концентрации NaOH, но не монотонно. Как видно из полученной нами зависимости, СД растет, начиная с концентрации NaOH около 25 %. Следует отметить, что в этой области наблюдается максимум удельной электропроводности, после которого электропроводность растворов NaOH начинает снижаться (рис. 5) [26].
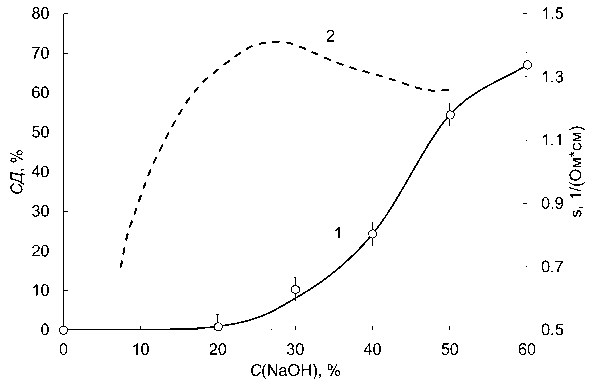
Рис. 5. Зависимость степени деацетилирования (СД) (1) и удельной электропроводности ( s ) (2) [27] от концентрации щелочи (C(NaOH)). Условия эксперимента: 100 ° C, 30 мин
Fig. 5. The degree of deacetylation and electric conductivity ( s ) dependence on the alkaly concentration (C(NaOH)). The experiment conditions: 100 ° C, 30 min
Полученные экспериментальные результаты очевидно могут быть объяснены явлением полной гидратации ионов гидроксида натрия.
В концентрированных растворах сильных электролитов наблюдается изменение структуры, которое объясняется связыванием молекул воды в гидратные комплексы катионов и анионов. При увеличении концентрации электролита увеличивается количество воды, включенной в гидратные оболочки, и уменьшается количество молекул "свободной" воды. К. П. Мищенко и др. было предложено существование границы полной сольватации (гидратации), при которой все молекулы воды связаны с растворенными ионами, входя в состав первичной гидратной оболочки [27].
Хитин, по-видимому, также может образовывать гидратный комплекс с водой, при этом, надо полагать, гидратированная молекула хитина деацетилируется с меньшей скоростью.
В 50 % NaOH "свободной" воды практически нет, она вся связана с ионами Na + и OH – . Поэтому при обработке хитина 50 % NaOH гидратации макромолекул хитина практически не происходит. Во влажном хитине гидратация уже произошла, поэтому скорость реакции деацетилирования оказывается ниже.
Замедление реакции деацетилирования при обработке сухого хитина, вероятно, объясняется образованием некоторого количества воды в процессе реакции. Эта вода, образующаяся в непосредственной близости к молекуле хитина, приводит к гидратации хитина, снижая скорость дальнейшего деацетилирования.
Главный вопрос – откуда берется "свободная" вода для гидратации хитина?
Реакция щелочного гидролиза ацетамидных связей (реакция деацетилирования) является бимолекулярным нуклеофильным замещением S N 2. В соответствии с механизмом этой реакции сильный нуклеофил гидроксил-ион атакует ацетамидную связь. В результате реакции деацетилирования вода не образуется и не расходуется. По уравнению реакции (рис. 3) гидроксил-ион реагирует с ацетамидной группой, в результате чего образуется ацетат-ион.
Мы предположили, что "свободная" вода для гидратации хитина высвобождается из гидратной оболочки гидроксил-иона при его превращении в ацетат-ион, и замедление реакции деацетилирования объясняется тем, что продуктом реакции деацетилирования является ацетат-ион. Энергия гидратации ацетат-иона меньше, чем гидроксил-иона (таблица), поэтому ацетат-ион является менее гидратированным, чем гидроксил-ион. В результате, высвобождается некоторое количество воды, которое локально приводит к гидратации макромолекулы хитина и замедляет реакцию деацетилирования.
Таблица. Энергия гидратации гидроксил-ионов, ионов натрия и ацетат-ионов Table. Hydration energy of hydroxyl ion, sodium and acetate ions
|
Ион |
A GsoLv , кДж/моль |
|
|
Гидроксил-ион OH – |
444 [28] |
430 [31] |
|
Ион натрия Na + |
398 [29] |
365 [31] |
|
Ацетат-ион CH 3 COO – |
322 [30] |
365 [31] |
Получается, что реакция деацетилирования не требует участия "свободной" воды, а остановка реакции, наоборот, происходит в результате образования "свободной" воды, которая локально имеет высокую концентрацию в месте ее образования около молекулы хитина. Вода участвует в создании гидратной оболочки молекулы хитина и замедляет деацетилирование, выводя кинетическую кривую на "плато".
Вернее всего, реакционная способность гидроксил-ионов в реакции деацетилирования растет при увеличении концентрации щелочи в результате уменьшения степени их гидратации из-за уменьшения концентрации воды. Следовательно, в этих условиях действуют два фактора: первый – уменьшение "свободной" воды при увеличении концентрации щелочи снижает степень гидратации хитина и второй – уменьшение гидратации гидроксил-ионов повышает их реакционную активность.
Заключение
Подводя итог разным гипотезам о причинах замедления реакции деацетилирования хитина/хитозана, мы можем сделать вывод о том, что в процессе гетерогенного деацетилирования некоторые (или почти все) механизмы замедления реакции имеют место, проявляясь одновременно в той или иной степени: влияние кристалличности, пористости, сольватации. Сольватация (гидратация), по всей видимости, вносит максимальный и решающий вклад в замедление реакции гетерогенного деацетилирования хитина/хитозана.
Список литературы Гидратационный механизм гетерогенного щелочного деацетилирования хитина
- Новиков В. Ю., Коновалова И. Н., Долгопятова Н. В. Химические основы технологии получения хитина и его производных из панциря ракообразных. СПб.: ГИОРД, 2012. 208 с.
- Shigemasa Y., Matsuura H., Sashiwa H., Saimoto H. Evaluation of different absorbency ratios from infrared spectroscopy for analyzing the degree of deacetylation in chitin//International Journal of Biological Macromolecules. 1996. V. 18, N 3. P. 237-242.
- Sannan T., Kurita K., Iwakura Y. Studies on chitin. V. Kinetics of deacetylation reaction//Polymer Journal. 1977. V. 9, N 6. P. 649-651.
- Chang K. L. B., Tsai G., Lee J., Fu W.-R. Heterogeneous N-deacetylation of chitin in alkaline solution//Carbohydrate Research. 1997. V. 303, N 3. P. 327-332.
- Lusena C. V., Rose R. C. Preparation and viscosity of chitosan//Journal of the Fisheries Research Board of Canada. 1953. V. 10, N 8. P. 521-522.
- Mima S., Miya M., Iwamoto R., Yoshikawa S. Highly deacetylated chitosan and its properties//Journal of Applied Polymer Science. 1983. V. 28, N 6. P. 1909-1917.
- Новиков В. Ю., Орлова Т. А., Воронина И. Э. Кинетика реакции дезацетилирования хитина и хитозана//Известия высших учебных заведений. Сер. Пищевая технология. 1990. № 5. С. 64-67.
- Kurita K., Sannan T., Iwakura Y. Studies on chitin, 4. Evidence for formation of block and random copolymers of N-acetyl-D-glucosamine and D-glucosamine by hetero-and homogeneous hydrolysis//Die Makromolekulare Chemie. 1977. V. 178, N 12. P. 3197-3202.
- Гамзазаде А. И. Структурная неоднородность как фактор изменчивости свойств хитина и хитозана//Хитин и хитозан: Получение, свойства и применение/под ред. К. Г. Скрябина, Г. А. Вихоревой, В. П. Варламова. М.: Наука, 2002. С. 112-118.
- Чеботок Е. Н., Новиков В. Ю., Коновалова И. Н. Влияние кристалличности хитина и хитозана на кинетику щелочного деацетилирования//Журнал прикладной химии. 2007. Т. 80, № 10. С. 1724-1729.
- Focher B., Naggi A., Torri G., Cosani A., Terbojevich M. Chitosans from Euphausia superba. 2: Characterization of solid state structure//Carbohydrate Polymers. 1992. V. 18, N 1. P. 43-49.
- Новиков В. Ю., Бражная И. Э. Математическое моделирование реакции дезацетилирования хитина/хитозана//Тез. 8-й науч.-техн. конф. МГТУ. Мурманск: МГТУ. 1997. Ч. 2. С. 101-102.
- Новиков В. Ю. Химический гидролиз хитина и хитозана//Современные перспективы в исследовании хитина и хитозана: материалы 7-й междунар. конф. Санкт-Петербург -Репино, 15-18 сент. 2003 г. М.: ВНИРО, 2003. С. 38-42.
- Yaghobi N., Mirzadeh H. Enhancement of chitin's degree of deacetylation by multistage alkali treatments//Iranian Polymer Journal. 2004. V. 13, N 2. P. 131-136.
- Varum K. M., Anthonsen M. W., Grasdalen H., Smidsrod O. Determination of the degree of N-acetylation and the distribution of N-acetyl groups in partially N-deacetylated chitins (chitosans) by high-field n.m.r. spectroscopy//Carbohydrate Research. 1991. V. 211, N 1. P. 17-23.
- Varum K. M., Anthonsen M. W., Grasdalen H., Smidsrod O. 13C-N.m.r. studies of the acetylation sequences in partially N-deacetylated chitins (chitosans)//Carbohydrate Research. 1991. V. 217. P. 19-27.
- Ottoy M. H., Varum K. M., Smidsrod O. Compositional heterogeneity of heterogeneously deacetylated chitosans//Carbohydrate Polymers. 1996. V. 29, N 1. P. 17-24.
- Lamarque G., Cretenet M., Lucas J.-M. et al. Optimization of a-and b-chitin heterogeneous de-N-acetylation from a multi-step process: new route of de-N-acetylation by means of freeze-pump-thaw cycles//Advances in Chitin Science. V. VII/ed. by I. Boucher, K. Jamieson, A. Retnakaran. Montreal, 2004. P. 66-73.
- Lamarque G., Cretenet M., Viton C., Domard A. New route of deacetylation of alpha-and beta-chitins by means of freeze-pump out-thaw cycles//Biomacromolecules. 2005. V. 6, N 3. P. 1380-1388.
- Новиков В. Ю., Коновалова И. Н., Кучина Ю. А. . Влияние надмолекулярной структуры частиц хитина на кинетику гетерогенного деацетилирования//Известия Уфимского научного центра РАН. 2016. № 3 (1). С. 76-78.
- Percot A., Chaussard G., Sorlier P. et al. Overall consideration on the evolution of the study of chitosan properties//Advances in Chitin Science. V. VII/ed. by I. Boucher, K. Jamieson, A. Retnakaran. Montreal, 2004. P. 1-6.
- Никитин В. М., Оболенская А. В., Щеголев В. П. Химия древесины и целлюлозы. М.: Лесная пром-ть, 1978. 368 с.
- Новиков В. Ю., Орлова Т. А., Волкова Н. И. Многократное использование раствора гидроокиси натрия для деацетилирования хитина//Рыбное хозяйство. 1988. № 12. С. 76-78.
- Новиков В. Ю., Сагайдачный В. А., Коновалова И. Н. Закономерности щелочного деацетилирования хитина//Современные перспективы в исследовании хитина и хитозана: материалы XI междунар. конф. Мурманск, 25-30 июня 2012 г. Мурманск: Изд-во РХО, 2012. С. 84-88.
- Новиков В. Ю., Чеботок Е. Н., Гизатулина Г. А., Коновалова И. Н. Кинетические закономерности химического деацетилирования хитина и хитозана//Вестник МГТУ. 2005. Т. 8, № 1. С. 179-182.
- Круглый С. М. Производство хлора, каустической соды и водорода. М.: Высш. шк., 1967. 268 с.
- Мищенко К. П., Полторацкий Г. М. Термодинамика и строение водных и неводных растворов электролитов. Л.: Химия, 1976. 328 с.
- Palascak M. W., Shields G. C. Accurate experimental values for the free energies of hydration of H+, OH-, and H3O+//The Journal of Physical Chemistry A. 2004. V. 108, N 16. P. 3692-3694.
- Hummer G., Pratt L. R., Garcia A. E. Free energy of ionic hydration//The Journal of Physical Chemistry. 1996. V. 100, N 4. P. 1206-1215.
- Pearson R. G. Ionization potentials and electron affinities in aqueous solution//Journal of the American Chemical Society. 1986. V. 108, N 20. P. 6109-6114.
- Marcus Y. Thermodynamics of solvation of ions. Part 5. Gibbs free energy of hydration at 298.15 K//Journal of the Chemical Society, Faraday Transactions. 1991. V. 87, N 18. P. 2995-2999.


