Гидродинамика в интактной и денервированной аорте в эксперименте
Автор: Петров Е.С., Тутуров Александр Олегович, Волов Д.Б., Косси-согбо кА.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 т.22, 2018 года.
Бесплатный доступ
Введение Нейрогенные механизмы на протяжении жизни и при различных заболеваниях претерпевают изменения в функции, а следовательно влияют на сердечно-сосудистую систему и ее гидродинамику. Цель Смоделировать и изучить гидродинамику кровотока в интактной и денервированной аорте. Методы С помощью аппаратуры для регистрации артериального давления, тензометрии продольных и диаметральных деформаций кровеносных сосудов в точке измерения давления проведено исследование прохождения пульсовой волны через интактный сегмент грудной аорты собаки, денервированный аутотрансплантат и аллотрансплантат грудной аорты, взятый у собаки-донора. Эксперименты выполнялись под общим эндотрахеальным наркозом. Проведены две серии острых экспериментов по замещению грудной аорты ауто-и аллотрансплантатом, по 8 собак в каждой серии. Доступ - торакотомия в IV межреберье слева. Замещение сегмента производили после введения гепарина при подключично-бедренном обходе и ретроградной аутоперфузии. Результаты Экспериментально установлено, что без иннервации в аорте невозможно формирование и распространение нормальной уединенной пульсовой волны и сохранение вязкого ламинарного течения крови. Эксперименты показали, что в интактной аорте сначала увеличивается диаметр аорты (на 400-500 мкм) с одновременным укорочением ее сегмента (на 250 мкм), опережая волну давления на 0,02-0,04 с. Причем скорость расширения аорты опережает скорость систолического подъема давления. Однако в отличие от интактной аорты аутотрансплантат удлиняется и суживается вместе с повышением давления. Выводы Для оптимальной гидродинамики кровотока в аорте необходима система нейрорефлекторного управления прохождением каждой пульсовой волны, которая должна определять ее солитонный характер и обеспечивать антифлаттерную стабилизацию потока крови.
Антифлаттерная стабилизация, аорта, гидродинамика, уединенная волна
Короткий адрес: https://sciup.org/142230653
IDR: 142230653 | DOI: 10.21688/1681-3472-2018-2-30-38
Текст научной статьи Гидродинамика в интактной и денервированной аорте в эксперименте
Функциональные механизмы регуляции гемодинамики — это наиболее глубоко исследованный раздел физиологии кровообращения. В то же время биомеханические и гидродинамические аспекты проблемы остаются недостаточно изученными.
Известно, что кровеносные сосуды, кроме капилляров, иннервируются паравазальными симпатическими нервными сплетениями, которые сохраняют тонус сосудов и регулируют кровоток в органах и тканях [1]. Симпатические постганглионарные адренергические нервные волокна поддержива- ют сосудистый тонуc и являются основными эффекторными нейронными путями, контактирующими с кровеносными сосудами [2]. В.Н. Швалев с соавт. описали феномен ранней возрастной инволюции симпатического отдела вегетативной нервной системы, который начинается после 35–40 лет [3]. С возрастом изменения в симпатическом отделе становятся более выраженными: адренергические терминали переходят в деструктивные. Ультраструктурные исследования симпатических ганглиев показали, что после 40 лет происходят не только нарушения контуров ядер симпатических нейронов, прогрессируют дегенеративные процессы крист митохонд-
@ (D
Статья доступна по лицензии Creative Commons Attribution 4.0.
рий, а в цитоплазме начинают накапливаться гранулы липофусцина. Без изменений не остаются и глиальные элементы. Все это указывает на то, что с возрастом влияние симпатических сосудистых нервных сплетений ослабевает [4, 5].
К настоящему времени накопилось достаточно фактов о том, что сердечно-сосудистая система работает не в полном соответствии с представлениями St. Hales [6] и O. Frank [7] о демпфирующей роли начальных отделов артериального русла, выполняющих функцию пассивного эластического резервуара или упругой компрессионной камеры, сглаживающей пульсации давления. Однако в полной мере механизмы стабилизации потоков крови сосудами эластического типа до сих пор не выявлены.
Описание гидродинамических и биомеханических аспектов регуляции сосудистого тонуса в начальных отделах артериального русла является первостепенной задачей. Для демонстрации функциональных механизмов регуляции гидродинамики кровотока необходим эксперимент, который заключается в сравнении и изучении поведения аорты в интактном и денервированном состоянии. Мы считаем, что это исследование позволит не только описать стабилизацию сосудистого русла, но и продемонстрировать биомеханику протезированного аортального сегмента в фазы сердечного цикла.
Цель работы — смоделировать и изучить гидродинамику кровотока в интактной и денервированной аорте.
Методы
Для оценки изменений на аорту установлен диагностический комплекс, состоящий из отдельных блоков: измерения давления (индикаторы давления ИД-2И, ДМИ), деформаций (тен-зостанции ТД-3 и ТА-5; тензодатчики сопротивления ПКП-20-200-11-111-25), регистрации диаметральных и продольных деформаций сосудов, объемного расхода крови (электромагнитные расходомеры РКЭ-1 и РКЭ-2).
Измеряли давление прямым способом с помощью полиэтиленовых катетеров диаметром 1,5–2,0 мм с гепариновым замком. Для регистрации деформаций сосудов изготовлены мягкие арочные изотонические тензодатчики на амагнитной титановой основе толщиной 0,1 мм. Изменение базы датчика на 1 мм осуществлялось при усилии менее 0,5 г. Такие датчики записывали наведенные частоты до 300 Гц. Тензодатчики фиксировали на аорте с помощью подшивания атравматическими иглами 3,0–6,0 (рис. 1).
Тарировку цепи измерения давления производили по ртутному манометру и шкале осциллографа в каждом эксперименте. Тарировку датчиков деформации производили на специальном стенде с помощью микрометра синхронно с перемещением светового пятна шлейфа по экрану осциллографа. Регистрацию параметров производили шлейфовым
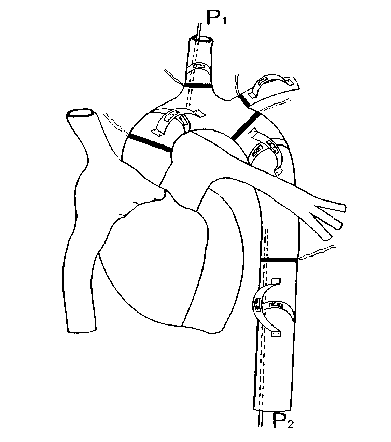
Рис. 1. Схема расположения катетеров ДМИ, тензодатчиков, датчиков расходомеров при исследовании пульсовой динамики давления, датчики продольной и диаметральной деформаций на грудной аорте и ее основных ветвях: давление в восходящей аорте (P1); давление в нисходящей аорте (P2). Впервые опубликован в [23], воспроизведен с разрешения автора Е.С. Петрова
Fig. 1. Layout of catheters, strain gauges, flow meters for pulse pressure profile, longitudinal/diametric deformation gauges for thoracic aorta and its main branches: ascending aorta pressure (P1); descending aorta pressure (P2). First published in [23], reprinted by permission of the author E.S. Petrov осциллографом Н-115 с записью на фотобумаге с большими скоростями протяжки 125–500 мм/с для фиксации минимальных фазовых сдвигов между кривыми.
Исследование одобрено локальным этическим комитетом (протокол заседания № 193 от 30.05.18), выполнено с соблюдением норм гуманного обращения с животными (Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях, Страсбург, 1986) и принципов надлежащей лабораторной практики. Эксперименты проведены на 16 взрослых беспородных собаках массой от 12 до 37 кг под общим эндотрахеальным наркозом с управляемым дыханием. Премедикация: аминазин — 5 мкг/ кг, пипольфен — 2,5 мкг/кг, атропин — 0,006 мг/кг и гексе-нал — 500 мг внутримышечно. Индукция в анестезию — дробные дозы дроперидола в суммарной дозе 250 мкг/кг и фентанила — 5 мкг/кг на фоне внутривенного введения 2,5% раствора гексенала от 350 до 700 мг. Анестезию поддерживали введением кетамина (дробно в дозе 9–16 мкг/кг/мин). Эвтаназию осуществляли путем отключения дыхательного автомата или передозировкой гексенала.
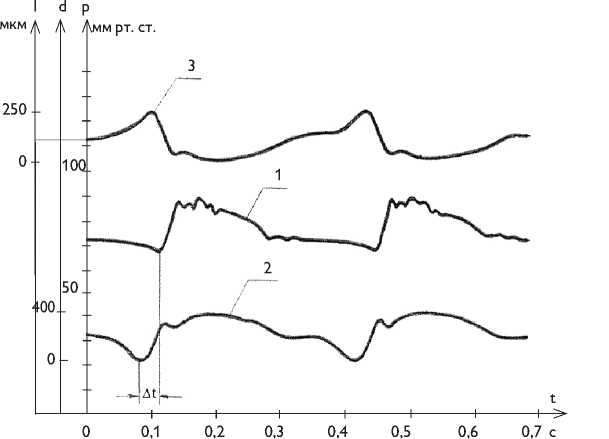
Рис. 2. Пульсовая динамика давления, диаметральной и продольной деформации сегмента грудной аорты в условиях интактного организма: давление в грудной аорте (1); диаметр грудной аорты (2); длина грудной аорты (3)
Fig. 2. Pulse pressure profile, diametric/ longitudinal deformation of a thoracic aorta segment of an intact organism: thoracic aorta pressure (1); thoracic aorta diameter (2); thoracic aorta length (3)
Проведены две серии острых экспериментов по замещению грудной аорты ауто- и аллотрансплантатом, по 8 собак в каждой серии. Доступ — торакотомия в IV межреберье слева. Замещение сегмента производили после введения гепарина при подключично-бедренном обходе и ретроградной аутоперфузии. После к грудной аорте подшивали диаметральный и продольный тензодатчики и выставляли кончик катетера давления, введенного через бедренную артерию на уровень расположения датчика диаметральной деформации. После этого производили запись осциллограмм при различной скорости протяжки фотобумаги от 125 до 500 мм/с.
Полной денервации грудной аорты добивались путем мобилизации с перевязкой и пересечением межреберных артерий и иссечения ее участка длиной 7,0 см, на котором сохраняли пришитые ранее тензодатчики с последующим вшиванием на прежнее место. Для возможности выключения из кровотока подводили турникеты выше и ниже этого сегмента. Заранее изготовленный из двух артериальных канюль и силиконовой трубки обходной анастомоз заполняли гепаринизированным физиологическим раствором и производили наложение подключично-бедренного шунта между левыми подключичной и бедренной артериями. Открытие шунта и затягивание турникетов позволяет надежно изолировать часть грудной аорты из кровотока на время, необходимое для замещения трансплантатом. Кровоснабжение спинного мозга при этом не страдает. После ушивания аутотрансплантата грудной аорты сохранялись продольное натяжение и датчики на тех же местах, что и во время контрольной записи пульсовой динамики давления, диаметральной и продольной деформации грудной аорты при сохраненной иннервации в условиях интактного организма.
Поперечное пересечение приводит к расхождению концов мобилизованного участка грудной аорты на 5–6 см. Для замещения образовавшегося диастаза использовали аллотрансплантат грудной аорты собаки-донора того же диаметра, который вшивали без предварительного продольного натяжения. После возобновления кровотока на аллотрансплантате грудной аорты фиксировали датчики поперечных и продольных деформаций и устанавливали кончик катетера датчика давления на уровне их перекреста.
Численные исследования проводились в конечно-элементном пакете Abaqus, позволяющем получать гемодинамические характеристики течения (поля давлений, скоростей температур и так далее), учитывать деформацию сосудов при течении жидкости, а также выявлять наиболее нагруженные участки.
Данные обрабатывались средствами 3D-визуализатора. Создавалась объемная модель течения жидкости, и моделировался пограничный слой. Для сосудов строилась оболочечная модель. При построении сетки для простых геометрических моделей использовалось гексагональное разбиение. Исследована сходимость расчетов, и выбран размер элемента 0,1–0,3 мм. Кровь предполагалась неньютоновской жидкостью с плотностью 1 050 кг/м3 и коэффициентом динамической вязкости 0,0037 Па·с. Задача решалась для несжимаемой жидкости с помощью уравнений Навье – Стокса. На входе в расчетный участок задавалась функция скорости, а на выходе — постоянное давление. Стенки сосуда считались сильно деформируемыми с возможностью нелинейного изменения геометрии. Вход сосуда жестко закреплен. Решалась совместная задача движения жидкости и деформации стенок сосуда. Для этого задавалось условие взаимодействия (Fluid-Solid Interaction) внутренней поверхности стенок сосуда с поверх-
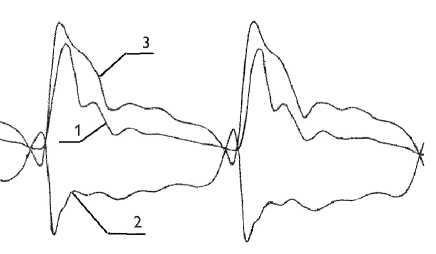
Рис. 3. Сужение и удлинение аутотрансплантата грудной аорты, возникновение в нем автоколебаний после стимуляции кровообращения адреналином: давление в аутотрансплантате грудной аорты (1); диаметр аутотрансплантата грудной аорты (2); длина аутотрансплантата грудной аорты (3)
Fig. 3. Narrowing and elongation of thoracic aorta autograft, occurrence of auto oscillations following blood flow stimulation by adrenaline: pressure in thoracic aorta autograft (1); thoracic aorta autograft diameter (2); thoracic aorta autograft length (3)
l d p
мкм A
A A мм рт. ст.
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 с
ностью потока крови. Механические свойства стенок сосудов назначались близкими к реальным.
Результаты
В динамике формирование пульсовой волны в грудной аорте происходит следующим образом (рис. 2).
Сначала увеличивается диаметр аорты (на 400–500 мкм) с одновременным укорочением сегмента (на 250 мкм), опережая волну давления на 0,02–0,04 с. Скорость расширения аорты опережает скорость систолического подъема давления. Дилатация — это самостоятельный активный процесс нейро-рефлекторной природы, в котором реализуются два механизма. Первый связан с рефлекторным торможением и мгновенным расслаблением циркулярного слоя тонической гладкой мускулатуры, когда на 0,02 с снимается базальный сосудистый мышечный тонус в 50 мм рт. ст. и тут же восстанавливается в следующие 0,02 с. Благодаря этому в момент пиковой линейной скорости потока крови и наибольшего проявления эффекта Бернулли стабилизирующее сосудистую стенку трансмуральное давление на мгновение увеличивается на 50 мм рт. ст. Расслабленная аорта быстро расширяется остаточным в ней давлением на 0,5 мм. Второй активный механизм расширения аорты связан с рефлекторным сокращением спиральной фазной гладкой мускулатуры, что сопровождается укорочением каждого сегмента в момент расширения. Увеличение при этом продольного натяжения также является фактором стабилизации стенки аорты.
В полностью денервированном аутотрансплантате грудной аорты те же датчики регистрируют противоположную последовательность событий (рис. 3).
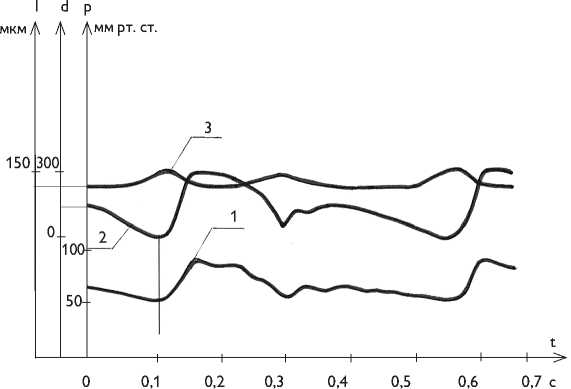
В отличие от интактной аорты аутотрансплантат грудной аорты, напротив, удлиняется и суживается вместе с повыше- нием давления. Прежде всего, исчезает фазовый сдвиг между кривыми диаметральной деформации и давления (рис. 4).
Затем происходит постепенное восстановление ударного объема, скорости кровотока и давления после периода редуцированного кровообращения. Полное восстановление производительности сердца происходит при внутривенном введении 0,1 мл 0,1% раствора адреналина. Следствием максимального увеличения скорости кровотока становится проявление эффекта Бернулли, когда неуправляемый аутотрансплантат кардинально изменяет поведение: с повышением давления начинает удлиняться и сужаться. И только максимальное повышение давления приводит к постепенному расширению. Поток крови при этом переходит в автоколебательный режим течения. Возникающий гидродинамический флаттер с частотой 25–40 Гц регистрируется как по кривой давления, так и тензограмме диаметральной деформации.
При продольном растяжении пассивной эластичной трубки происходит естественное сужение [13], что мы и наблюдаем во второй серии экспериментов с замещением аллотрансплантата грудной аорты. Имеющий иннервацию проксимальный конец грудной аорты сохраняет нормальное поведение. При этом аллотрансплантат грудной аорты, как пассивный элемент, вытягивается и суживается за 0,01 с до начала повышения давления.
Пульсовая волна подхватывает начавшийся процесс сужения сосудистой трубки за счет гидродинамических сил, например эффекта Бернулли (рис. 5).
Стимуляция сердечной деятельности адреналином приводит к ускорению кровотока, еще большему зажатию аллотрансплантата. И только максимальное повышение давления приводит к его постепенному расширению. Поток крови
Рис. 4. Исчезновение фазового сдвига между кривыми диаметральной деформации и давления в аутотрансплантате грудной аорты: давление в аутотрансплантате грудной аорты (1); диаметр аутотрансплантата грудной аорты (2); длина аутотрансплантата грудной аорты (3)
Fig. 4. Disappearance of phase shift between the curves of diametric deformation pressure in thoracic aorta autograft: pressure in thoracic aorta autograft (1); thoracic aorta autograft diameter (2); thoracic aorta autograft length (3)
при этом переходит в автоколебательный режим с частотой до 45 Гц (рис. 6).
Компьютерное моделирование гидродинамики в аорте показало, что денервированная аорта ведет себя как пассивная эластическая трубка и прохождение каждый раз ударного объема крови приводит к ее укорочению и появлению на стенке флаттера оболочечной моды, что значительно увеличивает сопротивление мерного участка сосудистого русла, увеличивает напряжение на стенке сосуда и давление в нем (рис. 7).
Компьютерное моделирование гидродинамики в интактной, сохраняющей иннервацию аорте показывает, что предварительное укорочение и увеличение ее по окружности снимает избыточное напряжение в сосудистой стенке, не допускает появления на ней флаттера оболочечной моды и обеспечивает безградиент-ное перемещение ударного объема крови (рис. 8).
Обсуждение
Сердечная модуляция сосудистого тонуса имеет смысл только в случае рефлекторного возникновения волны расширения (в систолу) или сужения (в диастолу) артерий, которые сопровождают каждую пульсовую волну давления и распространяются от сердца на периферию по артериальному руслу со скоростью пульсовой волны (у собаки и человека от 3,0 до 10,0 м/с). Классическая сосудодвигательная трехнейронная рефлекторная дуга строится нерационально. Ее чувствительное и ассоциативное звенья обладают высокой скоростью проведения нервного импульса, а на уровне эффекторного звена этого рефлекса скорость проведения возбуждения по постганглионарным симпатическим волокнам резко уменьшается в 10–15 раз. Наряду с этим обнаруживается такое малопонятное явление, как фоновая электрическая активность с пульсовой модуляцией, именно у вазоконстрикторных спинальных нейронов со скоростью проведения возбуждения
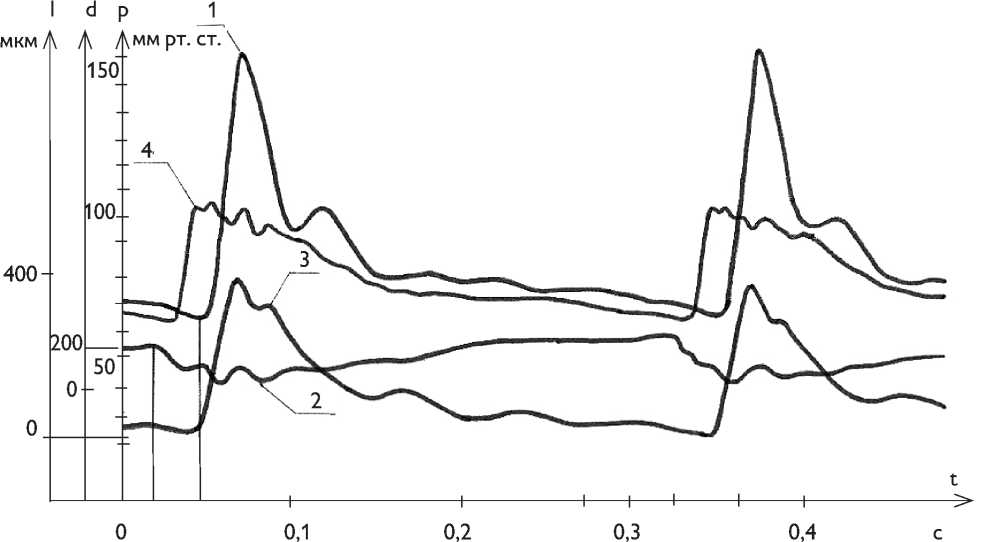
Рис. 5. Исчезновение фазового сдвига между кривыми диаметральной деформации и давления в аутотрансплантате грудной аорты: давление в аутотрансплантате грудной аорты (1); диаметр аутотрансплантата грудной аорты (2); длина аутотрансплантата грудной аорты (3)
Fig. 5. Narrowing and elongation of thoracic aorta allograft, as pulse wave passes through it: pressure in thoracic aorta allograft (1); thoracic aorta allograft diameter (2); thoracic aorta allograft length (3); ascending aorta pressure (4)
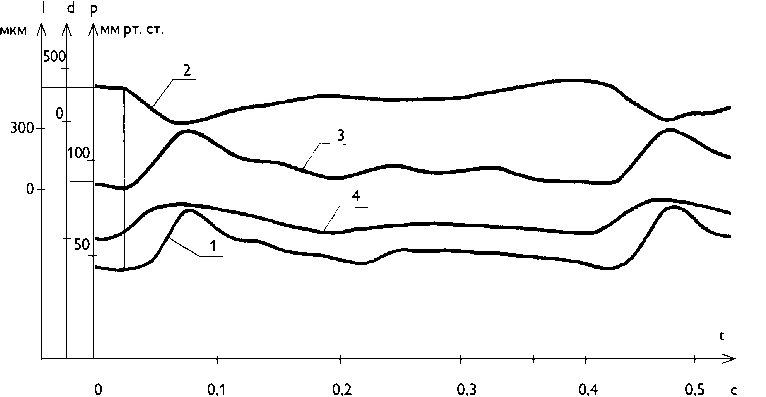
Рис. 6. Возникновение автоколебаний в аллотрансплантате грудной аорты собаки после стимуляции кровотока адреналином: давление в аллотрансплантате грудной аорты (1); диаметр аллотрансплантата грудной аорты (2); длина трансплантата (3); давление в восходящей аорте (4)
Fig. 6. Auto oscillations in a dog’s thoracic aorta allograft after blood blow stimulation by adrenaline: pressure in thoracic aorta allograft (1); thoracic aorta allograft diameter (2); thoracic aorta allograft length (3); ascending aorta pressure (4)
по преганглионарным симпатическим волокнам от 3,0 до 10,0 м/с, точно совпадающей со скоростью распространения пульсовой волны, постепенно нарастающей от 3,0 м/с в восходящей аорте до 10,0 м/с в бедренной артерии [15, 16]. Такое совпадение не может быть случайным, а спайковая активность преганглионарных нейронов — спонтанным фоновым процессом. Скорее всего, имеет место постоянно действующий кардиоваскулярный симпатический двухнейронный рефлекс, отслеживающий каждую пульсовую волну (рис. 9). Таким образом, сердечная модуляция мышечного тонуса артериальных сосудов — важное фундаментальное явление, без учета которого нельзя понять основные принципы функционального взаимодействия сердца и артериальной системы.
По современным представлениям, каждый электрический импульс, возникающий в синусовом узле, трансформируется с помощью кардиоваскулярного симпатического рефлекса с пейсмекерной зоны сердца в сосудистую реакцию в виде волн расширения [8–11], сужения [12] или сужения – расширения [16], всегда сопровождающих пульсовую волну. Функциональная подготовка начальных отделов аорты к быстрому выбросу крови из левого желудочка происходит в изоволюмический период кардиоцикла и заключается в рефлекторном расширении грудной аорты с одновременным увеличением объема, падением в ней давления, возникновением присасывающего эффекта и ретроградного тока крови, зарегистрированного в бедренных артериях [17], брюшной аорте [18] и коронарной артерии [19]. Такое расширение обеспечивается двумя механизмами — пассивным и активным [20]. Рефлекторное кратковременное (0,02 с) снижение тонуса циркулярных гладких мышц, обуславливающих базальный сосудистый тонус, приводит к пассивному расширению аорты остаточным давлением. Активный компонент дилатации связан с рефлекторным сокращением фазной гладкой муску-
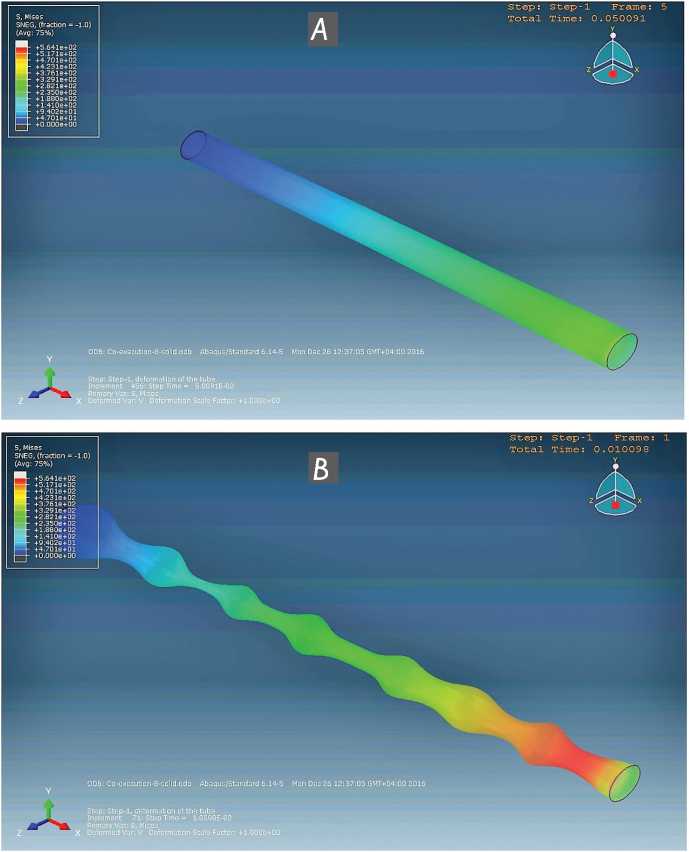
Рис. 7. Компьютерное моделирование гидродинамики потока в денервированной грудной аорте: модель исходного состояния грудной аорты ( А ); модель грудной аорты при прохождении пульсовой волны давления ( B ). Демонстрируется удлинение сосуда и появление на его стенке флаттера оболочечной моды
-
Fig. 7. Computer modelling of flow hydrodynamics in a denervated thoracic aorta: thoracic aorta baseline model ( A ); thoracic aorta model with pressure pulse wave passing through it ( B ). Shown are vessel elongation and occurrence of envelope mode flutter on its wall
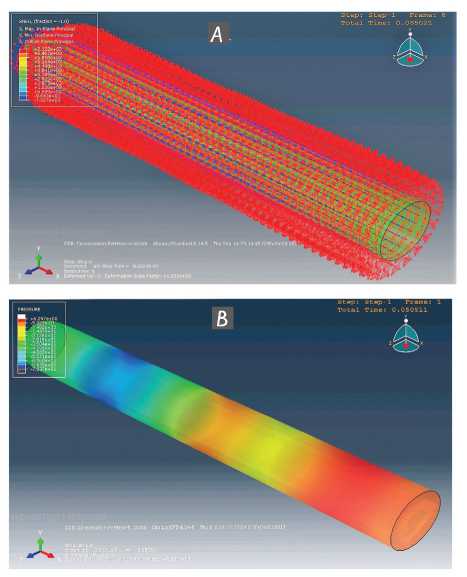
Рис. 8. Компьютерное моделирование гидродинамики потока в интактной грудной аорте: расширение аорты, предваряющее прохождение пульсовой волны давления, и ее укорочение ( А ); пульсовая волна давления в сосуде с предварительным увеличением по диаметру и укорочением не приводит к появлению на его стенке флаттера оболочечной моды и обеспечивает безградиентное перемещение ударного объема по сосуду ( B )
-
Fig. 8. Computer modelling of flow hydrodynamics in an intact thoracic aorta: aorta dilatation preceding the passage of pressure pulse wave and its shortening ( A ); pressure pulse wave in a preliminarily enlarged and shortened vessel does not lead to an envelope mode flutter on its wall and provides zero-pressure movement of stroke volume along the vessel ( B )
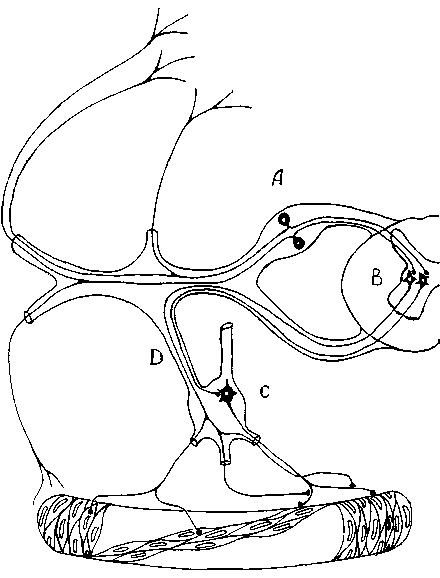
Рис. 9. Рефлекторные дуги тонического и модулирующего сосудодвигательного симпатического рефлекса : афферентный нейрон ( А ); преганглионарный нейрон ( В ); ганглионарный эффекторный нейрон ( С ); R. communicans albus ( D ). Впервые опубликован в [23], воспроизведен с разрешения автора Е.С. Петрова
-
Fig. 9. Reflex arches of a tonic/modulating vasomotor sympathetic reflex: afferent neuron ( A ); preganglionic neuron ( B ); ganglionic effector neuron ( C ); R. communicans albus ( D ). First published in [23] and is reprinted with the permission of the author E.S. Petrov
латуры сосудистой стенки, формирующей спиральные пучки мышечных волокон.
Таким образом, аорта не является пассивной эластической трубкой. Стенка на 45% состоит из гладких миоцитов [21], многие из которых относятся к мультиунитарному типу [22] и способны к быстрым сокращениям (до 15 в 1 с). Они обуславливают активное нейрорефлекторное взаимодействие сосудистой трубки с пульсовой волной давления.
Проведенные нами эксперименты убедительно доказывают: во-первых, фазовый сдвиг между кривыми не является техническим артефактом из-за несоответствия по частотным характеристикам систем измерения давления крови и размеров сосуда, иначе он наблюдался бы во всех случаях, не- зависимо от условий эксперимента; во-вторых, без иннервации артерий и функциональной связи сердца с артериальной системой невозможно формирование и распространение нормальной уединенной пульсовой волны, сохранение вязкого ламинарного течения крови. Для оптимальной гидродинамики кровотока в аорте необходима биокибернетическая система нейрорефлекторного управления прохождением каждой пульсовой волны, которая должна обуславливать ее солитонный характер и обеспечивать антифлаттерную стабилизацию потока крови.
Денервация сердечного пейсмекера на всем протяжении грудной аорты и поперечная блокада сердца снижают скорость пульсовой волны давления на 30%. Следовательно, обнаруженная биокибернетическая система управления прохождением каждой пульсовой волны увеличивает эффективный модуль упругости аорты на одну треть и реализует таким образом основное предназначение как рефлекторного анти-флаттерного механизма. Управляемая аорта является на 30% более функционально жесткой эластичной трубкой. Этим и объясняется отсутствие гидродинамического флаттера в аорте и основных ветвях в условиях интактного организма экспериментального животного.
Кроме того, полученные результаты имеют важное прикладное значение и прямо указывают на то, какими механическими свойствами должны обладать артериальные протезы, не способные к активному взаимодействию с пульсовой волной: максимально податливыми по диаметру и нерастяжимыми по длине [23].
Выводы
В настоящее время наиболее актуально изучение изменения гидродинамики кровотока в сосудистом русле после хирургических операций и различных патологий сердечнососудистой системы. К сожалению, сердечно-сосудистые хирурги не воспринимают сердце и сосуды как сложный биофизический механизм, имеющий иннервацию и критические пороги стабилизации при нарушениях. Проведенное исследование подтвердило патологические автоколебательные движения стенки денервированной грудной аорты, которые возникают в результате инволюции сердечно-сосудистой системы, а также при различных операциях протезирования участков аорты.
Исходя из результатов экспериментов и знаний механизмов антифлаттерной стабилизации, полученных при исследовании интактной грудной аорты, стоит пересмотреть материалы и методы создания сосудистых протезов, а также изменить представление о многих сосудистых патологиях у пациентов старше 30–40 лет.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Гидродинамика в интактной и денервированной аорте в эксперименте
- Matsuyama A., Takatori S., Sone Y., Ochi E., Goda M., Zamami Y., Hashikawa-Hobara N., Kitamura Y., Kawasaki H. Effect of nerve growth factor on innervation of perivascular nerves in neovasculatures of mouse cornea. Biol Hyarm Bull. 2017; 40(4): 396-401. PMID: 28381794. DOI: 10.1248/bpb.b16-00583
- Coote J.H. Landmarks in understanding the central nervous control of the cardiovascular system. Exp Physiol. 2007; 92(1): 3-18. PMID: 17030558. DOI: 10.1113/expphysiol.2006.035378
- Швалев В.Н. Тарский Н.А. Феномен ранней возрастной инволюции симпатического отдела вегетативной нервной системы. Кардиология. 2001; (2): 10-14.
- Швалев В.Н., Реутов В.П., Рогоза А.Н., Сергиенко В.Б., Аншелес А.А., Ковалев В.П. Развитие современных представлений о нейрогенной природе кардиологических заболеваний. Тихоокеанский медицинский журнал. 2014; 55(1): 10-14.
- Швалев В.Н., Рогоза А.Н., Тарский Н.А., Сергиенко В.Б., Аншелес А.А., Реутов В.П., Юдаев А.А. Внезапная сердечная смерть и морфофункциональная диагностика предшествующих возрастных нейродистрофических изменений организма. Тихоокеанский медицинский журнал. 2017; 67(1): 42-51. DOI: 10.17238/PmJ1609-1175.2017.1.42-51


