Гидролиз акрилонитрила клетками нитрилутилизирующих бактерий Rhodococcus ruber gt1 и Pseudomonas fluorescens C2, иммобилизованными в структуре геля агарозы
Автор: Максимов А.Ю., Максимова Ю.Г., Демаков В.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 10, 2009 года.
Бесплатный доступ
Проведена трансформация акрилонитрила клетками нитрилутилизирующих бактерий Rhodococcus ruber gt1 и Pseudomonas fluorescens C2, иммобилизованными включением в структуру агарозного геля. Показано, что активность нитрилгидратазы иммобилизованных клеток не снижается, тогда как активность нитрилазы не превышает 20% от исходной. В то же время операционная стабильность нитрилазы иммобилизованных клеток P. fluorescens C2 выше, чем у нитрилгидратазы клеток штамма R. ruber gt1.
Короткий адрес: https://sciup.org/147204447
IDR: 147204447 | УДК: 579.222
Текст научной статьи Гидролиз акрилонитрила клетками нитрилутилизирующих бактерий Rhodococcus ruber gt1 и Pseudomonas fluorescens C2, иммобилизованными в структуре геля агарозы
Известно, что нитрилконвертирующие микроорганизмы являются перспективными объектами биотехнологии получения амидов и карбоновых кислот из соответствующих нитрилов. Промышленный синтез акриламида, никотинамида, акриловой кислоты основан на использовании селекционированных бактериальных штаммов с высокой активностью нитрилгидратаз (КФ 4.2.1.84), амидаз (КФ 3.5.1.4) и нитрилаз (КФ 3.5.5.1) (За-базная и др., 1998; Hughes et al., 1998; Webster et al., 2001).
Эффективность процессов биотрансформации может быть повышена путем иммобилизации каталитически активных клеток бактерий. Иммобилизация клеток позволяет стабилизировать их ферментативную активность, повысить устойчивость к токсичным субстратам, обеспечить возможность более длительного использования биокатализатора по сравнению с суспендированной биомассой и увеличить выход конечного продукта.
Среди основных методов иммобилизации можно выделить адсорбцию, включение в структуру гелей и ковалентную сшивку с носителями. Каждый из вышеперечисленных способов имеет свои преимущества и недостатки и может быть адаптирован для конкретных биотехнологических целей.
Нами ранее было показано стабилизирующее влияние адсорбционной иммобилизации на нит-рилгидратазную активность клеток штамма R. ruber gt1 (Максимов и др., 2007; Максимова Ю.Г., 2008). В отличие от адсорбции, иммобилизация клеток методом включения в гель дает возможность достижения большей концентрации биока- тализатора в единице объема реактора. В научной литературе существуют данные по иммобилизации клеток нитрилгидролизующих бактерий в геле полиакриламида (Hughes et al., 1998), поливинилового спирта (Bauer et al., 1996), κ-каррагинана (Dias et al., 2001), альгинатов (Graham et al., 2000 Dias et al., 2001).
Целью данного исследования является изучение процесса трансформации акрилонитрила (НАК) иммобилизованными в структуре агарозного геля клетками R. ruber gt1, обладающими нит-рилгидратазной активностью, и P. fluorescens C2, содержащими нитрилазу.
Материалы и методы исследований
Бактериальные штаммы
В работе использованы бактериальные штаммы, селекционированные в лаборатории химического мутагенеза ИЭГМ УрО РАН: Rhodococcus ruber gt1 (ИЭГМ 612, Региональная специализированная коллекция алканотрофных микроорганизмов, Пермь) и Pseudomonas fluorescens C2.
Нитрилгидратазная активность штамма R. ruber gt1 достигала 300 мкмоль/мг/мин, нитрилазная активность штамма P. fluorescens С2 – 6 мкмоль/мг/мин.
Среды и условия культивирования
Культивирование бактерий проводили в колбах объемом 250 мл в 100 мл синтетической среды N с глюкозой и хлоридом аммония в качестве источника углерода и азота (Максимов и др., 2003) при 28°С на шейкере (100 об/мин).
Рост культуры оценивали по изменению оптической плотности клеточной суспензии при λ=540 нм, измеренной на фотоэлектроколориметре КФК-3 с использованием кюветы с длиной оптического пути 0.5 см. Единица ОП 540 для штамма R. ruber gt1 соответствует 0.43 мг сухих клеток в 1 мл суспензии, для штамма Ps. fluorescens С2 – 0.21 мг/мл.
Иммобилизация клеток в структуре агарозного геля
Раствор агарозы в концентрации 4% нагревали до температуры кипения. После охлаждения до 40° C смешивали 30 мл агарозы с 10 мл бактериальной суспензии и 10 мл смеси помещали в чашку Петри. После застывания гель измельчали механически, размер гранул составлял 1-2 мм2.
Трансформация акрилонитрила
Трансформацию НАК иммобилизованными клетками проводили в 10-20 мл калий-фосфатного буфера (рН 7.2±0.2) при 25°С. В реакционную среду вносили субстрат в концентрации от 0.06 до 1.3 М, реакцию проводили в течение 10–20 мин и останавливали добавлением концентрированной HCl до конечной концентрации 2 %.
Нитрилгидратазную и нитрилазную активность определяли по увеличению в реакционной среде концентрации амида и карбоновой кислоты соответственно. Концентрацию акриламида определяли, как описано ранее А.Ю. Максимовым и др., 2003. Концентрацию акриловой кислоты (АК) определяли методом ВЭЖХ на хроматографе LC–10 «Shimadzu» (Япония) с диодно-матричным УФ– и флуоресцентным детектором и колонкой HYDRO– RP (125х4,6 мм), заполненной силикагелем (фракция 4 мкм). В качестве подвижной фазы использовали раствор 25 мМ NaH 2 PO 4 , скорость потока составляла 0.75 мл/мин при температуре 25°С. Удельную ферментативную активность (ЕД) определяли как количество акриламида либо акриловой кислоты в мкмоль, образуемое за 1 мин биомассой бактерий, соответствующей 1 мг сухих клеток.
Операционная стабильность иммобилизованного биокатализатора
Операционную стабильность биокатализаторов на основе иммобилизованных клеток P. fluorescens С2 и R. ruber gt1 оценивали по сохранению нитрилазной и нитрилгидратазной активности при последовательном проведении реакции трансформации НАК, вносимого в каждом цикле до концентрации 1.3 М. Продолжительность реакции – 20 мин. После проведения реакционного цикла биокатализаторы отмывали 0.01 М калий-фосфатным буфером.
Результаты исследования и их обсуждение
Нитрилгидратазная активностьиммобилизованных клеток R. ruber gt1
Сохранение нитрилгидратазной активности клеток родококков после включения в структуру геля агарозы оценивали по образованию акриламида из акрилонитрила в реакционной среде за 10 мин трансформации.
Определяли зависимость нитрилгидратазной активности иммобилизованных клеток от количества НАК, который вносили в реакционную среду в концентрации от 0.06 М до 1.3 М. Определено, что при концентрации субстрата 0.59 М активность иммобилизованных клеток достигает значений исходной активности суспензии, а при дальнейшем увеличении концентрации субстрата до 1.13 М превышает ее (таблица). Дальнейшее повышение концентрации акрилонитрила приводит к снижению активности фермента. Отмечено, что концентрация субстрата 1.13 М является оптимальной для его трансформации иммобилизованными клетками.
Нитрилгидратазная активность клеток
R. ruber gt1, включенных в структуру геля агарозы
|
Концентрация НАК, М |
Активность, ЕД* |
Сохранение активности, % |
|
0.06 |
127 |
62 |
|
0.09 |
154 |
75 |
|
0.30 |
170 |
83 |
|
0.59 |
213 |
104 |
|
1.13 |
244 |
119 |
|
1.30 |
163 |
80 |
|
*Исходная активность клеток |
в суспензии – |
|
205 ЕД
Нитрилазная активность иммобилизованных клеток P. fluorescens C2
Изучена динамика трансформации 1.3 М раствора НАК иммобилизованными клетками P. fluorescens C2. Реакцию трансформации НАК катализировали клетками в количестве 4.3 мг (по сухому весу), включенными в гель агарозы. При включении клеток в гель нитрилазная активность снижалась по сравнению с таковой у суспендированных клеток и составляла не более 20% исходной активности. Показано, что за 24 ч трансформируется около 70% внесенного субстрата, а концентрация продукта возрастает линейно (рис. 1).
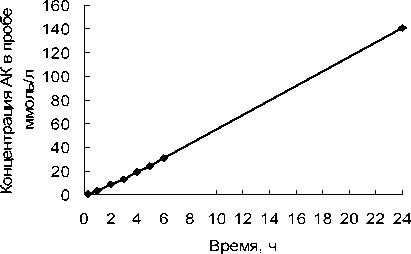
Рис. 1. Динамика трансформации НАК клетками P. fluorescens C2, включенными в
структуру геля агарозы
Операционная стабильность нитрилгидра-тазы иммобилизованных клеток R. ruber gt1
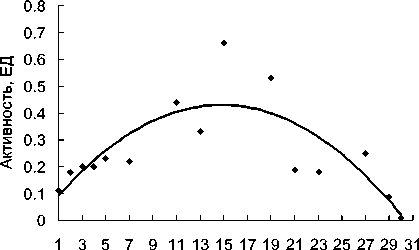
Включение клеток в структуру гелей позволяет получить достаточно стабильный биокатализатор, так как практически не происходит потерь клеток из матрицы геля. Показано, что при проведении повторных циклов конверсии НАК нитрилгидра-тазная активность возрастала до 6-го цикла, после чего наблюдалось постепенное снижение активности.
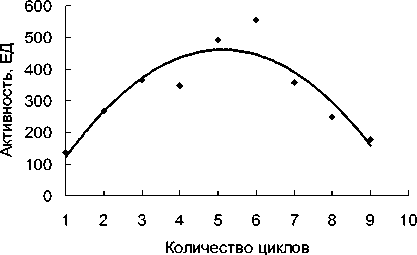
Рис. 2. Операционная стабильность нитрилгидратазы иммобилизованных клеток R. ruber gt1
Операционная стабильность нитрилазы иммобилизованных клеток P. fluorescens С2
Биокатализатор, приготовленный на основе клеток P. fluorescens С2, включенных в структуру агарозы, отличается большей стабильностью, чем биокатализатор на основе нитрилгидратазного штамма. Это может быть связано с тем, что термостабильная нитрилаза данного штамма более стабильна, чем нитрилгидратаза, что наблюдается при многоцикловой конверсии НАК интактными клетками обоих штаммов (данные не показаны). При иммобилизации клеток в геле агарозы активность нитрилазы заметно снижается лишь к 30-му циклу (рис. 3).
циклы
Рис. 3. Операционная стабильность нитрилазы иммобилизованных клеток P. fluorescens С2
На основании собственных исследований и литературных данных можно утверждать, что нит-рилгидратазная активность, встречающаяся у бактерий, во много раз превышает нитрилазную. Так, активность нитрилгидратазы достигает 200– 400 ЕД (Дебабов и др., 1997), активность нитрила-зы – 2-15 ЕД (Забазная и др., 1997; Полтавская и др., 2004).
Невысокая активность нитрилазы может быть скомпенсирована возрастанием операционной стабильности при иммобилизации клеток, в частности при включении в структуру агарозного геля.
Работа выполнена при финансовой поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы, шифр 2009-1.1-201-018, и программы поддержки междисциплинарных исследований УрО РАН.
Список литературы Гидролиз акрилонитрила клетками нитрилутилизирующих бактерий Rhodococcus ruber gt1 и Pseudomonas fluorescens C2, иммобилизованными в структуре геля агарозы
- Дебабов В.Г. Способ получения акриламида/В.Г. Дебабов, С.П. Воронин, С.В. Козулин и др. Пат. 2077588 РФ. 1997.
- Забазная Е.В. Штамм бактерий Alcaligenes species -продуцент нитрилазы/Е.В. Забазная, С.В. Козулин, Л.К. Куликова, С.П. Воронин, Пат. 2081169 РФ. 1997.
- Забазная Е.В. Отбор штаммов, трансформирующих акрилонитрил и акриламид в акриловую кислоту/Е.В. Забазная, С.В. Козулин, С.П. Воронин//Прикл. биохим. и микробиол. 1998. Т. 34, № 4. С. 377-381.
- Максимов А.Ю. Влияние нитрилов и амидов на рост и нитрилгидратазную активность штамма Rhodococcus sp. gt1/А.Ю. Максимов, М.В. Кузнецова, Г.В. Овечкина и др.//Прикл. биохим. и микробиол. 2003. Т. 39, № 1. С. 63-68.
- Максимов А.Ю. Иммобилизация на углеродных сорбентах клеток штамма Rhodococcus ruber gt1, обладающего нитрилгидратазной активностью/А.Ю. Максимов, Ю.Г. Максимова, М.В. Кузнецова и др.//Прикл. биохим. и микробиол. 2007. Т. 43, № 2. С. 193-198.
- Максимова Ю.Г. Иммобилизованные нерастущие клетки Rhodococcus ruber как гетерогенные биокатализаторы для процесса гирдатации акрилонитрила в акриламид/Ю.Г. Максимова, Г.А. Коваленко, А.Ю. Максимов и др.//Катализ в промышленности. 2008. № 1. С. 44-50.
- Полтавская С.В. Разработка и внедрение биокаталитического способа получения акриловой кислоты. I. Выделение штамма Alcaligenes denitrificans, трансформирующего акрилонитрил в акрилат аммония. Оптимизация среды культивирования/С.В. Полтавская, Т.Н. Козулина, И.Н. Сингирцев и др.//Биотехнология. 2004. № 1. С. 62-70.
- Bauer A. Polyvinyl alcohol-immobilized whole-cell preparations for the biotransformation of nitriles/A. Bauer, N. Layh, C. Syldatk, A. Willetts//Biotechnol. Lett. 1996. Vol. 18. P. 343-348.
- Dias J.C.T. Biodegradation of acetonitrile by cells of Candida guilliermondii UFMG-Y65 immobilized in alginate, -carrageenan and citric pectin/J.C.T. Dias, R.P. Rezende, V.R. Linardi//Braz. J. Microb. 2001. Vol. 31. P. 61-66.
- Graham D. Nitrile biotransformations using free and immobilized cells of a thermophilic Bacillus spp./D. Graham, R. Pereira, D. Barfield, D. Cowan//Enzyme Microbiol. Technol. 2000. Vol. 26. P. 368-373.
- Hughes J. Application of whole cell rhodococcal biocatalysts in acrylic polymer manufacture/J. Hughes, Y.C. Armitage, K.C. Symes//Antonie Van Leeuwenhoek. 1998. Vol. 74, № 1-3. P. 107-118.
- Webster N.A. Comparative characterization of two Rhodococcus species as potential biocatalysts for ammonium acrylate production/N.A. Webster, D.K. Ramsden, J. Hughes//Biotechnol. Lett. 2001. Vol. 23. P. 95-101.


