Гипоксическая проба как метод прогнозирования гемотрансфузионной тактики и характера течения раннего послеоперационного периода в коронарной хирургии
Автор: Мандель Ирина Аркадьевна, Киселев Валерий Олегович, Подоксенов Юрий Кириллович, Свирко Юлия Станиславовна, Шипулин Владимир Митрофанович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология, реаниматология и перфузиология
Статья в выпуске: 2 т.16, 2012 года.
Бесплатный доступ
Рассмотрена тактика гемотрансфузионной терапии при операции коронарного шунтирования в условиях искусственного кровообращения у больных с фракцией выброса левого желудочка выше и ниже 40%. В дооперационном периоде пациентам основной группы проводили гипокси-ческую пробу, на основании которой прогнозировали тактику периоперационной гемотрансфузии. Группу сравнения составили пациенты с традиционным подходом к назначению донорской крови. Проанализированы клинические и лабораторные данные, показатели гемодинамики и кислородного баланса, течение послеоперационного периода. В результате исследования доказана возможность снижения использования аллокрови на 48,8% (p = 0,02). На основании пробы определены критерии для снижения периоперационного триггерного уровня гемоглобина до 70 г/л, в том числе в группе больных с низкой фракцией выброса левого желудочка. Показано, что при нашей тактике определения триггерного уровня гемоглобина снижается продолжительность искусственной вентиляции легких (ИВЛ), частота развития гастроинтестинальных осложнений, полиорганной дисфункции и срок пребывания в отделении реанимации.
Гемотрансфузия, кровесберегающие технологии, низкая фракция выброса левого желудочка, гипоксическая проба, послеоперационные осложнения
Короткий адрес: https://sciup.org/142140477
IDR: 142140477 | УДК: 616-06
Текст научной статьи Гипоксическая проба как метод прогнозирования гемотрансфузионной тактики и характера течения раннего послеоперационного периода в коронарной хирургии
Кардиохирургические операции в условиях искусственного кровообращения (ИК) сопровождаются кровопотерей, которая является одним из факторов риска развития осложнений и обусловливает применение аллогемотрансфузий с частотой до 80% [11]. Учитывая спектр осложнений и проблем, связанных с применением донорской крови и ее компонентов, ограничение показаний становится предметом клинических исследований [1, 6, 8]. Кровесберегающие технологии в кардиохирургии предполагают совершенствование методов профилактики периоперационной кровопотери, заготовку аутокрови, реинфузии крови, ультрафильтрацию, применение аппарата «Cell-Saver» и определение безопасных триггерных уровней гемоглобина (Hb) для гемотрансфузии в периоперационном периоде [7, 9, 15].
Показания к переливанию крови и ее препаратов неоднозначны: периоперационная кровопотеря в объеме больше 12–15% ОЦК, снижение концентрации Hb до 70 г/л [9, 10, 13] или до 100 г/л [4, 12–14]. Однако многие факторы индивидуальной толерантности к анемии и компенсаторные воз- можности пациента не учитываются, что может привести к завышению показаний к гемотрансфузии. Цель исследования – разработка и оценка эффективного и безопасного метода прогнозирования толерантности кардиохирургических пациентов к периоперационной анемии и интраоперационной гемодилюции.
МАТЕРИАЛ И МЕТОДЫ
Исследование выполнено в отделении анестезиологии и реанимации НИИ кардиологии г. Томска в 2007–2011 гг. и одобрено этическим комитетом. Всего обследовано 208 больных, перенесших операцию реваскуляризации миокарда в условиях искусственного кровообращения. В основную группу включены 133 пациента с ишемической болезнью сердца (ИБС) в возрасте 56±8 лет III–IV функционального класса по канадской классификации. Пациентов с фракцией выброса левого желудочка (ФВ ЛЖ) <40% было 54 (40,6%).
За 5–7 суток до кардиохирургической операции всем пациентам для выявления пато- логии желудочно-кишечного тракта (ЖКТ) проводили фиброгастродуоденоскопию (ФГДС). За трое суток больным основной группы выполняли общую гипоксическую пробу (ОГП) – сеанс дыхания гипоксической газовой смесью с 14% (ГГС-14), 12% (ГГС-12) или 10% (ГГС-10) содержанием кислорода в течение 40 мин [4]. Гипоксическую газовую смесь готовили с помощью прибора «Гипок-сикатор ГП-М», работающего по принципу мембранного газоразделителя. Пробу начинали с ГГС-14 с 14% содержанием кислорода. При стабильном состоянии больного на этом уровне гипоксии переходили к дыханию смесью с 12%, затем с 10% кислорода. В исходном состоянии и на 10, 20, 30 и 40-й мин гипоксической пробы больным измеряли артериальное давление (АД), частоту сердечных сокращений (ЧСС), частоту дыхания (ЧД), оценивали клинические данные и жалобы больного.
Толерантность к гипоксии (ТГ) определяли по показателям сатурации крови методом пульсоксиметрии (SрО2), сатурации венозной крови прямым методом (SvO2), уровню в крови лактата, рассчитывали индекс экстракции кислорода: O2EI = (SрО2 – SvO2) / SрО2 × 100. Нормой считали SрО2 >85%; SvO2 >60%; O2EI – 22–30%; лактат – менее 2,5 ммоль/л [2]. При значениях показателей SрО2 >85%; SvO2 >60%; O2EI <30% и отсутствии роста уровня лактата на фоне 40 мин дыхания ГГС-10 ТГ считали высокой. Если указанные значения показателей кислородного баланса имели место при ГГС-12, ТГ – средняя. При низкой ТГ нормальные значения показателей кислородного баланса имели место при применении ГГС-14.
На основании результатов пробы определяли показания к инфузии препаратов аллокрови в периопераци- онном периоде и триггерный уровень Hb и гематокрита (Ht). Поскольку эти значения варьируют в различных клинических руководствах от 60–70 [9, 10, 13] до 100 г/л [4, 12–14], мы при выборе тактики гемотрансфузионной терапии руководствовались результатами пробы. Так, у больных с высокой ТГ считали допустимым снижение Ht во время ИК до 21% и снижение Hb <70 г/л в течение операции и раннего послеоперационного периода. При средней ТГ гемотрансфузионную терапию начинали в случае снижения концентрации Hb <80 г/л на любом этапе лечения, а во время ИК при уровне Ht менее 24%. Больным с низкой ТГ назначали препараты аллокрови при снижении Hb <90 г/л и уровне Ht <27% [13, 14].
Группу сравнения составили 75 больных, которые по клинической характеристике значимо не отличались от основной (табл. 1). У 27 (36%) из них до операции ФВ ЛЖ <40%. Всем пациентам этой группы, исходя из данных литературы, показанием для переливания донорской крови во время операции и в раннем послеоперационном периоде выбран триггерный уровень Hb 90 г/л [13, 14].
Больные основной и группы сравнения сопоставимы по объему операции, длительности ИК и окклюзии аорты, характеру и степени выраженности сопутствующей патологии, объему кровопотери. Все пациенты до операции заполняли информированное согласие по утвержденной в клинике форме. Критерии исключения из исследования – послеоперационное кровотечение, продленное ИК, реторакотомия, внутриаортальная балонная контрпульсация.
|
Таблица 1 Клиническая |
Показатель |
Группа |
р |
|
|
основная, n = 133 |
сравнения, n = 75 |
|||
|
характеристика |
Средний возраст, лет |
56±8 |
54±6 |
НД |
|
пациентов |
Мужской пол, % |
84 |
79 |
НД |
|
НД – различие между |
Площадь поверхности тела, м 2 |
1,95±0,14 |
1,94±0,15 |
НД |
|
группами недостоверно |
Функциональный класс по канадской классификации, n (%) |
|||
|
III |
84 (63,2) |
59 (78,7) |
НД |
|
|
IV |
49 (36,8) |
16 (21,3) |
НД |
|
|
Степень артериальной гипертензии, % |
||||
|
II |
28 |
34 |
НД |
|
|
III |
72 |
66 |
НД |
|
|
Класс сердечной недостаточности по NYHA, n (%) |
||||
|
II |
38 (28,6) |
24 (32,0) |
НД |
|
|
III |
95 (71,4) |
51 (68,0) |
НД |
|
|
ЧСС, уд/мин |
74±12 |
75±9 |
НД |
|
|
Инфаркт миокарда в анамнезе, % |
90,1 |
88,0 |
НД |
|
|
ФВ ЛЖ, n (%) |
||||
|
более 40% |
79 (59,4) |
48 (64,0) |
НД |
|
|
менее 40% |
54 (40,6) |
27 (36,0) |
НД |
|
|
Риск операции по шкале EuroSCORE, баллы (%) |
7±5 (2,43–31,79) |
7±5 (2,75–29,31) |
НД |
|
Рис. 1.
Показатели кислородного баланса у пациентов основной группы при проведении ОГП с 10% содержанием кислорода в газовой смеси (n = 87)
S±Sx; SрО2 – сатурация кислорода артериальной крови, %; SvО2 – сатурация кислорода венозной крови, %; O2EI – индекс экстракции кислорода; Lac – лактат, ммоль/л.
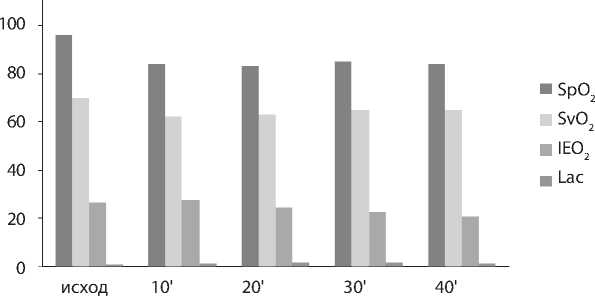
Рис. 2.
Соотношение больных с нормальной ( >40%) и сниженной ( <40%) ФВ ЛЖ в подгруппах основной группы (n = 128) и в группе сравнения (n = 75).
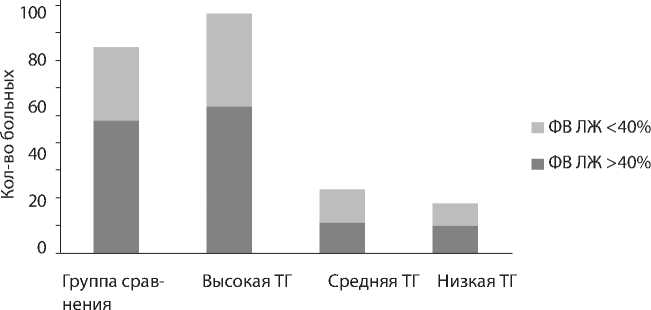
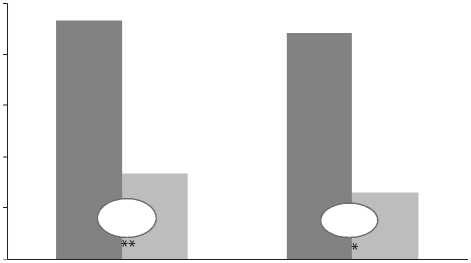
Рис. 3.
Средний объем периоперационных гемотрансфузий (мл) у пациентов с различной дооперационной сократимостью левого желудочка: * p = 0,05;
** p = 0,02.
т 100
S
■ Контрольная группа
■ Основная группа
ФВ ЛЖ >40%
ФВ ЛЖ <40%
Все операции проводили по стандартному анестезиологическому протоколу c использованием фентанила, бензодиазепинов, миорелаксантов [7] в условиях нормотермического ИК с объемной скоростью перфузии не ниже 2,5 л/мин × м2 и уровнем АД 60–80 мм рт. ст. Кардиоплегию осуществляли кустодиолом (20 мл/кг). Всем пациентам проводили ультрафильтрацию во время искусственного кровообращения.
Параметры центральной гемодинамики определяли методом термодилюции с использованием катетера Сван – Ганца у пациентов с ФВ ЛЖ менее 40% и с помощью чреспищеводного ультразвукового исследования у остальных пациентов. Исследовали газовый состав крови на приборе «Stat Profile 5» («Nova Bi o med i c a l», США), показатели кислотно-основного равновесия артериальной и венозной крови, уровни Hb и Ht, индексы п отребле ния и доставки кислорода, сатурацию крови (SрО2 и SvО2),
Таблица 2
Характеристика интра-и послеоперационного периодов у пациентов в основной (n = 128) и группе сравнения (n = 75) НД – различия показателей не достоверны
|
Показатель |
Группа сравнения |
ТГ в основной группе |
p |
||
|
высокая |
средняя |
низкая |
|||
|
Исходный Hb, г/л |
145±23 |
139±15 |
141±18 |
142±21 |
НД |
|
Исходный Ht, % |
38±3 |
37±2 |
36±3 |
39±4 |
НД |
|
Длительность ИК, мин |
86,3±7,6 |
73,4±7,2 |
78,9±10,3 |
75,3±7,6 |
НД |
|
Ишемия миокарда, мин |
52,1±9,3 |
44,90±8,44 |
49,7±6,9 |
47,1±6,3 |
НД |
|
Объем кровопотери, мл |
|||||
|
интраоперационной |
778±186 |
766±98 |
745±62 |
803±67 |
НД |
|
послеоперационной (за 12 ч) |
134±50 |
122±53 |
125±75 |
130±84 |
НД |
|
Объем интраоперационных и послеоперационных гемотрансфузий, мл/чел |
227±54 |
74±25* |
123±37 |
111±28 |
* 0,02 относительно группы сравнения |
ФВ ЛЖ, n
Таблица 3
Характеристика послеоперационного периода исследуемых групп больных
* p = 0,05 между основной и группой сравнения
|
Показатели |
группа сравнения |
группа высо |
кой ТГ |
|
|
>40%, 48 |
<40%, 27 |
>40%, 53 |
<40%, 34 |
|
|
Инотропная поддержка, ч |
12±3 |
29±9 |
14±4 |
47±15* |
|
ИВЛ, ч |
9±2 |
11±3 |
8±3 |
9±3 |
|
Медиастенит, n |
1 |
– |
– |
– |
|
Пневмония, n |
2 |
1 |
– |
1 |
|
Нагноение п/о раны, n |
1 |
2 |
2 |
– |
|
Гастроинтестинальные осложнения, n (%) |
2 (4,2) |
1 (3,7) |
1 (1,9) |
– |
|
Респираторные осложнения, n (%) |
1 (2,1) |
1 (3,7) |
– |
1 (2,9) |
|
Ренальная дисфункция, n (%) |
1 (2,1) |
2 (7,4) |
1 (1,9) |
1 (2,9) |
|
Неврологические осложнения, n (%) |
1 (2,1) |
– |
– |
– |
|
Пребывание в ОАР, дней |
4±1 |
4±1 |
3±1 |
4±1 |
|
Летальность, % |
4,2 |
3,7 |
3,8 |
2,9 |
индекс экстракции кислорода (O2EI), артериовенозную разницу по кислороду, уровень лактата крови, а также общий белок и альбумин на уже перечисленных этапах.
Объем кровопотери рассчитывали гравиметрическим методом, измеряли объем крови в аспирационных и дренажных резервуарах. Определяли частоту развития периоперационной анемии, инфекционных осложнений (медиастинита, пневмонии, нагноения послеоперационной раны). Характеристика интраоперационного периода представлена в табл. 2.
Статистическую обработку результатов выполняли с применением системы статистического анализа Statistica 6.0. Сравнение двух групп проводили с помощью t-критерия Стьюдента. Результаты представляли как среднее и среднеквадратичное отклонение (X±Sx ). Статистически значимыми считали различия при р <0,05.
РЕЗУЛЬТАТЫ
Непереносимость ОГП выявлена у 5 больных (3,8%), которых исключили из дальнейшего исследования.
Индивидуальную непереносимость ОГП констатиро- вали на основании увеличения клинических признаков: ЧСС более чем на 30 в мин, прироста АД более чем на 30 мм рт. ст., ЧД более чем на 10 в мин. Применение метода считали противопоказанным, если на первых минутах дыхания ГГС-14 наступали отмеченные изменения. Указанные симптомы были преходящими и ни в одном случае не привели к осложнениям.
Успешно пробу перенесли 128 (96,2%) пациентов основной группы, высокая ТГ выявлена у 53 пациентов (39,8%) с ФВ ЛЖ >40% и у 34 (25,6%) с ФВ ЛЖ <40%. Интегральные показатели кислородного баланса, наблюдаемые нами при дыхании ГГС-10, представлены на рис. 1. Статистически значимо снижалась лишь SрO2 до 83,0±4,2 (р = 0,02) на 13,55%, минимальная SvO2 за время проведения пробы составила 62,0±4,1 (р = 0,02), уровень лактата не поднимался выше 1,70±0,58 мМ/л (р = 0,02), O2EI находился в пределах нормы (24,50±5,21). Средняя ТГ отмечена у 23 больных (17,3%), из них ФВ ЛЖ <40% у 11 человек. Низкую ТГ наблюдали у 18 больных (13,5%), ФВ ЛЖ <40% у 9 человек (рис. 2).
В течение основного этапа операции показатели кислородтранспортной функции крови у больных основной группы закономерно изменялись и возвращались к нормальным значениям в постперфузионном периоде, что свидетельствовало об адекватном уровне Hb и Ht у каждого больного. У пациентов основной группы, имевших высокую ТГ, гемотрансфузии проводили в 14,9% случаев, из них 6 пациентам (6,9%) переливали донорскую кровь во время операции, 4 (4,6%) – в послеоперационном периоде, троим (3,4%) – как во время, так и после операции. В группе со средней ТГ – 30,4% случаев, из них 4 пациентам (17,4%) переливание донорской крови было во время операции, одному (4,3%) – в послеоперационном периоде, двоим (8,7%) – как во время, так и после операции. При низкой ТГ – в 44,5%, из них 4 пациентам (22,2%) переливали донорскую кровь во время операции, троим (16,7%) – в послеоперационном периоде, одному (5,6%) – как во время, так и после операции.
Поскольку 87 пациентов (65,4%) основной группы обладали высокой ТГ, потребность в аллокрови в этой группе в целом была ниже на 49,1% (р = 0,02). Объем кровопотери во время операции и в раннем послеоперационном периоде не имел значимого различия в исследуемых группах (табл. 2). Объем периоперационных гемотрансфузий у больных с ФВ ЛЖ >40% статистически значимо различался и был на 35,6% ниже в основной группе (p = 0,02; рис. 3). У пациентов с высокой ТГ и ФВ ЛЖ <40% объем периоперационных гемотрансфузий также на 33,4% меньше, чем в группе сравнения (p = 0,05). Свежезамороженную плазму у наших больных не использовали, так как не было показаний: синдрома диссеминированного внутрисосудистого свертывания, массивной кровопотери, дефицита плазменных факторов свертывания.
Частота ранних послеоперационных инфекционных осложнений в основной группе: 4,7% (6 больных), из них 2,3% (трое) – в группе с высокой ТГ; 0,8% (один) – со средней; 1,6% (двое) – с низкой. Инфекционные осложнения в группе больных с выбором тактики гемотрансфузии, основанной на результатах гипоксической пробы, встречались на 4,6% реже, чем в группе сравнения (табл. 3). В группе сравнения гемотрансфузионную терапию назначали более чем половине – 48 больным (64%). Частота послеоперационных инфекционных осложнений в группе сравнения – 9,3% (n = 7; р >0,05).
В раннем послеоперационном периоде больные с высокой ТГ, но исходно сниженной ФВ ЛЖ требовали более длительного проведения инотропной поддержки (47±15 ч), чем пациенты группы сравнения (29±9 ч; р = 0,05). Другие показатели, такие как продолжительность ИВЛ, частота развития гастроинтестинальных осложнений, респираторные и неврологические осложнения, ренальная и полиорганная дисфункции, показатель 30-дневной летальности, сроки пребывания в отделении реанимации и стационаре, статистически не различались.
По данным ФГДС, из 128 кардиохирургических пациентов основной группы, включенных в настоящее исследо- вание, патология ЖКТ обнаружена у 68 (53,1%). Этим пациентам интраоперационно назначали «Лосек». В группе сравнения патология ЖКТ определена у 43 больных (57,3%). В раннем послеоперационном периоде исследование ЖКТ включало клиническую оценку дисфункции и ФГДС по показаниям. Клинически значимые осложнения выявлены у троих больных (4%) группы сравнения и в одном случае (1,1%) в группе высокой ТГ (р >0,05).
ОБСУЖДЕНИЕ
В обзоре тактики гемотрансфузионной терапии у критических больных P.C. Hébert и др. (2000) п р едс т авили б оль шие различия в триггерном уровне Hb, диапазон которого составлял от 50 до 120 г/л, а также показали, что 40% врачей придерживались уровня Hb в 100 г/л. На решение о трансфузии влияли: возраст, диагноз, лекарственная терапия, кровопотеря, гипоксемия, шок, лак-татацидоз и тяжесть заболевания по шкале APACHE II, определяемая при поступлении [13, 14]. В исследовании проанализирована предложенная нами тактика выбора безопасного триггерного уровня Нb и Ht в пери-операционном периоде у кардиохирургических пациентов с ишемической болезнью сердца. В ходе гипоксической пробы выявлена группа больных, имеющих высокую ТГ, которым переливание крови проводили на 49,1% реже (р = 0,02), чем в группе сравнения, где гемотрансфузию назначали при триггерном уровне Hb 90 г/л.
Известно, что наиболее безопасными критериями определения ТГ являются значения O2EI выше 30% и отсутствие роста концентрации лактата в крови выше 2,5 М/л [4]. Этим критериям соответствовало большинство пациентов основной группы (65,4%) при проведении гипоксической пробы. Определенная в ходе пробы высокая ТГ дала основания снизить триггерный уровень Hb до 70 г/л. По нашему мнению, предлагаемый подход к определению показаний к гемотрансфузии позволил проводить рациональную гемотрансфузионную терапию и снизить частоту «рутинного» назначения аллокрови благодаря дифференцированной оценке адаптационного резерва и кислородного баланса у кардиохирургических больных [3, 4].
Нам представлялось особенно важным оценить возможность «рестриктивной» тактики гемотрансфузионной терапии у больных с исходно низкой фракцией выброса левого желудочка. Традиционно принято считать, что такие пациенты после операции нуждаются в более высоком уровне Hb дл я п оддержания адекватной газотранспортной функции крови [5]. Нами обследованы 34 пациента (25,6% из группы с высокой ТГ) с ФВ ЛЖ <40%, у которых мы безопасно сократили объем гемотрансфузий, что не привело к увеличению частоты ранних послеоперационных осложнений (рис. 3; табл. 3).
Снижение триггерного уровня Hb у пациентов основной группы с ФВ ЛЖ <40% могло быть одной из причин увеличения продолжительности периода инотропной терапии до 47±15 ч (р = 0,02). Однако, в целом, это не повлияло на продолжительность ИВЛ, частоту развития гастроинтестинальных, респираторных, ренальных осложнений, характеризующих симптомокомплекс синдрома малого сердечного выброса. Последние данные A.H.M. Straten и его коллег (2010) о том, что гемотрансфузия является фактором риска синдрома низкого сердечного выброса после аортокоронарного шунтирования, согласуются с нашими клиническими результатами и показывают, что «рестриктивная» тактика назначения алло-крови у пациентов со сниженной ФВ ЛЖ оправдана [14].
Меньшая частота ранних послеоперационных инфекционных осложнений у больных основной группы, составивших 4,7%, по сравнению с 9,3% в контрольной (р = 0,05), может быть обусловлена иммуносупрессивным воздействием аллогемотрансфузий [8], поскольку антибиотикопрофилактика в группах была стандартной. Таким образом, предлагаемая нами тактика прогнозирования толерантности к периоперационной анемии и интраоперационной гемодилюции методом проведения гипоксической пробы у пациентов с ИБС перед кардиохирургической операцией в условиях ИК позволяет проводить индивидуальную гемотрансфузионную терапию, эффективна и безопасна.
ВЫВОДЫ
-
1. Метод дооперационной оценки ТГ в хирургии ИБС безопасен и снижает частоту периоперационных гемотрансфузий в группе пациентов с высокой ТГ на 48,9%.
-
2. Дооперационная высокая ТГ в хирургии ИБС позволяет достоверно снизить периоперационный триггерный уровень Hb до 70 г/л.
-
3. Толерантность к гипоксии, выявленная при проведении гипоксической пробы, и дооперационный показатель ФВ ЛЖ у пациентов с ИБС не имеют статистически значимой зависимости.
-
4. Снижение триггерного уровня гемоглобина до 70 г/л на основании дооперационной оценки ТГ в коронарной хирургии не увеличивает продолжительность ИВЛ, частоту развития гастроинтестинальных осложнений, полиорганной дисфункции и срок пребывания в отделении реанимации.
Список литературы Гипоксическая проба как метод прогнозирования гемотрансфузионной тактики и характера течения раннего послеоперационного периода в коронарной хирургии
- Зильбер А.П. Клинико-физиологические основы кровопотери и гемотрансфузии//Бескровная хирургия -итоги и перспективы развития. М., 2002. С. 22-34.
- Ищук В.А.//Украинский кардиологический журнал. 2011. http://www.ukrcardio.org/journal.php/article/608.
- Караськов А.М., Ломиворотов В.В., Сидельников С.Г. и др.//Патология кровообращения и кардиохирургия. 2001. № 1. С. 48-53.
- Караш Ю.М., Стрелков Р.Б., Чижов А.Я. Нормобарическая гипоксия в лечении, профилактике и реабилитации. М., 1988.
- Ломиворотов В.В., Бобошко В.А., Чернявский А.М. и др.//Патология кровообращения и кардиохирургия. 2011. № 2. С. 49-54.
- Слепушкин В.Д., Доев Д.П., Аддаев Д.А. Бескровная хирургия (новые направления в хирургии, анестезиологии, трансфузиологии)/Под ред. Ю.В. Таричко. М., 2003. С. 23-25.
- Справочник по анестезиологии и реаниматологии/Под ред. А.А. Бунятяна. М., 2005.
- Таричко Ю.В., Стефанов С.А., Кириленко А.С. и др.//Вестник РУДН. 2004. № 1 (25). С. 58-61.
- Шипулин В.М., Подоксенов Ю.К., Свирко Ю.С. Кровесбережение в кардиохирургии. Томск, 2010.
- Bloody easy 3: blood transfusions, blood alternatives and transfusion reations: a guide to transfusion medicine/Ed. J.L. Callum, Y. Lin, P.H. Pinkerton et al. Canada: Ontario Regional Blood Coordinating Network. 2011. 152 р.
- Emmert M.Y., Salzberg S.P., Theusinger O.M. et al.//Interactive Cardiovasc. Thorac. Surg. 2011. V. 12 (2). Р. 183-188.
- Hébert P.C., Szick Sh.//JCOM. 2000. V. 7, № 9. Р. 29-40.
- Practice Guidelines for Blood Transfusion: A Compilation from Recent Peer-Reviewed Literature/Ed. R. Cable, B. Carlson, L. Chambers. Am. National Red Cross. 2007. 60 р.
- Straten A.H., Bekker M.W., Hamad M.A. et al.//Interactive Cardiovasc. Thorac. Surg. 2010. V. 10. Р. 37-42.
- Ferraris V.A., Brown J.R., Despotis GJ. et al.//Ann. Thorac. Surg. 2011. V. 91. Р. 944-982.


