Гипоплазия дуги аорты
Автор: Синельников Юрий Семенович, Кшановская Марина Сергеевна, Горбатых Артем Викторович, Иванцов Сергей Михайлович, Прохорова Дарья Станиславовна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 3 т.17, 2013 года.
Бесплатный доступ
Агрессивный подход к устранению коарктации аорты с сопутствующей гипоплазией дуги аорты при ранней коррекции порока привел к существенному улучшению отдаленных результатов хирургической коррекции, снизив количество случаев рекоарктации аорты и персистенции артериальной гипертензии. В настоящее время существует ряд методик, позволяющих определить степень гипоплазии дуги аорты, что позволяет планировать объем вмешательства на дуге аорты у пациентов педиатрической группы. Обзор посвящен анализу современных методик определения гипоплазии дуги аорты и результатов хирургического лечения данной патологии.
Гипоплазия дуги аорты, коарктация аорты, aortic сoarctation
Короткий адрес: https://sciup.org/142140560
IDR: 142140560 | УДК: 616.132.14
Текст обзорной статьи Гипоплазия дуги аорты
Агрессивный подход к устранению коарктации аорты с сопутствующей гипоплазией дуги аорты при ранней коррекции порока привел к существенному улучшению отдаленных результатов хирургической коррекции, снизив количество случаев рекоарктации аорты и персистенции артериальной гипертензии. В настоящее время существует ряд методик, позволяющих определить степень гипоплазии дуги аорты, что позволяет планировать объем вмешательства на дуге аорты у пациентов педиатрической группы. Обзор посвящен анализу современных методик определения гипоплазии дуги аорты и результатов хирургического лечения данной патологии. Ключевые слова: гипоплазия дуги аорты; коарктация аорты.
Поступила в редколлегию 4 июня 2013 г.
М.С. Кшановская,
А.В. Горбатых,
С.М. Иванцов,
Д.С. Прохорова, 2013
Коарктация аорты относится к группе часто встречаемых заболеваний. Среди новорожденных с врожденными пороками сердца частота может достигать 20% [2]. Впервые коарктация аорты была описана в 1760 г. Morgagni, а более точное описание этого порока в 1791 г. дал Paris, он же предложил и термин «коарктация» (от франц. «coarctare» – суживать, сдавливать). Первый прижизненный диагноз коарктации аорты установил Legrand в 1835 г. Детальное описание анатомии порока сделал в 1866 г. Barie на основании патологоанатомических исследований 86 случаев. Первые успешные операции выполнены в 1945 г. в США и Швеции Crafoord и Nylin. Резекция коарктации у младенца была осуществлена W. Mustard и др. в 1953 г. Методика заключалась в создании прямого циркулярного анастомоза.
В России первая операция по устранению коарктации аорты была выполнена в ННИИПК Е.Н. Мешалкиным в 1955 г. Возможность успешного хирургического лечения коарктации аорты стала очевидной, однако отдаленные результаты были неудовлетворительными вследствие высокой частоты рецидива порока. Дальнейший путь развития хирургии в этой области сводился к разработке и усовершенствованию новых технологий анастомозирования. В последние несколько десятков лет широко обсуждается роль гипоплазии дуги аорты как одного из факторов риска развития отдаленных осложнений хирургического лечения коарктации аорты. У детей сегментарное сужение аорты нередко сочетается с гипопла- зией перешейка или дуги аорты. Сочетание коарктации аорты с гипоплазией дуги аорты у новорожденных является частой находкой, ее распространенность достигает 70%, что связано с повышенным риском рекоарктаций [15]. Впервые четкое определение гипоплазии дуги было предложено Moulaert в 1976 г., которое было основано на измерении внешнего диаметра образцов при вскрытии. В соответствии с анатомией дуга аорты делится на три сегмента: проксимальный и дистальный сегменты поперечной части дуги и перешеек аорты (рис. 1).
Согласно исследованиям Moulaert и коллег, поперечная часть дуги считается гипоп-лазированной, когда ее внешний диаметр составляет 60% или менее от восходящей аорты. Для дистального отдела дуги и перешейка аорты эти цифры составили 50% или менее и 40% или менее.
Также они выявили патогенетическую связь между сопутствующей патологией, включающей в себя лево-правый сброс, и развитием патологии дуги аорты [18].
Морфология гипоплазированной дуги Имеются сообщения, что гипоплазиро-ванный сегмент содержит меньше эластина, чем сопоставимые сегменты нормальной дуги аорты. Функциональное значение этого наблюдения являлось гипотетическим, в частности потому что оно не было соотнесено с другими потенциальными показателями роста, такими как наличие или отсутствие гладкомышечных клеток, плот- ность коллагена и соотношение этих элементов по сравнению с другими сегментами аорты [4].
В своих исследованиях M. Machii и коллеги установили, что, несмотря на то что гипоплазированный сегмент имеет абсолютно меньшее количество пластин эластина, чем нормальная дуга, относительное к диаметру содержание пластин эластина превышает значения этого показателя для нормально развитой дуги аорты [14]. Эта парадоксальная ситуация, по мнению авторов, специфична для тубулярной гипоплазии дуги аорты. Кроме того, было определено содержание α-актин-положительных клеток в медии, так как этот показатель потенциально важен, поскольку в аорте плода с увеличением гестационного возраста содержание гладкомышечных α-актин клеток увеличивается, а гладкомышечных β-актин клеток уменьшается. Фенотипические характеристики этих клеток гладкой мускулатуры важны, потому что синтетическими являются те клетки, которые способны к пролиферации и производству компонентов внеклеточного матрикса, за счет чего происходит процесс роста. Таким образом, относительно высокое содержание пластин эластина и уменьшение α-актин-позитивных клеток указывают на снижение потенциала роста. При сравнении плотности коллагена отмечено значительно большее содержание коллагена в гипоплазиро-ванном сегменте в сравнении с нативной аортой. В восходящей аорте также определяется более высокая плотность коллагена, чем в норме. Эти морфологические изменения оказывают негативное влияние на растяжимость аорты.
Патологическая физиология
У пациентов с коарктацией аорты большой круг кровообращения частично разъединен на два бассейна (верхний и нижний) с разными значениями артериального давления. Нарушения гемодинамики при этой патологии обусловлены тремя главными факторами: артериальной гипертензией верхней половины тела, относительным снижением давления в артериях нижней половины тела, разницей давления (градиентом) в верхнем и нижнем артериальных бассейнах. При успешной коррекции коарктации аорты, но не диагностированной гипоплазии дуги все эти факторы сохраняются в относительной степени.
Самый простой, с физиологической точки зрения, случай наблюдается при легкой или умеренной обструкции. В результате этого возникает проксимальная системная гипертензия, левожелудочковая гипертрофия без левожелудочковой недостаточности и градиент давления на верхних и нижних конечностях.
По мере развития коллатеральных сосудов градиент давления может уменьшаться или даже исчезнуть. Такая физиологическая обстановка хорошо переносится пациентами, может оставаться асимпто-матичной в течение многих лет, до тех пор пока не возникают осложнения, связанные с левожелудочковой гипертрофией, дегенеративными изменениями аорты или хронической системной гипертензией.
Ограниченная пропускная способность аорты на уровне стеноза создает патологический градиент систолического давления между верхним и нижним артериальными бассейнами. Вследствие этого возникает некоторая задержка крови в верхней компрессионной камере, а все ее составляющие, включая восходящую аорту и брахиоцефальные сосуды, компенсаторно расширяются. Практически все артериальные сосуды верхней половины тела находятся в состоянии постоянной гипертензии, а некоторые из них, в частности межреберные, несут кровь в обратном направлении. В связи с тем что градиент давления существует не только в период систолы, но и в период диастолы, кровь из проксимальной части аорты в дистальную перетекает непрерывно. Поскольку в аорте на месте сужения остается рестриктивное отверстие, скорость крови в этом участке повышена. В широком посткоарктационном отделе струя создает турбулентные потоки, травмирующие стенку сосуда и способные привести к развитию аневризм аорты.
В результате гипертензии возникают аневризмы в сосудах виллизиевого круга, повреждается барроре-цепторный аппарат. Гемодинамическая обструкция выводного тракта левого желудочка ведет к его гипертрофии и застойной недостаточности кровообращения. Важная гемодинамическая особенность кровотока в дистальной аорте – его демпфированный (сглаженный) характер, отсутствие систолических и диастолических колебаний. Это неестественное свойство кровотока нарушает механизмы функционирования микрососудистого русла и является главной причиной его компенсаторной и патологической перестройки.
Систолическое давление в желудочке повышается в соответствии с уровнем артериальной гипертензии, сердечный выброс обеспечивается компенсаторной гипертрофией миокарда. Сердечная недостаточность развивается не всегда, поскольку высокое диастолическое давление в восходящей аорте обеспечивает хорошее коронарное кровообращение. С возрастом мощность миокарда левого желудочка уменьшается, что приводит к его дилатации. Диастолическое давление в полости левого желудочка повышается, вследствие чего давление в левом предсердии и легочных венах также растет. Митрализа-ция порока в некоторых случаях может достигать картины функционального митрального стеноза или относительной недостаточности левого АV-клапана [1, 6].
Диагностика гипоплазии дуги
Диагностика гипоплазии дуги весьма важна у новорожденных и детей раннего возраста. При пренатальном скрининге заподозрить порок практически невозможно. В большинстве наблюдений диагностика основывается на данных двухмерной ЭхоКГ с цветовой допплерографией и МРТ исследования. По данным ЭхоКГ визуализируются все сегменты аорты, обязательно измеряют размеры всех сегментов дуги аорты. По данным допплерографии отмечается ускоренный турбулентный кровоток, снижение импульсной волны давления в нисходящей аорте.
prox
Рис. 1.
Сегмент поперечной части дуги: prox. TA – проксимальный; dist. TA – дистальный, ist. – перешеек аорты.
Рис. 2.
МСКТ ангиография аорты с контрастированием, виден гипоплази-рованный дистальный сегмент дуги аорты.
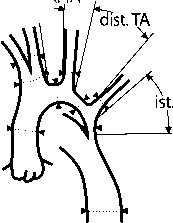
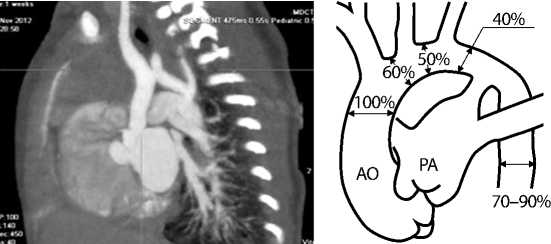
Рис. 3.
Правило, предложенное Moulaert.
Наличие антеградного кровотока в диастолу подтверждает гемодинамическую значимость обструкции аорты [25, 26]. Ультразвуковая локация позволяет получить изображения коарктации аорты с гипоплазией дуги и смежных структур, но иногда это оказывается невозможным в связи с экранированием сужения легочной тканью. Стандартным и наиболее достоверным методом для оценки анатомии дуги аорты является МРТ и МСКТ исследование (рис. 2). Благодаря данному методу возможно идентифицировать локализацию и длину сужения, состояние ветвей аортальной дуги, постстенотическую дилатацию, а после операции – обнаружить рестеноз и аневризму.
Методики определения гипоплазии дуги аорты
Метод хирургического лечения коарктации с гипоплазией дуги определяется степенью гипоплазии и анатомией дуги аорты. Впервые для определения гипоплазии дуги было предложено правило Moulaert и др. (1976), которое гласит, что диаметр проксимальной дуги должен быть больше чем 60%, диаметр дистальной дуги больше чем 50% и диаметр перешейка больше чем 40% от диаметра восходящей аорты (рис. 3). А при длине данных сегментов дуги аорты 5 мм и более принято говорить о тубулярной гипоплазии дуги аорты. Например, согласно данным критериям, тубулярная гипоплазия перешейка аорты присутствует, когда этот сегмент больше чем на 5 мм, а внешний диаметр составляет 40% или меньше, чем диаметр восходящей аорты [18]. Этого правила до настоящего времени придерживаются многие клиники и активно применяют его.
Второе правило, также активно применяемое многими клиниками, сформулировали Mee и его коллеги. Оно определяет наличие гипоплазии дуги аорты, требующей коррекции [13]. Реконструкция дуги показана, если диаметр поперечной части дуги (мм), измеренной на ЭхоКГ, в численном выражении меньше массы тела пациента (кг) плюс 1. Например, если у младенца массой 3 кг диаметр дуги аорты менее 4 мм (т. е. 3+1), дугу следует счи- тать гипоплазированной и ему показано хирургическое расширение дуги аорты каким-либо известным способом. Sakurai и др. [9] расширили это правило, сравнив размер безымянной артерии и поперечной дуги и предположив, что гипоплазия имеется, если диаметр поперечной дуги меньше, чем размер безымянной артерии (мм).
Morrow и др. [16] для измерения степени гипоплазии дуги аорты предложили использовать индекс дуги аорты. Данный параметр был разработан на основании морфометрического анализа магистральных сосудов способом двумерной эхокардиографии у 14 новорожденных с изолированной коарктацией и 14 здоровых новорожденных в возрасте менее 1 месяца. У пациентов с коарктацией поперечная дуга и перешеек были значительно меньше, чем в контрольной группе (р≤0,001). Кроме того, диаметр клапана легочной артерии и ее ствол были значительно больше у новорожденных с коарктацией, чем в группе здоровых новорожденных. Эти измерения были стандартизированы с помощью сравнительного коэффициента (индекса дуги аорты), который рассчитывался как диаметр поперечной дуги, деленный на диаметр восходящей аорты (ARCH INDEX = TA/AA). Этот показатель в контрольной группе составлял 0,76, у новорожденных с коарктацией – 0,54. Таким образом, о гипоплазии дуги аорты можно говорить в случаях, когда индекс дуги менее 0,5.
В последнее время наиболее популярно и, вероятно, наиболее точно измерение диаметра дуги и расчет отношения конкретного (определенного) сегмента дуги аорты относительно нормальных размеров, то есть определение отклонения от среднего значения возрастной нормы (Z). Дуга считается гипоплазированной при отклонении от стандартного значения – 2Z и более. Важно отметить, что стандартное отклонение может меняться в зависимости от размеров тела [7]. Для большинства измерений рекомендовано проводить расчет Z-scores относительно площади поверхности тела, а не роста или веса
|
Таблица 1 |
Автор |
Возраст |
Год |
Пациенты |
Летальность |
Рекоарктация |
||
|
Результаты резекции |
Wood et al. [28] |
<12 мес. |
2004 |
181 |
1 |
4 (2,2%) |
||
|
с расширенным |
Wright et al. [29] |
≤12 мес. |
2005 |
83 |
2 (2%) |
4 (%) |
||
|
анастомозом «конец |
Thomson et al. [27] |
<12 мес. |
2005 |
191 |
9 (5%) |
7 (4,2%) |
||
|
в конец» |
Burch et al. [5] |
<6 мес. |
2009 |
177 |
1 |
17 (9,6%) |
||
|
Kaushal et al. [13] |
<1 мес. |
2009 |
201 |
4 (2%) |
8 (4%) |
|||
|
Mc Guinness et al. [17] |
<3 мес. |
2010 |
192 |
2% |
4% |
|||
|
Таблица 2 |
Период наблю- |
|||||||
|
Результаты пластики |
Автор |
Возраст Год |
Пациенты дения, лет |
Летальность |
Рекоарктация |
|||
|
лоскутом подключичной |
Jahangiri et al. [10] |
<3 мес. 2000 |
185 |
24 |
6 (3%) |
11 (6%) |
||
|
артерии |
Kanter et al. [11] |
<3 мес. 2001 |
46 |
10 |
0 |
5 (11%) |
||
|
Pandey et al. [20] |
<1 мес. 2006 |
399 |
24 |
24,8 % |
13,6% |
|||
|
Barreiro et al. [3] |
<1 мес. 2007 |
119 |
20 |
5 (4%) |
12 (11%) |
|||
|
Таблица 3 |
Автор |
Возраст Год |
Период наблю- |
Торакотомия |
Срединная |
|||
|
Соотношение коррекции |
дения, лет |
Пациенты |
стернотомия |
|||||
|
гипоплазии дуги |
Elgamal et al. [9] |
<1 мес. 2002 |
5 |
65 |
0 |
65 (100%) |
||
|
аорты из срединной |
Kaushal et al. [12] |
<1 мес. 2009 |
16 |
201 |
157 (78%) |
44 (22%) |
||
|
стернотомии |
Sakurai et al. [23] |
<1 мес. 2012 |
20 |
288 |
237 (82%) |
51 (18%) |
||
|
Rakhra et al. [22] |
<1 мес. 2012 |
20 |
305 |
231 (76%) |
74 (24%) |
|||
в отдельности. Важно знать, что для маленьких пациентов нулевое значение может находиться в пределах двух стандартных отклонений от среднего значения. Например, полное отсутствие движения при тканевом Допплере в некоторых позициях в одной возрастной группе может давать Z-scores >–2 [8]. Petterson, проводя антропометрические измерения в большой группе детей (782 пациента), предложил специально для инфантов и детей раннего возраста таблицы расчета Z-scores для 21 отдельной сердечной структуры [21].
Современные возможности диагностики, анестезиологического, медикаментозного обеспечения, внедрение новых технологий перфузионного сопровождения обеспечили качественно новый подход в лечении пациентов с коарктацией аорты в сочетании с гипоплазией дуги. Во-первых, это ранняя (в период новорожденности) коррекция порока с агрессивным подходом к устранению гипоплазии дуги аорты, в том числе в условиях искусственного кровообращения из срединного стернотомного доступа с применением регионарной перфузии головного мозга; во-вторых, появилась возможность выхаживать пациентов с низкой массой тела, что в совокупности привело к существенному улучшению отдаленных результатов хирургической коррекции, снизилось количество случаев рекоарктации и персистенции артериальной гипертензии. При выборе метода коррекции у новорожденных и детей раннего возраста в последнее время отдается предпочтение технике расширенного анастомоза «конец в конец» или же пластике лоскутом подключичной артерии, у пациен- тов с умеренной коарктацией аорты с гипоплазией дуги методом выбора является баллонная ангиопластика.
Отдаленные результаты большинства клиник демонстрируют низкий процент рекоарктаций. Клиники, в которых предпочтительным методом хирургического лечения является выполнение «extended» анастомоза, сообщают о достаточно низком проценте рекоарктации в отдаленном периоде (табл. 1). Так, например, Kaushal и др. сообщают о 201 прооперированном за 16-летний период пациенте и выполнении резекции с расширенным анастомозом «конец в конец», 157 (78%) коррекция выполнялась из боковой торакотомии и 44 (22%) – из срединной стернотомии. Критерием для определения гипоплазии дуги аорты была формула, предложенная Mee и его сотрудниками: масса тела пациента (кг) плюс 1. Средний период наблюдения составил 5,0±4,3 года. В раннем послеоперационном периоде в течение 3 суток троим пациентам в связи с рекоарктацией была выполнена реверсивная пластика лоскутом подключичной артерии. Повторное вмешательство в связи с рекоарктацией в отдаленном периоде потребовалось восьми пациентам (4%) [13].
Несмотря на большее количество сторонников данной техники, некоторые центры для устранения гипоплазии дуги рекомендуют исключительно метод пластики лоскутом подключичной артерии, демонстрирующий хорошие результаты (табл. 2).
В исследуемой группе Johns Hopkins Medical Institutions, Baltimore [3] выявлена 4% летальность и 11% (12/114)
рекоарктации у пациентов с изолированной реверсивной пластикой. K.R. Kanter с коллегами [11] в группе пациентов с реверсивной пластикой лоскутом подключичной артерии отмечают нулевую 30-дневную летальность и 5 (11%) случаев рекоарктации. Для определения гипоплазии дуги применялись правила Moulaert [18] и Karl [12] с соавторами. Такая техника позволяет устранить гипоплазиро-ванный длинный сегмент дистальной части дуги аорты без использования искусственного кровообращения.
Совершенствование искусственного кровообращения и появление регионарной перфузии головного мозга определили новую эру в хирургии новорожденных. Появилась возможность устранения гипоплазии проксимальной и поперечной частей дуги аорты с одномоментной коррекцией сопутствующей патологии, в том числе и у детей с низкой массой тела. Последние наблюдения разных клиник отмечают более радикальный подход в лечении гипоплазии дуги аорты и устранение доступом из срединной стернотомии в условиях искусственного кровообращения (табл. 3).
Sakurai и соавторы [23], проводя анализ за 20-летний период и разделив свое исследование на два десятилетия, выявили, что в период между 1991–2000 гг. из срединного доступа было прооперировано 6%, а в период между 2001–2010 гг. – 36%. При этом в данной группе отмечался более низкий процент рекоарктаций (4%) в сравнении с группой, в которой коррекция порока выполнялась из боковой торакотомии: 16% в течение 1991–2000 гг. и 5% в период 2001–2010 гг. Таким образом, они определили, что коррекция коарктации с гипоплазией дуги доступом из срединной стернотомии значительно снижает риск рекоарктации, и считают это приемлемым даже у пациентов с пограничными размерами дуги. Для определения степени гипоплазии дуги авторы применяли предложенную ими формулу, сравнивая размер безымянной артерии и поперечной дуги, или же формулу, предложенную Mee и коллегами [13].
Группа ученых из Royal Children’s Hospital, Melbourne [22] в своем долгосрочном наблюдении также выявили, что техника «конец в бок», выполненная из срединного доступа, может быть предложена большинству пациентов с гипоплазией дуги аорты, так как процент рекоарктаций в данной группе был меньше, чем в группе, где коррекция порока выполнялась из боковой торакотомии методом расширенного анастомоза (свобода от рекоарктаций 92 против 61% за 10-летний период, p<0,001). Для определения степени гипоплазии дуги авторы использовали расчеты от среднего отклонения (Z-scores). Таким образом, анализируя результаты различных клиник, можно сделать вывод о том, что вопрос об «идеальной» технике хирургического лечения у детей гипоплазии дуги аорты остается открытым. Вероятно, при выборе метода хирургического лечения в каждом случае не должно быть шаблона и необходимо руководствоваться конкретной анатомо-гемодинамической ситуацией, учитывая все возможные варианты и предусматривая их последствия. В техническом выполнении выбранного способа лучше придерживаться проверенных стандартов, так как в условиях ограниченного времени безопасного пережатия аорты творческие поиски могут стать серьезной проблемой на пути надежности.
Список литературы Гипоплазия дуги аорты
- Дыкуха С.Е. и др.//Клин. хирургия. 1997. № 7. С. 77-78.
- Матчин Ю.Г., Козлов С.Г., Лякишев А.А. и др.//Кардиология. 1991. № 12. C. 105-106.
- Barreiro C.J., Ellison T.A., Williams J.A. et al.//Eur. J. Cardiothorac. Surg. 2007. V. 31. P. 649-653.
- Becker A.E.//Int. J. Cardiol. 1988. V. 20. P. 247-255.
- Burch P. et al.//J. Thorac. Cardiovasc. Surg. 2009. V. 138. P. 547-552.
- Castaneda A.R., Jonas R.A. et al.//Cardiac. Surgery Neonate Infant. 1994. V. 21. P. 337-339.
- Chubb H. et al.//Ann. Pediatric Cardiology. 2012. V. 5. P. 179-184.
- Eidem B.W., McMahon C.J., Cohen R.R. et al.//J. Am. Soc. Echocardiogr. 2004. V. 17. P. 212-221.
- Elgamal M.A. et al.//Ann. Thorac. Surg. 2002. V. 73. P. 1267-1273.
- Jahangiri M., Shinebourne E.A., Zurakowski D. et al.//J. Thorac. Cardiovasc. Surg. 2000. V. 120. P. 224-229.
- Kanter K.R. et al.//Ann. Thorac. Surg. 2001. V. 71. P. 1530-1536.
- Karl T.R., Sano B., Brawn W., Mee R.B.//J. Thorac. Cardiovasc. Surg. 1992. V. 104. P. 688-695.
- Kaushal S. et al.//Ann. Thorac. Surg. 2009. V. 88. P. 1932-1938.
- Machii M., Becket A.E.//Ann. Thorac. Surg. 1997. V. 64. P. 516-520.
- Mc Elhinney D.B., Yang S.G., Hogarty A.N. et al.//J. Thorac. Cardiovasc. Surg. 2001. V. 122. P. 883-890.
- Morrow W.R., Huhta J.C., Murphy D.J.Jr.//J. Am. Coll. Cardiol. 1986. V. 8. P. 616-620.
- Mc Guinness J.G., Elhassan Y., Lee S.Y. et al.//Ann. Thoracic. Surg, 2010. V. 90. P. 2023-2027.
- Moulaert A.J., Bruins C.C., Oppenheimer-Dekker A.//Circulation. 1976. V. 53. P. 1011-1015.
- Nielsen J.C., Powell A.J., Gauvreau K. et al.//Circulation. 2005. V. 111. P. 622-628.
- Pandey R., Jackson M., Ajab S. et al.//Ann. Thorac. Surg. 2006. V. 81. P. 1420-1428.
- Pettersen M.D., Du W., Skeens M.E.//J. Am. Soc. Echocardiogr. 2008. V. 21 (8). P. 922-934.
- Rakhra S.S., Lee M., Iyengar A.J. et al.//Interact. Cardio Vasc. Thorac. Surg. 2012. V. 1. P. 301.
- Sakurai T., Stickley J., Stumper O. et al.//Interact. Cardio Vasc. Thorac. Surg. 2012. V. 15 (5). P. 865-870.
- Sluysmans T., Colan S.D.//J. Appl. Physiol. 2005. V. 99. P. 445-457.
- Shaddy R.E. et al.//Circulation. 1986. V. 73. P. 82.
- Simpson I.A., Sahn D.J. et al.//Circulation. 1988. V. 77. P. 736.
- Thomson J.D., Mulpur A. et al.//Heart. 2006. V. 92. P. 90-94.
- Wood A.E., Javadpour H., Duff D. et al.//Ann. Thorac. Surg. 2004. V. 77. P. 1353-1357.
- Wright G.E., Nowak C.A., Goldberg C.S. et al.//Ann. Thorac. Surg. 2005. V. 80. P. 1453-1459.


