Гистологическая картина тканей животных при накожном применении препарата «Дегельм КД»
Автор: Лутфуллин М.Х., Залялов И.Н., Фазулзянова А.М., Лутфуллина Н.А.
Статья в выпуске: 2 т.230, 2017 года.
Бесплатный доступ
Акрицидный препарат «Дегельм КД» при накожном применении здоровым кроликам после однократного воздействия в первые сутки вызывает маловыраженные изменения преимущественно микроструктуры эпидермиса, тогда как изменения собственно кожи, подкожной клетчатки и эластического хряща не были обнаружены.
Кролики, псороптоз, "дегельм кд", фуксин, ушной хрящ, срез кожи
Короткий адрес: https://sciup.org/14288912
IDR: 14288912 | УДК: 619:611.018:615.285.7
Текст научной статьи Гистологическая картина тканей животных при накожном применении препарата «Дегельм КД»
Паразитарные болезни, в том числе кожные заболевания животных саркоптои-дозной этиологии, имеют широкое распространение. Они наносят значительный экономический ущерб, который складывается не только из падежа животных и птиц, но и снижения мясной, молочной и яичной продуктивности, ухудшения качества шкур, а также затрат на проведение лечебных мероприятий и дополнительных расходов корма.
В нашей стране и за рубежом на протяжении многих лет делали попытки изыскания эффективных, безвредных и доступных лекарственных средств для профилактики и лечения саркоптоидозов животных и птиц [1, 2, 3].
Однако разработка, всестороннее изучение и внедрение в практику новых эффективных и безопасных средств является насущной необходимостью [4, 5, 6].
Материалы и методы исследований. Гистологические изменения в тканях животных при накожном применении исследуемого препарата определяли на 9-ти кроликах породы белый великан обоего пола в возрасте 6-8 месяцев. Кролики были разделены на три группы, по 3 животных в каждой. Животным первой и второй групп (опытные) наносили 1%-ю эмульсию препарата «Дегельм КД», третью группу обрабатывали 5%-м раствором фуксина. Акарицидный препарат и фуксин наносили на кожу внутренней стороны ушных раковин, а также на заранее выстриженный участок кожи области поясницы кроликов размером 2 см2 дважды с интервалом 7 суток. Кусочки обработанных участков кожи и ушного хряща брали через одни сутки (I-я группа) и 10 суток (II-я группа) после повторного применения препарата.
Кусочки кожи и ушного хряща, взятых для гистологического исследования фиксировали в 10 %-м растворе формалина, затем уплотняли в парафине. Микропрепараты кожи толщиной 8-10 мкм окрашивали гематокси-лин-эозином по общепринятой методике.
Результаты исследований. Эпидермис у контрольных кролков был представлен небольшим по толщине многослойным плоским ороговевающим эпителием с выраженным обозначением функционально активных слоев. На незначительно колеблющейся по высоте базальной мембране располагались в один рядклетки базального слоя, имеющие овальную форму, базофильно окрашенную цитоплазму и обогащенные хроматином ядра (рисунок 1). Среди этих клеток встречались единичные фигуры митоза, в том числе цитотомин.
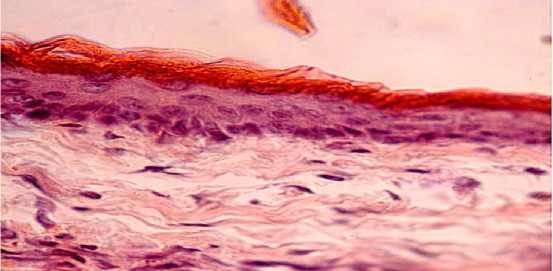
Рисунок 1 – Срез кожи кролика контрольной группы (I).
Окраска гематоксилином и эозином. Увел. 600.
Апикальнее базального слоя располагались в 2-4 ряда, в зависимости от места их положения, шиповатые клетки с обозначенными короткими цитоплазматическими мостиками. Выше расположенный зернистый слой плоских клеток был незначительным по толщине (1-3 слоя), выделялся полиморфиз- мом ядер эпидермоцитов, в том числе и ка-риопикнозом. Поверхностный слой эпидермиса у контрольных кроликов представлен сравнительно немногочисленными ороговевшими клетками образующие тонкий роговой слой, окрашенный резко оксифильно (рисунок 2).
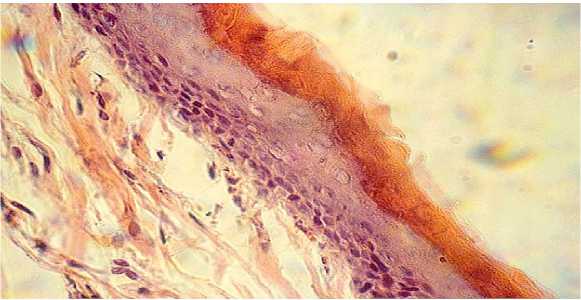
Рисунок 2 –Срез кожи кролика контрольной группы (II).
Окраска гематоксилином и эозином. Увел. 480.
Базальнее слоя эпидермиса располагалась собственно кожа (кориум), представленная сравнительно тонким сосочковым слоем, образованным из рыхлой волокнистой соединительной ткани. Ее апикальная область повторяла волнообразную линию базальной мембраны и производящего слоя эпидермиса. В рыхло расположенных тонких пучках соединительной ткани сосочкового слоя, имевшие преимущественно горизонтальную и наклонную ориентацию, располагались единичные лимфоидные клетки, фибробласты, гистиоциты.
Сетчатый слой кожи выделялся косо расположенными пучками волокнистой соединительной ткани, сравнительно малочисленностью фибробластов и лимфоидных клеток. В коже располагались единичные воло- сяные сумки. В сетчатом слое корни волос выделялись темными базофильными клетками дермального корневого влагалища (рисунок 3).
Глубже сетчатый слой плавно переходил в подкожную клетчатку, содержавшую разрозненно расположенные пучки коллагеновых волокон и скопления липоцитов, формирующие сравнительно тонкий подкожный жировой слой, переходящий в структуры эластического хряща ушной раковины, представленный тремя обозначенными слоями: наружным волокнистым, внутренним клеточным и клетками хрящевой ткани. Подавляющее большинство хрящевых клеток располагались в капсулах по одиночке, реже по две без формирования изогенных групп хондроцитов (рисунок 4).
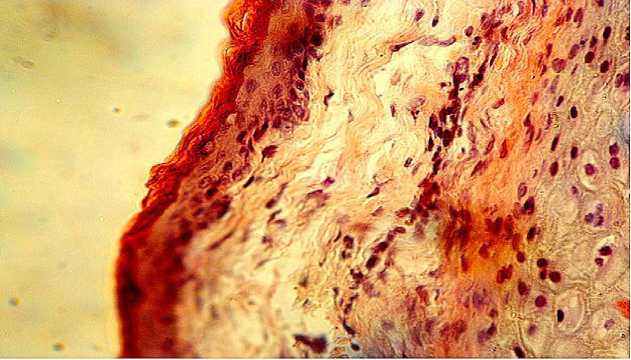
Рисунок 3 - Базофильные клетки дермального корневого влагалища.
Окраска гематоксилином и эозином. Увел. 660.
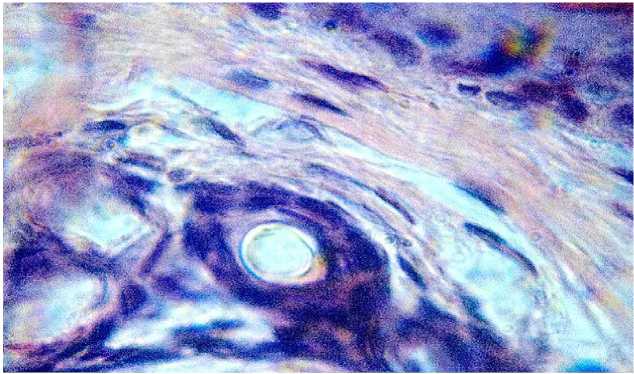
Рисунок 4 – Эластичный хрящ ушной раковины кролика контрольной группы. Окраска гематоксилином и эозином. Увел. 360.
Испытуемое средство у подопытных животных после однократного воздействия на поверхность кожи на первые сутки вызвало маловыраженные изменения преимущественно микроструктуры эпидермиса, тогда как изменения собственно кожи, подкожной клетчатки и эластического хряща не были обнаружены. Основные изменения были отмечены в структуре эпидермоцитов, проявлялись они уменьшением плотности расположения роговых чешуек в самом поверхностном слое рогового вещества. В результате отдельные уча- стки рогового слоя были незначительно равномерно истончены. Реактивные изменения в подлежащих слоях этих участков кожи были мало выраженными. В базальном слое сохранялся уровень митотической активности, аналогичный контрольным животным (рисунок 5).
Соответственно митотической активности клеток базального слоя сохранялась структура клеток шиповатого и зернистого слоев.
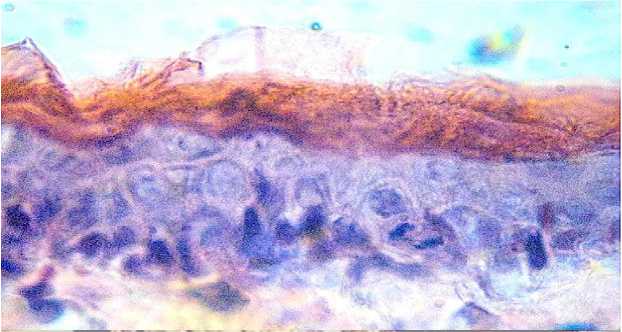
Рисунок 5 – Срез кожи кролика подопытной группы после воздействия препарата «Дегельм КД» на 1-е сутки. Окраска гематоксилином и эозином. Увел. 600.
По истечении 10-и суток после применения испытуемого препарата структура всех слоев кожи, включая эпидермис, а также структура эластического хряща ничем не отличались от исходных, отмеченной у контрольных животных (рисунки 6, 7).
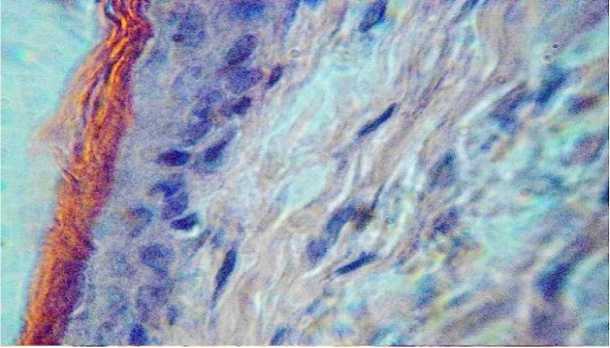
Рисунок 6 – Сохранение структуры клеток эпидермиса, волокон сосочкового и сетчатого слоев кожи на 10-е сутки после применения препарата. Окраска гематоксилином и эозином. Увел. 600.
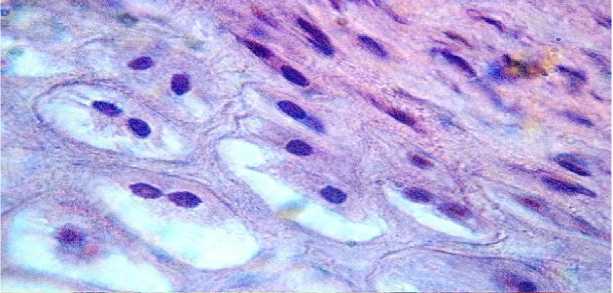
Рисунок 7 – Сохранившаяся структура эластического хряща области ушной раковины кролика. Формирование в капсулах одиночных хондроцитов.
Окраска гематоксилином и эозином. Увел. 600.
Заключение. Препарат «Дегельм КД» при накожном применении кроликам в виде 1%-й эмульсии вызывает маловыраженные изменения в течение 10 суток преимущественно микроструктуры эпидермиса. Основные изменения были отмечены в структуре эпидермоцитов, они проявлялись уменьшением плотности расположения роговых чешуек в самом поверхностном слое рогового вещества. В результате отдельные участки рогового слоя были незначительно равномерно истончены. Изменения собственно кожи, подкожной клетчатки и эластического хряща также были маловыраженными. В базальном слое сохранялся уровень митотической активности, аналогичный контрольным животным. Соответственно митотической активности клеток базального слоя сохранялась структура клеток шиповатого и зернистого слоев.
Резюме
Акрицидный препарат «Дегельм КД» при накожном применении здоровым кроликам после однократного воздействия в первые сутки вызывает маловыраженные изменения преимущественно микроструктуры эпидермиса, тогда как изменения собственно кожи, подкожной клетчатки и эластического хряща не были обнаружены.
Список литературы Гистологическая картина тканей животных при накожном применении препарата «Дегельм КД»
- Багамаев, Б.М. К вопросу интегрированной системы борьбы с псороптозом овец/Б.М. Багамаев, А.И.Лысенко//Актуальные проблемы инвазионной, инфекционной и незаразной патологии животных: мат. междунар. науч.-практ. конф., посв. 100-летию со дня рождения профессора С.Н. Никольского. -Ставрополь, 2003. -С. 20-26
- Сидоркин, В.А. Научные основы разработки и применения новых отечественных противопаразитарных лекарственных средств//дис.. док.вет. наук: 06.02.03/В. А. Сидоркин -Саратов, 2002. -467с.
- Сулейманова, Г.Ф. Эпизоотология и меры борьбы с отодектозом/Г.Ф. Сулейманова//Ветеринарная медицина. Современные проблемы и перспективы развития: Материалы Международной научно-практической конференции. -ФГОУ ВПО «Саратовский ГАУ». -2010. -С. 413-415.
- Хамзина, Е.В. Диагностика и лечение нотоэдроза кроликов/Е.В. Хамзина, М.Х. Лутфуллин, Д.К.Манирамбона, А.М. Зарипова//Международн. науч.-практ. конф. посв. 50-летию ФЦТРБ. -Казань, 2010. -С. 486-490.
- Лутфуллин, М.Х. Акарицидная эффективность различных препаратов при псороптозеовец / М.Х. Лутфуллин, Е.В.Хамзина, А.М. Фазулзянова // «Теория и практика борьбы с паразитарными болезнями» // Материалы докладов научной конференции. - М., 2013. - Вып. 14. - С. 406-409.
- Лутфуллин, М.Х. Акарицидное действие соединения «Дегельм КД» на клещей Psoroptesovis/М.Х. Лутфуллин, Е.В. Хамзина, А.М. Фазулзянова//Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. -Казань, 2013. -Т. 215. -С.194-197.


