Гистологические особенности сети яичника в остром периоде генитальной герпесвирусной инфекции
Автор: Боровая Татьяна Геннадьевна, Диденко Любовь Васильевна, Наровлянский Александр Наумович, Шевлягина Наталья Владимировна, Иванова Алла Ивановна, Санин Александр Владимирович, Пронин Александр Васильевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.23, 2015 года.
Бесплатный доступ
Проведено сравнительное изучение структурно-функционального состояния сети яичников здоровых половозрелых самок морских свинок и свинок в остром периоде генитального герпеса. Использованы методы световой и трансмиссионной электронной микроскопии, иммуногистохимического анализа альфа-рецепторов эстрогенов, иммунофлуоресцентного исследования антигенов вируса простого герпеса 2-го типа, количественной морфометрии. У всех животных в остром периоде инфекции выявлена многокамерная кистозная трансформация канальцев сети на фоне выраженных признаков воспаления в мозговом веществе яичников; зарегистрировано снижение активности иммуногистохимического маркирования ядер эпителиоцитов сети на альфа-рецепторы эстрогенов и позитивное иммунофлуоресцентное окрашивание ядер этих клеток на антигены вируса. Сделано заключение о негативном влиянии вируса простого герпеса 2-го типа на регуляторные эффекты эстрогенов и морфофизиологию яичниковой сети с исходом в кистозную трансформацию.
Сеть, яичник, герпес, вирус, транскрипция, киста
Короткий адрес: https://sciup.org/143177044
IDR: 143177044
Текст научной статьи Гистологические особенности сети яичника в остром периоде генитальной герпесвирусной инфекции
Введение. Сеть яичника (лат.: rete ovarii) представляет собой рудиментарные канальцы первичной почки, которые сохраняются в области ворот яичника после завершения его органогенеза. В эмбриональном и раннем постнатальном онтогенезе у многих представителей млекопитающих канальцы мезонефроса выполняют гисто-генетическую роль в образовании оболочек для половых клеток и в инициации мейоза [6, 7, 10, 20, 21, 22]. В постнатальном периоде онтогенеза (как считалось ранее) влияние канальцев мезонефроса на физиологию яичников практически не проявляется. В последние годы взгляды на сеть как на пассивный рудимент дефинитивных яичников изменились [1, 3]. В клинических наблюдениях и опытах на животных показано, что rete ovarii может стать источником кистозной и опухолевой патологии яичников в течение всего периода онтогенеза организма [4, 8, 19]. В репродуктивно зрелом возрасте этому способствуют гормональные дисфункции, в процессе старения – возрастные нейро-гуморальные перестройки. В опытах на мутантных линиях животных выявлено возможное первоначальное значение генетических факторов в патологической трансформации сети [9, 10, 12, 13, 14]. Несмотря на определенные успехи, достигнутые в исследовании причин патологии сети дефинитивных яичников, полной информации по этому вопросу не получено, как и отсутствуют данные о роли инфекционных факторов.
Цель исследования – оценить влияние острой генитальной герпесвирусной инфекции на структурно-функциональное состояние сети яичников половозрелых морских свинок.
Материал и методы исследования. Объектами исследования служили правый и левый яичники молодых (трехмесячных) половозрелых самок морских свинок в стадии диэструс полового цикла. Животные были распределены на две группы: 1 – интактные морские свинки (контроль, n = 5); 2 – свинки, зараженные вирусом простого герпеса 2 типа (ВПГ-2) (n = 5). Заражение производили ВПГ-2 штамм «ВН» (получен из «Института вирусологии им. Д.И.Ивановского ФГБУ ФНИЦ эпидемиологии и микробиологии им. Н.Ф.Гамалеи Минздрава России») путем внутривагинального введения 20 мкл вируссо-держащего материала. Вирус предварительно был размножен на перевиваемой культуре клеток Vero и его титр соответствовал 105 ТЦД50/мл (5,0 lg ТЦД50/мл). Выделение яичников для анализа производили в остром периоде инфекции – на 10 сутки инфицирования. Выведение животных из опыта и взятие материала осуществляли после усыпления парами хлороформа в соответствии с “Международными рекомендациями по проведению медико-биологических исследований с использованием животных (1989)”. Для анализа материала привлечены методы световой микроскопии, иммуногистохимической детекции альфа-рецепторов эстрогенов, иммунофлуоресцентного определения антигенов ВПГ-2. Для световой микроскопии и иммуногистохимических реакций яичники фиксировали 10% нейтральным формалином. Серийные парафиновые срезы толщиной 7 мкм окрашивали гематоксилином и эозином по общепринятой схеме. Для доказательства присутствия в клетках сети ВПГ-2 срезы монтировали на стекла с полилизиновым покрытием и проводили реакцию прямой иммунофлуоресценции на антигены вируса: срезы инкубировали в растворе поликлональных антител к ВПГ-2, меченых ФИТЦ (НПФ “Лабдиагностика”) в течение 90 мин при комнатной температуре. После промывки фосфатным буфером (рН=7,4) срезы заключали в глицерин. Иммуннофлуоресцентный анализ проводился с помощью светового микроскопа Axiostar plus (Zeiss, Germany) с модулем для люминесценции. Параллельно на стеклах с полилизиновым покрытием проводили непрямую реакцию иммуномечения на альфа-рецепторы эстрогенов на срединных срезах яичников (где сеть представлена наиболее полно) с использованием моноклональных мышиных антител, клон C-542 (фирмы ABCAM, CША) в разведении 1:100, HPR-коньюгата
(DAKO) и DAB-системы визуализации. Контроль на неспецифичность связывания антител проводили по тому же протоколу, но без инкубации с первыми (специфическими к рецепторам эстрогенов) антителами. Подсчет клеток с мечеными ядрами осуществляли на компьютерных изображениях срезов канальцев (по 20 срезов в каждой группе) при общем оптическом увеличении микроскопа равном 400. Иммуногистохимические препараты анализировали и фотографировали в световом микроскопе Axiostar plus (Zeiss, Germany). Для трансмиссионной электронной микроскопии образцы фиксировали в реактиве Ито-Карновски с постфиксацией в 1% растворе OsO4, дегидратировали в этаноле и заливали в смолу LR White (GmbH, Germany). Ультратонкие срезы (100А) контрастировали 1% раствором уранилацетата и цитрата свинца. Анализ ультратонких срезов яичников проводился в трансмиссионном электронном микроскопе JEM 100B (Jeol, Japan) при ускоряющем напряжении 80кВ.
Результаты исследования и их обсуждение. В гистологических препаратах четырех из пяти контрольных животных сеть яичника была представлена немногочисленными узкими или умеренно расширенными канальцами (рис. 1, фрагмент). Внутреннюю выстилку канальцев формировал один слой эпителиоцитов кубической или низкой столбчатой формы. На апикальных поверхностях большинства эпителиоцитов присутствовали множественные длинные реснички. Прилегающая к эпителию канальцев волокнистая соединительная ткань формировала тонкую внешнюю оболочку с небольшим количеством микрососудов и клеток фибробластического дифферона, которая незаметно переходила в соединительнотканную строму мозгового вещества яичника. У одной из контрольных морских свинок в левом яичнике обнаружено кистозное расширение канальцев сети с уплощением формы эпителиоцитов без сопутствующих признаков воспаления во внешней соединительнотканной оболочке и окружающем мозговом веществе; гистологическая структура канальцев сети правого яичника не отличалась от таковой у остальных контрольных животных. У всех морских свинок контрольной группы присутствовало специфическое иммуногистохимическое маркирование ядер эпителиальных клеток канальцев на альфа-рецепторы эстрогенов (рис. 3). Поскольку канальцы сети имели разные диаметры (и, соответственно, разное число эпителиоцитов в срезах канальцев), подсчета среднего количества эпителиальных клеток с окрашенными ядрами на один каналец не производилось. Общая численность эпителиоцитов, содержащих метку в ядрах, варьировала от 5 – 11 в срезах мелких канальцев до 19 – 28 – в
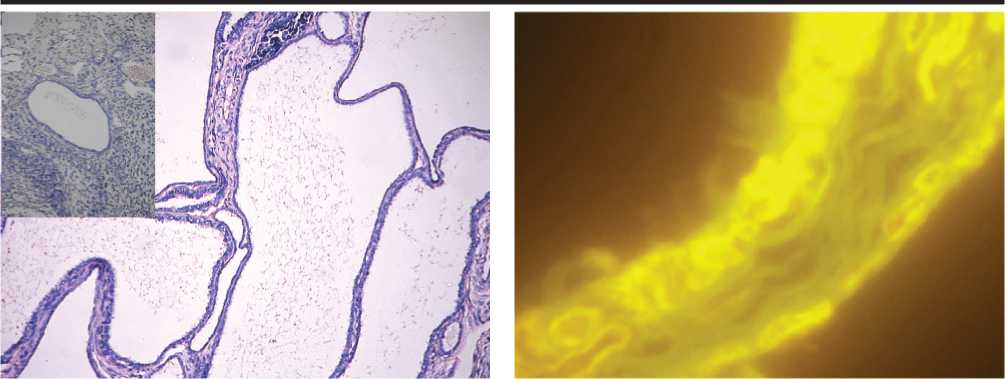
Рис. 2. Стенка кисты яичника (острый период генитального герпеса). Реакция прямой иммунофлуоресценции на антигены ВПГ-2. Ув. 900.
Рис. 1. Многокамерные кисты сети яичника (острый период генитального герпеса). Фрагмент – каналец сети яичника (контроль). Окраска гематоксилином и эозином. Ув. 63.
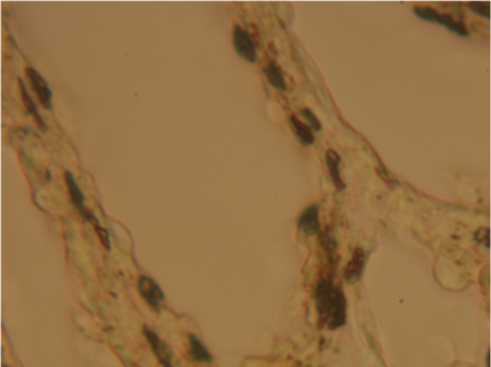
Рис. 3. Канальцы сети яичника (контроль). Иммуногистохимическое окрашивание ядер эпителиоцитов на альфа-рецепторы эстрогенов. Ув. 400.
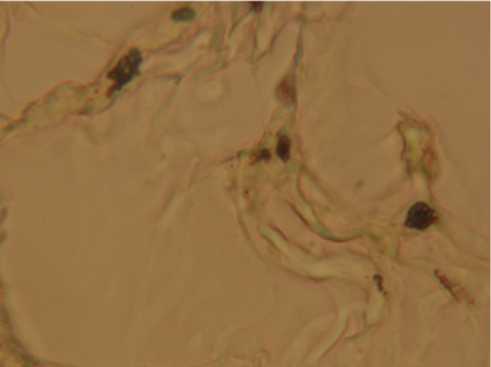
Рис. 4. Фрагмент многокамерной кисты яичника (острый период генитального герпеса). Иммуногистохимическое окрашивание ядер эпителиоцитов на альфа-рецепторы эстрогенов. Ув. 400.
более крупных канальцах с хорошо выраженным просветом. Интенсивное окрашивание на альфа-рецепторы эстрогенов отмечалось также в ядрах эндотелиоцитов сосудов внешней соединительнотканной оболочки канальцев. В кистозно измененных канальцах сети левого яичника одной из свинок контрольной группы число эпителиоцитов с окрашенными ядрами колебалось от 3 до 10 клеток на срез канальца.
Гистологическая картина сети яичников всех инфицированных животных кардинально отличалась от контрольной группы. В обоих яичниках каждой морской свинки сеть выглядела в виде многокамерных кист с резко истонченными стенками и уплощенным (местами “слущенным”)
эпителием. Кистозно-расширенные канальцы имели вид тонкостенных крупных “камер” (рис. 1) и располагались настолько компактно, что внешняя соединительнотканная оболочка в местах контактов канальцев друг с другом практически “исчезала” – была представлена единичными клетками и тонким слоем матрикса. В участках мозгового вещества пограничных с кистами располагались расширенные тонкостенные и кровенаполненные сосуды. При трансмиссионной электронной микроскопии количество реснитчатых эпителиоцитов в эпителиальной выстилке кист, а также высота, толщина и численность ресничек визуально были существенно ниже по сравнению с контролем, во многих эпителиоцитах отмечались признаки деструкции. В цитоплазме сохранных эпителиальных клеток присутствовали пиноци-тозные пузырьки. Результаты реакции прямой иммунофлуоресценции указывали на наличие антигенов вируса в ядрах эпителиоцитов кист у всех инфицированных животных (рис. 2); в контрольных препаратах реакция была отрицательной. Иммуногистохимическая метка на альфа-рецепторы эстрогенов локализовалась в ядрах отдельных эпителиоцитов – от 3 до 9 клеток (рис. 4) на срез канальца (“камеры кисты”). Интенсивность окрашивания ядер по сравнению с контролем была менее выраженной. Во всех участках мозгового вещества яичников отчетливо проявлялись признаки воспалительной реакции: интерстициальный отек, расширение и кровенаполнение сосудов, лейко- и эритропедез, паравазальные скопления плазматических и тучных клеток.
Данные литературы по вопросу кистообра-зования из канальцев сети яичников у морских свинок в определенной степени противоречивы. По одному из мнений, кисты сети у этих животных встречается довольно часто и в этой связи предлагается считать их “нормальным структурным признаком” яичников [18]. Подавляющее большинство других исследователей [17, 10, 16] поддерживают точку зрения, что кисты сети возникают при старении яичников (у морских свинок в возрасте старше 15 месяцев), когда происходят выраженные гормональные перестройки. В проведенном нами эксперименте были использованы молодые животные и присутствие у одной из свинок одностороннего умеренно выраженного кистозного расширения канальцев сети без признаков воспаления является, скорее всего, исключением. В правом яичнике этой же свинки канальцы сети имели физиологическую гистоструктуру, характерную для стадии диэструс. У всех инфицированных морских свинок сеть яичников трансформировалась в многокамерные кисты с истонченными стенками и занимала значительную часть площади срезов. Однотипность изменений сети у животных этой группы и положительные результаты реакции прямой иммунофлуоресценции на антигены ВПГ-2 в эпителиоцитах кист указывают на возможную патогенетическую роль вируса в развитии кистозного изменения сети. Гистологические признаки воспаления яичников, зарегистрированные у инфицированных животных, также свидетельствуют в пользу патогенного влияния ВПГ-2, обладающего свойством индуцировать воспалительные процессы в пораженных тканях [5]. Превращение канальцев сети в многокамерные кисты, по-видимому, можно рассматривать и с позиций их компенсаторного расширения при дренировании отечной жидкости, накапливающейся в яичнике при воспалении. Осуществление транспорта жидкости в полость канальцев подтверждают отмеченные в эпителиоцитах признаки пиноцитоза и присутствие дефектов в эпителиальной выстилке. Вместе с тем, в условиях действия вируса нельзя исключать и реактивного возрастания секреторной активности эпителиоцитов, о которой говорится в обзоре [22] как об одном из физиологических свойств сети дефинитивного яичника. По мнению [19] канальцы сети яичника переполняются секреторной жидкостью и превращаются в многокамерные тонкостенные кисты из-за отсутствия выпускников. Существующие в литературе сведения об изменении морфологического статуса канальцев сети в разные фазы полового цикла [23] указывают на их зависимость от уровня эстрогенов. Полученные нами данные иммуногистохимического маркирования ядер эпителиоцитов сети на альфа-рецепторы эстрогенов в контроле подтверждают это свойство, а зарегистрированное снижение активности специфического окрашивания ядер у инфицированных животных позволяет рассматривать этот факт как результат действия вируса, репликация которого происходит внутриядерно с участием клеточных факторов транскрипции [2, 11]. Известно, что регуляторные эффекты эстрогенов также реализуются через воздействие на процесс транскрипции в клетках-мишенях [15], и это является основанием для предположения о том, что в остром периоде герпесвирусной инфекции у животных возникает некий “перекрест” механизмов внутриядерного эффекта эстрогенов (как факторов транскрипции) и репликации вирусов. Это проявляется в снижении численности и интенсивности иммуногистохимического окрашивания ядер эпителиоцитов сети на альфа-рецепторы эстрогенов, изменении морфофункционального статуса сети и развитии кистозной трансформации.
Выводы:
-
1. В условиях острой генитальной герпесвирусной инфекции канальцы сети яичников половозрелых самок морских свинок трансформируются в крупные многокамерные тонкостенные кисты, занимающие значительную часть яичников. Указанные изменения сопровождаются развитием воспаления.
-
2. Изменения численности и интенсивности иммуногистохимического окрашивания ядер эпителиоцитов канальцев сети яичников в условиях острого генитального герпеса свидетельствуют о нарушении механизма реализации регуляторных эффектов эстрогенов на клетки сети с исходом в кистозную трансформацию.
Список литературы Гистологические особенности сети яичника в остром периоде генитальной герпесвирусной инфекции
- О.В. Волкова, Т.Г.Боровая, Е.О.Погорельская, В.А.Степаненко. Морфогенетическая роль сети в физиологии и патологии яичников//Медико-биологические науки. - 2002. - № 4. - С. 21 - 22.
- Е. Н. Карева, О. М. Олейникова, В. О. Панов, Н. Л. Шимановский, В.И. Скворцова. Эстрогены и головной мозг // Вестник РАМН. - 2012. - № 2. - С. 48 - 9
- Ф.А. Шаповалов, Т.Г. Боровая, Г.Г. Кругликов, Л.М. Каппушева. Морфологические особенности овариальной сети крыс в периоды репродукции и старения//Бюлл.эксп.биол., мед. - 2012. - Т. 154 (12). - С. 772 - 4
- Acikalin M.F., Tokar B. Giant cyst ofthe rete ovarii in a child//J PediatrSurg. - 2005 -. V. 40(6). - P. 17 - 19.
- Anower A.K., Shim J.A., Choi B., Kwon H.J., Sohn S. The role of classical and alternative macrophages in the immunopathogenesis of herpes simplex virus-induced inflammation in a mouse model//J. Dermatol. Sci. - 2014. - Vol. 73 (3). - P. 198 - 208.
- Byskov A.G. The role of the rete ovarii in meiosis and follicle formation in the cat, mink, and ferret//J Reprod Fertil. - 1975. - V. 45. - P. 201 - 209.
- Byskov A.G., Skakkebaek N.E., Stafanger G., et al. Influence of ovarian surface epithelium and rete ovarii on follicle formation//J Anat. - 1977. V. - 123. - P. 77 - 86.
- Crum, C. P. The female genital tract: Ovarian tumors. - 2005. - P. 1093-1104. In: Robbins and Cotran Pathologic Basis of Disease, 7th ed. (Kumar, V., Abbas, A.K. and Fausto, N. eds.) Elsevier Saunders, Philadelphia.
- Jiang J., Take Y., Kobayashi Y., et al. Adenomatous hyperplasia of the rete ovarii in beagle//J Toxicol Pathol. - 2004. - V. 17. - P. 127 - 128.
- Keller L.S., Griffith J.W., Lang C.M. Reproductive failure associated with cystic rete ovarii in guinea pigs//Vet Pathol. - 1987. - V. 24(4). - P. 335 - 9.
- Knipe D.M. The role of viral and cellular nuclear proteins in herpes simplex virus replication//Adv. Virus Res. - 1989. - Vol. 37. - P. 85 - 123.
- Kon Y., Konno A., Hashimoto Y., et al. Ovarian cysts in MRL/MpJ mice originate from rete ovarii//Anat Histol Embryol. - 2008. - V. 36. P. 172 - 178.
- Lee S., Ichii O., Otsuka S., et al. Quantitative trait locus analysis of ovarian cysts derived from rete ovarii in MRL/MpJ mice//Mamm Genome. - 2010. - V. 21. - P. 162 - 171.
- Lee S.H., Ichii O., Otsuka S., Hashimoto Y., Namiki Y., Kon Y. Identifying a new locus that regulates the development of rete ovarian cysts in MRL/MpJ mice// Jpn J Vet Res. - 2011. - V. 59(2-3). - P. 79 - 88.
- McInerney E.M., Weis K.E., Sun J., Mosselman S., Katzenellenbogen B.S. Transcription activation by the human estrogen receptor subtype beta (ER beta) studied with ER beta and ER alpha receptor chimeras//Endocrinology. - 1998. - Vol. 139 (11). -P. 4513 - 22.
- Pilny A. Ovarian cystic disease in guinea pigs// Vet Clin North Am Exot Anim Pract. - 2014. - V. 17(1). - P. 69 - 75.
- Quattropani S.L. Serous cysts of the aging guinea pig ovary. II. Scanning and transmission electron microscopy//Anat Rec. - 1978. - V. 190(2). - P. 285 - 98.
- Shi F., Petroff B.K., Herath C.B., Ozawa M., Watanabe G., Taya K. Serous cysts are a benign component of the cyclic ovary in the guinea pig with an incidence dependent upon inhibin bioactivity//J Vet Med Sci. -2002. - V. 64(2). - P. 129 - 35.
- Sung-Woo, Yong-Hoon, Sang-Rae, Kyoung-Min, Young-Jeon, Kang-Jin, Kwon-Sik, Doo, Hwa-Young, Dong-Suck and Kyu-Tae Bilateral Ovarian Cysts Originating from Rete Ovarii in an African Green Monkey(Cercopithecus Aethiops) online in J-STAGE 21 May 2012.
- Upadhyay S., Luciani J.M., Zamboni L. The role of the mesonephros in the development of indifferent gonads and ovaries of the mouse//Ann Biol Anim Biochim Biophys. - 1979. - V. 19. - P. 1179 - 1196.
- Waterberg H. Development of the early human ovary and role of the mesonephros in the differentiation of the cortex//Anat Embryol. - 1982. -V. 165. - P. 253 - 280.
- Wenzel J.G., Odend'hal S. The mammalian rete ovarii: a literature review//Cornell Vet. - 1985. - V. 75. - P. 411 - 425.
- Wenzel J.G., Odend'hal S., Player E.C. Histological and histochemical characterization of the bovine rete ovarii through the estrous cycle and gestation.//Anat Histol Embryol. - 1987. - Vol. 16(2). - P. 124-35.


