Gliocladium roseum и Trichoderma viride как биодеструкторы афлатоксина В1 и антагонисты токсигенного гриба Aspergillus flavus
Автор: Щербакова Лариса Александровна, Микитюк Олег Дмитриевич, Назарова Татьяна Александровна, Джавахия Виталий Георгиевич
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микотоксикология кормов, кормовые культуры
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Контаминация фуражного зерна и растительного сырья афлатоксинами представляет собой серьезную проблему. Подходы к ее решению в основном направлены на деконтаминацию уже загрязненного токсинами сырья или связаны с использованием микробных антагонистов, способных подавлять развитие токсигенных видов Aspergillium, в частности Aspergillus flavus. В представляемой работе у двух микромицетов ( Gliocladium roseum, штамм GRZ7 и Trichoderma viride, штамм TV35), которые были выделены нами ранее из консорциума токсигенного A. flavus, исследована способность к антагонизму в отношении этого гриба, а также к деградации, продуцируемого им афлатоксина В1 (АФВ1). Изучение динамики разрушения токсина при выращивании микромицетов на жидкой среде Чапека с гидролизатом казеина в присутствии АФВ1 (28 °С, 200 об/мин, 7 сут) показало, что исследуемый штамм G. roseum к концу культивирования разлагает 80-90 % АФВ1, добавленного в питательную среду. Штамм T. viride оказался менее активным биодеструктором АФВ1 (деградация не более 48 % микотоксина за тот же период культивирования в описанных выше условиях). Однако в отличие от G. roseum штамм T. viride эффективно подавлял рост колоний токсигенного A. flavus (штамм A11). При совместном культивировании T. viride TV35 и штамма A11 на агаризованной среде наблюдалось значительное торможение роста продуцента АФВ1, что приводило к сокращению диаметра колоний последнего в среднем на 63,9 % (р £ 0,004), тогда как в варианте с G. roseum - на 5,6 % (р £ 0,05). Исследование токсин-деградирующей активности культуральной жидкости G. roseum, выращенного в отсутствие АФB1, показало, что этот биодеструктор обладает способностью синтезировать и секретировать метаболиты с номинально отсекаемой молекулярной массой > 5 кДа, предположительно ферменты, разрушающие или конвертирующие этот микотоксин. Продемонстрирована возможность повышения афлатоксин-деградирующей активности у штамма TV35, проявлявшего антагонизм в отношении A. flavus. Полученные результаты могут стать основой для последующей идентификации катаболизирующих АФВ1 ферментов и разработки биологических методов деконтаминации кормов, загрязненных афлатоксином или его продуцентом.
Афлатоксин в1, биодеструкция
Короткий адрес: https://sciup.org/142214000
IDR: 142214000 | УДК: 636.085.19:615.917:579.64:579.222 | DOI: 10.15389/agrobiology.2016.6.946rus
Текст научной статьи Gliocladium roseum и Trichoderma viride как биодеструкторы афлатоксина В1 и антагонисты токсигенного гриба Aspergillus flavus
Контаминация фуражного зерна и растительного сырья афлатоксинами — вторичными метаболитами аспергилловых грибов представляет собой серьезную проблему. Из-за гепатотоксичности, канцерогености и тератогенности афлатоксины опасны для подавляющего большинства теплокровных (1), поэтому загрязнение ими кормов может быть причиной гибели или снижения продуктивности животных, а также приводить к попаданию токсинов в пищевые продукты (2). В связи с повсеместным распространением аспергиллов, их способностью развиваться как факультативные паразиты на вегетирующих растениях и в то же время вести сапро-трофный образ жизни практически невозможно полностью исключить вероятность контаминации зерна и кормовых трав продуцентами афлатоксинов во время сбора урожая и при его хранении. Поэтому подходы к решению рассматриваемой проблемы в основном направлены на деконтаминацию уже загрязненного токсинами сырья (3, 4) или биоконтроль потенциально афлатоксигенных видов Aspergillium , в частности Aspergillus flavus , микробными антагонистами (5). Из-за высокой стабильности афлатоксинов деконтаминацию с применением химических или физических методов обработки проводят в жестких условиях (6, 7). Это зачастую снижает качество кормов и делает такую обработку экономически невыгодной. Биологический способ деконтаминации (8-10) связан с использованием токсичных
∗ Работа выполнена при финансовой поддержке Российского научного фонда (соглашение ¹ 14-16-00150).
для A. flavus вторичных метаболитов некоторых растений (11), а также с поиском природных ингибиторов афлатоксиногенеза и микроорганизмов-деструкторов, которые могли бы служить источником ферментов, разлагающих афлатоксины или трансформирующих их до неопасных производных (12-16). Например, у ряда микромицетов, колонизирующих природные субстраты совместно с токсигенными изолятами A. flavus , типичный для этого гриба афлатоксин В1 (АФВ1) разлагается в культуральной жидкости (КЖ) (17). Подтверждена ферментативная природа детоксицирующей активности КЖ одного из таких биодеструкторов — Phoma glomerata (штамм PG41) (18).
В представленной здесь работе способность разлагать АФВ1 впервые исследована у двух других микромицетов ( G. roseum и T. viride ), ранее выделенных нами из консцорциума токсигенного A. flavus , с целью оценки перспектив их использования в качестве как источников ферментов, ката-болизирующих АФВ1, так и антагонистов его продуцента.
Методика. Деструктурирующую активность штаммов GRZ7 ( Glio-cladium roseum Bainier) и TV35 ( Trichoderma viride Pers.) из рабочей коллекции лаборатории патофитофизиологии (Всероссийский НИИ фитопатологии) оценивали, культивируя при 28 ° С с аэрацией (Excella TM E-25/25R, «New Brunswick Scientific Co., Inc.», США; 200 об/мин) в течение 7 сут на жидкой среде Чапека с гидролизатом казеина (Ч+ГК), в которую перед внесением инокулюма грибов стерильно вносили АФВ1 («Sigma», США) до конечной концентрации 5-10 мкг/мл. Высокомолекулярные метаболиты с номинально отсекаемой молекулярной массой > 5 кДа получали из КЖ G. roseum , выращенного при тех же условиях в отсутствие токсина (интактная КЖ), с помощью преципитации фильтрата сульфатом аммония и последующего ультрафильтрационного фракционирования водного раствора преципитата. АФВ1 добавляли в стерильные образцы высокомолекулярной фракции и инкубировали смесь при 27-28 ° С в течение 3 сут. Остаточные количества В1 в КЖ грибов или в образцах фракции определяли, используя высокоэффективную жидкостную хроматографию (18).
Влияние T. viride и G. roseum на рост токсигенного A. flavus (штамм А11) исследовали методом двойных культур (картофельно-глюкозный агар, 20-22 ° С, 6 сут). Измеряли минимальный и максимальный диаметры и рассчитывали площадь колоний, используя значения максимального диаметра. Контрольные культуры штамма А11 выращивали при тех же условиях в отсутствие предполагаемых антагонистов.
Статистическую обработку данных проводили в программе Statis-tiсa 6.0 («StatSoft», США). Достоверность различий между контролем и вариантами опыта подтверждали с помощью t -теста для независимых переменных (p < 0,05). В таблице и на рисунке приведены значения среднего ( M ) и стандартной ошибки среднего ( m ). Каждый эксперимент включал не менее 6 повторностей с 3-кратным воспроизведением.
Результаты . Изучение динамики разрушения афлатоксина грибом G. roseum показало, что уже через 3 сут его выращивания на среде с АФВ1 содержание последнего в КЖ сокращалось вдвое, а к концу культивирования не превышало 10-20 % от внесенного количества (рис., кривая 4). Значительное снижение концентрации АФВ1 отмечали и после его инкубации во фракции высокомолекулярных метаболитов, выделенных из фильтрата интактной КЖ G. roseum (см. рис., кривая 5). Термическая обработка фракции приводила к потере токсин-деградирующей активности (см. рис., кривая 1). Полученные результаты позволяют предполагать, что у этого биодеструктора, так же как у P. glomerata (18) или других аскомицетов (12, 19), в разложении АФВ1 могут принимать участие экстрацеллюлярные фермен-947
ты. Ранее было установлено, что G. roseum секретирует зеараленон-специ-фичную лактоназу (20), которая гидролизует лактонное кольцо в молекуле этого опасного для млекопитающих микотоксина фузариевых грибов, снижая тем самым его токсичность (21). Способность зеараленона ингибировать рост большинства микромицетов значительно ограничивает возможность применения грибов-антагонистов против заселяющих растительное сырье токсигенных фузариев, однако G. roseum не чувствителен к его действию (20). Как и в случае зеараленона, лактонное кольцо — один из структурных компонентов молекулы афлатоксина В1, с которым связывают его токсичность, мутагенный и канцерогенный эффекты (22-25). Афлатоксин-деградирующая активность, обнаруженная нами у G. roseum , делает его еще более привлекательным с точки зрения использования в качестве биоагента против грибов, продуцирующих микотоксины разной химической природы.
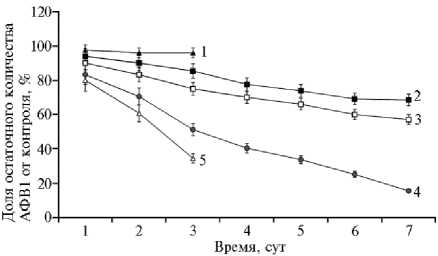
Динамика биодеградации афлатоксина В1 (АФВ1) микромицетами Gliocladium rose-um GRZ7 (4) и Trichoderma viride TV35 (2, 3), культивируемыми на среде с афлатоксином, а также нативными (5) или инактивированными нагреванием (1) высокомолекулярными внеклеточными метаболитами G. roseum. Контроли: для 2, 3, 4 — содержание АФВ1 в питательной среде, не инокулированной микромицетами; для 1, 5 — количество АФВ1, извлеченного из соответствующей фракции метаболитов сразу же после его добавления (без инкубации). Отличия от контроля достоверны при Р ≤ 0,05; Y-погрешности показывают стандартную ошибку среднего для 3 опытов при 6 повторах на вариант в каждом.
Деструктурирующая активность исследованного нами штамма T. viride была невысока. Утилизация АФВ1 из питательной среды происходила медленно, и его концентрация в КЖ по мере роста гриба снижалась незначительно (см. рис., кривая 2). Однако способность штамма к деструкции АФВ1 возрастала (кривая 3), если для засева жидкой среды использовали суспензию спор гриба, предварительно выращенного на агаризован-ной среде Ч+ГК, в которую был добавлен АФВ1 (0,9 мкг/мл). При использовании такого инокулюма доля деструктурированного токсина в погруженной культуре увеличивалась к концу ферментации на 20 % (р = 0,03). Из этого следует, что обнаруженная нами у T. viride АФВ1-деградирующая активность индуцибельна и может быть увеличена посредством мутагенеза и последующего отбора наиболее эффективных клонов. Кроме того, исследуемый штамм T. viride оказался эффективным антагонистом A. flavus . При культивировании токсигенного штамма А11 совместно с T. viride наблюдалось значительное торможение роста продуцента афлатоксина (табл.) с сокращением размера колоний в среднем на 64 %.
Радиальный рост токсигенного штамма А11 гриба Aspergillus flavus в индивидуальной культуре и при выращивании совместно с Trichoderma viride TV35 ( Tv ) или Gliocladium roseum GRZ7 ( Gr ) ( M ± m )
|
Культура |
Средний диаметр колоний, см |
Средний размер колоний, см2 |
Ингибирование роста, % к контролю |
р |
|
|
min |
max |
||||
|
А11 (контроль) |
6,90±0,03 |
7,10±0,00 |
39,50±0,00 |
||
|
А11 + Tv |
3,33±0,09 |
4,26±0,06 |
14,25±0,56 |
63,9 |
0,004 |
|
А11 + Gr |
6,20±0,06 |
6,89±0,08 |
37,27±0,12 |
5,6 |
0,05 |
Микопаразит G. roseum не оказывал заметного влияния на радиальный рост A. flavus , тем не менее, отличия от контроля были достоверны 948
(табл.), а к концу периода совместного культивирования в некоторых случаях отмечалось обрастание колоний штамма А11 мицелием глиокладиу-ма, что могло быть признаком гиперпаразитизма.
Таким образом, установлено, что исследованные штаммы Tricho-derma viride и Gliocladium roseum (виды-антагонисты многих патогенных грибов), конкурирующие с Aspergillus flavus за природные субстраты, in vitro различались по активности деградации афлатокcина B1 и способности ингибировать рост афлатоксигенного штамма A. flavus . Кроме того, обнаруженная нами возможность индуцирования деструктурирующей активности представляет несомненный интерес в теоретическом и практическом аспекте. Полученные результаты могут быть использованы при создании технологий биологической деконтаминации кормов, загрязненных как афлатоксином В1, так и его продуцентом. При этом G. roseum , по-видимому, может служить источником ферментов, разлагающих этот микотоксин, а T. viride — биоагентом, сдерживающим развитие продуцента.
Список литературы Gliocladium roseum и Trichoderma viride как биодеструкторы афлатоксина В1 и антагонисты токсигенного гриба Aspergillus flavus
- Bbosa G.S., Kitya D., Lubega A., Ogwal-Okeng J., Anokbonggo W.W., Kyegombe D.B. Review of the biological and health effects of aflatoxins on body organs and body systems. In: Aflatoxins: recent advances and future prospects/M. Razzaghi-Abyaneh (ed.). InTech, Rijeka, Croatia, 2013: 239-266 ( ) DOI: 10.5772/51201
- Filasi A., Sireli U.T. Occurrence of aflatoxins in food. In: Aflatoxins: recent advances and future prospects/M. Razzaghi-Abyaneh (ed.). InTech, Rijeka, Croatia, 2013: 143-170 ( ) DOI: 10.5772/51031
- Miller J.D., Schaafsma A.W., Bhatnagar D., Bondy G., Carbone I., Harris L.J., Harrison G., Munkvold G.P., Oswald I.P., Pestka J.J., Sharpe L., Sumarah M.W., Tittlemier S.A., Zhou T. Mycotoxins that affect the North American agrifood sector: state of the art and directions for the future. World Mycotoxin Journal, 2014, 7(1): 63-82.
- Whitlow L.W. Evaluation of mycotoxin binders. Proc. 4th Mid-Atlantic Nutrition Conference/N.G. Zimmermann (ed.). College Park, University of Maryland, 2006: 132-143.
- Dhramaputra O.S., Putri A.S.R., Retnovati I., Ambarwati S. Antagonistic effect of three fungal isolates to aflatoxin-producing Aspergillus flavus. Biothropia, 2003, 21: 19-31.
- Raters M., Matissek R. Thermal stability of aflatoxin B1 and ochratoxin A. Mycotoxin Research, 2008, 24(3): 130-134 ( ) DOI: 10.1007/BF03032339
- Womack E.D., Brownab A.E., Sparksa D.L. A recent review of non-biological remediation of aflatoxin-contaminated crops. J. Sci. Food Agric., 2014, 94(9): 1706-1714 ( ) DOI: 10.1002/jsfa.6520
- Wu Q., Jezkova A., Yuan Z., Pavlikova L., Dohnal V., Kuca K. Biological degradation of aflatoxins. Drug Metab. Rev., 2009, 41(1): 1-7 ( ) DOI: 10.1080/03602530802563850
- Kabak B., Dobson A.D.W., Var I. Strategies to prevent mycotoxin contamination of food and animal feed: A review. Critical Reviews in Food Science and Nutrition, 2006, 46: 593-619 ( ) DOI: 10.1080/10408390500436185
- Mishra H.N., Das C. A review on biological control and metabolism of aflatoxin. Critical Reviews in Food Science and Nutrition, 2003, 43: 245-264 ( ) DOI: 10.1080/10408690390826518
- Shukla R., Kumar A., Prasad C.S., Srivastava B., Dubey N.K. Antimycotic and antiaflatoxigenic potency of Adenocalymma alliaceum Miers. on fungi causing biodeterioration of food commodities and raw herbal drugs. Int. Biodeter. Biodegr., 2008, 62: 348-351 ( ) DOI: 10.1016/j.ibiod.2007.11.006
- Sardjono E., Rahayu S., Raharjo S., Rahayu K. Detoxification of aflatoxin B1 by extracellular enzymes of Aspergillus oryzae KKB4. Indonesian Food and Nutrition Progress, 2004, 11(1): 30-34.
- Motomura M., Toyomasu T., Mizuno1 K., Shinozawa1 T. Purification and characterization of an aflatoxin degradation enzyme from Pleurotus ostreatus. Microbiol. Res., 2003, 158: 237-242 ( ) DOI: 10.1078/0944-5013-00199
- Alberts J.F. Microbial degradation of mycotoxins. PhD Thesis. University of Stellenbosch, 2007.
- Guan S., Ji C., Zhou T., Li J.X., Ma Q.G, Niu T.G. Aflatoxin B1 degradation by Stenotrophomonas maltophilia and other microbes selected using coumarin medium. Int. J. Mol. Sci., 2008, 9: 1489-1503 ( ) DOI: 10.3390/ijms9081489
- Cao H., Liu D., Mo X., Xie C., Yao D. A fungal enzyme with the ability of aflatoxin B1 conversion: purification and ESI-MS/MS identification. Microbiol. Res., 2011, 166: 475-483 ( ) DOI: 10.1016/j.micres.2010.09.002
- Zhemchuzhina N., Mikityuk O., Shcherbakova L., Campbell B., Dorofeeva L., Dzhavakhiya V. Isolation of aflatoxin B1-degrading fungi among the mycoflora coincidental with toxigenic Aspergillus flavus. Proc. 14th Int. Congr. on Molecular Plant-Microbe Interactions. Quebec City, 2009: 158.
- Shcherbakova L., Statsyuk N., Mikityuk O., Nazarova T., Dzhavakhiya V. Aflatoxin B1-degrading activity by Phoma glomerata PG41 isolated from natural substrate colonized by aflatoxigenic Aspergillus flavus. Jundishapur Journal of Microbiology, 2015, 8(1): 1-5 ( ) DOI: 10.5812/jjm.24324
- Forootanfara H., Faramarzia M.A., Shahverdia A.R., Yazdia M.T. Purification and biochemical characterization of extracellular laccase from the ascomycete Paraconiothyrium variabile. Bioresource Technol., 2011, 10(2): 1808-1814 ( ) DOI: 10.1016/j.biortech.2010.09.043
- Utermark J., Karlovsky P. Role of zearalenone lactonase in protection of Gliocladium roseum from fungitoxic effects of the mycotoxin zearalenone. Appl. Environ. Microb., 2007, 73(2): 637-642 ( ) DOI: 10.1128/AEM.01440-06
- Utermark J., Karlovsky P. Detoxification of zearalenone by Gliocladium roseum: biological function and regulation of zearalenone lactonase synthesis. Proc. 29th Mycotoxin Workshop. Fellbach, 2007: 54.
- Lee L.S., Dunn J.J., De Lucca A.J., Ciegler A. Role of lactone ring of aflatoxin B1 in toxicity and mutagenicity. Experientia, 1981, 37: 16-17 ( ) DOI: 10.1007/BF01965543
- Guan S., Zhou T., Ym Y., Xie M., Ruan Z., Young J.C. Microbial strategies to control aflatoxins in food and feed. World Mycotoxin Journal, 2011, 4: 413-424 ( DOI: 10.3920/WMJ2011.1290
- Nicolás-Vázquez I., Méndez-Albores A., Moreno-Martínez E., Miranda R., Castro M. Role of lactone ring in structural, electronic, and reactivity properties of aflatoxin B1: a theoretical study. Arch. Environ. Con. Tox., 2010, 59(3): 393-406 ( ) DOI: 10.1007/s00244-010-9501-x
- Iram W., Anjum T., Iqbal M., Ghaffar A., Abbas M. Mass spectrometric identification and toxicity assessment of degraded products of aflatoxin B1 and B2 by Corymbia citriodora aqueous extracts. Scientific Reports, 2015, 5: 14672 ( ) DOI: 10.1038/srep14672


