Глутатион как критерий прогноза риска лекарственно-индуцированной поздней дискинезии у больных шизофренией
Автор: Щигорева Ю.Г., Бойко А.С., Кротенко Н.М., Смирнова Л.П., Корнетова Е.Г., Семке А.В., Иванова Светлана Александровна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Психофармакотерапия
Статья в выпуске: 6 (75), 2012 года.
Бесплатный доступ
В статье представлены результаты клиникобиохимического исследования 23 больных параноидной шизофренией на фоне антипсихотической терапии. У больных с признаками поздней дискинезии выявлено достоверное снижение количества восстановленного глутатиона в/сыворотке крови и индекса отношения количества восстановленного глутатиона к окисленному глутатиону. Перекис-ное окисление липидов по уровню малонового диальдегида и активность каталазы не отличаются у больных с побочными двигательными расстройствами и при их отсутствии. Показатели глатутиона позволяют прогнозировать риск развития поздней дискинезии и могут быть использованы в качестве дополнительных параклинических критериев.
Окисленный и восстановленный глу-татион, поздняя дискинезия, шизофрения
Короткий адрес: https://sciup.org/14295613
IDR: 14295613 | УДК: 616.895.87:612.015
Текст научной статьи Глутатион как критерий прогноза риска лекарственно-индуцированной поздней дискинезии у больных шизофренией
Основным методом лечения шизофрении является антипсихотическая терапия [1]. Антипсихотики улучшают долгосрочный прогноз заболевания и способствуют переходу заболевания в состояние ремиссии. Пациент нуждается в постоянном приеме этих препаратов, которые, кроме основного антипсихотического действия, обладают спектром побочных эффектов, включая метаболические, сердечно-сосудистые и двигательные нарушения.
Проблема побочных эффектов антипсихотиков имеет важную социальную значимость в связи с тем, что в России около 70—80 % больных шизофренией получают терапию традиционными нейролептиками, которые зачастую приводят к развитию двигательных расстройств [2, 3]. Экстрапирамидная симптоматика (дистония, паркинсонизм, акатизия и дискинезия) наблюдается у 50–60 % больных, получающих традиционные нейролептики [2], и требует дополнительного применения антихоли-нергических препаратов. Экстрапирамидные побочные эффекты, в свою очередь, осложняют течение основного заболевания, увеличивая выраженность негативных и когнитивных расстройств, и приводят к дополнительной социальной стигматизации больных. По данным других авторов, доля больных в России, получающих современные атипичные антипсихотики, не превышает 10 % [4].
Под поздней (тардивной) нейролептической дискинезией понимают любой гиперкинез, если он удовлетворяет двум основным критериям: во-первых, возникает вследствие длительного приема нейролептика, во-вторых, стойко сохраняется после отмены препарата [5]. Поздняя дискинезия (ПД) является серьёзным побочным эффектом длительной антипсихотической терапии у больных шизофренией и развивается у 20—30 % больных, получающих нейролептики [6].
Позднюю дискинезию вызывают традиционные нейролептики, блокирующие D 2 -рецепторы (галоперидол, хлорпротиксен, хлорпромазин, трифлуоперазин и др.) [7]. Данный побочный эффект в целом не характерен для атипичных нейролептиков, за исключением рисперидона, который также обладает сродством к D 2 -рецепторам, в редких случаях возможна острая или поздняя дискинезия при применении ами-сульпирида.
Патогенез экстрапирамидных нейролептических осложнений до настоящего времени не ясен. Появление гиперкинеза при применении нейролептиков, блокирующих D2-рецепторы, позволяет говорить об угнетении дофаминергической передачи. Помимо того, в ответ на блокаду рецепторов компенсаторно усиливаются синтез и высвобождение дофамина, который активирует незаблокированные D1- или гиперчувстви- тельные D2-рецепторы. Угнетение нейротрансмиссии в мезолимбической системе ответственно за развитие собственно антипсихотического эффекта, в нигростриальной области – за экст-рапирамидные побочные эффекты.
В связи с развитием дисбаланса в нейротрансмиттерной системе при шизофрении активируются процессы окислительного стресса [8, 9, 10]. Антипсихотики благодаря своей липофильности способны встраиваться в клеточные мембраны и нарушать метаболизм нейронов [11, 12]. Показано, что окислительный стресс и снижение антиоксидантной защиты способствует гибели нейронов и развитию поздней дискинезии [13, 14].
В настоящее время не существует достоверных предикторов риска развития поздней дискинезии на фоне приема нейролептиков. Учитывая высокие экономические затраты в связи с длительностью применения нейролептиков и факты, что тардивная дискинезия существенно ухудшает качество жизни пациентов и зачастую является причиной отказа приема антипсихотиков, необходим поиск критериев прогноза риска развития дискинезии.
Целью исследования явилось изучение перекисного окисления липидов (по концентрации малонового диальдегида как конечного продукта ПОЛ), активности каталазы и показателей системы глутатиона для оценки степени риска развития поздней дискинезии и ее прогноза.
Проведено обследование 23 больных с диагнозом «параноидная шизофрения». Психопатологическая симптоматика описывалась согласно руководству «Оценочный перечень симптомов и глоссарий для психических расстройств» для МКБ-10. Каждый пациент при поступлении в клинику до назначения фармакотерапии и через 6 недель фармакотерапии был обследован по шкале AIMS (оценка патологических непреднамеренных движений). В качестве нейролептической терапии пациенты получали следующие препараты в виде монотерапии или их комбинаций. Из традиционных нейролептиков назначались: галоперидол 10— 30 мг/сут, хлорпротиксен 100—200 мг/сут, хлорпромазин 100—200 мг/сут, трифлуоперазин 20—40 мг/сут, клопиксол 40—80 мг/сут; из числа атипичных нейролептиков: рисперидон 4—6 мг/сут, амисульпирид 600—800 мг/сут.
Шкала патологических непреднамеренных движений (AIMS), которая применяется для оценки поздней дискинезии [15], состоит из 7 основных шкал: по шкалам 1–4 оцениваются мимические движения лица и области рта; 5 – движения верхних конечностей, включая хоре-подобные движения и атетоидные движения; 6 – движения нижних конечностей; 7 – движение туловищем.
Степень выраженности по каждой шкале оценивается от 0 до 4: 0 – отсутствует, 1 – минимально выражено, 2 – слабо выражено, 3 – средне выражено, 4 – сильно выражено. Диагноз «поздняя дискинезия» ставится в международной практике с использованием двух различных критериев: 1) наличие у больного слабо выраженных расстройств (2) по двум шкалам или средневыраженных расстройств (3) по одной шкале (критерий Schooler, Kane); 2) более распространенный критерий – наличие слабо-выраженных расстройств (2) по одной шкале [16, 17, 18]. В наших исследованиях мы использовали второй критерий.
Через 6 недель терапии группа пациентов на основании оценки по шкале AIMS была разделена на две группы: с признаками поздней дискинезии и без признаков. У 7 пациентов наблюдались признаки поздней дискинезии, развившейся в результате лечения. В данную группу вошли 3 мужчин и 4 женщины; возрастной диапазон варьировал от 25 до 50 лет, средний возраст 32,6±5,75 года; средняя продолжительность заболевания 5,78±3,72 года. Группа больных шизофренией без признаков поздней дискинезии составила 16 человек, из них 7 мужчин и 9 женщин; их возрастной диапазон от 20 до 47 лет, средний возраст 30,9±3,78 года, средняя продолжительность заболевания 5,19±2,88 года. В качестве контрольной группы для биохимических анализов обследовано 20 психически и соматически здоровых лиц, соответствующих по полу и возрасту группе пациентов.
Состояние перекисного окисления липидов оценивали в сыворотке крови и гемолизате эритроцитов по содержанию ТБК-связывающих веществ в пересчете на концентрацию малонового диальдегида как промежуточного и наиболее изученного продукта ПОЛ спектрофотометрическим методом [19]. Активность каталазы определяли в сыворотке крови по изменению концентрации перекиси водорода при добавлении исследуемого образца. Расчет активности фермента производили на мг белка. Содержание белка в исследуемом образце определяли по методу Лоури. Состояние неферментативных механизмов антиоксидантной системы оценивали по содержанию восстановленного и окисленного глутатиона в сыворотке крови спектрофлуориметрическим методом [20]. Статистическая обработка проводилась с помощью пакета программ Statistica 6.0 for Windows. Производили расчеты средней арифметической (М) и ошибки средней арифметической (m).
В результате проведенного исследования не выявлено статистически значимых различий в процессах перекисного окисления липидов и активности каталазы у больных с поздней дискинезией по сравнению с пациентами без ее признаков (табл. 1).
Таблица 1
Про- и антиоксидантные показатели у больных шизофренией в зависимости от наличия поздней дискинезии и у здоровых лиц
|
Показатель |
Контроль |
Больные шизофренией |
|
|
без ПД |
с ПД |
||
|
МДА в эритроцитах, нмоль/л |
47,54±2,1 |
48,88±11,31 |
48,15±12,12 |
|
МДА в сыворотке, нмоль/л |
1,81±0,24 |
1,444±0,94 |
1,468±0,87 |
|
Каталаза, мМ Н 2 О 2 /мин/мг белка |
58,65±2 |
56,9±18,21 |
67,01±21,62 |
Характерной особенностью группы больных с поздней дискинезией является достоверное снижение количества восстановленного глутатиона в сыворотке крови в сравнении с больными без ПД и со значениями здоровых лиц (118,92±5,617 мкг/мл, 101,52±3,613 мкг/мл, 141,26±19,21 мкг/мл, p<0,05) (рис. 1). В отношении содержания окисленного глутатиона в сыворотке у пациентов с шизофренией между группой больных с поздней дискинезией и больных без дискинезии достоверных различий не выявлено (рис. 2). Кроме того, обнаружена разница между группами в числовом значении индекса отношения количества восстановленного глутатиона к окисленному глутатиону: у больных с развившейся тардивной дискинезией это отношение имеет более низкое значение (0,52±0,009 – у больных без ПД; 0,471±0,011 – у больных с ПД).
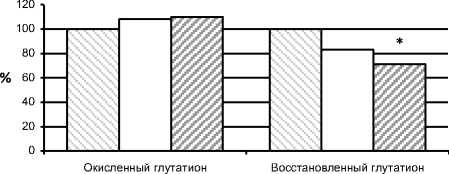
Контроль Группа 1 Группа 2
Рис. 1. Содержание окисленного и восстановленного глутатиона в сыворотке крови больных шизофренией с поздней дискинезией и без поздней дискинезии Примечание. Контроль – здоровые лица (значения контрольной группы приняты за 100 %). Группа 1 – больные без поздней дискинезии. Группа 2 – больные с поздней дискинезией. * – Достоверные различия группы больных с дискинезией с группой больных без дискинезии и со здоровыми лицами (p<0,05).
Уменьшение количества восстановленного глутатиона у больных шизофренией снижает общий антиоксидантный статус организма и, следовательно, способность связывать избыточное количество свободных радикалов, активно участвующих в патогенезе шизофрении, а также снижает способность клетки утилизировать ксенобиотики. Индекс отношения количест- ва восстановленного глутатиона к окисленному глутатиону характеризует окислительно восстановительный потенциал клетки: чем выше его значение, тем выше восстановительная способность клетки. Снижение этих показателей является неблагоприятным фактором и вносит вклад в развитие поздней дискинезии у пациентов.
Антипсихотики первого поколения могут приводить к гиперпродукции реактивных форм кислорода, нарушению активности антиоксидантных ферментов, вызывать нейротоксичность клеток, что, по мнению некоторых авторов, может лежать в основе развития двигательных побочных эффектов (11, 13, 14, 21).
Выявленные особенности изменения количества глутатиона послужили основой для разработки способа прогнозирования риска развития поздней дискинезии при шизофрении (22). Использование определения концентрации глутатиона и индекса отношения его восстановленной и окисленной форм в сыворотке крови больных шизофренией в качестве дополнительных параклинических критериев позволяет оценить риск возникновения побочных явлений терапии и своевременно назначить для пациента индивидуальную тактику лечения.


