Гормональная регуляция репаративного костеобразования
Автор: Свешников А.А., Патраков В.В., Ларионова Т.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2008 года.
Бесплатный доступ
У людей после травм и в процессе уравнивания длины конечностей определяли концентрацию гормонов стресс-группы и регулирующих репаративное костеобразование, а также циклических нуклеотидов. Для оценки функционального состояния костной ткани в процессе лечения контролировали плотность минеральных веществ (МП) у концов костных фрагментов и в регенерате на костных денситометрах фирм "Норлэнд" и «GE/Lunar» (США). Изучение гормонального фона в организме позволяет контролировать состояние отдельных звеньев репаративного процесса, подтверждает обоснованность заключений, проводимых по результатам денситометрических и радионуклидных исследований.
Репаративное костеобразование, минералы кости, остеотропные гормоны, циклические нуклео-тиды
Короткий адрес: https://sciup.org/142121093
IDR: 142121093
Текст научной статьи Гормональная регуляция репаративного костеобразования
Травма является мощным стресс-фактором, который вызывает изменения не только в системе гипоталамус-гипофиз-надпочечники, но и в других органах и тканях. Так, описан "диабетогенный" эффект травмы, изменения в желудочно-кишечном тракте. Своеобразным длительно действующим стрессором является растяжение напряжением тканей для уравнивания длины конечностей [4]. Изучение гормональной регуляции пролиферации, дифференцировки клеток костной ткани, минерализации основного вещества при переломах является актуальной и малоизученной проблемой. Выяснение взаимодействия гормонов с рецепторами клеток, изменения под их влиянием концентрации циклических нуклеотидов в клетках стало возмож-
МАТЕРИАЛ
Наши наблюдения проведены на 160 больных с закрытыми поперечными, косыми и винтообразными переломами костей голени. Чре-скостный остеосинтез осуществляли по методу Г.А. Илизарова. Гормоны определяли также у 138 больных, которым проводилось уравнивание длины конечности. Концентрацию гормонов (АКТГ, кортизола, альдостерона, паратирина, соматотропина, кальцитонина, остеокальцина) определяли методом радиоиммунологического анализа с использованием китов фирмы «CIS»
ным благодаря внедрению метода радиоимму-нологического анализа. Дальнейшие исследования в этом направлении, несомненно, будут способствовать расшифровке молекулярного механизма действия гормонов. В частности, целесообразно изучение циклических нуклеотидов, обладающих уникальной способностью передавать гормональную информацию клеткам и регулировать множество биохимических процессов.
В задачу исследования входило изучение концентрации гормонов крови, ответственных за синтез органической основы и ее минерализацию, а также циклических нуклеотидов при лечении закрытых переломов длинных костей или при уравнивании длины конечностей.
И МЕТОДЫ
(Франция), а циклических нуклеотидов - радио-конкурентным методом с наборами фирмы «Amersham» (Англия). Подсчет активности и распечатка результатов осуществлялись на бета-и гамма-счетчиках фирмы «Tracor Europa» (Голландия).
Для оценки функционального состояния костной ткани в процессе лечения контролировали плотность минеральных веществ у концов костных фрагментов и в регенерате на костных денситометрах фирмы "Норлэнд" и «GE/Lunar»
(США). Изучали состояние репаративного процесса начиная с 3-7-го дня после травмы или остеотомии.
В качестве инструмента вычислений исполь- зовали пакет статистического анализа и встроенные формулы расчетов компьютерной программы Microsoft® Excell (Microsoft® Office 2007 – Professional Runtime).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Гормоны стресс-группы. Кортикотропин. Незамедлительный ответ эндокринной системы на травму или остеотомию (для последующего удлинения) наиболее ярко был выражен в ближайшие часы и приводил к увеличению (в 10 раз) концентрации АКТГ, стимулирующего продукцию гормонов надпочечников. Вследствие этого существенно увеличивалось содержание альдостерона и кортизола. К концу суток концентрация АКТГ несколько уменьшалась (до 9,5 раза). Затем продолжала снижаться, но более интенсивно (рис. 1). К 14-м суткам была выше нормы в 4,6 раза, а к концу первого месяца – в 2 раза. В последующие недели концентрация кортикотропина была изменена очень незначительно. В это время обычно снимали аппарат.
Кортизол. В ближайшие часы после травмы наблюдалось увеличение концентрации в 2,9 раза. К концу суток эта величина составляла 2,6 раза, на 7-й день – 1,9 раза. На 2-3-й неделях снижение концентрации происходило более медленными темпами (рис. 1). Величины, близкие к норме, были в конце месяца. Полная нормализация отмечена на 45-й день.
Высокая концентрация кортизола угнетает синтез клеточных ферментов, биосинтез белка в печени, ускоряются аминотрансферазные реакции и распад некоторых аминокислот. Усиливаются процессы гликонеогенеза в печени, снижается утилизация углеводов в других тканях [3].
Альдостерон. В первые 4-5 часов после травмы концентрация была увеличена в 4,0 раза, но уже к концу суток начинала снижаться до 3,5 раза. На 7-й день была выше нормы в 2,5 раза, на 14-й день - в 1,6 раза. На 3-4-й неделях уменьшение концентрации происходило более медленно (рис. 1). К концу последующих двух недель происходила нормализация.
Повышение концентрации альдостерона приводило к развитию асептической воспалительной реакции. Он усиливал выведение калия из организма, что сопровождалось увеличением гидрофильности тканей и повышением тонуса мышц. Проявлением этого эффекта являлась отечность стопы и голени. У некоторых больных в течение нескольких дней была субфебрильная температура.
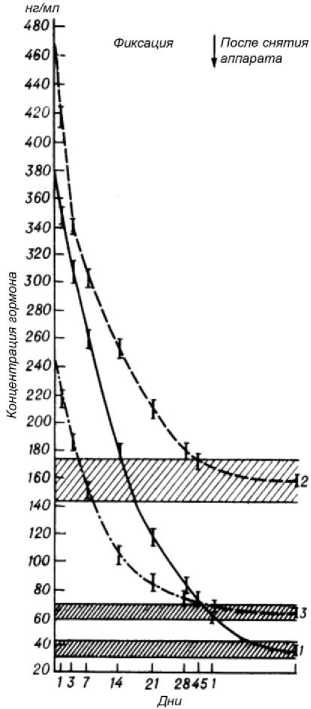
Рис. 1. Изменение концентрации кортикотропина (1), кортизола (2) и альдостерона (3) в процессе лечения переломов костей голени и при удлинении конечности
Регуляторы костеобразования. Парати-рин. В течение 1-х суток концентрация возрастала в 6,5 раза. Увеличение происходило вплоть до 14-го дня, однако ежедневный темп прироста концентрации был меньше, чем в 1-е сутки, и составлял 60 % за каждый день. В итоге на 14-й день она была больше нормы в 14,3 раза (рис. 2). На 3-й неделе наблюдалось довольно существенное снижение ее (на 51 % за каждый день). В течение 4-й недели уменьшение концентрации происходило более быстрыми темпами (140 % за каждые сутки) и поэтому на 28-й день она была близка к норме. Полная нормализация отмечалась на 45-й день после перелома.
Паратирин повышал содержание кальция и снижал количество фосфора в крови [11]. Это происходило в результате активирования резорбтивных процессов. Одновременно с растворением костного минерала происходила резорбция и органического матрикса, состоящего главным образом из коллагеновых волокон и гликозаминогликанов. В результате этих процессов с первых же дней после перелома наблюдалось повышенное накопление меченого пирофосфата, а также уменьшение количества костного минерала [3, 4].
Под влиянием паратирина и соматотропина активируется пролиферация костномозговых элементов, в том числе и остеогенных, превращение клеток-предшественников в остеобласты. Усиливается биосинтетическая активность их для образования костной ткани [2, 8].
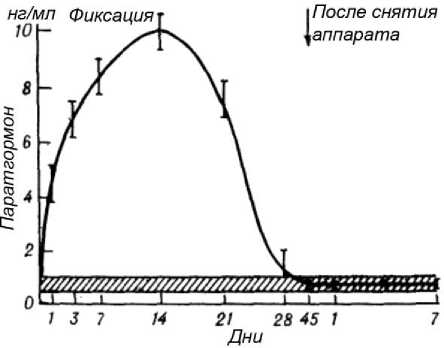
Рис. 2. Изменение концентрации паратиреоидного гормона в процессе лечения больных с переломами и при удлинении конечности
Соматотропин. Этот гормон стимулирует образование органической основы. Концентрация возрастала довольно медленно (1-е сутки – увеличение в 1,3 раза). В дальнейшем (до 21-го дня) концентрация увеличивалась за сутки на 36 % от значений в норме. В конце первого месяца (21-27-й дни) прирост несколько ослабевал (рис. 3). Максимальные значения (9,1 раза) отмечены на 28-45-й дни. Затем очень медленно (по 6 % за сутки) концентрация уменьшалась. Полная нормализация установлена на 135-й день после перелома.
Соматотропин подавляет действие инсулина, стимулирует образование коллагена путем воздействия на биосинтез РНК и ДНК и включение аминокислот в полипептидную цепь, оказывает влияние на минеральный обмен. В результате такого действия во фрагментах прекращалась дальнейшая убыль минералов и их масса начинала нарастать. Об этом свидетельствует увеличение в формирующемся регенерате меченого пирофосфата [5], который имеет сродство к незре- лому апатиту, а также нарастающее в регенерате количество минеральных веществ [3, 10].
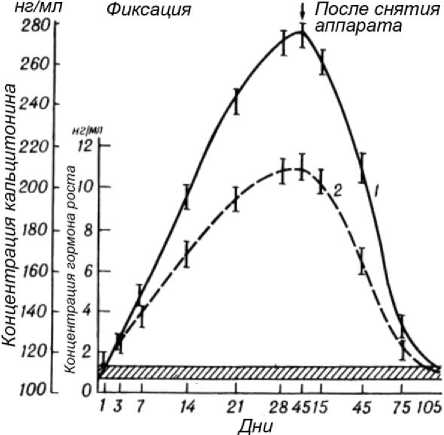
Рис. 3. Изменение концентрации кальцитонина (1) и соматотропина (2) в процессе лечения больных с переломами и при удлинении конечности
Кальцитонин. Изменения развивались однонаправленно с соматотропином (рис. 3), однако увеличение происходило более медленно: в первый день содержание увеличено на 10 % (р<0,05), на 3-й день – на 25 % (р<0,01). Прирост в 2 раза отмечен только на 15-й день. Максимальные величины наблюдались на 45-й день (рис. 3). Затем концентрация начинала уменьшаться, нормализация отмечена на 105-й день.
Кальцитонин ослабляет деминерализацию костных фрагментов, тормозит активность остеокластов, рассасывающих кость, способствует увеличению массы формирующегося регенерата.
Остеокальцин. Увеличение концентрации этого белка свидетельствует о повышении активности остеобластов. После переломов она была наибольшей на 28-й день (табл.). Через 2 месяца после снятия аппарата близка к норме. Полная нормализация отмечена через 4 месяца. При удлинении конечности самой высокой концентрация была на 28-60-е дни дистракции. После снятия аппарата содержание остеокальцина больше нормы в 3,2 раза, на 4-й – в 2,7 раза. В силу активно протекающих перестроечных процессов концентрация приближалась к нормальным значениях лишь через год после снятия аппарата.
Таблица
Концентрация остеокальцина (нг/мл) в крови в процессе лечения переломов и удлинении конечности (М±m)
|
Номер группы |
Дни после перелома или дистракции |
После снятия аппарата (месяцы) |
|||||
|
14 |
28 |
45 |
60 |
2 |
4 |
12 |
|
|
Нормальные значения остеокальцина 6,4±0,4 нг/мл. |
|||||||
|
Перелом |
27,3±1,3 |
36,8±1,6 |
29,7±1,1 |
17,2±1,0 |
8,4±0,6 |
6,6±1,0 |
6,3±0,6 |
|
Дистракция |
26,3±1,9 |
51,3±3,0 |
55,3±1,5 |
48,1±1,8 |
20,2±1,5 |
17,3±1,3 |
6,8±0,7 |
Циклические нуклеотиды. цАМФ. Через 4-5 часов после травмы наблюдалась самая высокая концентрация (28,6±3,1 пмоль/мл). К концу первых суток отмечалась тенденция к снижению. В последующие дни происходило снижение, и к 14-му дню содержание было близко к норме, а на 21-й день наблюдалась нормализация (рис. 4).
цГМФ. Увеличение содержания данного нуклеотида обнаружено на 3-и сутки. В даль- нейшем отмечалось стремительное увеличение с максимальными значениями (в 2,2 раза) на 14-й день. Затем она довольно медленно снижалась. На 45-й день - близко к норме.
цАМФ/цГМФ. Отношение нуклеотидов через 4-5 часов после травмы составляло 2,9, а к концу суток уже начинало уменьшаться. На 1421-е сутки отношение было ниже нормальных колебаний. К 28-м суткам восстанавливалось до нормы (рис. 5).
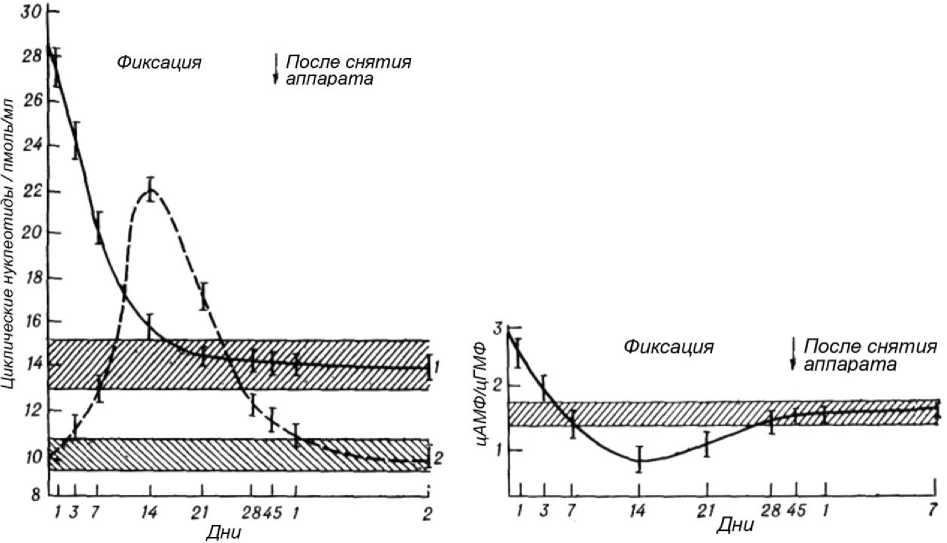
Рис. 4. Концентрация цАМФ (1) и цГМФ (2) при лечении переломов костей голени и при удлинении конечности
Рис. 5. Изменение отношения цАМФ/цГМФ в процессе лечения больных с переломами и при удлинении конечностей
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами установлено, что в ответ на травму, прежде всего, следует реакция со стороны ги-пофиз-адреналовой системы и отмечается увеличение активности паращитовидных желез. Под влиянием этих гормонов в мембранах клеток активируется аденилатциклаза [2]. В результате этого возрастало образование цАМФ, что отражало напряжение адренергических механизмов и являлось одной из первых ответных реакций организма. Но концентрация цАМФ в крови зависит в основном от секреции паратгормона. Характерный его эффект, сводящийся к снижению реабсорбции фосфатов и увеличению обратного всасывания кальция, достигается путем активации цАМФ в клетках почечных канальцев. Под влиянием этого нуклеотида лимитировалось и ингибировалось деление клеток, клональная пролиферация, замедлялось прохождение клеток через фазу митоза [1, 6]. Нуклеотид цАМФ осуществляет функцию посредника действия гормонов белковой природы (АКТГ, адреналин, глюкагон) внутри клетки. Будучи неспособными проникнуть в клетку вследствие нерастворимости их молекул в липидном слое наружной плазматической мембраны, указанные гормоны оказывали влияние на расположенный в этом слое клетки рецептор, связанный с аде-нилатциклазой, что приводило к его активации. В результате вблизи внутреннего слоя мембраны происходило образование из АТФ не обычного, а циклического аденозинмонофосфата, который и выполнял роль вторичного посредника («мессенджера») влияния гормона на клетку, как бы «распространяя» его действие на внутриклеточные структуры; цАМФ проявлял действие и в ядре клетки. Под влиянием цАМФ повышалась активность протеинкиназ - ферментов, осуществляющих фосфорилирование многих белков, в частности фосфорилаз, в результате чего усиливался распад гликогена, образование глюкортикоидов, липолиз и синтез белка. Особенности проявления эффекта цАМФ обусловлены набором ферментов в клетке. Но концентрация цАМФ в клетке зависит не только от активности аденилатциклазы, но и от фосфодиэстеразы, разрушающей цАМФ. Эффект же действия гормонов – от соотношения в клетке цАМФ и цГМФ.
Концентрация кортикотропина и кортикостероидов быстро снижалась и начинало нарастать содержание соматотропина и кальцитонина, а также цГМФ. Под влиянием соматотропина и паратирина активизируется пролиферация костномозговых элементов, в том числе и остеогенных, превращение клеток-предшественников в остеобласты, усиливается их биосинтетическая активность для образования костной ткани [1, 7].
Вслед за первоначальным повышением концентрация цАМФ снижалась, что приводило в движение клеточный пул, стимулировало пролиферацию клеток костного мозга. В период образования органического матрикса цАМФ осуществлял положительную регулирующую роль в пролиферативном ответе стволовых клеток-предшественников костного мозга [1]. При исследовании его после травмы с меченым серным коллоидом нами обнаружено повышение его функционального состояния в условиях чре-скостного остеосинтеза.
Уменьшение концентрации цАМФ являлось естественным и целесообразным механизмом относительного повышения цГМФ-зависимых реакций метаболизма клетки, то есть подключения холинергических механизмов и указывало на устойчивость организма к такому острейшему воздействию, как травма или операция. В итоге отношение этих нуклеотидов становилось ниже нормы и именно в это время начиналась интенсивная клеточная пролиферация. Индукторы пролиферации стволовых клеток, взаимодействуя с рецепторами мембран, усиливали транспорт ионов кальция внутрь клетки. Количество цГМФ прямо зависит от концентрации кальция, поэтому и происходило повышение его уровня. Противоположная зависимость цАМФ от содержания кальция обусловливало реципрокные отношения между этими циклическими нуклеотидами. Значительный уровень цГМФ стимулировал также освобождение химических медиаторов: лизосомальных энзимов и гистамина. Установлено, что вещества, способствующие росту и ускоряющие клеточную пролиферацию (инсулин, соматомедин), оказывают влияние на интраклеточный уровень цГМФ [2].
Можно предположить, что в период образования регенерата факторы микроокружения стволовых кроветворных клеток костного мозга реализуют свое действие через индукцию синтеза цГМФ, который в свою очередь изменял межклеточные контакты в дифференцирующихся тканях остеогенного аппарата.
После операции на клетки воздействовал целый ряд гормонов. Значительное увеличение паратирина в начальном периоде после операции, кальцитонина и цГМФ на более поздних этапах согласуется с мнением H. Rasmussen [9] о том, что происходит активация мезенхимальных клеток, усиление пролиферации клеток костного мозга и резорбции костной ткани.
Существенно изменялось функциональное состояние паращитовидных желез, о чем мы судили по концентрации паратирина. После переломов наибольшие значения были на 14-16-е дни, а в процессе удлинения на 14-19-е дни. Уровень достаточно велик в течение всей дистракции и только на 60-й день фиксации отмечена нормализация. Усиливает действие этого гормона повышенная концентрация цАМФ в крови. На начальном этапе действия паратири-на, как и других белково-пептидных гормонов, принимают участие специфические рецепторы плазматической мембраны клеток-мишеней -ферменты аденилатциклаза и протеинкиназа, расщепляющие белки. Вот почему в первые две недели в регенерате мало минералов, а к 21-му дню у концов костных фрагментов видна деминерализация.
Функциональное состояние щитовидной железы изменялось значительно медленнее, чем паращитовидных. После травмы наибольшая продукция кальцитонина отмечена на 25-28 дни, при удлинении укороченной голени - в начале фиксации. Его действие противоположно паратгормону и витамину D3. Кальцитонин угнетает резорбцию кальция из костей и усиливает отложение в них минерализованного кальция, тормозит всасывание Са++ и фосфатов из кишечника, а также увеличение экскреции кальция почками. Действие кальцитонина на обмен обусловлено снижением проницаемости мембран клеток для Са++. Усиление отложения нерастворимых солей кальция в остеоцитах тесно связано с влиянием на его обмен витамина D 3 .
Секреция кальцитонина регулируется содержанием кальция в крови: увеличение его усиливает, а уменьшение - подавляет секрецию кальцитонина. Повышенная концентрация кальцитонина создавала условия для начала интенсивного формирования органической основы регенерата. Кальцитонин тормозил также и активность остеокластов, рассасывающих кость. Поэтому ослаблялась деминерализация костных фрагментов.
При дистракции длительное время повышена концентрация гормона передней доли гипофиза - соматотропина, стимулирующего анаболические процессы. При удлинении укороченной конечности наибольшая его продукция приходилась на конец дистракции - начало фиксации. Соматотропин стимулировал синтез инсулиноподобного фактора роста, усиливал биосинтез матрикса, обмен веществ в кости и мышцах и увеличивал их массу, оказывал влияние на минеральный обмен, активнее происходил процесс минерализации регенерата. У концов костных фрагментов уменьшалась остеопения.
Под влиянием одновременного действия этого гормона и паратирина активизировались пролиферация костномозговых элементов, в том числе и остеогенных, превращение клеток-предшественников в остеобласты, усиливалась биосинтетическая активность для образования костной ткани.
Существенное значение имела стимуляция па-ратирином образования в почках активного метаболита витамина D-1,25-диоксихолекальциферола (витамин D 3 ), который существенно увеличивал всасывание кальция из кишечника и отложение его в костях. Абсорбцию кальция в кишечнике уменьшал кортизол. Для компенсации этого состояния в организме стимулировалась деятельность паращитовидных желез - увеличивался уровень иммунореактивного паратирина, ускоряющего деминерализацию и, следовательно, больше становился уровень остеокальцина в сыворотке (одного из белков костной ткани), который освобождался из кости в силу ухода кальция.
Всасывающиеся в желудочно-кишечном тракте минеральные вещества поступают в кровь и лимфу. Ионы кальция, например, уже в процессе или после всасывания соединяются со специфическим белком - остеокальцином. Основной причиной деминерализации костей и слабой оссификации является недостаток половых гормонов. Их эффект яснее выявляется у женщин, так как у них на 30 % меньше масса скелета, они меньше употребляют кальция. У них больше, чем у мужчин, концентрация пара-тирина и меньше кальцитонина. Половые гормоны защищают кость от воздействия парати-рина и усиливают образование кальцитонина [5]. При уравнивании длины конечности, укороченной вследствие полиомиелита голени, снижение концентрации эстрадиола было заметно в наибольшей мере. Удерживалась с 45-го дня дистракции и до 90-го - фиксации. У мужчин уровень тестостерона был снижен в течение меньшего времени: с 60-го дня дистракции и до 30-го дня фиксации. Эффективность снижения его менее заметна, чем от убыли эстрогенов. Устранение дефицита гормонов изменяло метаболизм в костной ткани за счет снижения резорбции.
Определение концентрации циклических нуклеотидов, их соотношения может лежать в основе диагностических и прогностических критериев степени тяжести состояния после операции, выраженности компенсаторных реакций и эффективности лечения.
Работа выполнена при поддержке РФФИ, проект № 07-04-96033.


