Гормонально-метаболический патоморфоз нарушений углеводного обмена у подростков с ожирением
Автор: Матюшева Н.Б., Саприна Т.В., Ворожцова И.Н., Горбатенко Е.В., Солодилова Е.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-2 т.26, 2011 года.
Бесплатный доступ
На современном этапе у подростков с ожирением выявлена высокая частота всех компонентов метаболического синдрома. Степень гормонально-метаболических нарушений возрастает с увеличением степени ожирения, однако индексы инсулинорезистентности максимально выражены у подростков со 2-й степенью ожирения с дальнейшим снижением у подростков с 3 и 4-й степенью ожирения. Ранним маркером нарушений углеводного обмена по данным внутривенного глюкозотолерантного теста (ВГТТ) являются: высокий уровень гликемии на 3-й минуте теста, уменьшение скорости снижения глюкозы и высокий постпрандиальный уровень гликемии. ВГТТ позволяет выделять у подростков с ожирением дополнительные факторы метаболического синдрома и прогрессирования сердечно-сосудистых нарушений (гиперурикемия).
Ожирение, метаболический синдром, инсулинорезистентность, внутривенный глюкозотоле рантный тест, гиперурикемия
Короткий адрес: https://sciup.org/14919628
IDR: 14919628 | УДК: 616-056.257-098-053.6:577.124.8
Текст научной статьи Гормонально-метаболический патоморфоз нарушений углеводного обмена у подростков с ожирением
Многие проблемы здоровья, связанные с ожирением, которые, как раньше считалось, относятся только к взрослым, в настоящее время все чаще наблюдаются и у детей: артериальная гипертензия, диабет 2-го типа, неалкогольная жировая болезнь печени, поликистозное изменение яичников и затрудненное дыхание во сне, метаболический синдром [16]. У 80% детей и подростков с данной патологией регистрируется повышенное артериальное давление. У 25% детей с ожирением выявляется нарушение толерантности к глюкозе (НТГ), еще у 4% – “скрытый” сахарный диабет 2-го типа (СД 2) [10, 12]. Для диагностики ранних этапов углеводной интолерантности необходимо своевременно выделять детей в группы риска на основании генеалогических и клинических данных [6]. В настоящее время все больше внимания уделяется исследованию ранних нарушений углеводного обмена, к которым относятся: нарушение толерантности к углеводам и нарушение гликемии натощак, а также их сочетание. Данные нарушения объединяют под общим термином “предиабет”, что подчеркивает неблагоприятный прогноз [1, 11]. У подростков с ожирением при прогрессировании нарушений углеводного обмена до НТГ могут проявляться основные дефекты функции β -клетки. Кроме того, прогрессивное снижение функции β -клетки способствует ухудшению толерантности к глюкозе. Основные метаболические дефекты на самой ранней стадии болезни перед началом любых нарушений толерантности к глюкозе, приводящие к развитию СД 2, требуют исследования. СД 2 у взрослых – заключительный этап развития заболевания, характеризующийся ухудшением инсулиноре-зистентности и секреции инсулина [16, 17]. Изменения, приводящие к развитию СД 2-го типа у подростков с ожирением, достаточно не изучены. Вышеизложенное определяет актуальность установления частоты компонентов метаболического синдрома и диагностики нарушений углеводного обмена на доклинической стадии у подростков с ожирением с целью изучения метаболических и гормональных механизмов их формирования.
Цель исследования: определить гормонально-метаболические показатели и диагностическую ценность внутривенного глюкозотолерантного теста в диагностике ранних нарушений углеводного обмена у подростков с ожирением.
Материал и методы
Проведено одномоментное открытое исследование. В исследование включено 54 человека (31 девушка, 23 юноши), средний возраст обследуемых составил 15,04±1,7 года. Критериями включения являлись: консти- туционально-экзогенное ожирение и метаболический синдром, возраст от 12 до 18 лет, мужского и женского пола. Критерии исключения: ожирение эндокринного генеза и генетической патологии, сахарный диабет 1 и 2-го типа, получение заместительной гормональной терапии. Группу контроля составили 10 практически здоровых подростков, сопоставимых по полу и возрасту.
Всем пациентам было проведено обследование: сбор жалоб, данных анамнеза жизни и заболевания (анализировался пол, течение анте- и неонатального периодов жизни, характера вскармливания, дебют и стаж заболевания, наличие хронических очагов инфекции, наследственная отягощенность по диабету, ожирению, сердечно-сосудистой патологии), объективное обследование, антропометрия, измерение окружности талии (ОТ), бедер (ОБ) с расчетом их отношения (ОТ/ОБ) и индекса массы тела (ИМТ). Степень ожирения устанавливали согласно классификации Ю.А. Князева ( 1982). Лабораторные данные: уровень общего холестерина (ОХ), триглицеридов (ТГ), липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности (ЛПВП), индекс ате-рогенности, трансаминаз (АСТ, АЛТ), лептин (Diagnostics Biochem Canada, Inc.), С-пептид (норма 0,78–1,89 нг/мл), антитела к глутаматдекарбоксилазе (IsletestТМ-GAD, “BIOMERICA”), антитела к β -клеткам (IsletestТМ-ICA, “BIOMERICA”). Исследовался иммунореактивный инсулин (ИРИ) иммуноферментным методом (Mercodia Iso-Insulin ELISA, норма 5–25 ммоль/л). Степень инсулинорезистен-тности (ИР) определяли по индексам HOMAR, Caro, Quicki.
Статистическую обработку данных проводили с помощью пакета SPSS 11.5. Данные представлены в виде среднего и стандартного отклонения (M±SD). Для проверки нормальности распределения величин показателей использовали критерий Колмогорова–Смирнова. Проверка достоверности различий двух сравниваемых групп проводилась по непараметрическому критерию Круска-ла–Уолиса для независимых выборочных совокупностей. Для попарного анализа использовали критерий Манна– Уитни при уровне значимости р<0,05. Корреляционный анализ для изучения взаимосвязи исследованных признаков проводился с использованием непараметрического критерия Спирмена.
Результаты и обсуждение
При обследовании 2-я степень ожирения выявлена у 13 человек, 3-я степень – у 31 человека, 4-я степень – у 10 человек. ИМТ составил 35,2±6,2, избыток массы тела – 71±27%. Средний возраст начала набора веса 6,6±2,9 года, стаж заболевания – 8,4±3,3 года. По результатам лабораторного обследования было выявлено увеличение уровня ОХС, ТГ, ЛПНП, индекса атерогенности и уменьшение
Таблица 1
Характеристика биохимических, гормональных показателей и индексов чувствительности к инсулину у подростков с различной степенью ожирения
|
Показатели |
2-я степень |
3-я степень |
4-я степень |
Контроль |
р |
|
ОХС |
3,9±0,5 |
4,0±0,7 |
4,3±0,9 |
3,7±0,7 |
рК3=0,025, рК4=0,051 |
|
ТГ |
1,0±0,5 |
1,3±0,7 |
1,3±0,5 |
1,0±0,4 |
рК3=0,03, рК4=0,051 |
|
ЛПВП |
1,7±0,4 |
1,4±0,2 |
1,5±0,4 |
1,7±0,3 |
р23=0,011, рК3=0,000 |
|
ЛПНП |
1,7±0,8 |
2,1±0,7 |
2,2±0,9 |
1,6±0,4 |
рК3=0,003, рК4=0,029 |
|
Индекс атерогенности |
1,5±0,8 |
2,0±0,7 |
2,0±1,0 |
1,3±0,3 |
р23=0,06, рК3=0,000, рК4=0,008 |
|
Мочевая кислота |
0,3±0,2 |
0,3±0,04 |
0,3±0,1 |
0,33±0,1 |
Не достоверно |
|
HOMAR |
8,0±7,4 |
6,7±5,1 |
4,5±5,7 |
0,51±0,42 |
РК2=0,030, рК3=0,016 |
|
Caro |
0,5±0,7 |
1,3±2,1 |
2,5±3,5 |
3,63±4,41 |
р23=0,015, рК2=0,01, рК3=0,013 |
|
Quicki |
0,5±0,2 |
0,8±0,7 |
0,7±0,4 |
1,49±0,96 |
р23=0,007, рК2=0,00 рК3=0,016 |
Примечание: p1,2,3 – уровень статистической значимости между группами подростков с ожирением; к – контрольная группа.
уровня ЛПВП с увеличением степени ожирения (табл. 1), что соответствует многим литературным данным [2].
Продолжается научная дискуссия по поводу значений индексов ИР. В литературных источниках предлагаются различные значения HOMAR: >3,16 [15], >3,2 [1], >3,43 [14]. В нашей работе мы использовали значение индекса HOMAR>4 [4]. По результатам количественной оценки инсулинорезистент-ности у подростков с ожирением 2-й степени регистрировались наиболее выраженные изменения (табл. 1). С увеличением степени ожирения отмечалось снижение значений индексов ин- сулинорезистентности, что подтверждалось уровнем инсулина и С-пептида в сыворотке крови. Более чувствительными для оценки ИР у подростков с ожирением оказались индексы HOMAR и Caro. Динамика изменений концентрации инсулина, С-пептида и рассчитанных на их основе индексов чувствительности к инсулину свидетельствуют о снижении эндогенной секреции инсулина у подростков 3 и 4-й степеней ожирения, что характерно для выраженных нарушений углеводного обмена и характеризуют стадию предиабета. Таким образом, на сегодняшний день мы имеем патоморфоз нарушений углеводной интолерантности у подростков с ожирением, когда в возрастной группе до 15 лет имеются патофизиологические сдвиги (инсулино-резистентность и снижение эндогенной секреции инсулина), характерные для развития СД 2.
Считается, что абдоминальный тип ожирения говорит об ИР и гиперинсулинемии (ГИ). По результатам проведенной работы абдоминальное ожирение (ОТ>90 перцентили) наблюдалось у 21 юноши, из них у 15 (72%) ИР подтверждена расчетными показателями, и у 23 девушек, из которых у 12 (50%) также регистрировались высокие
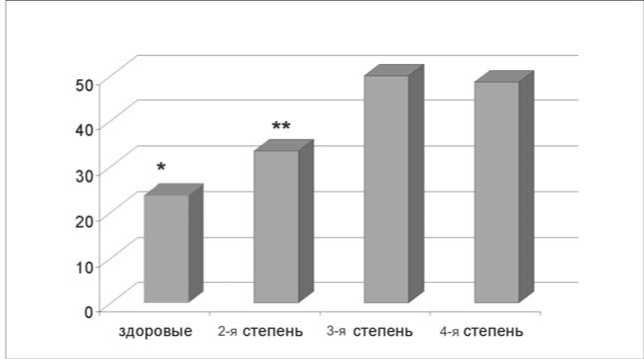
Рис. 1. Показатели лептинемии у подростков с различной степенью ожирения (** – р23=0,066, ** – р24=0,069, * – рК3=0,006, * – рК4=0,023)
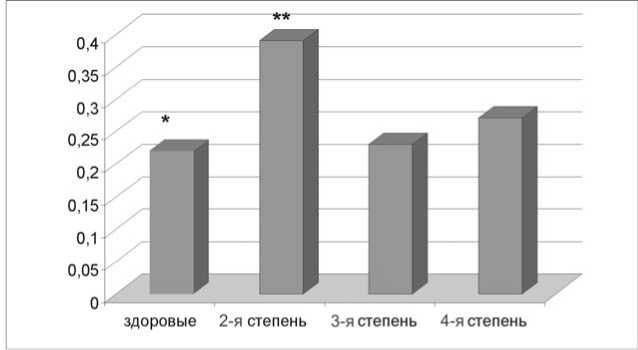
Рис. 2. Концентрация C-пептида в сыворотке крови у подростков с различной степенью ожирения (*р23=0,014, **рК2=0,009)
индексы ИР.
Существует мнение, что повышение концентрации лептина в сыворотке крови до 25–30 нг/мл связано с ожирением, а при более высоких его показателях развивается лептинорезистентность (ЛР). В результате, дальнейшее нарастание гиперлептинемии не сопровождает-
Таблица 2
Уровень инсулина в сыворотке крови на 0, 3 и 5-й минутах внутривенного глюкозотолерантного теста
|
Контроль |
2-я степень |
3-я степень |
4-я степень |
p |
|
|
ИРИ 0 мин |
3,07±2,5 |
38,52±37,79 |
30,93±22,22 |
17,31±20,92 |
p23=0,52, p24=0,067, p34=0,28 |
|
ИРИ 3 мин |
55,84±48,78 |
80,81±42,02 |
107,25±77,65 |
98,44±66,56 |
p23=0,9 |
|
ИРИ 5 мин |
52,3±33,28 |
82,43±48,06 |
92,46±70,15 |
109,55±79,37 |
p234>0,05, pк3<0,05, pк4<0,05 |
Примечание: p1,2,3 – уровень статистической значимости между группами подростков с ожирением; к – контрольная группа.
ся параллельным увеличением его концентрации в ткани мозга, следовательно, лептин утрачивает свое подавляющее влияние на синтез нейропептида Y, повышающего аппетит, и стимулирующее – на продукцию пептидов с аноректическим действием (кортикотропин-рили-зинг-гормон, меланоцитостимулирующий гормон), что, вероятно, играет дополнительную роль в развитии ожирения и формировании его осложнений за счет нарушения регуляции пищевого поведения [5]. В нашем исследовании ЛР развивалась уже при 2-й степени ожирения, увеличиваясь с повышением степени ожирения (рис. 1). Отмечена отрицательная корреляционная связь между уровнем кортизола и лептина (R=–0,387, p=0,041). Достоверной корреляции уровня лептинемии с полом выявлено не было, однако наметилась тенденция к более выраженной лептинемии (47,12±18,14 нг/мл) у подростков с абдоминальным типом ожирения в сравнении с подростками с глютео-феморальным типом распределения подкожножировой клетчатки (32,38±17,51 нг/мл, р=0,07).
Принадлежность к группе риска развития МС в подростковом возрасте оценивалась по критериям последнего консенсуса Международной диабетической федерации (IDF) 2007г. [9], наиболее частым из которых было абдоминальное ожирение (81%), дислипидемия (61%), артериальная гипертензия (33%) [7].
По результатам орального глюкозотолерантного теста у 6 (11%) подростков выставлен диагноз – нарушение гликемии натощак, у 4 (7%) пациентов – нарушение толерантности к глюкозе. Согласно данным внутривенного глюкозотолерантного теста (ВГТТ), выделяют пациентов с умеренными нарушениями углеводного обмена и выраженными нарушениями углеводного обмена (по выраженности коэффициентов k и Н) [13]. В проведенном нами исследовании по результатам ВГТТ у 10 человек выявлены умеренные нарушения углеводного обме-
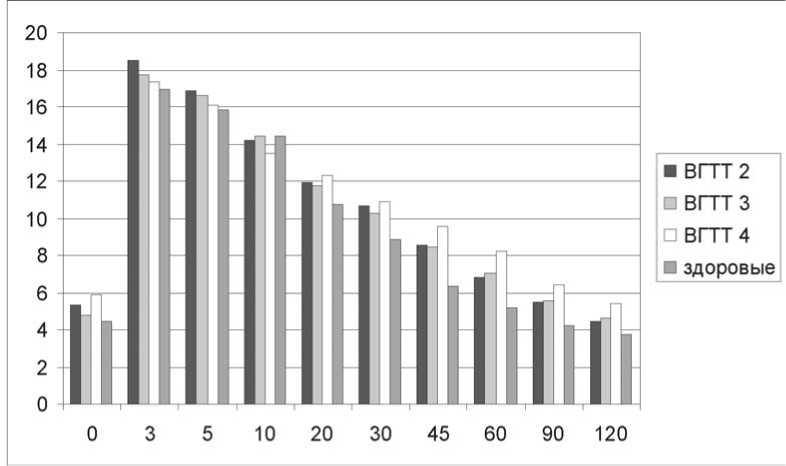
Рис. 3. Кинетика гликемии в ходе ВГТТ у подростков с различной степенью ожирения и в контрольной группе
на. В ходе теста исследовался уровень инсулина на 0, 3 и 5-й минутах (табл. 2).
Выявлено снижение уровня инсулина на 0-й минуте с увеличением степени ожирения, что подтверждается аналогичными изменениями концентрации С-пептида (p23=0,0001, p24=0,067).
По данным некоторых исследователей, гиперурике-мия отчетливо ассоциируется с АГ, гиперлипопротеине-мией, ожирением, ИР, ГИ и углеводными нарушениями диабетогенной направленности [3]. В нашем исследовании выявлен факт повышения уровня мочевой кислоты у пациентов с нарушением углеводного обмена (НУО), диагностированным по результатам ВГТТ (p=0,067), однако у подростков с нарушениями углеводного обмена, выделенных по данным ОГТТ, гиперурикемии зарегистрировано не было, что наводит на мысль, что ВГТТ выделяет пациентов с НУО по несколько другим механизмам, чем ОГТТ. В настоящее время роль и место нарушений в пуриновом обмене при МС освящается неоднозначно. Но все больше авторов склоняются к выводу, что пуриновая система является как активным, так и пассивным участником основных биохимических процессов в рамках аэробного гликолиза, а также пурины влияют на транспорт глюкозы, опосредуемый инсулином [8]. Таким образом, ВГТТ позволяет выделять различные механизмы на- рушений углеводного обмена, и что немаловажно, тест чувствителен к ранним метаболическим нарушениям, ассоциированным с инсулинорезистентностью и гипе-ринсулинемией.
Выводы
-
1. У подростков с ожирением выявлена высокая частота всех компонентов метаболического синдрома: абдоминальное ожирение (81%), инсулинорезистентность (61%), дислипидемия (39%) и артериальная гипертензия (33%).
-
2. Степень гормонально-метаболических нарушений возрастает с увеличением степени ожирения, однако индексы инсулинорезистентости максимально выражены у подростков с ожирением 2-й степени.
-
3. Ранними маркерами нарушений углеводного обмена по данным внутривенного глюкозотолерантного теста у подростков с ожирением являются: высокий уровень гликемии на 3-й минуте теста, уменьшение скорости снижения глюкозы и высокий постпрандиаль-ный уровень гликемии.
-
4. У подростков с ожирением 3 и 4-й степени регистрируется уменьшение секреции инсулина, а также более частое развитие нарушений углеводного обмена по данным ВГТТ и ОГТТ, что отражает современные тенденции к “омоложению” СД 2.
-
5. Данные ВГТТ в сравнении с ОГТТ позволяют дифференцировать нарушения углеводного обмена на ранних стадиях, выделять ведущий механизм (снижение секреции инсулина или нарушение темпов периферической утилизации глюкозы), а также стратифицировать подростков с ожирением в группы высокого риска развития СД 2.
Список литературы Гормонально-метаболический патоморфоз нарушений углеводного обмена у подростков с ожирением
- Витебская А.В., Васюкова О.В. Диагностика инсулинорезистентности у детей и подростков//Проблемы эндокринологии. -2006. -№ 52 (6). -С. 39-41.
- Дианов О.А., Гнусаев С.Ф., Иванов Д.А. и др. Нарушения функционального состояния сердечно-сосудистой системы и метаболизма у детей с ожирением//Педиатрия. -2007. -Т. 86, № 3. -С. 32-34.
- Мадянов И.В., Балаболкин М.И. Гиперурикемия как составляющая метаболического синдрома X//Проблемы эндокринологии. -1997. -№ 43 (6). -С. 30-32.
- Малявская С.И. Педиатрический метаболический синдром: состояние высокого риска//Педиатрия. -2010. -Т. 89, № 4. -С. 119-121.
- Одуд Е.А., Бородина О.В., Тимофеев А.В. Метаболический синдром у детей и подростков с ожирением: возможности диагностики, профилактики и лечения//Фарматека. -2003. -№ 8 (71). -С. 54-59.
- Сорвачева Т.Н., Петеркова В.А., Титова Л.Н. Ожирение у подростков//Лечащий врач. -2006. -№ 4. -С. 50-54.
- Рахимова Г.Н., Азимова Ш.Ш. Оценка частоты метаболического синдрома среди детей и подростков с ожирением согласно новым критериям международной диабетической ассоциации//Педиатрия. -2009. -Т. 88, № 6. -С. 14-17.
- Ровда Ю.И., Миняйлова Н.Н., Казакова Л.М. Некоторые аспекты метаболического синдрома у детей и подростков//Педиатрия. -2010. -Т. 89, № 44. -С. 111-115.
- Alberti K.G.M.M., Zimmet P.Z., Shaw J.E. The metabolic syndrome in children and adolescents//Lancet. -2007. -Vol. 369. -P. 2059-2061.
- American Association of Clinical Endocrinologists. Finding and recommendations from the AACE conference on insulin resistance syndrome (2002) [Электронный ресурс]. -URL: http://www.aace.cjm/pub/.
- Dabelea D., Hanson R.L., Bennett P.N. Increasing prevalence of type II diabetes in american indian children//Diabetologia. -1998. -Vol. 41. -P. 904-910.
- Drake A.J., Smith A., Betts P.R. Type II diabetes in obese white children//Arch. Dis. Child. -2002. -Vol. 86. -P. 207-208.
- Dreval A.V. European Congress of Endocrinology, 3-7 Sept. 2005: abstract book. -Goteborg, 2005. -P. 74; Abstr. P. 1-14.
- G. Cuartero B., G. Lacalle C., J. Lobo C. et al. The HOMA and QUICKI indexes and insulin and C peptide levels in healthy children. Cut off points to identify metabolic syndrome in healthy children//An. Pediatr. (Barc). -2007. -Vol. 66 (5). -P. 481-490.
- Keskin M. et al. Homeostasis model assessment is more reliable than the fasting glucose/insulin ratio and quantitative insulin sensitivity check index for assessing insulin resistance among obese children and adolescents//Pediatrics. -2005. -Vol. 115. -P. 500-503.
- Sinaiko A.R., Steinberger J., Moran A. et al. Relation of body mass index and insulin resistance to cardiovascular risk factors, inflammatory factors, and oxidative stress during adolescence//Circulation. -2005. -Vol. 111. -P. 1985-1991.
- Миняйлова Н.Н., Сундукова Е.Л., Ровда Ю.И. Гиперлептинемия и ее клинико метаболические ассоциации при синдроме инсулинорезистентности у детей и подростков//Педиатрия. -2009. -Т. 88, № 6. -С. 6-13.


