Характеристика грамотрицательной микрофлоры, выделенной из крови у кардиохирургических пациентов за пять лет
Автор: Самойлова Лариса Михайловна, Шилова Анна Николаевна, Горбатых Юрий Николаевич, Прохоров Станислав Николаевич, Струнин Олег Всеволодович, Новикова Марина Альбертовна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология, реаниматология и перфузиология
Статья в выпуске: 2 т.18, 2014 года.
Бесплатный доступ
В настоящее время грамотрицательные микроорганизмы признаются наиболее проблемными возбудителями. Мы изучили частоту развития бактериемии, обусловленную грамотрицательной микрофлорой, и ее чувствительность к антибиотикам у кардиохирургических пациентов. Проанализированы результаты исследования крови в течение 5 лет - с 2007 по 2011 г. За исследуемый период выделено 216 штаммов грамотрицательных бактерий. В структуре грамотрицательной флоры 57,4% (124) приходилось на энтеробактерии, 42,6% (92) - на неферментирующие глюкозу грамотрицательные бактерии. Преобладающими микроорганизмами, обнаруженными при исследовании крови у кардиохирургических пациентов, являются K. pneumoniae (25,5%) и P aeruginosa (15,3%). Для эмпирической терапии инфекций, вызванных K. pneumoniae, наиболее эффективно использование карбапенемов. В отношении P aeruginosa наибольшую активность из числа доступных для применения антибиотиков сохраняют пиперациллин/тазобактам, амикацин, нетилмицин. Назначать карбапенемы необходимо на основании результатов определения чувствительности микроорганизмов к антибиотикам.
Бактериемия, грамотрицательные возбудители, антибиотикорезистентность
Короткий адрес: https://sciup.org/142140600
IDR: 142140600 | УДК: 616.12-089-166-06:615:33
Текст научной статьи Характеристика грамотрицательной микрофлоры, выделенной из крови у кардиохирургических пациентов за пять лет
Актуальной проблемой хирургических стационаров остаются инфекционные осложнения, частота которых у кардиохирургических пациентов, по данным отечественных авторов, составляет 9–20%, от 4,9 до 30% за рубежом [1], у больных, находящихся в отделениях реанимации, бактериальные инфекции составляют до 51% [2]. Опасным для жизни осложнением является бактериемия, которая может свидетельствовать об инфекции кровотока, генерализации инфекции и развитии сепсиса или же быть результатом случайной контаминации. Кроме того, возможна транзиторная циркуляция бактерий под влиянием различных неблагоприятных факторов [3] – в этом случае больной также подвергается опасности, так как продолжающаяся инфузионная терапия, ослабленный иммунитет, наличие имплантированных при операции материалов могут привести к генерализации инфекции.
В настоящее время грамотрицательные микроорганизмы признаются наиболее проблемными патогенами, поэтому важно знать частоту их обнаружения в клинике, а также спектр чувствительности к антибиотикам даже в тех случаях, когда признаков генерализации еще нет [4].
Цель исследования – изучить частоту развития бактериемии, обусловленную гра- мотрицательной микрофлорой, структуру выделенных патогенов и спектр чувствительности к антибиотикам преобладающих видов микроорганизмов у кардиохирургических пациентов.
Материал и методы
Проанализированы результаты исследования крови за 5-летний период – с 2007 по 2011 г. Грамотрицательная микрофлора выделена у 178 пациентов, из них 62 человека с ишемической болезнью сердца (ИБС), 40 человек с приобретенными пороками сердца (ППС), 22 пациента – с сосудистой патологией, нарушениями ритма сердца, трансплантацией почки, после нейрохирургических операций. Также грамотрицатель-ная микрофлора обнаружена при исследовании крови у 54 больных с врожденными пороками сердца (ВПС), из них 46 – дети, 8 – взрослые. Распределение по возрасту: взрослые пациенты (132 человека) – от 18 до 80 лет, средний возраст 56,9±1,28 года; дети первого года жизни (41 пациент) – средний возраст 3,37±0,46 мес.; от 1 до 3 лет (4 человека) – средний возраст 1,33±0,05 мес.; один пациент – 15 лет.
Изучалась частота обнаружения гра-мотрицательной микрофлоры и ее чувствительность к антибиотикам. В исследование включались грамотрицательные микроорганизмы, выделенные у пациентов с врожденными и приобретенными пороками сердца. Штаммы, выделенные повторно у одного пациента, из анализа исключались.
Бактериологическое исследование крови проводили с использованием автоматизированной системы BacT/Alert 3D (BioMerieux, Франция), VersaTrek (Thermofisher (TREK Diagnostic Systems) США). Идентификацию микроорганизмов и определение их чувствительности к антибиотикам выполняли с использованием анализаторов ATB Expression (BioMerieux, Франция), Phoenix (BD, США) и диско-диффузионным методом (диски с антибиотиками BioRad (США), среда Мюллера – Хинтона (BioMerieux, Франция)).
Для характеристики чувствительности микроорганизмов к антибиотикам применяли термин «чувствительные»; «умеренно резистентные» и «резистентные» штаммы объединяли в группу «нечувствительные» [5]. Выявление продукции бета-лактамаз расширенного спектра (БЛРС) энтеробактериями проводили в соответствии с методическими рекомендациями по определению чувствительности микроорганизмов к антибактериальным препаратам (МУК 4.21890-04.2004).
Статистическую обработку данных проводили с использованием программы STATISTICA 6.0. Статистическую значимость различий тестировали с помощью критерия Фишера. Различия считали статистически значимыми при p<0,05.
Результаты
В течение 5-летнего исследования гемокультуры у кардиохирургических больных выделено 903 штамма различных микроорганизмов, из них 216 штаммов (23,9%) составила грамотрицательная микрофлора – от 18,6 до 31,7% в среднем в год. В структуре грамотрицательной флоры 57,4% (124) приходилось на энтеробактерии, 42,6% (92) – на неферментирующие глюкозу грамотрицательные бактерии (группа НГОБ).
За пятилетний период (2007–2011 гг.) выделялись от 28 до 73 штаммов грамотрицательных микроорганизмов в год. Доля энтеробактерий колебалась от 46,4 до 62,5%, гра-мотрицательная флора группы НГОБ составила от 37,5 до 53,6%. Частота обнаружения грамотрицательных бактерий, выделявшихся из крови, представлена в табл. 1.
Преобладающей микрофлорой за исследуемый период являлась K. pneumoniae , составив 25,5% от общего количества грамотрицательных бактерий. Частота ее обнаружения колебалась незначительно – 28,6–32,5% в 2007– 2010 гг., в 2011 г. отмечена тенденция к снижению ее доли среди всех грамотрицательных микроорганизмов до 19,2%.
Другие грамотрицательные бактерии семейства Enterobacteriaceae выделяли реже: Enterobacter spp. составил 9,3% (20), частота его обнаружения колебалась от 2,2 (1) до 13,7% (10 штаммов); E. coli составила 6,0% (13) – от 3,5 (1) до 8,5% (4) в год. Serratia spp. регистрировалась от 5,0 до 12,3% за исследуемый период (от 2 до 9 случаев в год), в среднем Serratia spp. составила 12,1% (26): из них 5,6% (12) – S. marcescens, 6,5% (14) – S. liquefaciens. Также в единичных случаях выделялись Proteus spp., M. morganii. Сальмонелла (Salmonella enteritidis) была выделена у пациента с расслоением аорты.
Преобладающим видом в структуре выделенных энтеробактерий являлась K. pneumoniae . В течение 4 лет (2007–2010 гг.) на ее долю приходилось до 61,5%, тенденция к снижению отмечена в 2011 г. (34,1%). За 5-летний период доля K. pneumoniae составила 44,4% (рис. 1).
В группе неферментирующих грамотрицательных бактерий частота обнаружения преобладающей в настоящее время P. aeruginosa нарастала постепенно от одного случая (3,5%) в 2007 г. до 18 штаммов (24,7%) к 2011 г. (p = 0,01, критерий Фишера) (табл. 1). В среднем за 5-летний период частота обнаружения P. aeruginosa составила 15,3% от числа всех грамотрицательных бактерий (табл. 1).
Также нарастала доля синегнойной палочки в структуре грамотрицательных бактерий группы НГОБ: от 8,3% в 2007 г. до 46,7% в 2010 г. (p = 0,037, критерий Фишера), тенденция к увеличению сохранялась и в 2011 г. (56,3%), достоверность различия при сравнении с 2007 г. возросла (p = 0,0043). В структуре грамотрицательных бактерий группы НГОБ за 5-летний период P. aeruginosa в среднем составила 35,9% (рис. 2).
Ацинетобактер за исследуемый период выделялся у 14 пациентов, что составило 6,5% среди всех грамотри-цательных бактерий. Преобладающий вид – Acinetobacter baumannii – 5,4% (11). Частота его обнаружения достоверно снизилась с 17,9% в 2007 г. до 2,5% в 2010 г. (p = 0,039; критерий Фишера) (табл. 1), в 2011 г. не регистрировался. Также достоверно снизилась доля ацинетобактера в структуре грамотрицательных бактерий группы НГОБ с 41,7% в 2007 г. до 6,7% в 2010 г. (p = 0,043, критерий Фишера).
Прочие грамотрицательные бактерии группы НГОБ представлены Stenotrophomonas maltophilia – выделена у 14 пациентов (6,5%), реже выделяли Burkholderia cepacia – 3,2% (7), Ralstonia pickettii – 1,9% (4), Pseudomonas spp. – 3,2% (7) (табл. 1). Структура выделенных грамотрицательных бактерий группы НГОБ представлена на рис. 2.
Таким образом, преобладающими грамотрицатель-ными микроорганизмами, обнаруженными при исследовании крови у кардиохирургических пациентов, являются K. pneumoniae 25,5% (55) и P. aeruginosa 15,3% (33).
Инфекционные осложнения, сопровождавшиеся бактериемией, развивались преимущественно у пациентов, находившихся в отделении реанимации, после сложных кардиохирургических вмешательств. Рост грамотрицатель-ной микрофлоры при исследовании крови был выявлен у 18 пациентов с пневмонией, что составило 10,1%. У 9 больных (5,1%) течение послеоперационного периода осложнилось медиастинитом, еще у 11 пациентов (6,2%) отмечено нагноение послеоперационной раны. Воспалительные процессы брюшной полости зарегистрированы у 11 пациентов, из них у 8 человек (4,5%) диагностирован перитонит, у 3 (1,7%) – некротический энтероколит. Грамот-рицательная микрофлора была выделена при активации
Таблица 1
Частота обнаружения грамотрицательных микроорганизмов, выделенных из крови кардиохирургических пациентов за 5-летний период
* p = 0,01 – различия достоверны при сравнении 2007 и 2011 гг.; # p = 0,039 – при сравнении 2007 г.
с 2010 г., критерий Фишера
|
Микрофлора, n (%) |
2007 |
2008 |
2009 |
2010 |
2011 |
За 5 лет |
|
Энтеробактерии |
||||||
|
Klebsiella pneumoniae sp. pneumoniae |
8 (28,6) |
12 (25,5) |
8 (28,6) |
13 (32,5) |
14 (19,2) |
55 (25,5) |
|
Escherichia coli |
1 (3,5) |
4 (8,5) |
2 (7,1) |
3 (7,5) |
3 (4,1) |
13 (6,0) |
|
Enterobacter spp. |
3 (10,7) |
1 (2,2) |
1 (3,6) |
5 (12,5) |
10 (13,7) |
20 (9,2) |
|
прочие |
4 (14,3) |
12 (25,5) |
2 (7,1) |
4 (10) |
14 (19,2) |
36 (16,7) |
|
всего |
16 (57,1) |
61,7 (29) |
46,4 (13) |
62,5 (25) |
56,2 (41) |
57,4(124) |
|
Группа НГОБ |
||||||
|
Pseudomonas aeruginosa |
1 (3,5) |
(3) 6,4 |
14,3 (4) |
17,5 (7) |
24,7%* (18) |
15,3 (33) |
|
Acinetobacter baumannii |
5 (17,9) |
(4)8,5 |
3,5 (1) |
2,5% # (1) |
(0) |
5,1(11) |
|
Stenotrophomonas maltophilia |
1 (3,5) |
(3) 6,4 |
17,9 (5) |
(7,5%) (3) |
2,7 (2) |
6,5 (14) |
|
прочие |
5 (17,9) |
(8) 17 |
(5) 17,9 |
(4) 10 |
(12) 16,4 |
(34) 15,7 |
|
всего |
12 (42,9) |
(18) 38,3 |
(15) 53,6 |
(15) 37,5 |
(32) 43,8 |
(92) 42,6 |
|
Грамотрицательная микрофлора |
28 |
47 |
28 |
40 |
73 |
216 |
Таблица 2
Штаммы K. pneumoniae по степени чувствительности к антибиотикам (n = 56)
|
Антибиотик |
Степень чувствительности, % |
|||
|
Ч |
УР |
Р |
НЧ |
|
|
Амикацин |
74,6 |
3,6 |
21,8 |
25,4 |
|
Амоксициллин/клавуланат |
20,5 |
9,1 |
70,4 |
79,6 |
|
Гентамицин |
56,3 |
0,0 |
43,7 |
43,7 |
|
Имипенем |
100,0 |
0,0 |
0,0 |
0,0 |
|
Меропенем |
87,5 |
7,1 |
5,3 |
12,4 |
|
Нетилмицин |
47,5 |
7,5 |
45,0 |
52,5 |
|
Пиперациллин/тазобактам |
22,2 |
22,2 |
55,6 |
77,8 |
|
Тикарциллин/клавуланат |
27,8 |
5,5 |
66,7 |
72,2 |
|
Цефепим |
10,7 |
3,6 |
85,7 |
89,3 |
|
Цефопреазон/сульбактам |
25,7 |
28,6 |
45,7 |
74,3 |
|
Цефотаксим |
10,4 |
0,0 |
89,6 |
89,6 |
|
Цефокситин |
66,4 |
0,0 |
33,3 |
33,3 |
|
Цефтазидим |
9,1 |
0,0 |
90,9 |
90,9 |
|
Цефтриаксон |
18,7 |
2,1 |
79,2 |
81,3 |
|
Ципрофлоксацин |
28,7 |
0,0 |
71,9 |
71,9 |
инфекционного эндокардита у 12 (6,7%) пациентов преимущественно с приобретенными пороками сердца. Инфекция мочевыводящих путей развилась у 3 (1,7%) пациентов. Сепсис с различным сочетанием очагов воспаления зарегистрирован у 31 пациента, что составило 17,4%.
Следует отметить, что клинически значимая микрофлора обнаружена при бактериологическом исследовании крови как у больных с инфекционными осложнениями, так и без генерализации инфекции. В ряде случаев выделенная микрофлора расценивалась как транзиторная бактериемия у пациентов с длительным субфебрилитетом – 7 человек (3,9%), полиорганной недостаточностью (ПОН) – 19 человек (10,7%), у 57 (32%) пациентов осложнений не было.
Частота развития инфекционных осложнений у взрослых пациентов составила 58,3% (77 человек) от числа пациентов, выделявших грамотрицательную микрофлору при исследовании крови. Инфекционные осложнения, обусловленные грамотрицательной микрофлорой, регистрировались у детей первого года жизни – показатель составил 43,9% (18 человек). У детей других возрастных групп бактериемия регистрировалась редко и расценивалась как транзиторная.
Считается, что основу лечения инфекций, вызываемых представителями семейства Enterbacteriaceae , составляют бета-лактамные антибиотики, однако в стационарах различного профиля все чаще регистрируются резистентные к ним штаммы. В нашем исследовании среди выделенных штаммов K. pneumoniae лишь незначительная часть была чувствительна к цефалоспоринам III–IV поколения – от 9,1 до 18,7%. Так, к цефотаксиму были резистентны 89,6% штаммов, к цефтриаксону нечувствительны 81,3%; к цефтазидиму резистентны 90,9% выделенных K. pneumoniae , к цефепиму – 85,7% (табл. 2).
Рис. 2.
Структура грамотрица-тельных бактерий НГОБ за 2007–2011 гг. (n = 92).
Рис. 1.
Структура грамотрицательных бактерий семейства Enterbacteriaceae за 2007–2011 гг. (n = 124).
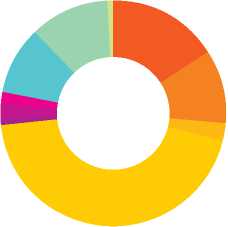
Enterobacter 16,1%
E. coli 10,5%
K. oxytoca 2,4%
K. pneumoniae 44,4%
M. morganii 0,8%
-
■ Proteus spp. 2,4%
-
■ Pantoea spp. 1,6%
-
■ S. liquefaciens 9,7%
-
■ S. marcescens 11,3%
Salmonella enteritidis 0,8%
-
■ Acinetobacter baumannii 10,9%
-
■ Pseudomonas aeruginosa 35,9%
Stenotrophomona s maltophilia 15,2%
-
■ Другие НГОБ 38,0%
Препаратами, альтернативными бета-лактамам, являются аминогликозиды и фторхинолоны, их активность в отношении K. pneumoniae также была различной. К аминогликозидам сохраняли чувствительность от 47,5 до 74,5% штаммов. К амикацину сохраняли чувствительность 74,5% штаммов, к гентамицину – 56,3% штаммов, к нетил-мицину – около половины штаммов (47,5%). Анализ активности фторхинолонов показал, что большинство штаммов K. pneumoniae нечувствительны к ципрофлоксацину (71,9%).
Таким образом, наиболее низкая активность зарегистрирована у цефалоспоринов III–IV поколения: к ним резистентны от 81,3 до 90,9% выделенных штаммов K. pneumoniae , в большинстве случаев (74,5% – 41 штамм) резистентность была обусловлена продукцией бета-лак-тамаз расширенного спектра. Известно, что штаммы-продуценты БЛРС нередко обладают перекрестной резистентностью к другим группам антибиотиков. Нами выявлены 9 штаммов (16,4%) K. pneumoniae , чувствительных только к имипенему и меропенему.
Активность карбапенемов против выделенных штаммов K. pneumoniae сохранялась на высоком уровне: все штаммы (100%) были чувствительны к имипенему и 87,3% к меропенему (табл. 1). В нашем исследовании выявлены 7 штаммов (12,7%) K. pneumoniae, нечувствительных к меро-пенему, из них 4 (7,1%) были резистенитными, 3 (5,3%) – умерено резистентны, все чувствительны к имипенему. В трех случаях (5,5%) K. pneumoniae была чувствительна только к имипенему. Еще у двоих пациентов (3,6%) зарегистрирована чувствительность к амикацину, нетилмицину и ципрофлоксацину. По одному штамму были чувствительны кроме имипенема к амикацину (1,8%), в другом случае – к ципрофлоксацину (1,8%).
Следует отметить, что наряду с резистентными штаммами у пациентов выделялись штаммы, чувствительные ко всем тестируемым антибиотикам: такие микроорганизмы обнаружены у 3 пациентов, что составило 5,5%.
Исследованные штаммы P. aeruginosa характеризовались значительной частотой резистентности к различным классам антибиотиков. Высокая активность в отношении P. aeruginosa зарегистрирована только у полимиксина В – 100% и колистина – 96% (табл. 3). Среди других групп антибиотиков наибольшей активностью обладали аминогликозиды. Так, к амикацину были чувствительны 65,6% штаммов, к нетилмицину – 65,2% . Несколько ниже активность гентамицина, к нему чувствительны 52,9% штаммов. К ципрофлоксацину чувствительны 50% штаммов P. aeruginosa . В нашем исследовании преобладали штаммы, резистентные к цефтазидиму (63,7%). Кроме того зарегистрирована значительная частота обнаружения штаммов, нечувствительных к карбапенемам: к имипенему – 68,7%, меропенему – 60,6%. К цефепиму были чувствительны 42,4% выделенных штаммов, цефопреазону/сульбактаму – 52% штаммов. К пиперациллину/тазобактаму сохранялась чувствительность у 73,7% выделенных штаммов.
Обсуждение
Внутрибольничные инфекции кровотока остаются актуальной проблемой. В настоящее время ситуация не улучшается, что обусловлено наличием ряда факторов риска. Важным фактором риска является возраст: так, у пациентов старше 65 лет частота развития септицемии
Таблица 3
Штаммы P. aeruginosa по степени чувствительности к антибиотикам (n = 33)
|
Антибиотик |
Степень чувствительности, % |
|||
|
Ч |
УР |
Р |
НЧ |
|
|
Амикацин |
65,6 |
6,3 |
28,1 |
34,4 |
|
Азтреонам |
59,1 |
13,6 |
27,3 |
40,9 |
|
Гентамицин |
52,9 |
5,9 |
41,2 |
47,1 |
|
Имипенем |
31,3 |
3,1 |
65,6 |
68,7 |
|
Колистин |
96,0 |
4,0 |
0,0 |
4,0 |
|
Левофлоксацин |
28,7 |
0,0 |
71,4 |
71,4 |
|
Меропенем |
39,4 |
6,1 |
54,5 |
60,6 |
|
Нетилмицин |
65,2 |
4,3 |
30,4 |
34,7 |
|
Пиперациллин/тазобактам |
73,7 |
0,0 |
26,3 |
26,3 |
|
Полимиксин В |
100,0 |
0,0 |
0,0 |
0,0 |
|
Тикарциллин/клавуланат |
25,0 |
25,0 |
50,0 |
75,0 |
|
Цефепим |
42,4 |
6,1 |
51,5 |
57,6 |
|
Цефопреазон/сульбактам |
52,0 |
4,0 |
44,0 |
48,0 |
|
Цефтазидим |
36,4 |
6,0 |
57,6 |
63,6 |
была в 3 раза выше. Другая возрастная группа риска по инфекциям крови – дети и новорожденные. Частота развития инфекций крови на 1-м году жизни в 2 раза выше, чем в других возрастных группах [6]. Также важным фактором риска является пребывание в лечебных учреждениях различного профиля, это значимо как для детей, так и пожилых пациентов.
Для пациентов хирургических клиник фактором риска является оперативное вмешательство, так как при этом снижается пороговый уровень бактериальной нагрузки, способный привести к инфекционным осложнениям [7], а имплантация искусственных материалов способствует адгезии микроорганизмов. Кроме того, искусственное кровообращение увеличивает риск развития инфекционных осложнений в 20 раз [8].
По данным различных исследований, частота обнаружения грамотрицательной микрофлоры значительно варьировала – от 21,6% [9] до 50% [10–12]. В нашем исследовании за 5-летний период грамотрицательная микрофлора составила 23,9% (от 18,6 до 31,7%).
По многолетним наблюдениям российских исследователей [5], основными грамотрицательными возбудителями в российских ОРИТ по-прежнему остаются P. aeruginosa , A. baumannii , K. pneumoniae , E. coli , Enterobacter spp. , Proteus spp . В нашем исследовании преобладающей грамотрицательной микрофлорой являлись K. pneumoniae 25,5% (55) и P. aeruginosa 15,3% (33). Реже из крови у кардиохирургических пациентов выделяли E. coli , Enterobacter spp. Грамотрицательные бактерии группы НГОБ выделялись реже у детей первого года жизни – так, рост P. aeruginosa зарегистрирован только в 2010 г. [13].
В настоящее время грамотрицательные микроорганизмы признаются наиболее проблемными [4], что обусловлено возросшей частотой обнаружения, повышением их роли в развитии инфекционных осложнений в стационарах различного профиля. Актуальным вопросом является частое формирование резистентных штаммов, кроме того резистентность к антибактериальным препаратам обеспечивает выживаемость внутрибольничных возбудителей [6].
Пациенты кардиохирургического профиля нередко поступают в клинику из стационаров, где проводилась антибактериальная терапия, в том числе антибиотиками широкого спектра действия, происходит колонизация организма госпитальными штаммами микроорганизмов. Поступая в клинику, такие пациенты являются источником резистентных штаммов, возникают проблемы с выбором антибактериальных препаратов.
В нашем исследовании частота обнаружения штаммов-продуцентов БЛРС составила 74,5%, что несколько выше по сравнению с результатами более ранних исследований, проведенных в нашей клинике [14]. По другим данным, распространенность штаммов, продуцирующих бета-лактамазы расширенного спектра, составила от 92,5 до 95,7% [4] и от 64,2 до 100% [5].
Доказанной клинической эффективностью обладают только карбапенемы, что определяет выбор этих антибиотиков для лечения жизнеугрожающих состояний [15]. По нашим данным, сохраняется высокая активность кар-бапенемов в отношении K. pneumoniae , что согласуется с результатами отечественных и зарубежных исследователей [5], однако нами также отмечено появление штаммов K. pneumoniae , резистентных к карбапенемам. В нашем исследовании у 5,3% пациентов K. pneumoniae была чувствительна только к имипенему.
Природная устойчивость P. aeruginosa к большинству антибактериальных препаратов – проблема многих лечебных учреждений, так как возникают трудности с назначением адекватной терапии, более того, резистентность обеспечивает выживание внутрибольничных возбудителей [6]. По результатам исследования НИИ антимикробной химиотерапии г. Смоленска, наибольшей активностью обладали имипенем и меропенем, частота резистентности к ним составила 39 и 41,4% [5]. Исследователями отмечены значительные отличия в активности исследованных антибиотиков в различных стационарах, что свидетельствует о необходимости получения локальных данных о резистентности грамотрицательных нозокомиальных возбудителей. По данным отечественных работ, выявлен рост резистентности грамотрицательной микрофлоры к антибиотикам [4].
Нами зарегистрирована невысокая активность кар-бапенемов в отношении P. aeruginosa , которая составила 31,3% к имипенему и 39,4% к меропенему. К цефепиму были чувствительны 42,4%, к цефтазидиму – 36,4% штаммов. К другим антибактериальным препаратам отмечена более высокая чувствительность: 52% к цефопреазону/ сульбактаму, 50% к ципрофлоксацину, 65,6 и 52,9% к амикацину и гентамицину. Наши показатели в той или иной степени согласуются с данными отечественных исследователей, что еще раз подтверждает тезис о необходимости собственных исследований, в том числе в различных отделениях клиники, так как показатели отделения реанимации, в которых сосредоточены пациенты в критическом состоянии, могут значительно отличаться [4, 5].
Таким образом, преобладающими грамотрицатель-ными микроорганизмами, обнаруженными при исследовании крови у кардиохирургических пациентов, являются K. pneumoniae 25,5% (55) и P. aeruginosa 15,3% (33).
Для эмпирической терапии инфекций, вызванных K. pneumoniae , наиболее эффективно использование кар-бапенемов, однако регистрируются единичные карбапе-нем-устойчивые штаммы, что подтверждает необходимость дальнейшего мониторинга, особенно в отделениях интенсивной терапии.
В отношении P. aeruginosa ситуация сложнее, так как выявляется значительное количество резистентных штаммов, в том числе штаммов с множественной устойчивос- тью. Наибольшую активность из числа доступных для применения антибиотиков сохраняют пиперациллин/тазо-бактам, амикацин, нетилмицин. Для назначения карбапе-немов необходимо учитывать результаты определения чувствительности микроорганизмов к антибактериальным препаратам.


