Характеристика экспрессии маркеров пролиферации и регуляции апоптоза в зависимости от характера дисрегенераторных изменений в эпителии бронхов при плоскоклеточном раке легкого
Автор: Панкова Ольга Владимировна, Перельмутер Владимир Михайлович, Савенкова Ольга Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (41), 2010 года.
Бесплатный доступ
У 49 больных, оперированных по поводу плоскоклеточного рака, исследовались фрагменты ткани удаленного легкого вне опухоли. По результатам микроскопического исследования выявлены различные варианты дисрегенераторных из- менений. Изучались факторы, отражающие уровень пролиферативной активности и участвующие в апоптозе (Ki67, p53, bcl-2) в динамике гиперпластических, пренеопластических и неопластических изменений эпителия бронхов. Показано, что увеличение числа клеток, экспрессирующих Ki67, p53 и bcl-2 в последовательности базально-клеточная гиперплазия - плоскоклеточная метаплазия - дисплазия I (пренеоплазия) - дисплазия II-III (неоплазия), не зависит от индивидуальных особенностей, поскольку наблюдается при сочетании разных форм дисрегенераторных изменений в бронхиальном эпи- телии одного больного.
Бронхиальный эпителий, дисрегенераторные изменения, пролиферативная активность, апоптоз
Короткий адрес: https://sciup.org/14055677
IDR: 14055677
Текст научной статьи Характеристика экспрессии маркеров пролиферации и регуляции апоптоза в зависимости от характера дисрегенераторных изменений в эпителии бронхов при плоскоклеточном раке легкого
Канцерогенез в бронхиальном эпителии – сложный многоступенчатый процесс, требующий последовательного накопления генетических и молекулярных отклонений и идущий параллельно с морфологическими изменениями от нормального эпителия к пренеоплазии, а затем к неоплазии [9]. Риск и скорость прогрессирования пренеопластических поражений в инвазивный рак, а также механизм их прогрессии или регрессии еще не полностью понятны.
В основе появления и прогрессии неоплазии лежит генетическая нестабильность. Она базируется на нарушениях механизмов репарации ДНК, изменениях регуляции клеточного цикла и апоптоза. Потеря контроля над процессами пролиферации, дифференцировки и гибели клеток коррелирует с развитием дисплазии (неоплазии), увеличением степени ее тяжести и является известным фактом, описанным в эпителии многих органов [1, 3–6]. По данным исследования M. Lai (2009), у больных с бронхиальной интраэпителиальной неоплазией выявлена аномальная пролиферация, заключающаяся в «гиперэкспрессии» Ki67 [8]. Мнения о роли молекулярных маркеров р53 и bcl-2 в динамике развития пренеопластических процессов противоречивы. Ряд авторов считают, что последовательность метаплазия–дисплазия– карцинома в легком ассоциируется с высокой пролиферативной активностью и не зависит от экспрессии p53 и bcl-2 [11]. По мнению Z. Vukobrat-Bijedic еt а1. (2007), экспрессия р53 в «предзлокачественных поражениях» может рассматриваться как индикатор канцерогенеза [12]. В преинвазивных изменениях высокая экспрессия p53 отмечается при умеренной дисплазии в 25 %, при СIS – в 75 % случаев [9]. Процент клеток, экспрессирующих bcl-2, также увеличивается с тяжестью преинвазивных изменений от легкой к тяжелой степени [7]. По результатам работ ряда исследователей экспрессия белка р53 в клетках опухоли является неблагоприятным прогностическим фактором, а bcl-2 – благоприятным [2, 7].
Цель исследования – изучение параметров пролиферативной активности и апоптоза в динамике гиперпластических, пренеопласти-ческих и неопластических изменений эпителия бронхов.
Материал и методы
В исследование вошли 49 больных в возрасте от 46 до 73 лет, прооперированных по поводу плоскоклеточного рака легкого. Материалом для морфологического исследования явились фрагменты ткани удаленного легкого вне опухоли. Гистологический материал фиксировался в нейтральном формалине, проводился по стандартной методике и заливался в парафин. Срезы толщиной 5–6 мкм окрашивались гематоксилином и эозином. Морфологическое исследование осуществлялось с помощью светового микроскопа «Axiostar plus» («К. Zeiss», Германия).
Иммуногистохимическое исследование проводилось по общепринятой методике. Демаскировку антигенов осуществляли путем инкубации срезов в микроволновой печи в течение 20 мин в цитратном буфере или ЭДТА-8. В качестве хромогена применяли диаминобензидин (ДАБ). Визуализацию реакции антиген-антитело осуществляли с помощью системы «Super Sensitive Polymer – HRP Detection System» (Bio Genex, США). Использовались моноклональные антитела к белкам р53 (clon CM1, рабочее разведение 1:150, «Novocastra»), выявляющие «дикий» и «мутантный» варианты протеина, bcl-2 (clon bcl-2/100/D5, рабочее разведение 1:80, «Novocastra») и Ki67 (clon MIB-1, RTU, «Daco»). Результаты иммуногистохимической реакции оценивали по процентному содержанию положительно окрашенных клеток в разных участках препарата, соответствующих различным морфологическим процессам – гиперплазии бокаловидных клеток (ГБК), базально-клеточной гиперплазии (БКГ), плоскоклеточной метаплазии (ПМ), пренеоплазии, неоплазии. Обработка полученных результатов выполнялась с помощью пакета программ «Statistica 6.0». Использовались параметрические и непараметрические критерии (критерий t-Стьюдента, критерий Манна-Уитни).
Результаты и обсуждение
По результатам микроскопического исследования гистологического материала удаленного легкого в крупных и средних бронхах выявлены различные варианты дисрегенераторных изменений. Группы наблюдения формировали, используя два подхода. При одном – определяющим признаком, на основании которого образовывали группы, был морфологический процесс, имевший более выраженную степень тяжести. Например, если в слизистой одновременно определялись БКГ, ПМ и неоплазия (Д II–III), то случай относили к группе неоплазий. На основании этого принципа пациенты были разделены на пять групп (табл. 1).
У 4 больных (1 группа) морфологическая картина соответствовала ГБК. У пациентов второй группы отмечались признаки базальноклеточной гиперплазии. В третьей группе у 10 пациентов ПМ имела очаговый характер и наблюдалась на фоне базально-клеточной гиперплазии. У 6 больных ПМ была диффузной. Четвертая группа (Д I) характеризовалась признаками дисплазии I степени, которая в различных вариантах сочеталась с базально-клеточной гиперплазией и/или метаплазией. В пятой группе (Д II–III) у 3
Таблица 1
|
Группа |
Характер дисрегенераторного процесса |
|
1. ГБК |
Гиперплазия бокаловидных клеток – 4 больных |
|
2. БКГ |
Базально-клеточная гиперплазия – 19 больных |
|
3. ПМ |
Плоскоклеточная метаплазия на фоне базально-клеточной гиперплазии или без таковой – 16 больных |
|
4. Д I |
Дисплазия I степени в различных вариантах сочетания с БКГ и/или метаплазией – 3 больных |
|
5. Неоплазия (Д II–III) |
Дисплазия II–III степени в различных вариантах сочетания с БКГ и/или метаплазией – 7 больных |
Таблица 2
Распределение больных в зависимости от морфологической характеристики эпителия
|
Группы |
Варианты дисрегенераторных изменений эпителия |
|
1 |
Нормальный (Н) бронхиальный эпителий – 11 больных |
|
2 |
Гиперплазия бокаловидных клеток – 4 больных |
|
3 |
Базально-клеточная гиперплазия – 33 больных |
|
4 |
Плоскоклеточная метаплазия – 25 больных |
|
5 |
Дисплазия I степени – 3 больных |
|
6 |
Неоплазия (дисплазия II–III степени) – 7 больных |
Распределение больных по группам в зависимости от характера дисрегенераторного процесса
пациентов выявлена дисплазия II степени, у 4 – III степени. Во всех случаях дисплазии II степени и в одном – III степени дисплазия сочеталась с базально-клеточной гиперплазией и/или плоскоклеточной метаплазией. У 3 больных с тяжелой дисплазией она носила диффузный характер.
Поскольку у каждого пациента в разных участках слизистой бронха одновременно наблюдались неодинаковые дисрегенераторные процессы, представляло интерес сравнить экспрессию показателей пролиферативной активности и апоптоза в клетках каждого варианта дисрегенераторных изменений, независимо от наличия или отсутствия других форм патологии. Например, для оценки параметров БКГ в одну группу объединяли все случаи с наличием этого варианта дисрегенераторных изменений без учета других форм патологии (плоскоклеточной метаплазии или дисплазии). Исходя из такого подхода, были сформированы следующие группы (табл. 2).
Исследование факторов, отражающих уровень пролиферативной активности и участвующих в апоптозе (Ki67, p53, bcl-2) в группах больных, сформированных по степени тяжести морфологического процесса, выявило следую- щую картину. Показатель пролиферативной активности постепенно возрастал по мере прогрессирования дисрегенераторных процессов: ГБК – БКГ – ПМ – неоплазия (рис. 1).
У больных первой (ГБК) и второй (БКГ) групп количество меченых ядер составляло 11,1 ± 3,6 % и 16,9 ± 7,2 % соответственно (р1–2=0,14). Резко возрастал показатель пролиферативной активности в группе больных с ПМ – 49,8 ± 7,1 % меченых ядер (р2–3=0,0001). В группе пациентов с Д I значение данного параметра не отличалось от группы ПМ. При неоплазии количество Ki67-экспрессируемых клеток достигало 77,0 ± 8,5 % (р4–5=0,006).
Подобными оказались различия пролиферативной активности и в группах, сформированных по морфологическим типам эпителия независимо от степени выраженности дисрегенераторных процессов. Ki67-положительные клетки встречались в нормальном респираторном эпителии и в очагах бокаловидно-клеточной гиперплазии, но характеризовались низкой экспрессией – 13,4 ± 6,1 % и 10,7 ± 4,6 % соответственно (р1–2=0,2). Однако в участках базально-клеточной гиперплазии уровень экспрессии Ki67 резко возрастал до 28,7 ± 10,9 % (р1–3=0,002). Одинаково выражен- ным этот показатель был в очагах плоскоклеточной метаплазии – 57,8 ± 9,5 % (р3–4=0,0001) и дисплазии эпителия I степени – 57,3 ± 10,1 % (р4–5=0,6). Самая высокая пролиферативная активность отмечалась в клетках неоплазии – 83,4 ± 9,8 % (р4–6, р5–6=0,0001) (рис. 2).
Экспрессия белка p53 была близка по динамике пролиферативной активности (рис. 3). Продукт экспрессии р53 регистрировался в ядрах при всех вариантах дисрегенераторных изменений. В первой группе выявлялось 7,2 ± 0,9 % окрашенных ядер в клетках бронхиального эпителия, во второй – 9,4 ± 2,3 % (р1–2=0,09). Значительно выше был уровень экспрессии гена-супрессора р53 в группах больных с плоскоклеточной метаплазией – 24,1 ± 7,2 % (р2–3 р2–4=0,0001) и дисплазией I степени 24,3 ± 6,4, % (р3–4=0,9). Наиболее высокая экспрессия р53 наблюдалась в группе пациентов с дисплазией II–III степени – 41,3 ± 8,9 % (р4–5=0,02).
Такой же была динамика процентного содержания клеток, экспрессирующих р53, и в группах, сформированных по варианту дисре-генераторного процесса эпителия независимо от его сочетания с другими процессами (рис. 4). В участках неизмененной слизистой оболочки бронха и бокаловидно-клеточной гиперплазии р53 выявлялся в ядрах клеток в минимальном количестве – 6,2 ± 1,7 % и 6,7 ± 1,9 % соответственно (р1–2=0,1). В эпителиальном пласте с признаками базально-клеточной гиперплазии значения данного показателя составляли 13,6 ± 5,4 % (р2–3=0,001), кроме того, они повышались до 28,7 ± 7,2 % в участках плоскоклеточной метаплазии (р3–4=0,0002) и до 32,0 ± 6,2 % – при дисплазии I степени (р4–5=0,2). В участках дисплазии II–III степени позитивная экспрессия р53 была максимальной – 45,7 ± 11,2 % (р5–6=0,001).
Экспрессия ингибитора апоптоза bcl-2 при гиперпластических, пренеопластических и неопластических процессах в бронхиальном эпителии также соответствовала динамике экспрессии вышеописанных маркеров – Ki67 и p53 (рис. 5). Уровень экспрессии bcl-2 в группе с ГБК и БКГ составлял 6,8 ± 2,7 % и 8,4 ± 4,7 % соответственно (р1–2=0,5). Также он возрастал в группах пациентов с плоскоклеточной метаплазией – 16,7 ± 4,7 % (р2–3=0,0001) и Д I – 18,6 ±
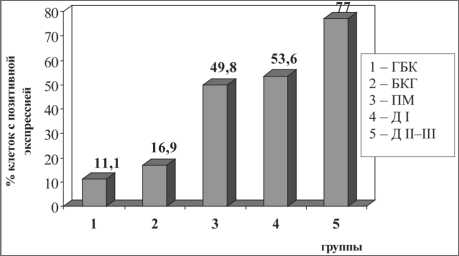
Рис. 1. Экспрессия Ki 67 в бронхиальном эпителии в группах больных с различными дисрегенераторными процессами. При- мечание: различия между группами статистически значимы:
p1–3=0,0001, p1–4=0,0007, p2–3=0,0001, p2–4=0,0001, p3–5=0,007, p4–5=0,006
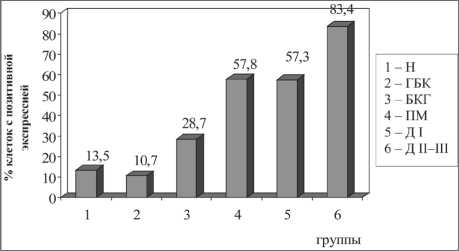
Рис. 2. Экспрессия Ki67 в эпителии различных вариантов дис-регенераторных изменений. Примечание: различия между группами статистически значимы: p1–3=0,002, p2–3=0,001, p3–4=0,0001, p3–5=0,0001, p4–6=0,0001, p5–6=0,0001
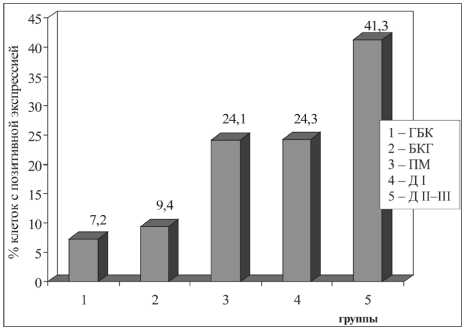
Рис. 3. Экспрессия p53 в бронхиальном эпителии в группах больных с различными дисрегенераторными процессами. Примечание: различия между группами статистически значимы: p1–3=0,0006, p1–4=0,01, p2–3=0,0001, p2–4=0,0001, p4–5=0,02
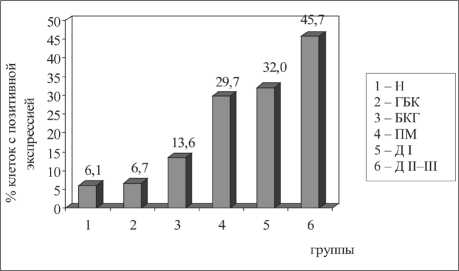
Рис. 4. Экспрессия p53 в эпителии различных вариантов дис-регенераторных изменений. Примечание: различия между группами статистически значимы: p1–3=0,001, p2–3=0,001, p3–4=0,0002, p3–5=0,002, p4–6=0,001, p5–6=0,0001
7,1 % (р3–4=0,5). Значения данного показателя при Д II–III достигали 28,1 ± 6,7 % (р4–5=0,05).
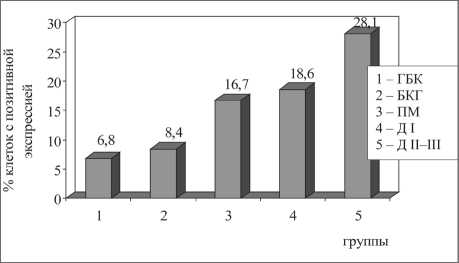
Рис. 5. Экспрессия bcl-2 в бронхиальном эпителии в группах больных с различными дисрегенераторными процессами. Примечание: различия между группами статистически значимы: p1–3=0,001, p1–4=0,02, p2–3=0,0001, p2–4=0,003
Характер экспрессии bcl-2 в цитоплазме клеток различных типов дисрегенераторных процессов также не зависел от их глубины у каждого пациента (рис. 6). Экспрессия bcl-2 в «нормальном» эпителии, в участках эпителия с бокаловидно-клеточной гиперплазией и базально-клеточной гиперплазией была наименьшей – 9,3 ± 4,3 %, 7,7 ± 3,7 % и 9,9 ± 5,3 % соответственно. Значительно большее количество клеток экспрессировало bcl-2 в участках плоскоклеточной метаплазии – 19,5 ± 4,6 % (р1–4, р3–4=0,002, р2–4=0,001) и Д I – 20,0 ± 5,2 % (р4–5=0,5). Наиболее высокая экспрессия bcl-2 наблюдалась в неопластическом эпителии – 33,3 ± 5,7 % (р4–6, р5–6=0,001).
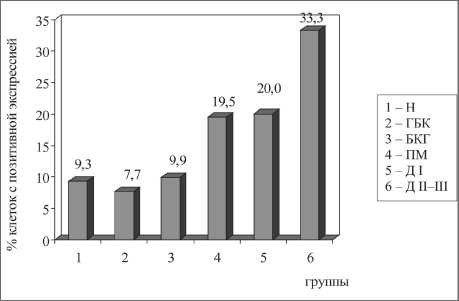
Рис. 6. Экспрессия bcl-2 в эпителии различных вариантов дисрегенераторных изменений. Примечание: различия между группами статистически значимы: p1–4=0,002, p1–5=0,002, p2–4=0,003, p2–5=0,003, p4–6=0,001, p5–6=0,001
Анализ экспрессии онкомаркеров в группах больных с различными дисрегенераторными процессами показал достоверное увеличение пролиферативной активности и экспрессии белка р53 в динамике гиперпластических, пренеопластических и неопластических изменений бронхиального эпителия. Наиболее высок уровень экспрессии маркеров Ki67, p53 и bcl-2 отмечен в группах больных с плоскоклеточной метаплазией и дисплазией. Наши данные согласуются с результатами исследования T. Ishizumi et al. (2010), утверждающих, что «канцерогенез в бронхиальном эпителии начинается с нормального эпителия и продолжается через гиперплазию, метаплазию, дисплазию/рак in situ в инвазивный плоскоклеточный рак» [6]. Согласно исследованиям W. Pankiewicz et al. (2007), изменения в экспрессии онкомаркеров Ki67, p53 и bcl-2 наблюдаются в случае плоскоклеточной метаплазии, дисплазии и CIS (рак in situ) [10]. По мнению авторов, эти изменения происходят последовательно, а их количество и частота растут вместе с развитием атипии по пути метаплазия – дисплазия – CIS.
Результаты исследования позволяют предположить, что феномен увеличения доли клеток, экспрессирующих Ki67, p53 и bcl-2 в последовательности базальноклеточная гиперплазия – плоскоклеточная метаплазия – дисплазия I (пренеоплазия) – дисплазия II–III (неоплазия), не зависит от индивидуальных особенностей, поскольку наблюдается при сочетании раз- ных форм дисрегенераторных изменений в бронхиальном эпителии одного больного. Не исключено, что развитие неопластического процесса обусловлено не столько генетическими изменениями, возникающими при ДI–ДII, сколько экспансией клона клеток, появляющихся уже в пределах метапластического фокуса, а быть может, и в участках базально-клеточной гиперплазии.


