Характеристика клинического течения и структурно-функционального состояния левого желудочка при декомпенсации хронической сердечной недостаточности у больных ишемической хронической сердечной недостаточностью и воспалением миокарда
Автор: Кручинкина Екатерина Владимировна, Рябова Тамара Ростиславовна, Роговская Юлия Викторовна, Баталов Роман Ефимович, Рябов Вячеслав Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.33, 2018 года.
Бесплатный доступ
Цель: изучить клиническое течение и структурно-функциональное состояние левого желудочка у больных декомпенсированной ишемической хронической сердечной недостаточностью с систолической дисфункцией и воспалением миокарда. Материал и методы. Выполнено открытое, нерандомизированное, проспективное исследование, зарегистрированное на сайте ClinicalTrials.gov, идентификационный номер: NCT02649517. Включили 25 больных: 21 мужчина - 84% и 4 женщины - 16% в возрасте от 35 до 75 лет (средний возраст - 60,12±9,3). Кроме стандартного обследования и лечения выполняли трансторакальную, включающую 2D-speckle tracking, ЭхоКГ. Все больные подверглись инвазивной коронарной ангиографии для исключения прогрессирования коронарного атеросклероза как причины декомпенсации хронической сердечной недостаточности, а также эндомиокардиальной биопсии для выявления воспаления миокарда. Выполняли сравнительный анализ клинических, лабораторных, инструментальных показателей в зависимости от факта диагностики воспаления в миокарде. Результаты. Не выявлено различий в клинических характеристиках декомпенсации ишемической хронической сердечной недостаточности с систолической дисфункцией левого желудочка в зависимости от факта наличия воспаления в ткани миокарда. Однако у больных с воспалением чаще выполнялось аортокоронарное шунтирование (p=0,0065). Кроме того, у больных с воспалением установлено снижение апикальной ротации (p=0,0313), ее систолической скорости (p=0,0157) при декомпенсации хронической сердечной недостаточности и наблюдающееся через год улучшение биомеханики верхушки левого желудочка, но продолжающееся снижение абсолютного модуля глобальной продольной деформации левого желудочка (p=0,0431) после проведенного противовоспалительного лечения. Также через год в обеих группах отмечалось увеличение индекса конечного диастолического объема левого желудочка (p=0,0180 и p=0,0280 соответственно), уменьшение толщины межжелудочковой перегородки левого желудочка (p=0,0491) в группе с воспалением и увеличение индекса массы миокарда левого желудочка (p=0,04995) у больных без воспаления. Выводы. Снижение апикальной ротации левого желудочка и ее систолической скорости у больных с ишемической хронической сердечной недостаточностью и систолической дисфункцией левого желудочка с учетом отсутствия клинического улучшения после оптимальной реваскуляризации миокарда может являться дополнительным критерием сопутствующего воспаления в миокарде. Среди больных с ишемической хронической сердечной недостаточностью и систолической дисфункцией левого желудочка более выраженное ремоделирование сердца, проявляющееся дилатацией левого желудочка и истончением стенок левого желудочка, наблюдалось в группе с воспалением.
Острая декомпенсация хронической сердечной недостаточности, ишемическая болезнь сердца, воспаление миокарда, 2d-speckle tracking эхокардиография, биопсия миокарда, иммуногистохимический анализ
Короткий адрес: https://sciup.org/149125212
IDR: 149125212 | УДК: 616.12-005.4-008.46-07 | DOI: 10.29001/2073-8552-2018-33-2-26-34
Текст научной статьи Характеристика клинического течения и структурно-функционального состояния левого желудочка при декомпенсации хронической сердечной недостаточности у больных ишемической хронической сердечной недостаточностью и воспалением миокарда
В 59% случаев ишемическая болезнь сердца (ИБС) и в 10–15% ишемическая кардиомиопатия (ИКМП) являются причиной развития декомпенсации хронической сердечной недостаточности (ХСН) [1]. Среди госпитализаций по поводу декомпенсации ХСН большая часть случаев (60%) приходится на ХСН со сниженной фракцией выброса левого желудочка (ФВ ЛЖ) [2]. Следует отметить, что выживаемость больных ХСН за последние 30 лет улучшилась в связи с широким внедрением современных подходов в лечении, изменяющим не только качество жизни, но и прогноз, таких как использование ингибиторов ангио-тензин-превращающего фермента, бета-блокаторов и антагонистов рецепторов минералокортикоидов, реваскуляризации миокарда и девайсной терапии [3]. Тем не менее ≈50% людей, страдающих ХСН, умирают в течение 5 лет [4], что свидетельствует о многофакторности патогенеза декомпенсации ХСН. Определение причин декомпенсации ХСН позволит выбрать более эффективную тактику лечения. Однако оптимальные клинические критерии определения фенотипа ХСН еще не определены [5].
В последнее время актуальным стало изучение влияния воспалительной реакции на патогенез ХСН [6]. При диагностике воспаления в ткани миокарда «золотым стандартом» является эндомиокардиальная биопсия (ЭМБ) [7, 8]. Однако существует потребность в создании новых общедоступных неинвазивных визуализационных методов диагностики с формированием доказательной базы. Известно, что с помощью широко используемого в клинической практике метода диагностики — ЭхоКГ можно определить систолическую функцию левого желудочка (ФВ ЛЖ), которая является маркером неблагоприятного прогноза у больных ХСН [9, 10]. Однако измерение ФВ ЛЖ зависит не только от качества визуализации, но и от опыта специалиста. В последнее время набирает популярность 2D-speckle tracking ЭхоКГ, которая является методом количественного определения деформации миокарда. В проводившихся исследованиях по изучению деформации желудочков и глобальной продольной деформации левого желудочка (ЛЖ) среди больных ХСН со сниженной ФВ ЛЖ выявлено, что глобальная продольная деформация ЛЖ является более точным маркером сократимости, чем ФВ ЛЖ [11]. Однако на данный момент нет данных о влиянии воспаления в ткани миокарда на структурно-функциональное состояние ЛЖ среди больных с декомпенсацией ишемической ХСН и сниженной ФВ ЛЖ.
Таблица 1
Цель: изучить клиническое течение и структурнофункциональное состояние ЛЖ у больных декомпенсированной ишемической ХСН с систолической дисфункцией и воспалением миокарда.
Материал и методы
В исследование включено 25 больных с симптомами декомпенсации ишемической ХСН с систолической дисфункцией ЛЖ, проходивших лечение в отделении неотложной кардиологии НИИ кардиологии г. Томска в период с 2015 по 2017 г. (табл. 1). Данное исследование зарегистрировано на сайте ClinicalTrials.gov, идентификационный номер: NCT02649517 [12].
Клиническая характеристика больных ишемической кардиомиопатией и симптомами декомпенсации ХСН
|
Показатели |
Me (Q1; Q3), %, ( n ) ( n =25) |
Me (Q1; Q3), %, ( n ) |
|
|
с воспалением ( n =16) |
без воспаления ( n =9) |
||
|
Мужской пол |
84 (21) |
81 (13) |
89 (8) |
|
Возраст, лет |
61 (56;67) |
63 (56;68) |
59 (57;66) |
|
Индекс массы тела, кг/м2 |
29,7 (25,7;31,9) |
29,7 (25,7;31,9) |
31,6 (30,3;33,4) |
|
Курение в настоящий момент |
24 (6) |
25 (4) |
22 (2) |
|
Наследственная предрасположенность к сердечно-сосудистым заболеваниям |
68 (17) |
81 (13) |
44 (4) |
|
Потребление алкоголя |
56 (14) |
56 (9) |
56 (5) |
|
Длительность ХСН, мес. |
14,5 (7,8;42,5) |
13,0 (6,5;50,5) |
22,0 (12,0;47,0) |
|
Время от последнего инфаркта миокарда до развития ХСН, мес. |
72,0 (13,0;114,0) |
88,0 (15,0;114,0) |
26,0 (12,0;114,0) |
|
Анамнез: |
|||
|
Сахарный диабет 2-го типа |
48 (12) |
50 (8) |
44 (4) |
|
Постинфарктный кардиосклероз |
100 (25) |
100 (16) |
100 (9) |
|
Функциональный класс ХСН по (NYHA) до госпитализации |
|||
|
II |
40 (10) |
32 (5) |
56 (5) |
|
III |
28 (7) |
32 (5) |
22(2) |
|
IV |
32 (8) |
38 (6) |
22 (2) |
|
Клинические проявления ХСН при поступлении |
|||
|
Цианоз |
44 (11) |
38 (6) |
56 (5) |
|
Одышка при физической нагрузке / в покое |
64 (16)/36 (9) |
63 (10)/38 (6) |
67 (6)/33 (3) |
|
Хрипы в легких |
44 (11) |
25 (4) |
28 (7) |
|
Отеки/пастозность |
40 (10)/16 (4) |
38 (6)/ 6 (1) |
44 (4)/11 (1) |
|
Повышение массы тела за последнюю неделю |
24 (6) |
19 (3) |
33 (3) |
|
Набухание шейных вен |
32(8) |
25(4) |
44(4) |
|
Перебои в работе сердца |
52(13) |
56(9) |
44(4) |
|
Печень (до 5 см / более 5 см) |
60(15)/8(2) |
63(10)/6(1) |
56(5)/11(1) |
|
Школа оценки клинического состояния (ШОКС), баллы |
5,0 (3,0;8,0) |
5,0 (2,5;7,5) |
7,0(3,0;11,0) |
|
Систолическое давление, мм рт. ст. |
128,0(104,0;138,0) |
128,0(103,0;139,0) |
130,0(110;130) |
|
Диастолическое давление, мм рт. ст. |
80,0(70,0;80,0) |
76,0(67,0;82,0) |
80,0(70,0;80,0) |
|
ЧСС, уд. /мин. |
72,0(65,0;87,0) |
74,0(66,5;89) |
68,0(64,0;82,0) |
|
ЧДД, вд./мин. |
19,0(17,0;20,0) |
19,5(16,5;23,0) |
20,0(18,0;20,0) |
|
Нарушение ритма сердца |
|||
|
Желудочковая тахикардия |
48(12) |
44(7) |
56(5) |
|
Фибрилляция/трепетание предсердий |
56(14)/28(7) |
63(10)/16(4) |
44(4)/ 33(3) |
|
Атриовентрикулярная блокада |
56(14) |
44(7) |
56(5) |
|
Блокада левой ножки пучка Гиса |
32(8) |
32(5) |
33(3) |
|
Блокада правой ножки пучка Гиса |
24(6) |
13(2) |
44(4) |
|
QRS (>120 мс/<120 мс) |
48(12)/52(13) |
44(7)/56(9) |
33(3)/67(6) |
|
Функциональный класс стенокардии напряжения до госпитализации |
|||
|
I |
32 (8) |
32 (5) |
33 (3) |
|
II |
56 (14) |
44 (7) |
78 (7) |
|
III |
12 (3) |
13 (2) |
11 (1) |
|
Медикаментозное лечение при поступлении |
|||
|
Блокаторы рецепторов А2 / ингибиторы ангиотензинпревращающего фермента |
40 (10) |
56 (9) |
22 (2) |
|
Антагонисты альдостерона |
72 (18) |
69 (11) |
67(6) |
|
Бета-блокаторы |
68 (17) |
56 (9) |
89(8) |
|
Сердечные гликозиды |
68 (17) |
25(4) |
0(0) |
|
Диуретики |
40 (10) |
69 (11) |
67(6) |
|
Инвазивная терапия |
|||
|
Чрескожное коронарное вмешательство |
68(17) |
63(10) |
78(7) |
|
Аортокоронарное шунтирование |
60(15) |
81(13)* |
22(2) |
|
Чрескожное коронарное вмешательство и аортокоронарное шунтирование |
32(8) |
19(3) |
22(2) |
|
Имплантация ИКД (до включения в исследование/во время исследования) |
24(6)/8(2) |
19(3)/19(3) |
33(3)/22(2) |
|
КРТ (до включения в исследование / во время исследования) |
4(1)/0(0) |
25(4)/0(0) |
0(0)/ 0(0) |
|
Имплантация КРТ-Д (до включения в исследование / во время исследования) |
8(2)/ 8(2) |
0(0)/ 13(2) |
22(2)/11(1) |
|
Лабораторные показатели при поступлении |
|||
|
Лейкоциты в крови, 1 мм3 |
7,5(6,3;9,1) |
7,7(6,25;10,1) |
7,1(6,7;8,7) |
|
Гемоглобин, г/л |
133,0(123,0;146,0) |
124,0(117,0;148,0) |
135,0(130,0;146,0) |
|
Глюкоза, ммоль/л |
6,2(5,6;7,5) |
6,2(5,6;9,7) |
6,4 (5,7;6,7) |
|
Креатинин, мкмоль/л |
99,0(90,0;125,0) |
98,5(87,5;127,5) |
99,0(90,0;116,0) |
|
Мочевина, ммоль/л |
7,1(6,1;9,8) |
7,7(5,9;9,7) |
7,1(6,7;9,8) |
|
Тропонин I нг/мл (через 12 ч) |
0,043(0,028;0,057) |
0,043(0,022;0,030) |
0,030(0,012;0,069) |
|
Тропонин I нг/мл (через 12 ч) |
8(2) |
6(1) |
11(1) |
|
КФК, ед./л (через 12 ч) |
72,0(58,0;132,0) |
67,5(58,0;128,0) |
121,0(70,0;132,0) |
|
КФК, ед./л (через 12 ч) |
12(3) |
6(1) |
22(2) |
|
КФК МВ, ед./л (через 12 ч) |
13,0(11,0;18,0) |
15,5(12,0;20,0) |
13,0(12,0;18,0) |
|
КФК МВ, ед./л (через 12 ч) |
8(2) |
12(2) |
- |
|
СРБ, мг/л (через 12 ч) |
6,5(12,0;19,0) |
7,0(4,5;9,0) |
5,5(5,0;6,0) |
|
СРБ, мг/л (через 12 ч) |
4(1) |
6(1) |
- |
|
Фибриноген, г/л |
3,4(2,6;3,7) |
3,33(2,55;3,55) |
3,93(3,32;4,48) |
|
Скорость оседания эритроцитов, мм/ч |
9,0(3,0;16,0) |
11,5(7,0;18,0) |
6,0(2,0;10,5) |
|
Лабораторные показатели на момент выписки |
|||
|
Лейкоциты в крови, 1 мм3 |
7,9(6,7;8,5) |
8,05(7,0;9,0) |
6,9 (6,6;7,9) |
|
Гемоглобин, г/л |
133,0(127,0;147,0) |
132,0(118,5;140,5) |
139,0(133,0;153,0) |
|
Глюкоза, ммоль/л |
6,0(5,3;7,0) |
6,0(5,0;6,7) |
6,5(5,7;7,2) |
|
Креатинин, мкмоль/л |
104,0(81,0;110,0) |
104,0(92,5;110,5) |
91,0(84,0;107,0) |
|
Мочевина, ммоль/л |
6,4(5,7;9,4) |
6,7(5,0;9,7) |
6,4(5,7;7,5) |
|
Тропонин I, нг/мл |
0,047(0,02;0,09) |
0,047(0,025;0,060) |
0,043(0,030;0,059)* |
|
Тропонин I, нг/мл |
16(4) |
19(3) |
11(1) |
|
КФК, ед/л |
68,0(51,0;142,0) |
68,0(51,0;148) |
68,0(60,0;73,0) |
|
КФК, ед/л |
4(1) |
6(1) |
– |
|
КФК МВ, ед/л |
12,0(10,0;16,0) |
12,0(9,0;17,0) |
12,0(11,0;15,0) |
|
КФК МВ, ед/л |
4(1) |
6(1) |
– |
|
СРБ, мг/л |
6,5(12,0;19,0) |
6,0(4,0;13,0) |
5,5(5,0;6,0) |
|
СРБ, мг/л |
8(2) |
6(1) |
11(1) |
|
Фибриноген, г/л |
3,5(3,0;4,1) |
3,43(2,78;3,99) |
6,5(5,7;7,2) |
|
СОЭ, мм/ч |
13,0(7,0;24,0) |
18,0(8,0;25,0) |
9,5(5,5;19,5) |
Примечание: * — р <0,05, статистически значимое между группами; ИКД — кардиовертер-дефибриллятор; КРТ — кардиоресинхронизирующая терапия; КРТ-Д — кар-диоресинхронизирующий дефибриллятор; КФК — креатинкиназа; КФК МВ — креатинкиназа МВ; СРБ — С-реактивный белок; СОЭ — скорость оседания эритроцитов.
Критериями включения больных в исследование служили: возраст не старше 75 лет, клинические проявления декомпенсации ХСН, ФВ ЛЖ менее 40%, c успешно выполненной ангиопластикой и/или коронарным шунтированием, не ранее 6 мес. до вступления в исследование.
Критериями исключения являлись: острый коронарный синдром менее чем за 6 мес. до госпитализации; гемодинамически значимые клапанные пороки сердца; наличие тяжелых сопутствующих заболеваний, которые могли бы повлиять на течение основного заболевания и результаты исследования.
Все пациенты подписывали информированное согласие на участие в исследовании. Проведение исследования одобрено комитетом по биомедицинской этике НИИ кардиологии Томского НИМЦ.
Данные ЭхоКГ получены с помощью ультразвуковых систем VIVID Е9 (GE Healthcare) с использованием матричного секторного фазированного датчика M3S (1,5–4,0 MHz) в парастернальном доступе по длинной и короткой оси, а также в апикальном доступе (5-, 4-и 2-камерной позиции). Оценка данных ЭхоКГ проводилась согласно рекомендациям по оценке камер сердца Американской и Европейской ассоциаций эхокардиографии [10].
В качестве показателя глобальной систолической функции ЛЖ оценивали показатели глобальной продольной деформации, апикальной и базальной ротации, скручивания и их скоростных характеристик в конце систолы.
В режиме кинопетли регистрировали три сердечных цикла и затем выполняли оценку деформационных свойств миокарда ЛЖ в каждом сердечном цикле с помощью новой ультразвуковой технологии — 2D-speckle tracking с использованием Soft программы (Echopac PC, GE Healthcare). Ротация оценивалась из парастернальной позиции по короткой оси ЛЖ на уровне базальных сегментов и верхушки, скоростные показатели ротации оценивались в конце систолы. Ротация верхушки в норме имеет положительное значение, а ротация на базальном уровне — отрицательное значение, т. к. верхушка в систолу движется против часовой стрелки, а базальные сегменты — по часовой стрелке. Скручивание ЛЖ рассчитывалось как абсолютная разница между апикальной и базальной ротацией [13]. При оценке глобальной продольной деформации ЛЖ за снижение показателя принималось значение более 18% [14].
Кроме того, всем больным проводилась инвазивная коронарная ангиография с целью исключения прогрессирования коронарного атеросклероза как причины декомпенсации ХСН, ЭМБ — для диагностики воспаления в ткани миокарда. Критерии активности воспаления оценивались по Далласским критериям [7]. После чего были сформированы две группы: с воспалением в миокарде (группа 1), без воспаления в миокарде (группа 2).
Все больные с признаками вирусного миокардита (64%), а также с выраженной и умеренной экспрессией кардиотропных вирусов без миокардита (13%) получали специфическую противовирусную терапию (валцикло-вир для элиминации вируса герпеса 1, 2, 6-го типа, интерферон альфа-2-бета для элиминации энтеровируса, аденовируса и цитомегаловируса) [15].
Клинико-функциональные параметры оценивали при помощи следующих методик: шкала оценки клинического состояния (ШОКС) в модификации В. Ю. Мареева, тест 6-минутной ходьбы, динамика ФК ХСН и ИБС.
Статистическую обработку материала осуществляли с помощью программы Excel 2010 и Statistica 10.0 (Stat Soft Inc., Tulsa OK, USA). Проверка гипотезы о гауссовском распределении по критерию Шапиро — Уилка отвергала эту гипотезу. Сравнение независимых малых выборок проводили с помощью теста Манна — Уитни. Для оценки различий между двумя зависимыми выборками использовался критерий Уилкоксона. Корреляция оценивалась по Спирмену. Для определения зависимости частоты встречаемости признака в зависимости от воспаления в миокарде использовали точный критерий Фишера. Результаты представлены в виде M ± SD (где М — среднее арифметическое, SD — среднеквадратичное отклонение), Me (Q1; Q3), где Me — медианы и Q1-нижнего и Q3-верхнего квартилей. Во всех процедурах статистического анализа критический уровень значимости p принимался равным 0,05.
Результаты
С 2015 по 2017 г. в отделение неотложной кардиологии НИИ кардиологии Томского НИМЦ было госпитализировано 25 человек с симптомами декомпенсации ишемической ХСН и систолической дисфункцией ЛЖ. Включено: 21 мужчина — 84% и 4 женщины — 16% в возрасте от 35 до 75 лет (средний возраст — 60,12±9,3). Время от диагностики ИБС до развития ХСН составило 72,0 (13,0;144,0) мес., а период развития ХСН — 14,5 (7,8;42,5) мес. Анализ клинико-анамнестических данных не выявил статистически значимых различий между группами, кроме преобладания количества случаев аортокоронарного шунтирования — АКШ ( p =0,0309) в группе 1 (табл. 1). Установлено, что у каждого второго больного наблюдалось нарушение ритма сердца, представленное желудочковой тахикардией — 48% и фибрилляцией предсердий — 56%, а также нарушение проведения ритма сердца в 48% случаев. Обращает на себя внимание и низкая приверженность к медикаментозной терапии на догоспитальном этапе (табл. 1).
Проведенный анализ клинических проявлений согласно классификации острой сердечной недостаточности показал, что в группе 1 — 31% и в группе 2 — 22% случаев, когда наблюдались признаки перегрузки и периферической гипоперфузии (рис. 1).
Анализ лабораторных показателей продемонстрировал увеличение маркеров некроза миокарда у нескольких больных, однако статистически значимых различий между группами не наблюдалось. В группе 2 на момент выписки отмечалось статистически значимое увеличение уровня тропонина I ( p =0,0382), но не соответствовало критериям
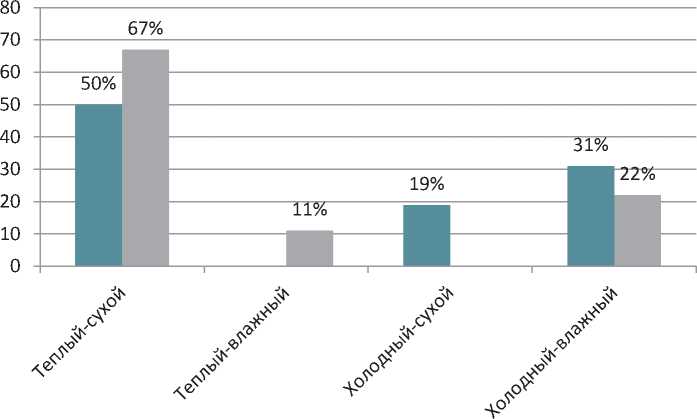
Рис. 1. Классификация острой сердечной недостаточности
-
■ воспаление +
-
■ воспаление -
- инфаркта миокарда. Также не установлена связь маркеров некроза миокарда (тропонин I, КФК, КФК МВ) с некрозом и лимфоцитозом в ткани миокарда (табл. 1).
При анализе ЭхоКГ-показателей различий между группами не найдено, у всех больных была зарегистрирована дилатация ЛЖ, нарушение локальной сократимости и ФВ ЛЖ менее 30%. Через год наблюдений установлено статистически значимое увеличение КДИ ЛЖ в обеих группах ( p =0,0180 и p =0,0280 соответственно), уменьшение толщины МЖП ЛЖ ( p =0,0491) в группе 1 и увеличение ИММ ЛЖ ( p =0,04995) в группе 2. Также за время наблюдения значимо улучшилась функция митрального клапана ( p =0,0330) в обеих группах (табл. 2).
Из таблицы 3 видно, что исходно в обеих группах наблюдалось снижение базальной ротации ЛЖ, ее систолической скорости и глобальной продольной деформации ЛЖ. Кроме того, в группе 1 наблюдалось нарушение скручивания ЛЖ и статистически значимое снижение апикальной ротации на 49% ( p =0,0313) и ее систолической скорости на 44% ( p =0,0157) при декомпенсации ХСН. Через год наблюдений между группами не наблюдалось различий за счет улучшения биомеханики верхушки ЛЖ в группе 1. Кроме того, в группе 1 отмечалось снижение абсолютного модуля глобальной продольной деформации ЛЖ на 28% ( p =0,0431).
Таблица 2
ЭхоКГ-показатели у больных декомпенсированной ХСН ишемического генеза
|
Показатели |
Me (Q1; Q3), % (n) |
|||
|
с воспалением |
без воспаления |
|||
|
при поступлении ( n =16) |
через год ( n =12) |
при поступлении ( n =9) |
через год ( n =8) |
|
|
КДИ ЛЖ, мл/м2 |
100,0(82,1;126,4) |
168,5(78,0;200,0)** |
97,8(69,8;105,8) |
139,0(100,0;163,5)** |
|
КСИ ЛЖ, мл/м2 |
69,3(58,5;98,9) |
83,5(41,3;100,3) |
74,3(47,5;80,3) |
67,3(41,0;77,7) |
|
ФВ ЛЖ, % |
24,0(20,5;40,5) |
28,0(20,5;39,5) |
26,3(20,0;35,8) |
29,5(19,5;39,5) |
|
ИНЛС, усл. ед. |
1,81(46,7;86,5) |
1,81(1,44;1,94) |
2,06(1,76;2,09) |
1,69(1,50;2,06) |
|
МЖП, мм |
10,0(8,0;11,0) |
9,0(7,0;11,0)** |
12,0(10,5;14,5) |
12,0(11,0;12,0) |
|
ЗСЛЖ, мм |
11,0(11,0;12,0) |
12,0(11,0;13,0) |
12,5(11,0;14,0) |
12,5(12,0;13,5) |
|
ЛП, мм |
47,0(41,0;53,0) |
43,0(42,0;44,0) |
47,5 (39,0;52,5) |
48,5 (43,5;51,0) |
|
ЛПИ, мл/м2 |
41,0(38,0;51,0) |
37,6(32,8;46,0) |
39,0(29,0;53,6) |
30,0(17,5;34,3) |
|
ИММ ЛЖ, г/м2 |
152,4(127,5;223,4) |
168,7(114,8;218,5) |
166,1(143,7;232,9) |
184,1(169,4;212,8)** |
|
СДПЖ, мм рт. ст. |
45,0(37,0;61,0) |
37,0(35,5;45,0) |
46,0(36,0;17,0) |
35,0(24,0;47,0) |
|
МН 1–2/3–4-й степени |
56(9)/ 44(7) |
83(10)/8(1) |
78(7)/11(1) |
75(6)/- |
|
ТН 1–2/3–4-й степени |
50(8)/6(1) |
50(6)/- |
11(1)/22(2) |
75(6)/13(1) |
Примечание: * — р <0,05, статистически значимое между группами. ** — р <0,05, статистически значимое изменение показателя в динамике. КДИ — индекс конечного диастолического объема; КСИ — индекс конечного систолического объема; ФВ ЛЖ — фракция выброса левого желудочка; ИНЛС — индекс нарушения локальной сократимости; МЖП — межжелудочковая перегородка; ЗСЛЖ — задняя стенка левого желудочка; ЛП — левое предсердие; ЛПИ — индекс объема левого предсердия; ИММ ЛЖ — индекс массы миокарда левого желудочка; СДПЖ — систолическое давление в правом желудочке; МН — митральная недостаточность; ТН — трикуспидальная недостаточность.
Таблица 3
Показатели 2D speckle-tracking ЭхоКГ
Me (Q1; Q3)
|
Показатели |
с воспалением |
без воспаления |
||
|
при поступлении ( n =16) |
через год ( n =12) |
при поступлении ( n =9) |
через год ( n =8) |
|
|
Глобальная продольная |
–6,80 |
–4,4 |
–6,00 |
–5,2 |
|
деформация ЛЖ, % |
(–8,30;–5,40) |
(–5,40;–3,70) |
(–7,20;–3,45) |
(–6,2;–4,4) |
|
–3,75 |
–4,48 |
–3,44 |
–4,78 |
|
|
Базальная ротация, ° |
(–6,36;–2,81) |
(–5,31;–0,69) |
(–4,50;–1,53) |
(–5,50;–0,69) |
|
Систолическая скорость |
–27,34 |
–34,38 |
–37,19 |
–51,41 |
|
базальной ротации, °/с–1 |
(–37,19;–20,78) |
(–59,06;–5,47) |
(–52,52;–25,71) |
(–62,44;–16,41) |
|
2,88 |
2,89 |
5,76 |
4,30 |
|
|
Апикальная ротация, ° |
(1,20;4,81)* |
(1,55;7,73) |
(4,21;7,40) |
(1,02;13,28) |
|
Систолическая скорость |
19,69 |
24,41 |
39,38 |
38,28 |
|
апикальной ротации, °/с–1 |
(15,00;27,13)* |
(7,66;41,56) |
(24,61;54,14) |
(17,50;80,94) |
|
6,50 |
8,00 |
8,86 |
8,42 |
|
|
Скручивание, ° |
(3,95;8,77) |
(1,03;12,38) |
(5,25;9,88) |
(3,28;8,77) |
|
Систолическая скорость |
36,09 |
48,09 |
46,49 |
57,97 |
|
скручивания, °/с–1 |
(28,00;61,72) |
(9,84;70,00) |
(23,31;49,61) |
(40,47;108,28) |
Примечание: * — р <0,05, статистически значимое между группами.
За истекший период уровень общей смертности среди больных ХСН с систолической дисфункцией ишемического генеза составил 38% в группе 1 и 11% в группе 2, сердечно-сосудистой смерти — 25 и 11% соответственно. В свою очередь, количество повторных госпитализаций по поводу декомпенсации ХСН за этот временной промежуток в группе 1 составило 25 и 11% в группе 2.
Обсуждение
Анализ клинико-анамнестических характеристик больных не показал различий между группами, кроме значимо чаще выполняемого АКШ ( p =0,00650) в группе 1. Стоит отметить незначительное преобладание жалоб на одышку, перебои в работе сердца, тахипноэ в группе 1. Группы не различались по сывороточным маркерам воспаления, однако отмечалась отрицательная динамика в виде статистически значимого повышения уровня тропонина I в группе 2, вызванное местной воспалительной реакцией после проведения ЭМБ, по сравнению с группой 1, где неспецифическое увеличение уровня тропонина I находилось на одном уровне за счет исходного воспаления в ткани миокарда.
Следовательно, при быстром развитии и прогрессировании ишемической ХСН после оптимальной реваскуляризации миокарда необходимо исключить воспалительный компонент, являющийся наиболее возможной причиной ее декомпенсации.
Результаты проведенной ЭхоКГ через год продемонстрировали статистически значимое увеличение КДИ ЛЖ в обеих группах — на 68,5% ( p =0,0180) и 42% ( p =0,0280) соответственно, а также увеличение ИММ ЛЖ ( p =0,04995) в группе 2.
Кроме того, полученные нами данные о нарушении базальной и апикальной ротации, их скоростных характе- ристик, а также нарушение глобальной продольной деформации ЛЖ соответствуют мировой литературе [16]. В настоящее время в рутинной практике используется только глобальная продольная деформация ЛЖ, остальные же показатели 2D speckle-tracking используются только в качестве исследовательского инструмента [10, 11]. Следует отметить, что 2D speckle-tracking ЭхоКГ является вспомогательным инструментом для оценки структурно-функциональных изменений миокарда ЛЖ и коррелирует с воспалением, подтвержденным при помощи ЭМБ [17]. Обнаруженное нами значимое снижение апикальной ротации ЛЖ (p=0,0313) и ее систолической скорости (p=0,0157) только в группе 1, а также отсутствие различий между группами через год наблюдений за счет улучшения биомеханики верхушки ЛЖ, уменьшения толщины МЖП ЛЖ (p=0,0491), вероятно, обусловлено уменьшением воспалительного процесса в миокарде после проведенной противовоспалительной терапии. Таким образом, нарушение биомеханики верхушки ЛЖ с учетом отсутствия клинического улучшения после оптимальной реваскуляризации миокарда и ухудшение течения ХСН могут являться возможным дополнительным критерием воспаления в миокарде. Стоит отметить также снижение абсолютного модуля глобальной продольной деформации ЛЖ на 28% (p=0,0431) в группе 1.
В свою очередь, снижение глобальной продольной деформации ЛЖ, увеличение КДИ ЛЖ и ИММ ЛЖ можно расценивать как проявления продолжающегося неблагоприятного ремоделирования ЛЖ среди больных с ишемической ХСН и систолической дисфункцией ЛЖ [11]. При этом в группе 1 наблюдались более явные нарушения структурно-функционального состояния ЛЖ и преобладание количества неблагоприятных исходов, что может свидетельствовать о негативном влиянии воспаления на течение ХСН.
Выводы
Снижение апикальной ротации ЛЖ и ее систолической скорости у больных ишемической ХСН и систолической дисфункцией ЛЖ с учетом отсутствия клинического улучшения после оптимальной реваскуляризации миокарда может являться дополнительным критерием сопутствующего воспаления в миокарде.
Среди больных ишемической ХСН и систолической дисфункцией ЛЖ более выраженное ремоделирование сердца, проявляющееся дилатацией ЛЖ и истончением стенок ЛЖ, наблюдалось в группе с воспалением.
Список литературы Характеристика клинического течения и структурно-функционального состояния левого желудочка при декомпенсации хронической сердечной недостаточности у больных ишемической хронической сердечной недостаточностью и воспалением миокарда
- Энглевский Н. А., Гутор C. С., Шилов Б. В., Казаков В. А., Андреев С. Л., Суходоло И. В. Создание программного комплекса для автоматизации морфометрии миокарда при выборе метода оперативного лечения больных ишемической кардиомиопатией. Медицинские информационные системы. 2014; 2: 33-39.
- Кручинкина Е. В., Рябов В. В., Рябова Т. Р., Роговская Ю. В., Баталов Р. Е. Встречаемость и профиль кардиотропных вирусных агентов в миокарде у больных декомпенсированной сердечной недостаточности с систолической дисфункцией ишемического генеза. Сибирский медицинский журнал. 2017; 32(1): 46-50.
- Mozaffarian D., Benjamin E. J., Go A. S., Arnett D. K., Blaha M. J., Cushman M., Das S. R., Ferranti S., Despres J., Fullerton H. J., Howard V. J., Huffman M. D., Isasi C. R., Jimenez M. C., Judd S. E., Kissela B. M., Lichtman J. H., Lisabeth L. D., Liu S., Mackey R. H., Magid D. J., McGuire D. K., Mohler E. R., Moy C. S., Muntner P., Mussolino M. E., Nasir K., Neumar R. W., Nichol G., Palaniappan L., Pandey D. K., Reeves M. J., Rodriguez C. J., Rosamond W., Sorlie P. D., Stein J., Towfighi A., Turan T. N., Virani S. S., Woo D., Yeh R. W., Turner M. B. Heart Disease and Stroke Statistics-2016 Update. A Report from the American Heart Association. Circulation. 2016; 135(20): e38-e360. DOI: 10.1161/CIR.0000000000000350
- Roger V. L. Epidemiology of Heart Failure. NIH Public Access. 2013; 113(6): 646-659. DOI: 10.1161/CIRCRESAHA.113.300268
- Chioncel O., Mebazaa A., Harjola V. P., Coats A. J., Piepoli M. F., Crespo-Leiro M. G., Laroche C., Seferovic P. M., Anker S. D., Ferrari R., Ruschitzka F., Lopez-Fernandez S., Miani D., Filippatos G., Maggioni A. P.; ESC Heart Failure Long-Term Registry Investigators. Clinical phenotypes and outcome of patients hospitalized for acute heart failure: the ESC Heart Failure Long-Term Registry. Eur. J. Heart Fail. 2017; 19: 1242-1254.
- Кручинкина Е. В., Рябов В. В. Иммунный ответ при декомпенсации ишемической хронической сердечной недостаточности. Российский кардиологический журнал. 2018; 1(153): 72-77.
- Amm Ch. E., Cooper L. T. Management of myocarditis. Heart Metab. 2014; 62: 8-12.
- Caforio A. L., Marcolongo R., Jahns R., Fu M., Felix S. B., Iliceto S. Immune-mediated and autoimmune myocarditis: clinical presentation, diagnosis and management. Heart Fail. Rev. 2013; 8(6): 715-732.
- DOI: 10.1007/s10741-012-9364-5
- Павлюкова Е. Н., Трубина Е. В., Карпов Р. С. Деформация левого желудочка у больных с ишемической и дилатационной кардиомиопатией по данным ультразвуковой технологии «след пятна». Сибирский медицинский журнал. 2012; 27(3): 37-42.
- Lang R. M., Badano L. P., Mor-Avi V., Afilalo J., Armstrong A., Ernande L., Flachskampf F. A., Foster E., Goldstein S. A., Kuznetsova T., Lancellotti P., Muraru D., Picard M. H., Rietzschel E. R., Rudski L., Spencer K. T., Tsang W., Voigt J.-U. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2015; 28(1): 1-39. http://dx.doi. org/.
- DOI: 10.1016/j.echo.2014.10.003
- Sengelov M., Jorgensen P. G., Jensen J. S., Bruun N. E., Olsen F. J., Fritz-Hansen T., Nochioka K., Biering-Sorensen T. Global Longitudinal Strain Is a Superior Predictor of All-Cause Mortality in Heart Failure with Reduced Ejection Fraction. JACC Cardiovasc. Imaging. 2015; 8(12): 1351-1359. 10.1016/j. jcmg.2015.07.013.
- DOI: 10.1016/j.jcmg.2015.07.013
- Ryabov V. V., Kruchinkina E. V., Rogovskaya Y. V., Ryabova T. R., Batalov R. E., Rebenkova M. S., Popov S. V., Karpov R. S. Clinical and morphological characteristics of chronic inflammation in the myocardium in patients with decompensated chronic heart failure accompanied by ischemic systolic dysfunction: study protocol for an open-label nonrandomized trial. Clin. Trials Degener. Dis. 2016; 1(4): 160-165.
- Карпов Р. С., Павлюкова Е. Н. Глобальная деформация, ротация и скручивание левого желудочка у больных ишемической болезнью сердца с тяжелой левожелудочковой дисфункцией. Центрально-азиатский медицинский журнал. 2012; 1: 19-27.
- Favot M., Courage C., Ehrman R., Khait L., Levy P. Strain Echocardiography in Acute Cardiovascular Diseases. West J. Emerg. Med. 2016; 17(1): 54-60.
- DOI: 10.5811/westjem.2015.12.28521
- Dominguez F., Kuhl U., Pieske B., Garcia-Pavia P., Tschope C. Update on Myocarditis and Inflammatory Cardiomyopathy: Reemergence of Endomyocardial Biopsy. Rev. Esp. Cardiol. 2016; 69(2): 178-187.
- DOI: 10.1016/j.rec.2015.10.015
- Phillips A. A., Cote A. T., Bredin S. S., Warburton D. E. Heart disease and left ventricular rotation -a systematic review and quantitative summary. BMC Cardiovasc. Disord. 2012; 12(46): 1-19.
- DOI: 10.1186/1471-2261-12-46
- Escher F., Kasner M., Kuhl U., Heymer J., Wilkenshoff U., Tschope C., Schultheiss H.-P. New Echocardiographic Findings Correlate with Intramyocardial Inflammation in Endomyocardial Biopsies of Patients with Acute Myocarditis and Inflammatory Cardiomyopathy. Hindawi Publishing Corporation Mediators of Inflammation. 2013; 1-19. Article ID 875420. http://dx.doi. org/.
- DOI: 10.1155/2013/875420


