Характеристика таутомерных форм оротата калия, полученных методом механоактивации
Автор: Чучкова Н.Н., Канунникова О.М., Пазиненко К.А., Сметанина М.В., Карбань О.В., Полякова О.Л.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 2 (70), 2021 года.
Бесплатный доступ
Цель исследования: получение механоактивированных таутомерных форм калия оротата, оценка физикохимических характеристик таутомеров и эффективности их действия на организм лабораторных животных. Методы исследования: механоактивациия калия оротата в шаровой планетарной мельнице, исследование порошков методами атомно-силовой микроскопии, рентгенофазового анализа, NEXAFS-спектра, исследование эффектов применения порошков различных таутомерных форм калия оротата на животных. Установлено, что механоактивация исходной оксо-формы в течение 1 ч привела к формированию гидрокси-формы, после 6 ч -дигидрокси-формы, отличающихся по физико-химическим свойствам. В экспериментах на животных выявлена более высокая эффективность механоактивированных препаратов (гидрокси-форма > дигидрокси-форма) по сравнению с исходной оксо-формой. Полученные данные могут быть положены в основу клинической апробации гидрокси-формы оротовой кислоты, как наиболее активной формы препарата.
Механоактивация, оротат калия, таутомеры оротовой кислоты, гепатопатия
Короткий адрес: https://sciup.org/142227866
IDR: 142227866 | УДК: 544.127:546.32:547.29:542.22
Текст научной статьи Характеристика таутомерных форм оротата калия, полученных методом механоактивации
Фармацевтический эффект многих лекарственных препаратов зависит от изомерного состояния действующих веществ этих препаратов, причем биологическая активность изомеров, как правило, сильно различается [8, 10]. Влияние таутомерии на способность органических соединений взаимодействовать с биологическими системами (например, молекулой ДНК) обсуждается в ряде работ [9].
Таутомерные превращения происходят, как правило, в растворе, газовой фазе или аморфном состоянии, поскольку перенос протонов в таких состояниях происходит легко. Получение изомеров (таутомеров) лекарственных препаратов с измененными физико-химическими свойствами возможно при их механообработке [1]. Механохи- мически-индуцированные структурные превращения показаны для солей калия, натрия, кальция, магния [3, 5, 6].
Оротат калия относятся к хорошо известным препаратам для лечения и профилактики заболеваний печени, сердечно-сосудистой системы. Механизм действия оротовой кислоты обусловлен ее действием на нуклеотидный обмен [2, 7], однако эффективность действия препаратов на основе оротатов ограничена их низкой растворимостью и, как следствие, биологической доступностью.
ЦЕЛЬ РАБОТЫ
Получить таутомерные формы оротатов калия методом механоактивации, оценить физико-химических характеристики таутомеров и сопоставление эффективности их действия на организм лабораторных животных.
МЕТОДИКА ИССЛЕДОВАНИЯ
Механоактивация оротата калия (Калия оро-тат, ОАО АВВА РУС, Россия) проводилась в шаровой планетарной мельнице АГО-2С с водяным охлаждением барабанов. Длительность обработки исходного препарата составила 1, 3 и 6 ч. Скорость вращения барабанов составляла 600 об./мин. Температура механоактивиро-ванной смеси составляла порядка 60 °C. Морфология частиц порошка оротата калия после механоактивации исследовалась методом атомной силовой микроскопии с использованием сканирующей лаборатории Интегра-Прима в полукон-тактном режиме на воздухе. Рентгенофазовый анализ проводился на спектрометре Bruker D8 Advance с использованием CuKα-излучения. ИК-спектры получали на ИК Фурье спектрометре ФСМ 1202. NEXAFS-спектры получены на оборудовании Центра Гельмгольца (Берлин, Германия) синхротронного центра BESSY II.
Биологические исследования проводились на белых беспородных крысах (Rattus Norvegicus Berk) № 30, массой 180–200 г с индуцированной гепатопатией (ИГ) [4]. Для этого животные с ИГ были разделены на 3 группы по 10 крыс в каждой, которые ежедневно перорально получали оротат калия (ОрКа) в суточной дозе 5г/животное, что соответствует терапевтической дозировке лекарственного препарата. Экспериментальная группа 1 получала лекарство в исходной оксо-форме, без механообработки (ОрКа-1), группа 2 – (ОрКа-2) с длительностью механообработки в течение 1-го часа (гидрокси-форма), группа 3 – в (ОрКа-3) с длительностью механообработки в течение 6 часов (дигидрокси-форма). Препарат с длительностью обработки в течение 3 часов в биологическом эксперименте не использовался, поскольку
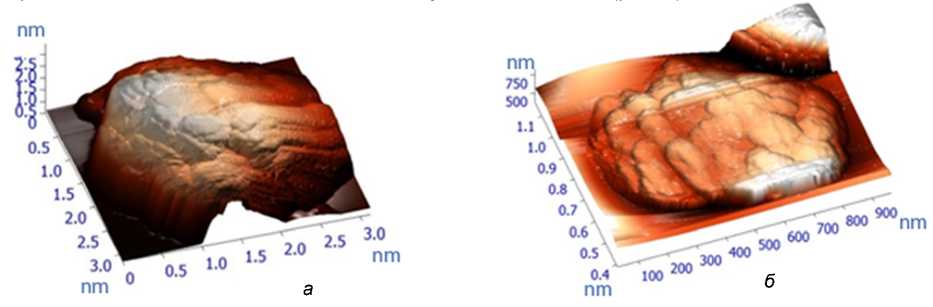
Рис. 1. Форма частиц порошка калия оротата после механоактивации в течение 1 (а) ч и 6 ч (б)
представлял переходный вариант, смесь гидрокси- и дигидрокси-форм. Курс применения препаратов составил 3 недели. После окончания срока введения у животных транскардиаль-но забирали кровь для анализа на ферменты печени (АСТ, АЛТ, щелочную фосфатазу), билирубин, триглицериды, общий холестерин, ЛПВП. Исследование проводили на приборах Olympus AU-480, Sysmex XS-500i и Alifax Roller 10 Plus.
Содержание животных осуществлялось в соответствии с нормативным документом СП 2.2.1.321814 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. № 51. Исследование одобрено комитетом по биомедицинской этике ФГБОУ ВО «Ижевская государственная медицинская академия» Минздрава РФ (протокол № 656 от 23.04.2019).
Статистическая обработка данных, полученных на животных, проводилась с использованием метода многомерного дисперсионного анализа (MANOVA) в компьютерной программе SPSS.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
После 1 часа механоактивации порошок представляет собой отдельные частицы сферической формы с преимущественным размером 60 нм. Максимальный размер отдельных крупных частиц не превышает 250 нм. Через 3 ч механоактивации происходит агрегирование частиц с формой эллипсоида вращения и размером 80–50 нм и формирование неустойчивых агрегатов размером до 1,5 мкм, которые разрушаются при сканировании кремниевым зондом. Через 6 ч механоактивации формируются слоистые агрегаты частиц размером 5 мкм и более. Отдельные слои собраны из частичек в форме дисков средней толщиной 100 нм и диаметром 400–900 нм (рис. 1).
Анализ NEXAFS-спектров показал, что пространственно-групповая симметрия элементарной ячейки исходного порошка оротата калия соответствует орторомбической Cmma с размерами элементарной ячейки a = 6,842 Å, b = 12,535 Å и c = 7,685 Å. В процессе механо- активации оротата калия тип кристаллической структуры не изменяется.
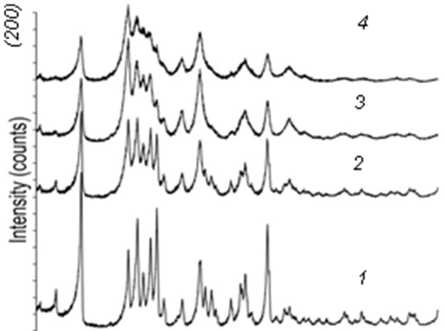
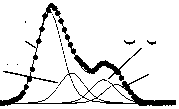
Методом РФЭС выявлено уширение дифракционных линий (рис. 2), что свидетельствует о снижении размеров кристаллитов и росте уровня микроискажений (e0) решетки.
5 15 25 35
2Ө (degree)
Рис. 2. Дифрактограммы исходного (1) и механоактивированных оротатов калия в течение 1 ч (2), 3 ч (3), 6 ч (4)
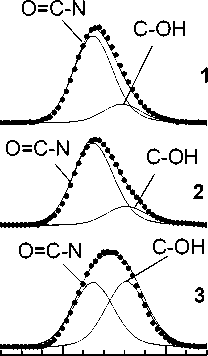
Уже после 60 мин механоактивации про-
нилось химическое строение оротата. В спек-
слеживается преимущественная ориентировка кристаллитов вдоль плоскостей (200) и (201).
трах исходного образца доминируют пики от групп –N= и С=О, т. е. доминирует оксо-форма
При этом молекулы оротата калия ориентиро-
оротата калия. Механоактивация в течение 1 ч
ваны (упакованы в молекулярном кристалле
приводит к уменьшению интенсивности пиков
в виде ламелей) параллельно плоскости (100) .
Очевидно, что возросший вклад в интенсивность отражений от данного набора плоскостей обусловлен характером диспергирования
от С=О и –NH- групп и появлению достаточно интенсивных линий от С-ОН и –N= групп, что свидетельствует о формировании гидроксиформы оротата калия. После 6 ч механоакти-
оротата калия.
Анализ РФЭС спектров свидетельствует
вации пики С-ОН и –N= доминируют, свидетельствуя о том, что в образце доминирует ди-
также, что в результате механоактивации изме-
гидрокси-форма оротата калия (рис. 3).
CH
O=C-N
C-OH
O-C=N
O=C-N
ar cyc
O-C=N
CH2
C-OH
O=C-N ar cyc
O=C-N
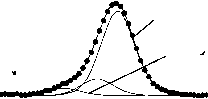
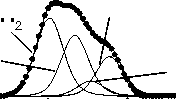
O=C-N
CH
C-OH
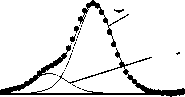
O=C-N ar cyc
O-C=N
280 285 290 395 400 405 530
Binding energy (eV)
Рис. 3. Рентгеноэлектронные C1s-, O1s-, N1s-спектры исходного и механоактивированного оротата калия: 1 – исходный препарат, 2 – механоактивированный в течение 1 ч, 3 – механоактивированный в течение 6 ч
Таким образом, механоактивация 6 ч не изменяет кристаллической структуры калия орота-та, наблюдается лишь уменьшение размеров частиц и кристаллитов, приводит к изменению таутомерной структуры аниона оротата (превращение оксо-формы в гидрокси- и дигидрокси-форму). Обе формы устойчивы и сохраняются в эксикаторе в течение нескольких месяцев, что позволило провести испытания препаратов на животных.
Введение препаратов крысам с индуцированной гепатопатией (ИГ) сопровождается сни- жением уровня аланинаминотрансферазы во всех группах по сравнению с ИГ: в 1,51 раза у крыс, которым вводили ОрКа-1, в 1,79 раз – ОрКа-2, в 2,14 раза – ОрКа-3 (р < 0,05) (табл. 1). Уровень аспартатаминотрансферазы снижается только в группе с введением гидроксиформы (в 1,26 раза, р < 0,05). Щелочная фосфатаза в группах ОрКа-1 и ОрКа-3 повышается, в отличие от ОрКа-1.
Количество билирубина достоверно снижено только в группе, получавшей гидроксиформу оротата калия.
Таблица 1
|
Показатели, экспериментальные группы |
АЛТ ед./л |
АСТ ед./л |
ЩФ мккат/л |
Билирубин ммоль/л |
|
ИГ |
65,3 ± 7,70 |
162,08 ± 29,17 |
3,82 ± 0,35 |
0,085 ± 0,0089 |
|
ОрКа-1 |
43,5 ± 4,50 |
172,5 ± 40,5 |
5,18 ± 0,30* |
0,051 ± 0,0089 |
|
ОрКа-2 |
36,5 ± 8,69 |
119,5 ± 6,84* |
4,23 ± 0,31 |
0,034 ± 0,009* |
|
ОрКа-3 |
30,5 ± 5,5* |
143,0 ± 10,0 |
4,98 ± 0,32* |
0,053 ± 0,0072 |
* Различия достоверны в отношении показателей группы сравнения с индуцированной гепатопатией (ИГ) при р < 0,05.
Данные биохимических анализов у животных с индуцированной гепатопатией после введения таутомерных форм оротовой кислоты
Липидный спектр крови животных после введения таутомерных форм калия оротата лабораторным животным испытывает разнонаправленные изменения (табл. 2). В группе ОрКа-1 на 36,26 % в сравнении с ИГ повышаются триглицериды, на 22,52 % – общий холестерин, повышается индекс атерогенности в 1,47 раз (р < 0,05). Наиболее «удачной» выглядит ли- нейка липидов в группе с введением гидроксиформы (ОрКа-2): уровень триглицеридов снижается в 1,78 раз (р < 0,05). В группе ОрКа-3 по сравнению с ИГ индекс повышается на 50,57 %, что прогностически является неблагоприятным фактором в отношении развития атеросклеротических осложнений, обусловленных патологией печени.
Таблица 2
Показатели липидного спектра крови у животных с индуцированной гепатопатией после введения таутомерных форм оротовой кислоты
|
Показатели (ммоль/л), экспериментальные группы |
Триглицериды |
Общий холестерин |
ЛПВП |
Индекс атерогенности |
|
ИГ |
0,91 ± 0,17 |
1,51 ± 0,13 |
0,83 ± 0,16 |
0,87 ± 0,05 |
|
ОрКа-1 |
1,24 ± 0,76* |
1,85 ± 0,55 |
0,81 ± 0,10 |
1,28 ± 0,24* |
|
ОрКа-2 |
0,51 ± 0,14* |
1,57 ± 0,15 |
0,77 ± 0,16 |
1,06 ± 0,09* |
|
ОрКа-3 |
0,53 ± 0,098* |
1,33 ± 0,13* |
0,55 ± 0,08* |
1,31 ± 0,27* |
*Различия достоверны в отношении показателей группы сравнения с индуцированной гепатопатией (ИГ) при р < 0,05.
Проведенный анализ MANOVA показал статистически значимые различия в уровнях ферментов в зависимости от группы F (12, 81) = 3,638, p < 0,0001; След Пиллаи = 1,051, частичная эта-квадрат = 0,350. Принадлежность к группе оказывает статистически значимое влияние на уровни: АЛТ – F (3, 32) = 2,930, p = 0,05;
частичная эта-квадрат = 0,239, АСТ – F (3, 32) = 6,779, p = 0,001; частичная эта-квадрат = 0,421, триглицериды – F (3, 32) = 3,640, p = 0,025; частичная эта-квадрат = 0,281.
Для холестерина статистическая значимость выявлена не была F (3, 32) = 2,506, p = 0,079; частичная эта-квадрат = 0,212.
ЗАКЛЮЧЕНИЕ
Методом механоактивации получены ме-тастабильные, устойчивые формы оротовой кислоты (оротат калия): гидрокси- (механообработка в течение 1 ч) и дигидрокси-формы (механообработка в течение 6 ч). Ответ организма животных на введение таутомеров оро-товой кислоты показал, что эффективность ме-ханоактивированных препаратов была выше, чем исходной оксо-формы оротата калия. Анализ внутригрупповых различий (MANOVA) указывает на преимущество гидрокси-формы оро-товой кислоты перед оксо- и дигидроксиформой. Наибольшая гидрофобность характерна гидрокси-форме оротат-аниона, во-первых, за счет образования ароматического гетероциклического кольца, во-вторых, за счет появления ОН-групп. Гидрофобность является одним из факторов, обеспечивающих биодоступность лекарственного вещества. Оротат-анион гидрокси-формы имеет все четыре функциональные группы, которые имеют разную химическую природу (-N=, C=J, -NH-, C-OH) что расширяет возможность взаимодействия с клеточной мембраной по сравнению с оксо- и дигидрокси-формами, в каждой из которых функциональные группы только двух типов (-N= и C=O в оксо-форме, –NH- и C-OH в дигидроксиформе). Полученные данные могут быть положены в основу клинической апробации гидрокси-формы оротовой кислоты, как наиболее активной формы препарата.
Список литературы Характеристика таутомерных форм оротата калия, полученных методом механоактивации
- Болдырев, В. В. Фундаментальные основы механической активации, механосинтеза и механо-химических технологий / В. В. Болдырев, Е. Г. Аввакумов. - Новосибирск: Изд. СО РАН, 2009. - 343 с. - Текст: непосредственный.
- Громова, О. А. Метаболомный компендиум по магния оротату / О. А. Громова, И. Ю. Торшин, А. Г. Калачева [и др.]. - Текст: непосредствен ный // Эффективная фармакотерапия. - 2015. -№ 44. - С. 14 - 26.
- Получение, физико-химические и биологические свойства таутомерных наноформ препарата "магнерот" / О. М. Канунникова, О. В. Карбань, Н. Н. Чучкова [и др.]. - Текст: непосредственный // Нанотехнологии: наука и производство. -2014. - Т. 4, № 31. - С. 80 - 88.
- Механомодифицированная форма оротовой кислоты в коррекции гепатопатии, вызванной гипер-гомоцистеинемией / К. А. Пазиненко, М. В. Сметанина, Н. Н. Чучкова [и др.]. - Текст: непосредственный // Молекулярная медицина. - 2021. -Т. 19, № 1. - С. 35 - 40.
- Механохимически индуцированные структурные превращения в глюконатах калия, натрия и кальция / Д. С. Рыбин, Г. Н. Коныгин, В. Е. Порсев [и др.]. - Текст: непосредственный // Химическая физика и мезоскопия. - 2013. - № 3. - С. 429 - 440.
- Сравнительное исследование эффективности применения таутомеров оротата магния для компенсации дефицита магния. Часть I. Влияние таутомеров магния оротата на изолированные клетки лабораторных животных и человека / Н. Н. Чучкова, М. М. Канунников, М. В. Сметанина [и др.]. - Текст: непосредственный // Уральский медицинский журнал. - 2018. - Т. 159, № 4. - С. 141 - 146.
- Loffler, M. Orotate (orotic acid): An essential and versatile molecule. Nucleosides Nucleotides Nucleic Acids / M. Loffler, E. A. Carrey, E. Zameitat. -Text (visual): unmediated // Nucleosides Nucleotides Nucleic Acids. 2018. - Vol. 35, № 10-12. -Р. 566 - 577.
- Nagham Mahmood Aljamali. Review in Chemical Structures of Drugs. - Text (visual): unmediated // International Journal of Engineering & Technology. - 2018. - № 7. - Р. 644 - 654.
- Negi, A. Success Stories of Enolate Form of Drugs / A. Negi, B. S. Gill. - Text (visual): unmediated // PharmaTutor. - 2013. - № 2. - Р. 45 - 53.
- Smith, R. L. Thalidomide-type teratogenicity: structure-activity relationships for congeners / R. L. Smith, S. C. Mitchell. - Text (visual): unmediated // Toxicol Res (Camb). - 2018 - № 6. -Р. 1036 - 1047.


