Характеристика токсигенности энтеробактерий, выделенных при желудочно-кишечных болезнях сельскохозяйственных животных
Автор: Ленченко Е.М., Мансурова Е.А., Моторыгин А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная микробиология, ветеринария
Статья в выпуске: 2 т.49, 2014 года.
Бесплатный доступ
Как известно, у бактерий семейства Enterobacteriaceae, которые занимают существенное место в этиологии неонатальных заболеваний сельскохозяйственных животных, в большинстве случаев отсутствует корреляция между серологической группой и токсигенностью. В связи с этим при диагностике целесообразно либо выявлять бактериальные адгезины, либо непосредственно подтверждать присутствие токсинов на различных лабораторных моделях, что, как правило, достаточно сложно и занимает много времени. Мы оценили токсигенность и вирулентность у патогенных и условно-патогенных энтеробактерий, выделенных при желудочно-кишечных болезнях молодняка сельскохозяйственных животных (1-5-суточные телята голштинской и черно-пестрой пород), и у референтных штаммов с использованием различных тестов на лабораторных животных (беспородные белые мыши, морские свинки линии Self, кролики породы Chinchilla и перепела Coturnix comuni). Доминирующая часть эпизоотических энтеробактерий, выделенных нами от телят (64 из 86 изолятов), идентифицировалась как Escherichia coli. Из изолятов E. coli 34 не серотипировались по О-антигену. При этом 35,0 % таких изолятов оказались патогенными и 65,0 % - непатогенными в тесте на белых мышах при внутрибрюшинном заражении бактериальной суспензией. В то же время токсигенность была выявлена у 53,9 % изученных изолятов и референтных штаммов энтеробактерий родов Salmonella (2 изолята), Klebsiella (2 изолята), Kluyvera (1 изолят), Yersinia (3 изолята), Escherichia (13 изолятов). Умеренно токсигенными и слаботоксигенными свойствами характеризовались соответственно 15,4 и 38,5 % изолятов, нетоксигенными - 46,1 %. Гистохимическими методами выявлены структурные изменения в тканях и органах лабораторных животных при экспериментальном моделировании токсемии, вызываемой энтеробактериями. При экспериментальной токсемии, обусловленной токсинами E. coli и Y. pseudotuberculosis, динамика патологических процессов характеризовалась развитием гидропической дистрофии эпителиоцитов ворсинок в тонком отделе кишечника, а также общей реакции сосудов микроциркуляторного русла в слизистой оболочки желудка, тонкого и толстого отделов кишечника животных.
Энтеробактерии, желудочно-кишечные заболевания, сельскохозяйственные животные, лабораторные модели, токсемия
Короткий адрес: https://sciup.org/142133501
IDR: 142133501 | УДК: 636:619:
Текст научной статьи Характеристика токсигенности энтеробактерий, выделенных при желудочно-кишечных болезнях сельскохозяйственных животных
Целью работы была оценка токсигенности энтеробактерий, доминирующих при желудочно-кишечных болезнях молодняка сельскохозяйственных животных, с использованием различных лабораторных тестов, а также регистрации гематологических и гистохимических изменений, наблюдаемых при инфицировании лабораторных животных.
Методика . Исследовали изоляты энтеробактерий, выделенные из патологического материала, смывов из носовой полости и из фекалий телят голштинской и черно-пестрой пород в возрасте от 1 до 5 сут ( n = 70) из хозяйств Кораблинского района Рязанской области. Видовую принадлежность изолятов идентифицировали с использованием дифференциально-диагностических питательных сред: ВСА, Эндо («HiMedia Laboratories Pvt. Ltd.», Индия), Rambach agar, XLT-4 agar, Cromocult Coliform agar («Merck KGaA», Германия). Биохимические свойства микроорганизмов изучали с использованием сред Гисса и множественной тест-системы «Пластина биохимическая, дифференцирующая энтеробактерии» («ПБДЭ», НПО «Диагностические системы», г. Нижний Новгород, Россия) и API («BioM e rieux S.A.S.», Франция). Для серотипирования E . coli по О-ан-тигену применяли диагностические сыворотки (ФГУП «Армавирская биофабрика», Россия) в соответствии с рекомендациями («Наставления по применению агглютинирующих О-коли сывороток». М., 1998). В качестве референтных использовали паспортизированные штаммы Escherichia coli О2 № 388, E . coli О78:К80 № 320, E . coli О138:К81 № 723, Klebsiella pneumonia № 356, Salmonella typhimurium № 5715, Yersinia pseudotuberculosis I № 290, Y. enterocolitica (S- и R-формы) № 383 (получены из коллекции «Центр качества и стандартизации лекарственных средств для животных и кормов» — ВГНКИ, г. Москва).
Патогенные и токсигенные свойства энтеробактерий изучали общепринятыми методами на лабораторных животных — беспородных белых мышах (живая масса 14-16 г), морских свинках (линия Self, живая масса 200-300 г), кроликах (порода Chinchilla, живая масса 2,5 кг) и перепелах Coturnix comuni (6, 7).
При оценке патогенности изолятов заражали беспородных белых мышей внутрибрюшинно взвесью микроорганизмов (по 0,5 см3; плотность бактериальной суспензии — 1 млрд кл/см3) ( n = 60). Для наблюдения за местными изменениями в слизистых оболочках с применением ке-ратоконъюнктивальной пробы морским свинкам ( n = 6) в конъюнктивальную полость вводили взвесь изучаемых микроорганизмов (1*109-1х1010 клеток) (8). При исследовании токсигенных свойств штаммы предварительно выращивали в жидкой среде Хоттингера в течение 24 ч при 37 ° С ( Y. pseudotuberculosis и Y. enterocolitica — при 28 ° С), культуры (S-формы) осветляли центрифугированием (6000 об/мин в течение 30 мин) и супернатант использовали в плантарном тесте и тесте расширения кишечника. В плантарном тесте осветленную культуральную жидкость вводили беспородным белым мышам ( n = 3) в область плантарной поверхности лапы (в контроле стерильный бульон Хоттингера инъецировали в другую лапу в том же количестве). В тесте расширения кишечника белым беспородным мышам-сосункам 2-3-суточного возраста per rectum вводили надосадочную жидкость в объеме 0,2 мл и рассчитывали коэффициент расширения тонкого кишечника (отношение массы тонкого кишечника с содержимым к остальной массе тела).
С целью исследования клинико-гематологических показателей морским свинкам (n = 6) и кроликам (n = 6) внутрибрюшинно в дозе 5*109 клеток вводили 18-часовую бактериальную культуру; в аналогичных контрольных группах животным инъецировали стерильный раствор NaCl (0,9 %). При изучении клинико-гематологических изменений у 10-суточных перепелов Coturnix comuni (n = 12) птицу интраназально заражали 18часовой культурой Е. coli 1111 (О149:К91:К88) в дозе 5*109 бактериальных клеток. Клинико-гематологические показатели изучали на морских свин- ках при внутрибрюшинном заражении референтным штаммом Y. pseudotuberculosis I и изолятом Е. coli 0115.
Для оценки динамики гибели белых мышей использовали внутрибрюшинное заражение культурой микроорганизмов (500 млн кл/см3) и интрагастральное введение 0,5 см3 токсина, полученного после осветления жидкой культуры. Из животных по принципу аналогов сформировали 6 групп (по 10 гол. в каждой): особям из I и II группы вводили соответственно культуру микроорганизмов и токсин E. coli 08 (выделен из фекалий 3-суточного теленка с клиническими признаками диареи; из III и IV — соответственно культуру микроорганизмов и токсин K. pneumoniae (референтный штамм № 356); из V групп — внутрибрюшинно ассоциацию (по 250 млн кл/см3) культур микроорганизмов E. coli O8 и K . pneumoniae ; из VI группы (контроль) — внутрибрюшинно и интрагастрально стерильный раствор NaCl (0,9 %). Рассчитывали летальность (отношение числа погибших от болезни к числу заболевших) и смертность (отношение числа погибших от болезни к общей численности контролируемой популяции).
Патологоанатомические исследования проводили общепринятыми методами, при гистохимических исследованиях патологический материал от животных и птицы фиксировали 10,0 % формалином и заключали в парафин, срезы окрашивали гематоксилином и эозином, по Ван Гизону, по Крантцу и по Лейшману.
В экспериментах использовали анализаторы крови фирмы « Mindray» (Китай); микроскоп модели H604 Trinocular («Unico, Inc.», США) с цифровой фотокамерой Canon Power Shot A 640 (США), цифровую окулярную видеокамеру МА 88 («Hight Technology Inc.», США).
Полученные данные обрабатывали методом вариационной статистики в соответствии с методическим руководством с применением программы Statgraphics Plus v. 5.0 (9).
Результаты . Использование питательных сред Rambach agar, XLT-4 agar, Cromocult Coliform agar при проведении бактериологических исследований позволило идентифицировать и дифференцировать колонии таксономически сходных видов энтеробактерий. Результаты идентификации с применением сред Гисса согласовывались с результатами тест-систем, но последние позволяли сократить сроки и снизить затратность процедуры. Из патологического материала, смывов из носовой полости и фекалий телят, а также смывов, полученных в репродукторных помещениях животноводческих объектов, выделили 86 культур микроорганизмов, принадлежащих к семейству Enterobacteriaceae , из которых 64 культуры идентифицировались как E . coli, 10 — как Proteus mirabilis, 9 — Klebsiella pneumoniae , 3 — Salmonella typhimurium , то есть среди них доминировали эшерихии.
При серологической идентификации с использованием О-коли сывороток из 139 эпизоотических штаммов E . coli к группе 08 отнесли 20 штаммов, к 0141 — 27, 0138 — 18, 09 — 11, 0139 — 9 и к 0157 — 3. К нетипируемым причислили 34 изолята E . coli. По данным литературы, се-ротипирование E . coli по 0-антигену затруднено из-за узкого спектра и невысокой чувствительности существующих наборов 0-коли сывороток, в частности по 0-серогруппе не удалось типировать 49,0 % изолятов E . colt , выделенных от птицы, и 22,0 % изолятов E . coli от пушных зверей (10, 11).
При идентификации микроорганизмов, не типируемых по 0-антигену, в соответствии с общепринятыми методами определяли патогенные свойства при внутрибрюшинном заражении белых мышей. Из исследо- ванных нами штаммов энтеробактерий 35,0 % оказались патогенными и 65,0 % — непатогенными. Известно, что парентеральное введение иер-синий мышевидным грызунам из-за естественной восприимчивости последних не дает объективных сведений о наличии факторов патогенности у указанных микроорганизмов и их способности вызвать инфекционный процесс (8). Поэтому для изучения патогенных свойств референтных штаммов Y. enterocolitica 09 № 383 и Y. pseudotuberculosis № 290 мы апробировали кератоконъюнктивальную пробу. Для сравнения в качестве тест-штамма использовали изолят E. coli 08, выделенный из фекалий 2-суточного теленка с клиническими признаками диареи. На морских свинках в течение 1 нед при ежедневном осмотре после введения в конъюнктивальную полость взвеси микроорганизмов (штамм E. coli 08, референтные штаммы Y. enterocolitica 09 № 383 и Y. pseudotuberculosis № 290), регистрируя выраженность признаков конъюнктивита (сужение глазной щели, гиперемия конъюнктивы, отек век, наличие и характер отделяемого) и состояния роговицы, установили следующие различия. Штамм E. coli 08 вызывал прогрессирующий конъюнктивит и кератит, характеризующийся склеиванием изъязвленных век, обильным гнойным или гнойно-творожистым экссудатом, сильное помутнение роговицы. В случае референтного штамма Y. enterocolitica 09 (S-форма) № 383 отмечался выраженный и прогрессирующий к 5-7-м сут конъюнктивит при незначительном непрогрессирующем помутнении роговицы, в то время как в варианте с референтными штаммами Y. enterocolitica (R-форма) № 383 и Y. pseudotuberculosis № 290 наблюдали незначительно выраженный конъюнктивит через 2-3 сут после заражения, отсутствие или слабую выраженность кератита через 2-3 сут без прогрессирования или даже с исчезновением помутнения роговицы через 5-7 сут. В целом было установлено, что кератоконъюнктивальная проба может считаться чувствительным и легко воспроизводимым в практических условиях тестом для оценки патогенности иерсиний.
В плантарном тесте на продукцию токсина средняя разность массы лапок у мышей в опыте и контроле через 24 ч колебалась от 6,66 ± 4,41 до 48,33+3,54 мг. У 42,8 % изолятов энтеробактерий получили критерий достоверности td > 9,9, что соответствовало достоверности различий Р < 0,01; у 52,4 % изолятов — td > 4,3, что соответствовало достоверности различий Р < 0,05. Из 21 изученной культуры референтных и эпизоотических штаммов энтеробактерий, в том числе эшерихий, не типируемых набором 0-коли сывороток, 42,9 % были умеренно токсигенными, 28,5 % — слаботоксигенными и 33,3 % — нетоксигенными (табл. 1).
1. Результаты оценки токсигенности эпизоотических и референтных штаммов энтеробактерий в плантарном тесте на белых лабораторных мышах
|
Вид микроорганизма, № штамма (источник выделения) |
Токсигенность |
||
|
масса лапки, мг |
средняя разность массы, мг ( M ± m ) |
t d |
|
|
опыт контроль |
|||
|
Salmonella typhimurium № 5715 (референтный штамм) 205 160 215 165 45,00±2,64 12,4 205 165 S . typhimurium (смывы, полученные в репродукторных по- 185 165 мещениях) 185 160 23,33±6,43 8,3 200 175 Klebsiella pneumoniae № 356 (референтный штамм) 190 155 195 150 38,33±4,32 7,2 190 145 |
|||
Ïðîäîëæåíèå òàáëèöû 1
Гистохимические изменения в тканях плантарной поверхности лап при введении токсина Y. pseudotuberculosis характеризовались деструкцией ороговевшего слоя эпидермиса кожи и общей сосудистой реакцией, отеком и гиперемией соединительной ткани дермы. В сосочковом слое дермы между волокнами рыхлой волокнистой соединительной ткани располагались гомогенные массы экссудата бледно-красного цвета. Гемоциркуляторные изменения проявлялись в виде полнокровия артериол, венул, капилляров, в просвете сосудов микроциркуляторного русла отмечалась агрегация эритроцитов и нити фибрина, что свидетельствовало о процессе тромбообразования, вдоль эндотелия сосудов наблюдалась так называемая пограничная локализация лейкоцитов. В сосочковом слое дермы между волокнами рыхлой волокнистой соединительной ткани находились гомогенные массы экссудата бледно-красного цвета, наблюдалась инфильтрация лейкоцитами (рис. 1, а, б).
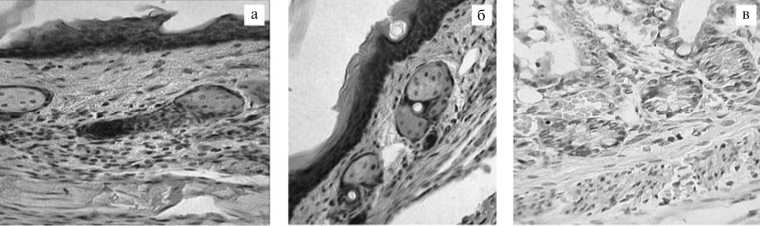
Рис. 1. Морфология тканей у лабораторных мышей после введения бактериальной взвеси референтного штамма Yersinia pseudotuberculosis внутрикожно (плантарный тест) и его токсина per rectum (осветленная культуральная жидкость, тест расширения кишечника): а — деструкция ороговевшего слоя эпидермиса плантарной поверхности лап, б — инфильтрация лейкоцитами сосочкового слоя дермы плантарной поверхности лап; в — гидропическая дистрофия энтеро-цитов кишечника . Окрашивание гематоксилином и эозином, увеличение *250.
В тесте расширения кишечника с использованием надосадочной жидкости Y. pseudotuberculosis средние значения коэффициента для тонкого кишечника находились в пределах от 0,070±0,009 до 0,116±0,005. Из общего числа изученных штаммов 27,7 % характеризовались как токси-генные, 18,1 % — как слаботоксигенные и 54,5 % — как нетоксигенные. Гистохимические изменения при введении токсина энтеробактерий проявлялись в гидропической дистрофии энтероцитов за счет накопления жидкости в цитоплазме клеток, деструктивно-некротических изменениях, во всех оболочках тонкого и толстого отдела кишечника наблюдались сосудистые нарушения и инфильтративные явления (см. рис. 1, в).
В целом результаты теста расширения кишечника и плантарного теста имели высокую степень корреляции ( r = 0,96). Вместе с тем недостатком теста расширения кишечника на мышах-сосунках следует считать б о льшую чувствительность и гибель животных при транспортировке и содержании, возможность выбраковки при травме кишечника при введении материала. Оценка токсигенности энтеробактерий в плантарном тесте онкометрическим методом с использованием плетизмо-метра позволяет наблюдать развитие экспериментально вызванной реакции у животных за счет изменения объема вытесняемой жидкости из водной камеры до и через определенный промежуток времени после введения токсина (12).
Оценка динамики гибели белых мышей при внутрибрюшинном заражении и интрагастральном введении токсина изолята E. coli О8 и референтного штамма K. pneumoniae № 356 показала, что летальность и смертность составили 100 % независимо от способа поступления исследуемого материала в организм. При внутрибрюшинном заражении изоля-том E. coli О8, выделенным из фекалий 3-суточного теленка с клиническими признаками диареи (I группа), гибель 6 мышей наступила через 24 ч, 4 — через 48 ч, тогда как при интрагастральном введении токсина E. coli О8 (II группа) гибель 8 особей регистрировали через 12 ч, 2 — через 24 ч. При внутрибрюшинном заражении культурой микроорганизмов референтным штаммом K. pneumoniae № 356 (III группа) гибель 2 мышей зафиксировали через 24 ч, 8 — через 48 ч, тогда как при интрагастраль- ном введении токсина K. pneumoniae № 356 (IV группа) смерть 4 мышей наступила через 12 ч, 6 — через 24 ч. При внутрибрюшинном заражении ассоциацией эшерихий и клебсиелл (V группа) 3 особи погибли через 6 ч, 7 — через 12 ч. В целом при введении токсина животные погибали быстрее, чем при заражении культурой микроорганизмов (рис. 2).
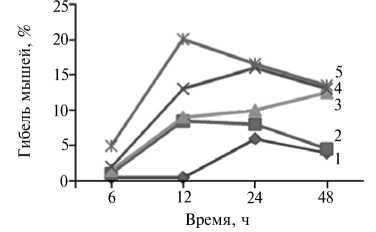
Рис. 2. Динамика гибели лабораторных мышей при внутрибрюшинном заражении культурой энтеробактерий или интрагастральном введении их токсинов: 1 и 2 — I и II группы, соответственно культура и токсин изолята Escherichia coli 08 (выделен из фекалий 3-суточного теленка с клиническими признаками диареи); 3 и 4 — III и IV группы, соответственно культура и токсин Klebsiella pneumoniae (референтный штамм № 356); 5 — V группа, введение внутрибрюшинно ассоциации E. coli O8 и K . pneumoniae ; 6 — VI группа
(контроль), введение внутрибрюшинно и интрагастрально стерильного раствора NaCl (0,9 %) .
Учитывая данные литературы о восприимчивости лабораторных животных к энтеробактериям (13), клинико-гематологические показатели при внутрибрюшинном заражении референтным штаммом Y. pseudotuberculosis исследовали на морских свинках, изолятом Е. coli 0115 — на кроликах. Клинические признаки болезни у морских свинок отмечали на 2-е сут после заражения в виде потери аппетита и отказа от корма, конъ- юнктивита, повышения температуры тела до 40 °C, прогрессирующей диареи, через 5 сут у животных наблюдались судороги и паралич конечностей. У кроликов клинические признаки болезни регистрировали через 5 сут после заражения Е. coli 0115 (отсутствие аппетита, жажда, цианоз слизистых оболочек, прогрессирующая диарея). Гематологические и биохимические показатели крови и сыворотки крови у животных при заражении Y. pseudotuberculosis и E. coli 0115 характеризовались снижением содержания гемоглобина, альбумина и глюкозы, повышением гематокрита, числа лейкоцитов, количества билирубина, аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ) и лактатдегидрогеназы (ЛДГ), креатинина, а-амилазы (табл. 2).
2. Изменение гематологических и биохимических показателей при заражении морских свинок референтным штаммом Yersinia pseudotuberculosis и кроликов изолятом Escherichia coli 0115 ( M ± m )
Р < 0,001.
После интраназального заражения 10-суточных перепелов Coturnix comuni ( n = 12) референтным штаммом Е. coli 1111 (О149:К91:К88) клинические признаки болезни наблюдали через 3 сут в виде прогрессирующей депрессии, жажды, отсутствия аппетита, цианоза слизистых оболочек, в последующие 4-5 сут развивались признаки диареи. Патологоанатомические изменения, обусловленные подострой септикотоксемией, характеризовались геморрагическим энтеритом, серозно-фибринозным перигепатитом, атрофией фабрициевой бурсы, серозно-фибринозным аэро-саккулитом, серозно-фибринозным перитонитом.
При прогрессирующей диарее на 3-5-е сут после заражения цыплят наблюдались нарушения водно-электролитного баланса. Так, показатели по Na + (ммоль/л) составили в опыте 128,11±0,32, в контроле — 154,21±0,33; по К + (ммоль/л) — соответственно 33,81±0,23 и 3,97±0,13; по Cl - (ммоль/л) — 102,66±0,31 и 101,16±0,42. В первую очередь при потерях ионов натрия развивались компенсаторные изменения кислотно-щелочного состояния, при тяжелой дегидратации — гиперкалиемия. Такие нарушения относятся к тяжелым патоморфологическим синдромам, особенно при средней и тяжелой степени дегидратации, и будучи нераспознанными и неустраненными, во многом определяют выраженность клинических признаков, течение и исход заболевания. Ранее мы сообщали, что при доминировании токсигенных энтеробактерий в микробиоценозах кишечника поросят гематологические показатели характеризовались повышением показателя гематокрита, фагоцитарной активности и общей окислительно-восстановительной способности лейкоцитов крови (14). Наши результаты изучения изменений, происходящих при патологических процессах, в целом согласуются с данными других исследователей: например, установлено, что токсины энтеробактерий, адсорбируясь на эпителиальных клетках ворсинок тонкого кишечника, стимулируют адени-латциклазу, поэтому увеличивается концентрация аденозинмонофосфата, усиливающего гиперсекрецию воды и хлоридов в просвет кишечника и угнетающего резорбцию натрия. Как следствие, просвет кишки переполняется жидкостью, активируется перистальтика кишечника и развивается диарея (15, 16).
Таким образом, при идентификации энтеробактерий, не типируе-мых по О-антигену, общепринятая схема бактериологического исследования завершается биологической пробой. Восприимчивость лабораторных моделей зависит от вирулентности возбудителя, дозы, метода введения, чувствительности к термолабильным и термостабильным токсинам. Так, при внутрибрюшинном введении белым беспородным мышам бактериальной взвеси результаты воспроизведения болезни на лабораторных и 102
естественно восприимчивых животных не коррелируют (16). Установлено, что энтеротоксигенные (ЕТЕС) штаммы E . coli продуцируют два типа энтеротоксинов — термолабильный (ТЛЭ) и термостабильный (ТСЭ), различающиеся по структуре, молекулярной массе, иммуногенности, механизмам действия. В настоящее время для оценки ТЛЭ применяют тест отека лап у белых мышей, кожную пробу на кроликах, реакции агрегации тромбоцитов, в случае ТСЭ — инокуляцию 15-суточных куриных эмбрионов и анальную пробу на 15-суточных мышатах-сосунах (5, 16). Однако вследствие того, что оценка токсического эффекта на лабораторных моделях сопряжена с определенными трудностями, перспективными для этих целей признаны тест-системы, основанные на методе обратной пассивной латексной агглютинации, методы иммунодиффузии, позволяющие быстро определить наличие термостабильного и термолабильного токсинов.


